魚腥草水提液及其主要成分體外對71型腸道病毒的抑制作用觀察
張慧鋒,郭淑英,馬瑩慧,莊艷,于歡
(1吉林醫藥學院,吉林吉林132013;2吉林大學生命科學學院;3齊魯醫藥學院)
手足口病是近年來嚴重影響嬰幼兒健康的一種傳染病,該病是由多種腸道病毒引發的嬰幼兒急性傳染病[1],其中最為常見的病原體是腸道病毒71型(EV71)和柯薩奇病毒A組16型(CA16)[2]。EV71感染易出現神經系統損害[3],常引起重癥甚至導致死亡[4],因此許多研究者開展抗EV71感染研究[5~8],以期實現對EV71感染所致手足口病的預防和治療,降低手足口病危重癥的發生率。傳統中草藥具有價格低廉、廣譜抗病毒等許多優點[9],其中很多中藥單體已被發現具有良好的抗EV71作用[10~12],但中草藥口感較差,且部分具有腎毒性,在5歲以下患兒的預防和治療應用中受到巨大限制。魚腥草為三白草科植物蕺菜的新鮮全草或干燥地上部分,具有清熱解毒等功能[13]。現有研究[14~17]表明魚腥草對一些病毒具有抑制作用,且其為藥食兩用植物,嬰幼兒服用毒性作用小。為此,本研究觀察了魚腥草水提液及其主要成分綠原酸、蘆丁、金絲桃苷、槲皮素體外抗EV71的作用,現報告如下。
1 材料與方法
1.1 病毒、細胞及主要實驗材料 EV71采集于哈爾濱市兒童醫院,經real-time PCR檢測為EV71陽性的樣本開展病毒分離,經real-time PCR檢測確認。RD細胞來源于人橫紋肌肉瘤細胞,由吉林大學饋贈,本實驗室傳代培養,最大代數為21代。魚腥草采購于吉林大藥房(太極集團四川錦陽制藥有限公司,批號Z51020213),經鑒定為三白草科植物蕺菜的干燥地上部分。綠原酸、蘆丁、金絲桃苷和槲皮素購自上海綠源生物有限公司(批號分別為R2015032、T2015141、W2015083、S2015168),純度經黑龍江省食品藥品檢驗所中藥室測定分別為99.68%、98.59%、98.36%和99.15%。主要試劑包括核酸提取試劑盒(QIAGEN 74104)、MEM(GIBCO 4500-034)、胎牛血清(Hyclone sr30087.02)、EDTA-胰酶(GIBCO 25200)、PBS(GIBCO 10010)、二甲基亞砜(Sigma D5879)、MTT(Amresco 0793)、手足口real-time PCR檢測試劑盒(江蘇碩世生物科技有限公司)。主要儀器包括核酸提取儀(德國QIAGEN公司QIAcube)、熒光定量PCR儀(美國 ABI 7500)、CO2培養箱(日本SANYO MCO-15A)、倒置顯微鏡(日本Nikon TE2000-5)。
1.2 藥液配置及其細胞毒性檢測 ①病毒增殖和感染性的測定:按參考文獻[18]開展實驗并測定病毒的TCID50=1.52×10-5/0.1 mL。②藥液配置:魚腥草藥液采用索氏提取器沸水浴中進行恒溫浸提2 h,減壓抽濾,濾液過0.2 μm濾膜,定容至250 mL,則所得溶液當量為50 mg/mL生藥,4 ℃保存備用;金絲桃苷藥液和綠原酸藥液以兩藥各20 mg分別加入到0.2 mL的DMSO和4.8 mL的5%胎牛血清細胞培養液組成的稀釋液中,藥液濃度為4 mg/mL,4 ℃保存備用;槲皮素藥液和蘆丁藥液以兩藥各100 mg,加入到0.25 mL的DMSO和4.75 mL的5 %胎牛血清細胞培養液組成的稀釋液中,藥液濃度為20 mg/mL,4 ℃保存備用。③藥液細胞毒性檢測:將配置好的上述藥液用細胞培養液對倍稀釋5個稀釋度,接種于準備好的RD細胞上,每個稀釋度設4孔,同時設不加藥液的正常細胞為對照,每日觀察細胞病變,連續7 d觀察藥物毒性,細胞出現病變者判為存在毒性。結果顯示各種藥液實驗濃度對RD細胞均無細胞毒性作用,可用于后續實驗。
1.3 魚腥草水提液及其主要成分抗EV71作用觀察 將RD細胞分為魚腥草組、金絲桃苷組、槲皮素組、蘆丁組、綠原酸組、對照組。魚腥草組分別給予5 000、2 500、1 250、625、313 mg/L的魚腥草水提液;槲皮素組加入槲皮素藥液,蘆丁組加入蘆丁藥液,藥液濃度分別為10.00、5.00、2.50、1.25、0.63 mg/mL;金絲桃苷組加入金絲桃苷藥液,綠原酸組加入綠原酸藥液,藥液濃度分別為4.00、2.00、1.00、0.50、0.25 mg/mL;對照組加入細胞培養液。
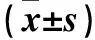
表1 魚腥草水提液及其主要成分對EV71的復制抑制作用、生長阻滯作用、抗吸附作用、滅活作用結果
1.3.1 病毒復制抑制作用觀察 取100 TCID50的EV71病毒液感染形成單層的RD細胞,每孔100 μL,37 ℃孵育2 h后棄病毒液,用PBS洗單層細胞,將感染EV71的RD細胞分為6個組,各組給藥方法參考“1.3”,給藥后培養1~3 d,觀察細胞病變(CPE)。采用MTT法測算病毒復制抑制率[19]。以藥品濃度為橫坐標,病毒復制抑制率為縱坐標作圖,然后得到50%抑制率對應的藥液濃度即為IC50。
1.3.2 病毒生長阻滯作用觀察 將RD單層細胞分為6個組,分組及給藥方法參考“1.3”,培養3 d后棄培養液,PBS清洗2次后加100 TCID50的EV71病毒液100 μL接種,37 ℃孵育1 h,用PBS清洗以去除未吸附的病毒,加入含0.5%胎牛血清的細胞維持液,培養1~3 d,逐日觀察CPE。生長阻滯率=[(A490測試孔-A病毒對照)/(A490細胞對照-A490病毒對照)]×100%。
1.3.3 抗病毒吸附作用觀察 將RD單層細胞分為6個組,根據“1.3”方法分別將不同藥物濃度培養液分別接入已長滿單層細胞的96孔板內,每孔100 μL,37 ℃孵育2 h后棄藥液,接入100 TCID50的EV71病毒液100 μL,37 ℃孵育2 h。用PBS洗單層細胞,去除未吸附的病毒和中藥成分,加入含0.5 %胎牛血清的細胞維持液,培養1~3 d,觀察CPE。吸附抑制率=[(A490測試孔-A病毒對照)/(A490細胞對照-A490病毒對照)]×100%。
1.3.4 滅活病毒作用觀察 取100 TCID50的EV71病毒液與不同藥物濃度培養液等體積混合,37 ℃作用90 min,然后4 ℃ 13 000 r/min離心5 min,去除中藥成分,沉淀用PBS洗滌后再4 ℃ 13 000 r/min離心10 min。病毒沉淀以DMEM培養液重懸,接種至單層RD細胞上,培養1~3 d,觀察CPE。滅活率=[(A490測試孔-A病毒對照)/(A490細胞對照-A490病毒對照)]×100%。
1.3.5 抗病毒穿入作用觀察 將單層的RD細胞接種100 TCID50的EV71病毒液100 μL,4 ℃下吸附1 h,用PBS洗單層細胞,去除未吸附的病毒。將吸附病毒的細胞分為6個組,各組按“1.3”方法加入不同濃度藥液37 ℃培養15、30、60 min,加入蛋白酶K反應20 min,用1 mmol/L苯甲基磺酰氟(PMSF)終止反應,用PBS洗單層細胞2次,加入含0.5 %胎牛血清的細胞維持液,培養1~3 d,觀察CPE。穿入抑制率=[(A490測試孔-A病毒對照)/(A490細胞對照-A490病毒對照)]×100%。

2 結果
魚腥草水提液及主要成分綠原酸、蘆丁、金絲桃苷、槲皮素體對EV71的抗病毒作用結果見表1、2。由表1可知,魚腥草組、槲皮素組病毒復制抑制率高于其余四組,且藥物作用濃度越高,抑制作用越強(P均<0.05);金絲桃苷組和蘆丁組病毒生長阻滯抑制率高于其余四組(P均<0.05);金絲桃苷組、魚腥草組病毒吸附抑制率高于其余四組(P均<0.05)。魚腥草具有一定的病毒復制抑制作用和較弱的抗病毒吸附作用,IC50為3.22 g/L。金絲桃苷具有較弱的病毒生長阻滯作用和抗病毒吸附作用。槲皮素具有一定的病毒復制抑制作用,IC50為0.403 mg/mL。蘆丁具有較弱的病毒生長阻滯作用。魚腥草水提液及其主要成分均沒有滅活病毒的作用。
藥物作用15、30、60 min時各組CPE均為++++。由表2可以看出,各組在作用15、30 min時均未表現出對病毒穿入的抑制作用。在作用60 min時,魚腥草組、槲皮素組、蘆丁組、綠原酸組病毒穿入抑制率高于金絲桃苷組和對照組(P均<0.05)。魚腥草、槲皮素、蘆丁、綠原酸對EV71均有不同程度的穿入抑制作用。魚腥草對EV71穿入的抑制作用受濃度變化影響不明顯;槲皮素和蘆丁的作用隨藥物濃度降低而減弱;綠原酸的作用隨著濃度降低而增強。
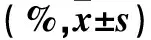
表2 魚腥草水提液及其主要成分抗EV71病毒穿入作用結果
3 討論
手足口病為嬰幼兒傳染病,危重癥患者多為EV71型病毒感染。本研究期望在藥食兩種植物魚腥草中,找到對EV71有抑制作用的成分,在EV71感染所致手足口病的預防和治療中得以應用。
通過研究發現,魚腥草具有抑制EV71病毒復制的作用,金絲桃苷、蘆丁、綠原酸沒有表現出這種作用,而槲皮素卻表現出這種作用。槲皮素為非水溶性物質,因此可能是其他物質在魚腥草水提液中起作用或槲皮素轉化的結構類似產物起作用。據文獻報道魚腥草中槲皮素含量為2.11~4.65 mg/g[20,21]。如果是槲皮素結構類似轉化產物起作用,根據槲皮素含量推算,魚腥草的IC50應為87~191 g/L,而本實驗結果中魚腥草IC50為3.22 g/L,值較小,因此推斷是魚腥草水提液中其他物質具有抑制EV71復制的作用,或槲皮素轉化的結構類似產物作用增強。
魚腥草沒有顯現出對EV71病毒生長的阻滯作用,而金絲桃苷和蘆丁有較弱的生長阻滯作用。我們考慮魚腥草組結果出現的原因可能與用量有關。據文獻報道,魚腥草中金絲桃苷含量為1.5~5.7 mg/g[21,22],實驗用魚腥草組最大金絲桃苷含量為0.007 5~0.028 5 mg/mL,遠遠低于金絲桃苷組最低濃度0.25 mg/mL,因此可能是魚腥草組中金絲桃苷含量比較低,所以魚腥草組未能表現出對EV71的生長阻滯作用。同時,文獻報道魚腥草中蘆丁的含量為1.44~9.31 mg/g[23~25],實驗用魚腥草組最大蘆丁含量為0.007 2~0.046 5 mg/mL,遠遠低于蘆丁組最低濃度1.25 mg/mL,同樣可能因為魚腥草組中蘆丁含量比較低,導致魚腥草組出現陰性結果。因此可以推斷金絲桃苷和蘆丁具有對EV71的生長阻滯作用。
本研究結果顯示,魚腥草具有抗EV71吸附作用,金絲桃苷組同樣具有較弱的抗病毒吸附作用,而其他組別均無此作用;且金絲桃苷組的抗病毒吸附作用效果強于魚腥草組,推測作用差異與用量有關。
在本研究中,魚腥草水提液及其主要成分均未表現出滅活EV71的作用,說明魚腥草不具有滅活EV71的作用。作用60 min時魚腥草組表現出較弱的抗EV71穿入作用,同時槲皮素組、蘆丁組、綠原酸組也有抗EV71穿入作用;槲皮素組和蘆丁組的作用隨濃度降低而減弱,但綠原酸組該作用隨著濃度降低而增強,魚腥草組的作用隨濃度變化不明顯,可能是槲皮素、蘆丁、綠原酸等多種物質共同作用的結果。各組藥物作用15、30 min時均未表現出抗EV71穿入作用,說明該作用的發揮需要一定時間。
總之,上述研究結果為魚腥草水提液及其有效成分抗EV71的臨床應用提供了實驗數據。然而,中草藥的功效可能是多種成分共同作用的結果,同時由于藥物含量不同,因此整體功效與單一組分存在差異。我們認為,魚腥草的抗病毒作用可能是通過多成分、多靶點、多機制共同作用的結果,應根據不同的目的開展更加深入的研究,以獲得更好功效的成分配比。
參考文獻:
[1] Zhao YY, Jin H, Zhang XF, et al. Case-fatality of hand, foot and mouth disease associated with EV71: a systematic review and meta-analysis[J]. Epidemiol Infect, 2015,143(14):3094-3102.
[2] 梅小麗,時珺,陳俊,等.重癥和危重癥手足口病患兒死亡的影響因素分析[J].山東醫藥,2016,56(36):59-61.
[3] Lee DS, Lee YI, Ahn JB, et al. Massive pulmonary hemorrhage in enterovirus 71-infected hand, foot, and mouth disease[J]. Korean J Pediatr, 2015,58(3):112-115.
[4] 甘正凱,李靖欣,孟繁岳,等.腸道病毒71型所致疾病及其流行病學特征[J].中華流行病學雜志,2015,36(1):45-48.
[5] Nishimura Y. Infection mechanism of enterovirus 71[J]. Uirusu, 62(1):121-128.
[6] Mizuta K, Aoki Y, Matoba Y, et al. Molecular epidemiology of enterovirus 71 strains isolated from children in Yamagata, Japan, between 1990 and 2013[J]. J Med Microbiol, 2014,63(10):1356-1362.
[7] Beh PL, Farid AJ, Nabil SH, et al. Detection and characterization of viruses causing hand, foot and mouth disease from children in Seri Kembangan, Malaysia[J]. Trop Biomed, 2014,31(4):654-662.
[8] Xun M, Ma CF, Du QL, et al. Differential expression of miRNAs in enterovirus 71-infected cells[J]. Virol J ,2015,12(1):1-10.
[9] Tang S, Kong L, Li Y, et al. Novel N-benzenesulfonyl sophocarpinol derivatives as coxsackie B virus inhibitors[J]. ACS Med Chem Lett, 2015,6(2):183-186.
[10] Lin TY, Liu YC, Zheng JR, et al. Anti-enterovirus 71 activity screening of chinese herbs with anti-infection and inflammation activities[J]. Am J Chin Med, 2009,37(1):143-158.
[11] Chen XQ, Wang CY, Xu LF, et al. A laboratory evaluation of medicinal herbs used in china for the treatment of hand, foot, and mouth disease[J]. Evid Based Complement Alternat Med, 2013(2013):5045-5063.
[12] Wang C, Gao L, Jin Y, et al. Regulation of host responses and viral replication by the mitogen-activated protein kinases in intestinal epithelial cells infected with enterovirus 71[J]. Virus Res, 2015(197):75-84.
[13] 國家藥典委員會.中華人民共和國藥典2015版一部[S].北京:中國醫藥科技出版社,2015:224.
[14] Chen X, Wang Z, Yang Z, et al. Houttuynia cordata blocks HSV infection through inhibition of NF-κB activation[J]. Antiviral Res, 2011,92(2):341-345.
[15] Yin J, Li G, Li J, et al. In vitro and in vivo effects of Houttuynia cordata on infectious bronchitis virus[J]. Avian Pathol, 2011,40(5):491-498.
[16] Leardkamolkarn V, Sirigulpanit W. Establishment of a stable cell line coexpressing dengue virus-2 and green fluorescent protein for screening of antiviral compounds[J]. J Biomol Screen, 2012,17(3):283-292.
[17] 劉方舟,時瀚,時宇靜,等.魚腥草注射液體內抗流感病毒藥效學研究[J].藥學學報,2010,45(3):399-402.
[18] 中華人民共和國衛生部.手足口病預防控制指南(2009版)[S].北京:中華人民共和國衛生部,2009.
[19] 葉勁松,關文達,招穗珊,等.白藜蘆醇抗柯薩奇病毒作用機理研究[J].廣東農業科學,2011(14):113-115.
[20] 錢錦花,王慧玲,陳勇軍,等.HPLC法測定魚腥草破壁飲片中槲皮素含量[J].今日藥學,2015,25(1):28-30.
[21] 鄭一敏,骨秀英,傅善權,等.高效液相色譜法測定魚腥草中金絲桃苷與槲皮素的含量[J].現代中藥研究與實踐,2005,19(3):27-28.
[22] 李永偉,何兵,周德兵,等.高效液相色譜法同時測定魚腥草中綠原酸和金絲桃苷含量[J].中國藥業,2015,24(7):49-51.
[23] 壽露,蒲首承,孫梅好.HPLC-DAD對魚腥草不同部位蘆丁含量分析[J].生物技市世界,2016(4):13.
[24] 李利華.HPLC測定魚腥草不同部位綠原酸和蘆丁的含量[J].中國實驗方劑學雜志,2012,18(19):94-97.
[25] 李瑞玲,崔運啟,劉奇森.HPLC法測定不同產地魚腥草中不同部位蘆丁的含量[J].天然產物研究與開發,2013,25(6):799-801.

