棘阿米巴表達(dá)文庫(kù)的免疫學(xué)篩選
張宏梅 , 鄭文彧 , 劉 迪 , 時(shí)文艷 , 孫宏宇 , 崔佰吉 , 高俊濤 , 馮憲敏
(1.吉林醫(yī)藥學(xué)院病原生物學(xué)教研室 , 吉林 吉林 132013 ; 2.吉林市中心醫(yī)院 , 吉林 吉林 132000)
棘阿米巴角膜炎(Acanthamoeba Keratitis,AK)是一種嚴(yán)重威脅視力的感染性眼病, 其發(fā)生與一定的危險(xiǎn)因素有關(guān),如配戴角膜接觸鏡、接觸污染的水源、角膜輕度擦傷,以及機(jī)體抵抗力降低等[1-2]。目前為止,對(duì)棘阿米巴原蟲(chóng)的研究主要集中在形態(tài)分型、基因分型、藥物殺傷試驗(yàn)、感染模型和致病機(jī)制研究階段,對(duì)于棘阿米巴角膜炎的病因?qū)W、免疫學(xué)、病理生理學(xué)以及診斷治療等方面的研究仍有待深入。在前期工作中,課題組成功構(gòu)建了棘阿米巴原蟲(chóng)滋養(yǎng)體全長(zhǎng)cDNA文庫(kù)[3]和棘阿米巴角膜炎的兔模型[4]。本文通過(guò)棘阿米巴感染兔血清對(duì)構(gòu)建好棘阿米巴原蟲(chóng)滋養(yǎng)體全長(zhǎng)cDNA文庫(kù)進(jìn)行免疫學(xué)篩選,以期獲得高反應(yīng)原性的抗原基因,為進(jìn)一步棘阿米巴原蟲(chóng)感染的快速診斷試劑和免疫預(yù)防分子的篩選奠定基礎(chǔ)。
1 材料與方法
1.1 蟲(chóng)株 棘阿米巴原蟲(chóng)標(biāo)準(zhǔn)蟲(chóng)株(Acanthamoebahealyi)由延邊大學(xué)病原教研室惠贈(zèng),本室凍存。將棘阿米巴原蟲(chóng)純培養(yǎng)于蛋白胨-酵母-葡萄糖培養(yǎng)基(Peptone-Yeast-Glucose, PYG)中, 取對(duì)數(shù)生長(zhǎng)期的滋養(yǎng)體, 生理鹽水調(diào)整原蟲(chóng)濃度為1×106/mL(90%以上滋養(yǎng)體),并用臺(tái)盼藍(lán)染色檢測(cè)蟲(chóng)體活力>90%,用于試驗(yàn)。
1.2 試劑與儀器 棘阿米巴cDNA和原始cDNA文庫(kù)由本室制備,-80 ℃冷凍保存[3]。E.coliXL1-Blue,PBST,辣根過(guò)氧化酶標(biāo)記羊抗兔IgG,RNA提取試劑盒,cDNA合成試劑盒,2×TaqPCR Green Mix,引物,瓊脂糖凝膠DNA回收試劑盒。
1.3 免疫血清制備
1.3.1 感染兔模型 健康新西蘭白兔6只(吉林大學(xué)白求恩醫(yī)學(xué)院動(dòng)物實(shí)驗(yàn)中心提供),體重2.0~2.5 kg,雌雄兼用。試驗(yàn)組4只,對(duì)照組2只。試驗(yàn)組單眼注射,左眼為試驗(yàn)眼,右眼為病變對(duì)照眼。實(shí)驗(yàn)前實(shí)驗(yàn)眼用0.5%氫化可的松滴眼液點(diǎn)眼, 每天3~4次,共3 d。實(shí)驗(yàn)開(kāi)始后,停用激素。試驗(yàn)組兔固定后,經(jīng)氯胺酮肌肉注射全麻后,左眼再經(jīng)0.5%可卡因點(diǎn)眼局麻,用1 mL無(wú)菌注射器向?qū)嶒?yàn)眼角膜基質(zhì)內(nèi)注射棘阿米巴原蟲(chóng)混懸液0.2 mL(1×106/mL),2只對(duì)照兔左眼角膜基質(zhì)內(nèi)注射等量生理鹽水,右眼未做處理。于注射12 h開(kāi)始,每天觀察兔眼角膜病變情況,直到處死(42 d)[5]。
1.3.2 10%氫氧化鉀濕封片鏡檢 分別于注射后3 d、7 d、14 d及28 d,刮取兔角膜較深層病變組織涂于滴加10%KOH的載玻片上,置于光學(xué)顯微鏡下查找滋養(yǎng)體或包囊。
1.3.3 血清抗體滴度檢測(cè) 分別于感染后第1、7、14、21、28、35、42天耳緣靜脈或動(dòng)脈取血,制備血清,采用間接酶聯(lián)免疫吸附法(ELISA)檢測(cè)兔血清中抗棘阿米巴原蟲(chóng)抗體的滴度。將棘阿米巴蟲(chóng)體粗抗原(濃度為1.63 2 mg/mL)稀釋至10 μg/mL,按每孔100 μL包被96孔板,4 ℃過(guò)夜。次日用0.05 mol/L pH值7.4的PBS-Tween-20(PBST)洗液洗滌3次,每次5 min;3%脫脂奶粉每孔100 μL封閉1 h,PBST洗滌后,加入稀釋的兔血清(1∶4 000,1∶8 000,1∶16 000, 1∶32 000),37 ℃孵育1 h,PBST洗滌后,加入1∶5 000稀釋的二抗(bs-0295G-HRP rabbit IgG/HRP,公司),37 ℃孵育5 h;PBST洗滌后,以TMB為底物顯色10 min,4 mol/L硫酸終止反應(yīng),用bio-rad 680酶標(biāo)儀(美國(guó))測(cè)定OD450值。
1.4 cDNA文庫(kù)滴度測(cè)定 取1 μL原始文庫(kù),用1×λ dilution Buffer 分別進(jìn)行1×10-3、1×10-4和1×10-5倍稀釋。從每個(gè)濃度分別吸取1 μL加入至100 μLE.coliXL1-Blue感受態(tài)細(xì)胞,37 ℃孵育15 min。將上述混合液與6 mL LB/MgSO4/麥芽糖軟頂瓊脂混合后傾注平板,室溫冷卻,于37 ℃培養(yǎng)16~18 h。計(jì)數(shù)溶菌斑數(shù)量,以確定該文庫(kù)的滴度。
1.5 cDNA文庫(kù)免疫篩選 1×10-3稀釋的棘阿米巴cDNA文庫(kù)0.5 μL,加入至100μLE.coliXL1-Blue感受態(tài)細(xì)胞,37 ℃孵育15 min。將上述混合液與6 mL LB/MgSO4/麥芽糖軟頂瓊脂混合后傾注平板,室溫冷卻,于37 ℃培養(yǎng)16~18 h,至噬菌斑清晰可見(jiàn),未融合。將預(yù)先準(zhǔn)備好的140 mm直徑的PVDF膜覆蓋于噬菌斑表面,標(biāo)記固定,37 ℃正置孵育4 h,4 ℃倒置過(guò)夜。取下PVDF膜,PBST洗滌3次后,5%脫脂奶粉室溫封閉1h,洗滌后首抗和二抗各自孵育1 h,DAB顯色。首抗:分別取1 μL感染后第7、14、21天和28天兔血清,混合后,與E.coliXL1-Blue裂解液室溫混合過(guò)夜;次日2 000×g,室溫離心10 min,收集上清,用抗體稀釋液進(jìn)行1∶5000 稀釋。二抗:辣根過(guò)氧化酶標(biāo)記羊抗兔IgG,使用濃度1∶500。從培養(yǎng)板上挑取陽(yáng)性克隆置于1.5 mL離心管中,加入50 μL 1×λdilution Buffer,4 ℃過(guò)夜;次日離心取上清進(jìn)行復(fù)篩和測(cè)序。
1.6 陽(yáng)性克隆測(cè)序與序列分析 將上述噬菌體溶液送北京鼎國(guó)昌盛生物技術(shù)有限公司采用通用引物T3和T7進(jìn)行雙向測(cè)序。根據(jù)測(cè)序結(jié)果,采用ORF finder軟件進(jìn)行ORF預(yù)測(cè),并對(duì)預(yù)測(cè)的氨基酸序列進(jìn)行Blastp同源性分析。同時(shí)根據(jù)堿基序列設(shè)計(jì)特異性引物,以棘阿米巴cDNA為模板進(jìn)行擴(kuò)增檢測(cè),PCR反應(yīng)體系為:2×TaqPCR Green Mix,12.5 μL;Ameba cDNA,0.5 μL;引物F/R各1 μL;無(wú)核酸酶的去離子水至總體積25 μL。反應(yīng)條件為:94 ℃ 5 min;92 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,共30個(gè)循環(huán);72 ℃ 延伸5 min。PCR產(chǎn)物用1%瓊脂糖凝膠,進(jìn)行電泳,PCR產(chǎn)物回收,進(jìn)行二次測(cè)序。
2 結(jié)果
2.1 免疫兔血清制備 在家兔角膜感染棘阿米巴原蟲(chóng)后3、7、14 d及28 d分別作角膜深層組織刮片,滴加10%KOH,置于光學(xué)顯微鏡下觀察,4只試驗(yàn)眼均查見(jiàn)滋養(yǎng)體或包囊(圖未列出),表明感染模型構(gòu)建成功。
分別于感染后第1、7、14、21、28、35、42天耳緣靜脈或動(dòng)脈取血,制備血清,采用間接酶聯(lián)免疫吸附法(ELISA)檢測(cè)兔血清中抗棘阿米巴原蟲(chóng)抗體的滴度。隨著感染的進(jìn)行,實(shí)驗(yàn)組兔血清抗體水平于感染后的第7天開(kāi)始逐漸升高,第28天達(dá)到峰值,而后抗體滴度開(kāi)始緩慢下降;陰性對(duì)照組兔血清抗體水平?jīng)]有明顯變化(圖1)。根據(jù)抗體水平的變化,選用感染后第7、14、21天和28天兔血清進(jìn)行文庫(kù)的免疫學(xué)篩選。
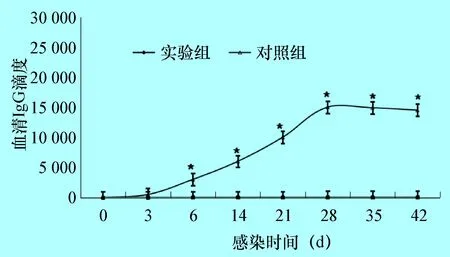
圖1 兔棘阿米巴角膜炎模型血清抗體滴度的變化
2.2 cDNA文庫(kù)的免疫學(xué)篩選和序列分析 對(duì)培養(yǎng)板上的噬菌斑進(jìn)行計(jì)數(shù),計(jì)算出cDNA文庫(kù)滴度為3.88×107PFU/mL。用預(yù)吸附的感染兔血清對(duì)棘阿米巴原蟲(chóng)cDNA文庫(kù)進(jìn)行初篩和復(fù)篩,獲得3個(gè)持續(xù)陽(yáng)性克隆(圖2)。根據(jù)測(cè)序結(jié)果,采用NCBI-Blastp對(duì)氨基酸序列的同源性進(jìn)行比對(duì)。如表1顯示,克隆1插入序列長(zhǎng)度為956 bp,含有一個(gè)774 bp的開(kāi)放閱讀框架,編碼258個(gè)氨基酸,分子量大小為29.13 kDa,GenBank注釋為肌動(dòng)蛋白1(actin1);克隆2插入序列長(zhǎng)度為658 bp,含有一個(gè)234 bp的開(kāi)放閱讀框架,編碼78個(gè)氨基酸,分子量大小為8.96 kDa,GenBank注釋為聚泛素(polyubiquitin);克隆3插入序列長(zhǎng)度為1 290 bp,含有一個(gè)564 bp的開(kāi)放閱讀框架,編碼188個(gè)氨基酸,分子量大小為21.36 kDa,GenBank注釋為熱休克蛋白20(HSP20)。
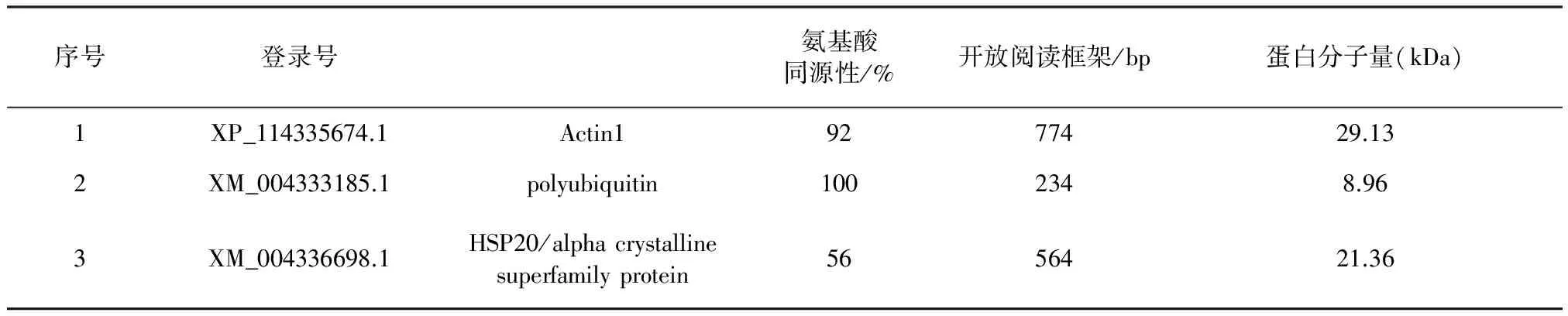
表1 3個(gè)陽(yáng)性克隆序列比對(duì)分析
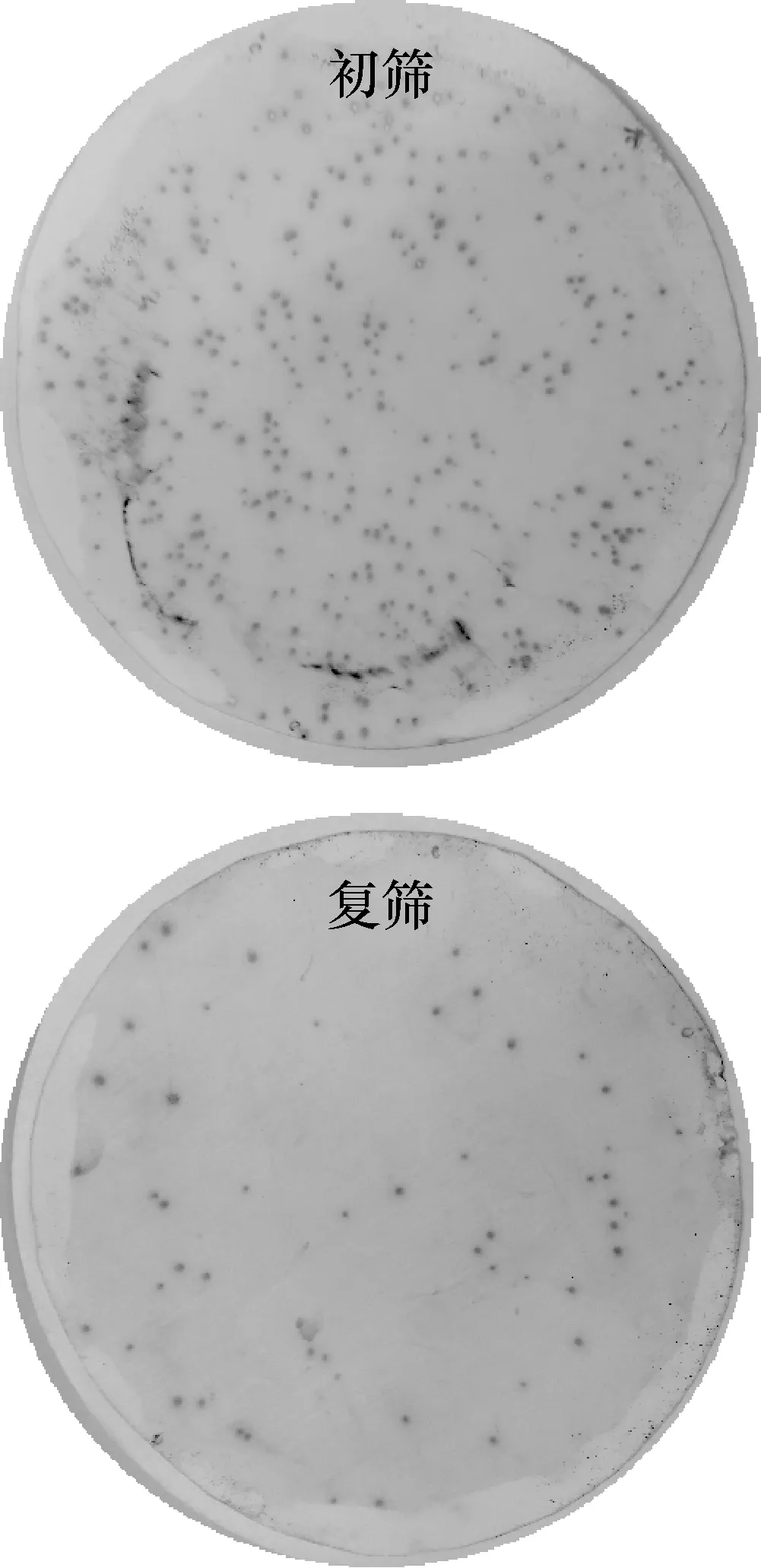
圖2 棘阿米巴cDNA文庫(kù)的免疫學(xué)篩選
根據(jù)測(cè)序結(jié)果設(shè)計(jì)特異性引物,以棘阿米巴原蟲(chóng)cDNA為模板進(jìn)行PCR擴(kuò)增鑒定,結(jié)果顯示,3個(gè)陽(yáng)性克隆全部擴(kuò)增出特異條帶,插入的cDNA片段大小分別為774 bp、234 bp和564 bp(圖3),與序列比對(duì)結(jié)果一致。
3 討論
棘阿米巴角膜炎(AK)是由自由生棘阿米巴原蟲(chóng)感染引起的一種致盲性眼病。其發(fā)生與一定的危險(xiǎn)因素有關(guān),如佩戴角膜接觸鏡、接觸污染的水源、角膜擦傷、眼部外科手術(shù)以及機(jī)體抵抗力降低等。棘阿米巴原蟲(chóng)的生活史包括滋養(yǎng)體和包囊兩個(gè)階段,滋養(yǎng)體的繁殖速度極快,感染包囊3 d內(nèi)可轉(zhuǎn)變?yōu)樽甜B(yǎng)體,侵入組織或經(jīng)過(guò)治療后又可以轉(zhuǎn)變成包囊,包囊抵抗力極強(qiáng),不易被殺滅,故該病治療預(yù)后不良[6-9]。臨床診斷的標(biāo)準(zhǔn)為病原學(xué)診斷,其樣本的采集主要為角膜刮片,診斷率低,不易被患者所接受。此外,由于AK患者早期癥狀不特異,臨床上容易和病毒性或真菌性角膜炎混淆,發(fā)生漏診、誤診和誤治,導(dǎo)致疾病的惡化[10-11]。因此對(duì)AK感染的預(yù)防和早期診斷一直是亟待解決的問(wèn)題。隨著分子生物學(xué)和分子免疫學(xué)的發(fā)展,基因工程重組診斷抗原和分子疫苗的研究成為診斷試劑,以及疫苗研發(fā)的重要手段。cDNA表達(dá)文庫(kù)和感染血清篩選是分離和鑒定抗原候選基因的常用方法之一。
前期工作中,課題組通過(guò)SMART法構(gòu)建了棘阿米巴原蟲(chóng)的cDNA表達(dá)文庫(kù)。在本研究中通過(guò)角膜注射構(gòu)建棘阿米巴角膜炎兔模型,并獲得用于文庫(kù)免疫學(xué)篩選的感染血清。根據(jù)抗體滴度的變化規(guī)律,選用感染后第7、14、21天和第28天的混合血清,去除E.coliXL1-Blue交叉反應(yīng)性后,對(duì)文庫(kù)進(jìn)行免疫學(xué)篩選。經(jīng)過(guò)三輪的初篩和復(fù)篩,共得到6個(gè)基因的表達(dá)產(chǎn)物可以與感染血清發(fā)生特異性結(jié)合。經(jīng)序列比對(duì)后,其中3個(gè)基因(actin1、polyubiquitin和HSP20)在棘阿米巴原蟲(chóng)基因庫(kù)中具有明確的注釋。為進(jìn)一步的基因克隆,原核表達(dá)系統(tǒng)的構(gòu)建、誘導(dǎo)表達(dá)和鑒定,以及AK的免疫診斷和疫苗的研究奠定了基礎(chǔ),但三者在棘阿米巴入侵和致病過(guò)程中的作用有待進(jìn)一步研究。
參考文獻(xiàn):
[2] Carnt Nicole,Robaei Dana,Watson Stephanie L,etal. The Impact of Topical Corticosteroids Used in Conjunction with Antiamoebic Therapy on the Outcome of Acanthamoeba Keratitis[J]. Ophthalmology,2016,123(5):984-990.
[3] 王月華,馮憲敏,李瑤,等.棘阿米巴原蟲(chóng)全cDNA文庫(kù)的構(gòu)建[J].中國(guó)病原生物學(xué)雜志,2014,9(5):452-454.
[4] 王月華,鄭文彧,趙麗薇,等.兔棘阿米巴角膜炎模型血清抗體效價(jià)分析[J].中國(guó)寄生蟲(chóng)學(xué)與寄生蟲(chóng)病雜志,2014,32(4):324-326。
[5] Xianmin Feng,Wenyu Zheng,Yuehua Wang,etal. A Rabbit Model of Acanthamoeba Keratitis That Better Reflects the Natural Human Infection[J]. Anat Rec (Hoboken),2015,298(8):1 509-1 517.
[6] Palme Christoph, Steger Bernhard, Haas Gertrud,etal. Bechrakis Nikolaos E. Severe reactive ischemic posterior segment inflammation in Acanthamoeba keratitis: Case report of a?patient with Sj?gren's syndrome[J].Spektrum der Augenheilkunde,2017,31(1):10-13.
[7] Siddiqui Ruqaiyyah,Aqeel Yousuf,Khan Naveed.Ahmed.The use of dimethyl sulfoxide in contact lens disinfectants is a potential preventative strategy against contracting Acanthamoeba keratitis[J]. Cont Lens Anterior Eye,2016,39(5):389-393.
[8] Shokri Azar,Sarvi Shahabeddin,Daryani Ahmad,etal. Isolation and Genotyping of Acanthamoeba spp. as Neglected Parasites in North of Iran[J]. Korean J Parasitol,2016,54(4):447-453.
[9] Fabres Laura Fuhrich,Rosa Dos Santos,Sayonara Peixoto,etal.Isolation and identification of Acanthamoeba spp. from thermal swimming pools and spas in Southern Brazil[J]. Acta Parasitol,2016,61(2):221-227.
[10] 李穎超,孫中華,吳欣怡.激光共聚焦顯微鏡診斷棘阿米巴角膜炎[J].山東大學(xué)耳鼻喉眼學(xué)報(bào),2013,27(1):72-76.
[11] 秦茜,鄭美琴,汪盈,等.快速診斷早期棘阿米巴角膜炎qPCR方法的建立及應(yīng)用[J].中國(guó)病原生物學(xué)雜志,2014,9(3):249-253.

