胸段食管癌病變上擴張食管在放療期間靶區范圍及周圍危及器官劑量與體積變化情況分析
魏曉廣,鄭佳南陽市第一人民醫院消化內科,河南 南陽473 南陽市中心醫院耳鼻喉科,河南 南陽473
目前,食管癌的放療方式主要包括調強放射治療(intensity modulated radiotherapy,ⅠMRT)和三維適形放射治療(three dimensional conformal radio‐therapy,3DCRT)。這兩種方式不僅可以最大程度地增加靶區的治療劑量,還可以有效地減少周圍正常組織的照射劑量,進而減少放射相關損傷的發生[1];然而,在放療期間由于腫瘤縮小等原因,照射到腫瘤的治療劑量出現變化,放療劑量損失,癌癥復發率增加。中國部分患者食管明顯擴張的原因多為腫瘤發現較晚,已出現各種程度的積氣、擴張和積液。在放療過程中,腫瘤縮小,食管擴張減輕。此時若仍然按照最初的靶區范圍放療,使脊髓和雙肺等正常組織受到不必要的照射,影響食管腫瘤照射劑量[2‐3]。本研究對胸段食管癌病變上擴張食管在放療期間的體積、靶區范圍的變化和周圍危及器官照射劑量的變化情況進行了分析,現報道如下。
1 一般資料
回顧性分析2014年1月至2015年10月南陽市第一人民醫院診治的125例胸段食管癌放療患者的臨床資料。納入標準:①未進行過手術和放療的胸段食管癌患者;②可以在放療過程中行復位檢查;③患者體力活動狀態(performance status,PS)評分≤2分(若評分>2分,表示患者不能自由走動和生活不能完全自理);④胸段食管癌明顯阻塞。排除標準:①術前有其他危重疾病;②胸腔臟器中有積液。125例患者中,男85例,女40例;年齡為51~80歲,平均為(65.0±5.6)歲;臨床TNM分期:Ⅰ期有66例,Ⅱ期有49例,Ⅲ期有10例;有包膜侵犯為73例,無包膜侵犯為52例;有淋巴管侵犯為84例,無淋巴管侵犯為41例;有肌肉侵犯為79例,無肌肉侵犯為46例。
2 方法
2.1 放療勾畫靶區與復位計劃
2.1.1 勾畫新靶區和危及器官按照靶區在放療復位時的變化情況勾畫新的靶區。125例患者的新靶區劃分均由本研究負責人完成,并由南陽市第一人民醫院3位資歷較深的放療科醫師指導。勾畫靶區和危及器官:①大體腫瘤體積(gross tu‐mor volume,GTV)在食管癌中界定較為明確,原發腫瘤的長度是根據腔內超聲等內窺鏡結果結合CT圖像進行勾畫。②計劃靶體積(plan target volume,PTV)界定可以參考GTV的外形,軸向外擴1.5 cm,縱向外擴3.0 cm。③危及器官,肺部采用放射治療計劃系統(radiotherapy treatment planning system,TPS)軟件中的自動勾畫工具勾畫肺部采之后人工對其進行修改,使支氣管和氣管不包括在內;脊髓先調整CT窗位和窗寬等指標,使CT可以清晰地反映脊柱椎管內的脊髓組織,隨后對其進行勾畫[4]。
2.1.2 制定復位圖像的雜交計劃和新的復位計劃將CT1定義為125例患者放射治療開始時定位的CT圖像,將PTV1定義為最初治療計劃靶區,將Plan1定義為初始定位計劃。將CT2定義為復位時定位的CT圖像,將PTV2定義為按照復位重新勾畫的計劃靶區,將CT2/Plan2定義為專家按照PTV2制定的復位計劃,在CT2上中心復制最初的定位治療計劃,即復位圖像的雜交計劃,以CT2/Plan1再次定義。重新勾畫靶區,按照125例患者對應的臨床癥狀給予合適的處方劑量[5]。
評價復位圖像計劃的標準包括各斷面等劑量分布和劑量‐體積直方圖(dose volume histogram,DVH),計劃評價可以通過DVH有效地比較各類危及器官受照劑量體積的不同,同時需要合理地限制危及器官劑量和處方劑量。通過比較CT2/Plan1和CT2/Plan2的差異,研究因解剖結構改變而引起的劑量改變。所有患者在治療前均進行食管造影檢查,并計算食管狹窄率。食管狹窄率(stenotic ra‐tio)=(長徑-短徑)/長徑×100%[6]。
2.2 統計學方法
采用SPSS 17-.0統計軟件分析數據,計量資料以均數±標準差(±s)表示,組間比較采用兩獨立樣本t檢驗和配對t檢驗。P<0.05為差異有統計學意義。
3 結果
3.1 食管狹窄率與GTV
患者放療復位時GTV平均體積、食管狹窄率、食管病灶上方擴張最小橫徑、食管病灶上方擴張最大橫徑、復位GTV體積/初始GTV體積均小于放療前,差異有統計學意義(P<0.05)。(表1)
3.2 危及器官體積與劑量變化
患者放療復位時,PTV體積在復位計劃(CT2/Plan2,重新計劃)中大于雜交計劃(CT2/Plan1,沒有重新計劃),而雙肺平均劑量、脊髓平均最大劑量、雙肺受照體積在復位計劃中小于雜交計劃,差異均有統計學意義(P<0.05)。(表2)
4 討論
表1 放療期間食管狹窄率和GTV的變化(± s)
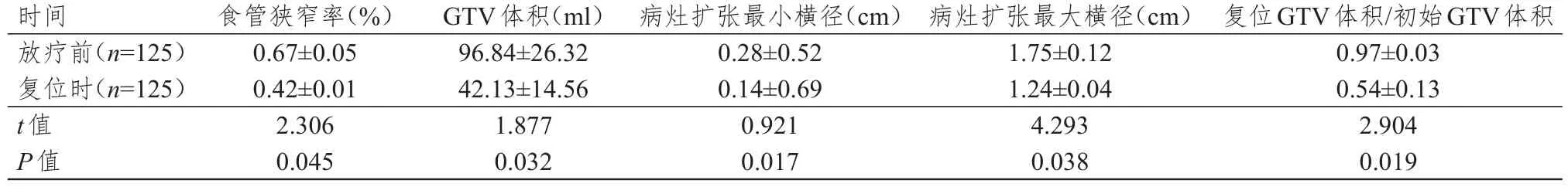
表1 放療期間食管狹窄率和GTV的變化(± s)
時間放療前(n=125)復位時(n=125)t值P值食管狹窄率(%)0.67±0.05 0.42±0.01 2.306 0.045 GTV體積(ml)96.84±26.32 42.13±14.56 1.877 0.032病灶擴張最小橫徑(cm)0.28±0.52 0.14±0.69 0.921 0.017病灶擴張最大橫徑(cm)1.75±0.12 1.24±0.04 4.293 0.038復位GTV體積/初始GTV體積0.97±0.03 0.54±0.13 2.904 0.019
食管癌屬于比較常見的惡性腫瘤,與環境、飲食習慣等不良因素有關。近年來,隨著體檢的普及和醫療水平的提髙,中國食管癌患者的生存率逐漸增加。但是,與其他國家的發病率和病死率比較,依舊很高[7‐8]。據相關文獻報道,不同腫瘤對放療的敏感性不同,這對腫瘤的消退速度有一定的影響;而中晩期食管癌的不同分型對放療的敏感性也有所不同[9],因此,若想有效地延長食管癌患者的生存期,必須規范食管癌的治療。胸上段和頸段食管癌患者,由于其特殊的解剖位置,進行手術切除治療,對醫師的技術要求較高,成功率較低;因此,這類食管癌患者的治療方式主要為放射治療[10]。相關資料顯示,由于胸段上部、頸段食管癌比較趨近于區域性和局限性生長,進行放療的效果優于手術治療的效果,對患者的相關損傷更少,因此,本研究中125例胸段食管癌患者主要采用放射治療。
表2 危及器官-體積和劑量變化在復位計劃、雜交計劃中的比較(± s)
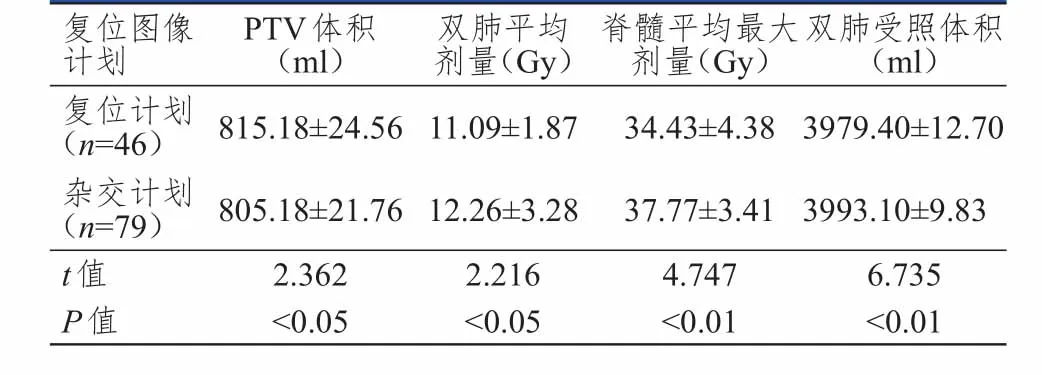
表2 危及器官-體積和劑量變化在復位計劃、雜交計劃中的比較(± s)
復位圖像計劃復位計劃(n=46)雜交計劃(n=79)t值P值815.18±24.56 805.18±21.76 2.362<0.05 11.09±1.87 12.26±3.28 2.216<0.05 34.43±4.38 37.77±3.41 4.747<0.01 3979.40±12.70 3993.10±9.83 6.735<0.01 PTV體積(ml)雙肺平均劑量(Gy)脊髓平均最大劑量(Gy)雙肺受照體積(ml)
125例患者的初始靶區劃分均由本研究的負責人完成,并由南陽市第一人民醫院資歷較深的3位放療科醫師指導。在GTV的具體勾畫方面,目前醫療界對食管癌患者的正常食管壁和病灶部分的界限劃分,仍沒有明確的標準。大多數學者比較認可以下兩種標準:①在CT掃描影像中,正常食管管壁與其他周圍組織結構可以被清晰地分辨;②管壁的厚度<5 mm,與周圍器官組織分界清晰[11‐13]。內靶區(internal target volume,ⅠTV)和臨床靶區(clinical targer volume,CTV)為計劃靶區PTV的兩種主要形式,還包括由擺位誤差和放療造成的靶區范圍、位移等變化,使受照范圍擴大,這樣勾畫新靶區才可以使治療病灶時獲得充足的受照劑量。在胸段食管癌患者的放療過程中,大血管的搏動、呼吸的起伏以及心臟的跳動等均可能造成靶區移位;同時,食管不同程度的充盈狀態和食管的蠕動也會使腫瘤出現移位。具體計劃靶區邊界可以依據CT圖像得到“運動GTV”,也可以通過常規模擬機監測得到圖像。評估三維治療計劃,不僅需要參考正常組織的受照劑量,同時還需要考慮靶區的適形度[14‐15],與本研究相關的雙肺和脊髓的受照劑量應該重點考慮。本研究的計劃評估對象來源于DVH。采用DVH的原因是其可以同時實施多個治療計劃的優選和評估,并且可以決定是否能接受一個治療計劃。食管癌周圍的雙肺和脊髓照射劑量參考如下:脊髓最大劑量≤45 Gy;肺V20≤30%,肺V30≤20%,肺平均劑量(mean lung dose,MLD)≤13 Gy。為了避免因周圍正常組織的照射體積、劑量過大而出現較危險的放射性損傷,一般在靶區劑量分布已經滿足相關要求的情況下,需要嚴格控制像脊髓這類組織的最大受照劑量必須低于最低耐受劑量。肺是放射性敏感器官,對患者進行放療時極易出現各種并發癥,如肺炎和胸悶等。通過放療時肺組織的受照面積、受照劑量,在一定程度上可以預測肺炎的發生率。
本研究通過分析DHV得出如下結果:比較125例患者復位時和初始時GTV的體積變化,發現其GTV體積在放療過程中呈減少趨勢,比較兩組數據,差異有統計學意義(P<0.05)。根據研究數據得出,放療期間腫瘤病灶發生顯著改變,改善了食管梗阻的情況,使上段擴張食管出現不同程度的復縮,造成了實施食管癌放療時各種不確定情況的發生。比較患者放療復位時雜交計劃(CT2/Plan1)和復位計劃(CT2/Plan2),危及器官的劑量和體積均在逐漸減少,差異有統計學意義(P<0.05)。這個結果顯示,在放療過程中,周圍正常組織和病灶本身均在不斷變化,脊髓和肺的受照劑量和體積均發生了改變。
綜上所述,為了提高胸段食管癌患者,特別是伴有上食管明顯擴張患者的生存質量,重新制定計劃和行CT掃描在行胸段食管癌放療過程中非常重要。
[1]顏丙峰.CT觀察胸段食管癌氣管食管溝淋巴結轉移的臨床意義探討[J].檢驗醫學,2016,31:11‐12.
[2]黎亮,湯昔康.術前放療聯合小切口胸段食管癌根治術治療胸段食管癌療效及其對患者肺功能的影響[J].臨床和實驗醫學雜志,2015,14(12):1020‐1022.
[3]毛亞威.小切口胸段食管癌根治術在胸段食管癌治療中的療效觀察[J].臨床醫藥文獻電子雜志,2015,2(32):6601.
[4]陳滿雙,馬文竹,許小輝,等.放射療法對乳牙釉質硬度和微觀形態的影響[J].上海交通大學學報(醫學版),2016,36(3):344‐348.
[5]修光宏,王曉東.高壓氧聯合放射療法治療肺轉移瘤48例療效分析[J].中華航海醫學與高氣壓醫學雜志,2016,23(2):160‐161.
[6]王杰,尹立杰,丁田貴.希羅達聯合放射療法在直腸癌患者中的應用效果觀察[J].中國療養醫學,2017,26(2):204‐205.
[7]褚耀華.直腸癌術后調強放療和適形放療靶區劑量學研究和危及器官毒性觀察分析[J].醫藥衛生(文摘版),2016,2:91.
[8]常巧梅,陳凡,劉曉剛,等.高海拔地區LSCLC按誘導化療前/后不同靶區范圍放療的隨機對照研究[J].中華腫瘤防治雜志,2015,22(11):86‐88.
[9]張紅志,鄧小武,徐利明,等.調強放射治療物理技術指南[C]//中華醫學會放射腫瘤治療學分會物理學組.北京:第九次全國放射腫瘤治療學學術會議,2012:202‐207.
[10]謝雅琳.胸段食管癌病變上擴張食管放療過程對腫瘤和危及器官劑量影響研究[D].濟南:山東大學,2015.
[11]黃智昊,鐘陸行.食管癌放療技術及放療方式研究進展[J].中國腫瘤臨床,2016,43(12):527‐530.
[12]Li H,Li Y,Liu X,et al.Patterns of lymphatic spread in thoracic esophageal squamous cell carcinoma:a study of 313 cases[J].Zhonghua Zhong Liu Za Zhi,2015,37(11):841‐844.
[13]Chang JY,Senan S,Paul MA,et al.Stereotactic ablative radiotherapy versus lobectomy for operable stageⅠnon‐small‐cell lung cancer:a pooled analysis of two ran‐domised trials[J].Lancet Oncol,2015,16(6):630‐637.
[14]Teh BS,Lu HH,Sobremonte S,et al.The potential use of intensity modulated radiotherapy(ⅠMRT)in women with pectus excavatum desiring breast‐conserving therapy[J].Breast J,2001,7(4):233‐239.
[15]Sant M,Chirlaque Lopez MD,Agresti R,et al.Survival of women with cancers of breast and genital organs in Eu‐rope 1999‐2007:results of the EUROCARE‐5 study[J].Eur J Cancer,2015,51(15):2191‐2205.

