多重易位小麥新品種(系)的選育及細胞學鑒定
楊漫宇,楊足君,楊武云,楊恩年
(1.四川省農業(yè)科學院作物研究所,四川成都 610066; 2.電子科技大學生命科學與技術學院,四川成都 611731)
小麥是世界上重要的糧食作物之一,小麥生產的安全性對經濟發(fā)展和社會穩(wěn)定均具有重要意義。而小麥-外源染色體易位新種質的創(chuàng)制對于培育突破性新品種具有舉足輕重的作用。有關染色體易位的研究,主要涉及小麥與其近緣種屬間的染色體易位,如黑麥屬[1-3]、簇毛麥屬[4-5]、偃麥草屬[6]等。由于大部分小麥-外源易位系都是非同源染色體間易位,補償性差,基因組重復或缺失,導致其農藝性狀差,很難直接用于小麥品種改良[7]。在利用異源染色體易位培育新品種方面,以小麥-黑麥1RS·1BL、小麥-簇毛麥6VS·6AL以及小偃6號中的小麥-長穗偃麥草易位這3個易位系的應用最為成功。目前,利用1RS·1BL和6VS·6AL易位培育出的小麥新品種,在世界上數(shù)十個國家中推廣應用[8-9]。在我國,以小麥-黑麥1RS·1BL易位系為親本,育成了豐抗號、矮孟牛系列、魯麥8 號、魯麥11 號等一系列抗逆、抗病、高產小麥品種[10];以小麥-簇毛麥6VS·6AL易位系為親本,育成了南農9918、石麥14、揚麥18、內麥系列等一批小麥品種[9,11];以小偃6號為親本育成并大面積推廣的品種已知有49個[12]。然而,在利用小麥-異源易位染色體的同時,還應關注小麥染色體之間的易位。例如,歐洲培育的小麥品種大多含有5BS·7BS和5BL·7BL易位染色體,推測這對相互易位染色體可能更適應歐洲氣候條件[13-14]。大量的研究表明[15-20],雙重或多重易位系具有良好的抗病性或優(yōu)異的農藝性狀特性,能夠用于小麥育種改良。如小麥-黑麥-簇毛麥純合雙重易位系(1RS·1BL,6VS·6AL)和小麥-黑麥-簇毛麥純合三重易位系(1RS·7DS,1BL·7DL,6VS·6AL)具有良好的農藝性狀和白粉病抗性[15-17];小麥-簇毛麥-小傘山羊草雙重易位系(6VS·6AL,6AL·6AS-6US)育性優(yōu)良且抗白粉病[18];小麥-黑麥-長穗偃麥草雙重易位系(1RS·1BL,7DL-7Ai)抗病性好、耐旱、產量高[19];小麥-黑麥三重易位(5BS·7BS,5BL·7BL, 4BL·5RL )對銅元素具有高效利用率[20]。亓增軍等[17]認為,將不同類型的小麥易位系聚合到同一遺傳背景,培育多重易位系,不僅能提高品種的抗性,還能拓寬品種的遺傳基礎,對小麥的品種改良和種質創(chuàng)新都具有一定的理論意義和應用價值。Belan等[19]報道,小麥-黑麥-長穗偃麥草雙重易位系Lutescens 242/97-2-10在俄羅斯登記命名為春小麥品種Omskaya 41且已進入品種試驗。然而,利用小麥染色體間的多重易位培育小麥品種(系)的報道還較少。鑒于此,本研究利用分子細胞遺傳學方法對四川省農業(yè)科學院作物研究所育成的小麥品種及高代品系進行分析鑒定,以期篩選出多重易位品種(系),為小麥染色體間多重易位染色體在小麥育種中的應用提供證據(jù)和新的思路。
1 材料與方法
1.1 供試材料
供試材料為小麥品種川麥62以及兩個高代品系16EW381和16EW458,均由四川省農業(yè)科學院作物研究所創(chuàng)制。四川省農業(yè)科學院植物保護研究所鑒定川麥62高抗條銹病、高感白粉病。16EW381和16EW458選自于雜交組合內麥8號/2*川麥62,其中,內麥8號是6VS·6AL易位系[9]。
1.2 試驗方法
1.2.1 根尖中期細胞染色體制片
將待鑒定的種子置于墊有濕潤濾紙的培養(yǎng)皿中發(fā)芽(22~24 ℃),待根尖長至1~2 cm時取根,冰水處理22~24 h后,用卡諾氏固定液固定7 d,70%的酒精保存。酶解制片方法參照Han等[21]描述的方法:根尖放入酶液37 ℃水浴50~60 min;用70%酒精洗凈酶液,搗碎根尖;低速離心,倒掉酒精;適量冰醋酸重懸浮細胞;滴片,晾干;鏡檢觀察。
1.2.2 FISH鑒定
利用寡核苷酸探針Oligo-pSc119.2-1和Oligo-pTa535-1[22]對川麥62及其高代品系16EW381和16EW458的根尖中期染色體進行非變性FISH(ND-FISH)分析。寡核苷酸探針按照Tang等[22]描述的方法在序列5′末端加上6-羧基熒光素(6-carboxyfluorescein, 6-FAM)或6-羧基四甲基若丹明(6-carboxytetramethylrhodamine, Tamra)標記成綠色或紅色,由上海英駿生物技術有限公司合成。寡核苷酸探針序列詳見表1。原位雜交程序參照Fu等[23]描述的方法:將適量的探針加入2×SSC/1×TE Buffer中充分混勻備用,每張玻片加10 μL的雜交液后置于42 ℃恒溫箱中雜交1 h,雜交好的玻片于2×SSC溶液中洗脫(室溫),晾干后加10 μL含PI或DAPI的抗褪色劑進行染色,幾分鐘后使用OLYMPUS BX51熒光顯微鏡觀察并照相。
1.2.3 產量比較與抗病性鑒定
產量比較試驗:試驗采用隨機區(qū)組設計,3次重復,小區(qū)計產面積為13 m2,每個小區(qū)8行,行長6.5 m,行距25 cm,播種量以180萬株·hm-2為標準。以川麥62為對照。
條銹病抗性鑒定:采用條銹病生理小種條中30號、條中31號、條中32號及水源11的混合菌種接種誘發(fā)材料川育12,菌種由甘肅省農科院植物保護研究所賈秋珍提供。待供試材料充分發(fā)病時進行觀察并記載反應型(infection type,IT),按0、0;、1、2、3、4六級標準記載,其中,0、0;、1、2為抗病反應型,3和4為感病反應型[24]。白粉病抗性鑒定:采用田間自然發(fā)病法,待供試材料充分發(fā)病時采用0~9級的分級標準進行記載,其中,0為免疫,0;為近免疫,1~2為高抗,3~4為中抗,5~6為中感,7~9為高感[25]。
2 結果與分析
2.1 小麥品種川麥62的細胞學分析結果
隨機選取10粒川麥62種子進行根尖有絲分裂中期染色體的ND-FISH分析,結果發(fā)現(xiàn),10粒種子的染色體數(shù)目均為2n=42。以Tang等[22]利用寡核苷酸探針建立的中國春和綿陽11的標準核型作參考,分析發(fā)現(xiàn),川麥62含一對5BS·7BS易位染色體以及一對5BL·7BL易位染色體(圖1),而且10粒種子都含有這兩對相互易位染色體。
2.2 高代品系16EW381和16EW458的產量及抗病性
為了利用高抗白粉病的6VS·6AL易位系品種內麥8號改良川麥62高感白粉病的缺點,本課題組用川麥62與內麥8號雜交、回交,選育出了高代穩(wěn)定品系16EW381和16EW458。2017年度品種比較試驗結果(表2)表明,16EW381和16EW458的產量分別為5 365.50和5 160.30kg·hm-2,兩者產量在0.05水平上均顯著高于親本川麥62的產量(4 468.95 kg·hm-2)。抗病性鑒定結果(表2)表明,16EW381高抗條銹病和白粉病,16EW458中抗條銹病和高抗白粉病,川麥62高抗條銹病和高感白粉病。說明16EW381和16EW458比親本川麥62在產量和抗病性方面都得到了顯著改善。

表1 寡核苷酸探針序列Table 1 Sequences of oligonucleotide probes
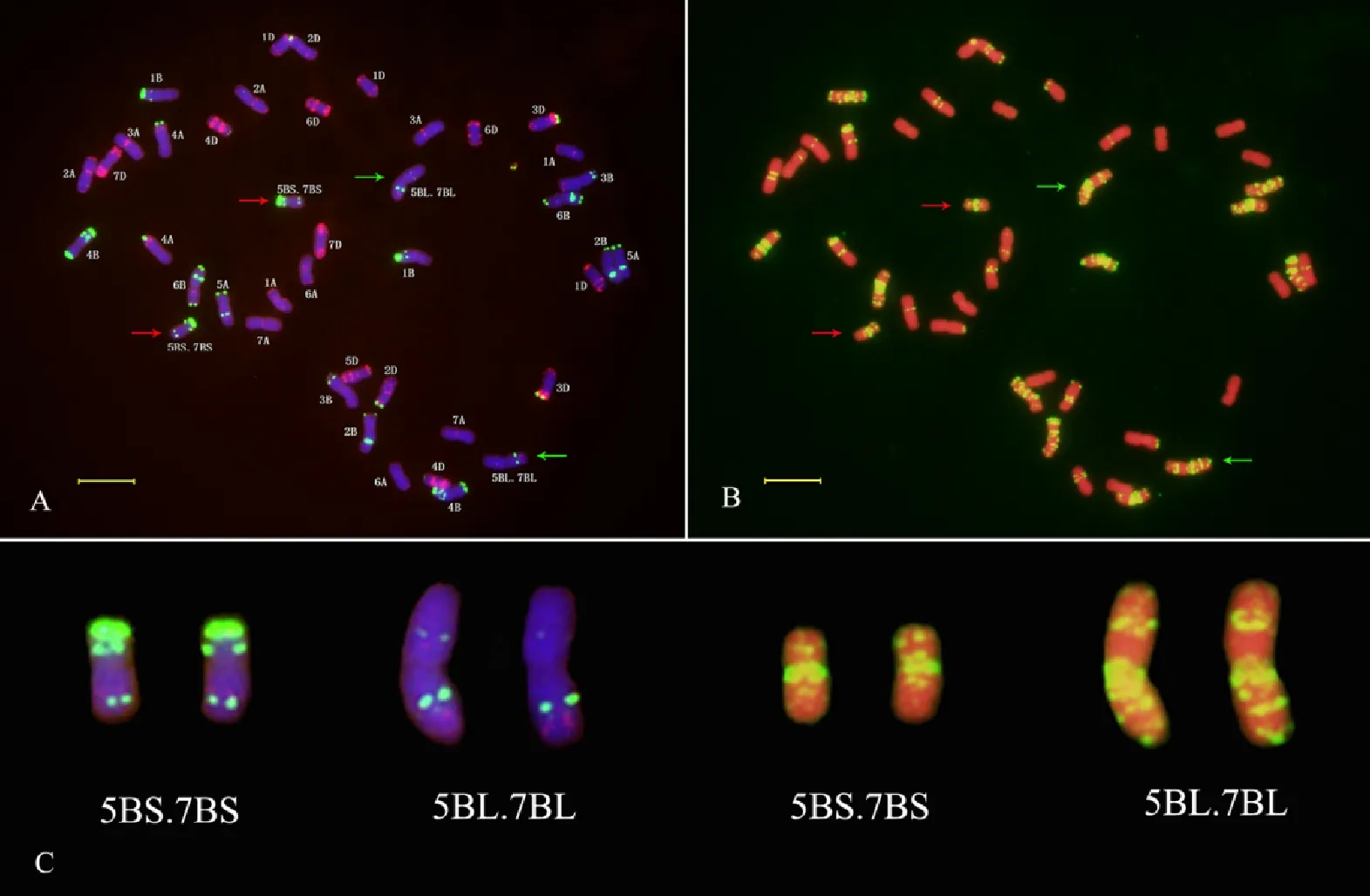
圖A中,以Oligo-pTa535(紅色信號)和Oligo-pSc119.2(綠色信號)作探針,染色體被DAPI染為藍色;圖B中,以Oligo-(GAA)7(黃色信號)作探針,染色體被PI染為紅色;紅色箭頭示5BS·7BS易位染色體,綠色箭頭示5BL·7BL易位染色體;圖C中,易位染色體來源于圖A和圖B;標尺為10 μm。
In Fig.A,the Oligo-pTa535(red) and Oligo-pSc119.2(green) were used as ND-FISH probes,and chromosomes were counterstained with DAPI(blue);In Fig.B,the Oligo-(GAA)7(yellow) were used as ND-FISH probes,and chromosomes were counterstained with PI(red);Red arrows indicate 5BS·7BS translocation chromosomes;Green arrows indicate 5BL·7BL translocation chromosomes;Translocation chromosomes in Fig.C were from Fig.A and Fig.B;Bar indicates 10 μm.
圖1川麥62根尖中期染色體的ND-FISH分析
Fig.1ND-FISHanalysisofmetaphasechromosomesinroot-tipofChuanmai62
2.3 高代品系16EW381和16EW458的細胞學分析結果
為了進一步明確16EW381和16EW458的染色體組成,隨機從這兩個品系及內麥8號中各選取10粒種子進行根尖中期染色體的ND-FISH分析,結果發(fā)現(xiàn),16EW381和16EW458染色體數(shù)目均為2n=42(圖3);16EW458含有來自于親本內麥8號的一對6VS·6AL易位染色體及來自于親本川麥62的一對5BS·7BS易位染色體和一對5BL·7BL易位染色體(圖1、圖2和圖3A~3C);16EW381除了含有來自雙親的6VS·6AL易位染色體、5BS·7BS易位染色體和5BL·7BL易位染色體以外,還發(fā)現(xiàn)有3B和5A染色體間發(fā)生的相互易位染色體,即3BS·5AS易位染色體和3BL·5AL易位染色體(圖1、圖2和圖3D~3F)。說明16EW381和16EW458的遺傳背景中都成功地轉入了6VS·6AL易位染色體,其中,16EW458是含有6VS·6AL、5BS·7BS和5BL·7BL易位染色體的三重易位系;16EW381是含有6VS·6AL、5BS·7BS、5BL·7BL、3BS·5AS和3BL·5AL易位染色體的五重易位系。
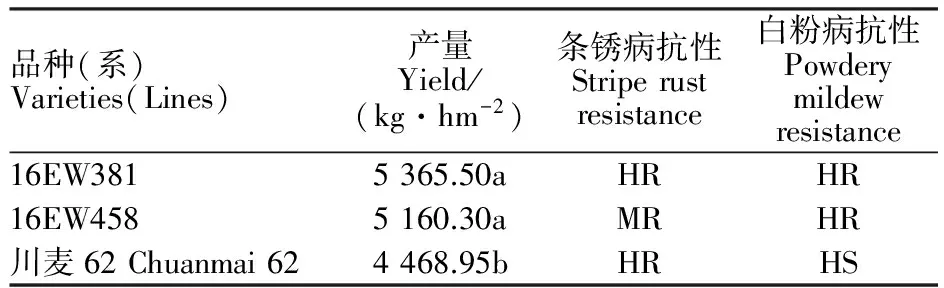
表2 產量比較和抗病性鑒定結果Table 2 Results of yield comparison and identification of resistance to stripe rust and powdery mildew
同列數(shù)據(jù)后不同字母表示差異在0.05水平顯著;HR:高抗;MR:中抗;HS:高感。
Different letters following the data indicated the difference was significant at 0.05 level;HR:High resistance;MR:Moderate resistance;HS:High susceptibility.
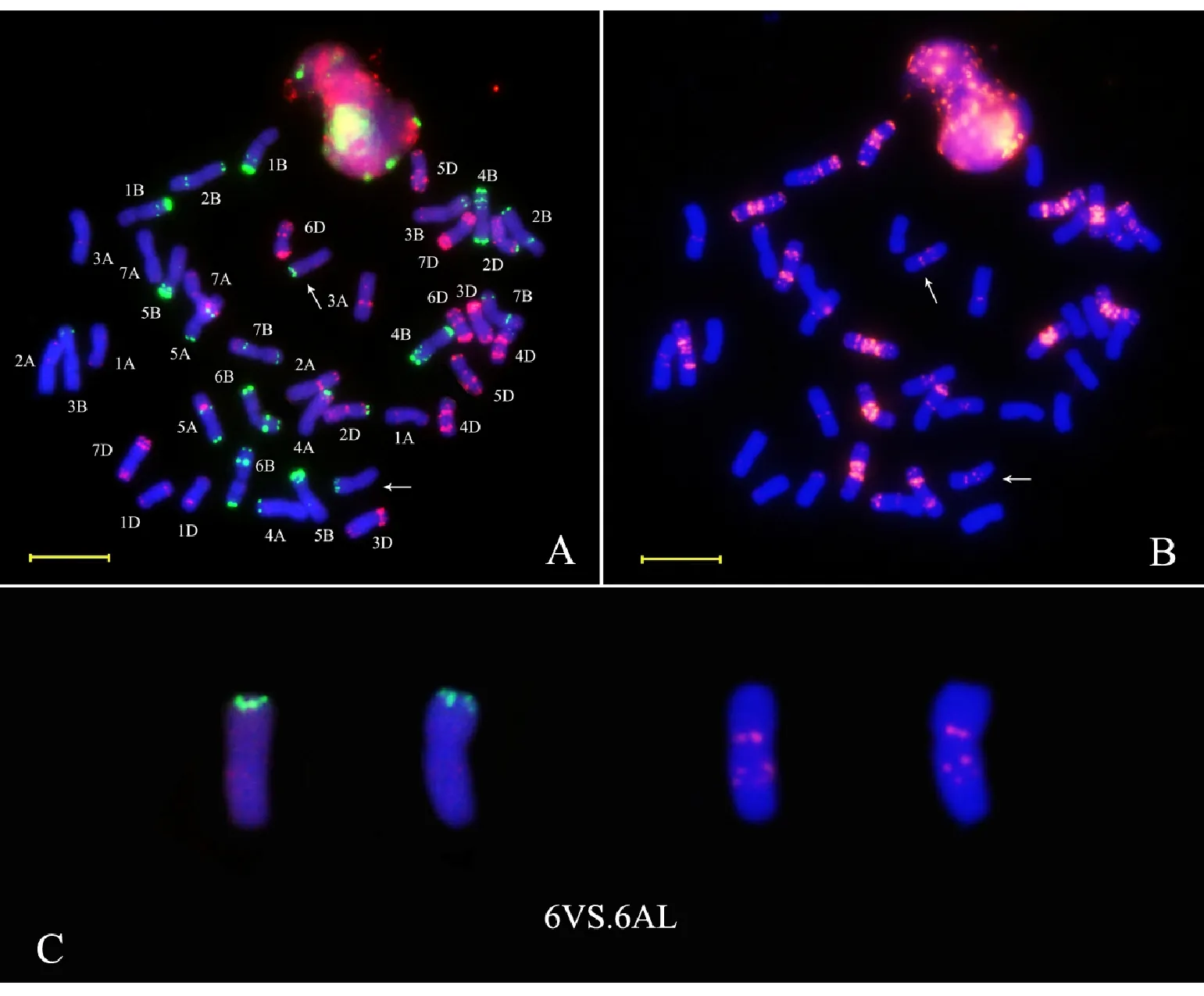
圖A中,以Oligo-pTa535(紅色信號)和Oligo-pSc119.2(綠色信號)作探針,染色體被DAPI染為藍色;圖B中,以Oligo-(GAA)7(紅色信號)作探針,染色體被DAPI染為藍色;箭頭示6VS·6AL易位染色體;圖C中,易位染色體來源于圖A和圖B;標尺長度為10 μm。
In Fig.A,the Oligo-pTa535(red) and Oligo-pSc119.2(green) were used as ND-FISH probes,and chromosomes were counterstained with DAPI(blue);In Fig.B,the Oligo-(GAA)7(red) were used as ND-FISH probes,and chromosomes were counterstained with DAPI(blue);Arrows indicate 6VS·6AL translocation chromosomes;Translocation chromosomes in Fig.C were from Fig.A and Fig.B;Bar indicates 10 μm.
圖2內麥8號根尖中期染色體的ND-FISH分析
Fig.2ND-FISHanalysisofmetaphasechromosomesinroot-tipofNeimai8
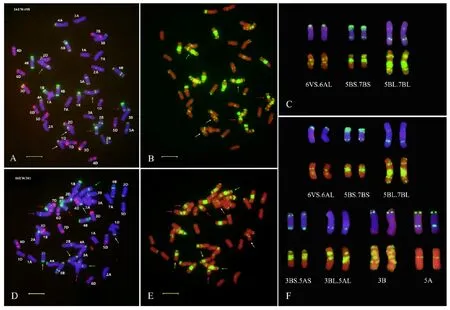
圖A和D中,以Oligo-pTa535(紅色信號)和Oligo-pSc119.2(綠色信號)作探針,染色體被DAPI染為藍色;圖B和E中,以Oligo-(GAA)7(紅色信號)作探針,染色體被PI染為紅色;白色箭頭指示6VS·6AL易位染色體;紅色箭頭指示5BS·7BS易位染色體;綠色箭頭指示5BL·7BL易位染色體;黃色箭頭指示3BS·5AS易位染色體;紫色箭頭指示3BL·5AL易位染色體;圖C中,易位染色體來源于圖A和圖B;圖F中,易位染色體來源于圖D和圖E,3B和5A染色體分別來源于圖1A和圖1B;標尺長度為10 μm。
In Fig.A and D,the Oligo-pTa535(red) and Oligo-pSc119.2(green) were used as ND-FISH probes,and chromosomes were counterstained with DAPI(blue);In Fig.B and E,the Oligo-(GAA)7(yellow) were used as ND-FISH probes,and chromosomes were counterstained with PI(red);White arrows indicate 6VS·6AL translocation chromosomes;Red arrows indicate 5BS·7BS translocation chromosomes;Green arrows indicate 5BL·7BL translocation chromosomes;Yellow arrows indicate 3BS·5AS translocation chromosomes;Purple arrows indicate 3BL·5AL translocation chromosomes;Translocation chromosomes in Fig.C were from Fig.A and Fig.B;In Fig.F, translocation chromosomes were from Fig.D and Fig.E,and chromosomes 3B and 5A were from Fig.1A and Fig.1B,respectively;Bar indicates 10 μm.
圖316EW458(A、B和C)和16EW381(D、E和F)根尖中期染色體的ND-FISH分析
Fig.3ND-FISHanalysisofmetaphasechromosomesinroot-tipof16EW458(A,BandC)and16EW381(D,EandF)
3 討 論
3.1 熒光原位雜交技術快速鑒定小麥多重易位系輔助育種選擇
通過染色體易位將外源優(yōu)異基因導入小麥是小麥品種改良的重要途徑之一,而外源遺傳物質及小麥基因組本生狀態(tài)的準確鑒定對育種工作者顯得十分重要。以重復序列作探針的FISH技術作為識別小麥染色體的一個強有力工具被廣泛應用。利用重復序列pSc119.2和Afa 家族進行FISH分析, Kubalakova等[26]和Sepsi等[27]成功地識別了小麥所有染色體。Komuro等[28]利用重復序列pSc119.2、pTa-535以及簡單重復序列GAA對小麥A、B、D染色體組進行了準確鑒定。Tang 等[22]利用寡核苷酸探針Oligo-pSc119.2和Oligo-pTa535分別建立了小麥品種中國春和綿陽11的標準核型圖。本研究采用FISH技術對材料進行分析,準確鑒定出每個材料的染色體組成:川麥62含有5BS·7BS和5BL·7BL易位染色體; 16EW458含有6VS·6AL、5BS·7BS和5BL·7BL易位染色體;16EW381含有6VS·6AL、5BS·7BS、5BL·7BL、3BS·5AS和3BL·5AL易位染色體。因此,在小麥多重易位染色體的聚合過程中,利用FISH技術輔助育種選擇,確認被鑒定個體的染色體組成與結構變異, 可以實現(xiàn)早期定向選擇,加快小麥多重易位系選育及新品種(系)培育進程。
3.2 多重易位系的應用價值
在小麥品種改良中,除了利用與其近緣種屬的種間染色體易位外,小麥種內染色體相互易位的應用也較為成功,如5BS·7BS和5BL·7BL。研究發(fā)現(xiàn),該雙重易位的5BS染色體臂上含有條銹病成株抗性基因[13,29],Law等[13]認為,正是由于該抗性基因使得5BS·7BS和5BL·7BL易位染色體廣泛存在于許多歐洲冬小麥品種中,如法國冬小麥品種Cappelle-Desprez。本研究的細胞學鑒定結果表明,川麥62是5BS·7BS和5BL·7BL雙重易位系。根據(jù)來源,川麥62的選育雜交組合為Fr3/2*SW1862,其中,母本Fr3是引進的法國強冬性高抗條銹病優(yōu)質材料,父本SW1862來源于自育選系。經細胞學鑒定結果表明,F(xiàn)r3含有5BS·7BS和5BL·7BL易位染色體,而SW1862不含有該易位染色體,這說明川麥62中雙重易位染色體來自于法國材料Fr3。因此,我們推測川麥62的條銹病抗性可能來自于5BS上的成株抗性基因。
由于簇毛麥6VS上攜帶有白粉病抗性基因 Pm21,自1995年以來, 6VS·6AL易位系在中國及其他23個國家中對已知的白粉病生理小種均表現(xiàn)免疫,在世界范圍內廣受小麥育種家的關注[30]。在中國,由于優(yōu)良的白粉病抗性,6VS·6AL易位系作為親本被廣泛應用于小麥育種工程。據(jù)報道,6VS·6AL易位系品種在國內的種植面積已超過340萬hm2[30]。本研究中,為了改良小麥品種川麥62高感白粉病的特性,利用川麥62與6VS·6AL易位系品種內麥8號雜交并回交,成功選育出了產量高于親本川麥62且抗條銹病和白粉病的高代品系16EW381和16EW458。FISH分析發(fā)現(xiàn),兩個高代品系為多重易位系,不僅成功地引進了6VS·6AL易位染色體,使川麥62的白粉病抗性得到改良,同時也聚合了川麥62的5BS·7BS和5BL·7BL易位染色體。在高代品系16EW381中,還發(fā)現(xiàn)了3BS·5AS和3BL·5AL新易位染色體,我們認為該新易位的產生可能是6VS·6AL、5BS·7BS和5BL·7BL易位染色體聚合過程中誘導產生的,但誘導易位形成的機制有待于進一步研究。此外,3BS·5AS和3BL·5AL易位是否在抗性或農藝性狀方面存在利用價值,能否如5BS·7BS和5BL·7BL易位一樣被廣泛應用也有待于進一步研究。
綜上所述,多重易位系將不同類型的小麥易位染色體聚合到同一遺傳背景培育,使優(yōu)異基因得到累加和聚合,提高品種的抗性、增進小麥遺傳變異是切實可行的,本研究將為今后的小麥育種及種質創(chuàng)新提供一個新的方向。
[1] BELAN I A,ROSSEEVA L P,TRUBACHEEVA N V,etal.Important agronomic traits of Omskaya 37 lines of spring wheat cultivar carrying wheat-rye translocation 1RS.1BL [J].RussianJournalofGenetics:AppliedResearch,2011,1(3):241.
[2] AN D G,ZHENG Q,ZHOU Y L,etal.Molecular cytogenetic characterization of a new wheat-rye 4R chromosome translocation line resistant to powdery mildew [J].ChromosomeResearch,2013,21(4):419.
[3] FU S L,REN Z L,CHEN X M,etal.New wheat-rye 5DS-4RS·4RL and 4RS-5DS·5DL translocation lines with powdery mildew resistance [J].JournalofPlantResearch,2014,127(6):743.
[4] ZHANG R Q,CAO Y P,WANG X E,etal.Development and characterization of aTriticumaestivum-H.villosaT5VS·5DL translocation line with soft grain texture [J].JournalofCerealScience,2010,51(2):220.
[5] ZHANG R Q,HOU F,FENG Y G,etal.Characterization of aTriticumaestivum-DasypyrumvillosumT2VS·2DL translocation line expressing a longer spike and more kernels traits [J].TheoreticalandAppliedGenetics,2015,128(12):2415.
[6] ZHAN H X,ZHANG X J,LI G R,etal.Molecular characterization of a new wheat-Thinopyrumintermediumtranslocation line with resistance to powdery mildew and stripe rust [J].InternationalJournalofMolecularSciences,2015,16(1):2162.
[7] 任正隆,張懷瓊.小麥-黑麥染色體小片段易位的誘導[J].中國科學:C輯,1997,27(3):258.
REN Z L,ZHANG H Q.Induction of small-segment-translocation between wheat and rye chromosomes [J].ScienceinChina(SeriesC),1997,27(3):258.
[8] RABINOVICH S V.Importance of wheat-rye translocations for breeding modern cultivar ofTriticumaestivumL.[J].Euphytica,1998,100(1-3):323.
[9] 李桂萍,陳佩度,張守忠,等.小麥-簇毛麥6VS/6AL易位染色體對小麥農藝性狀的影響[J].植物遺傳資源學報,2011,12(5):744.
LI G P,CHEN P D,ZHANG S Z,etal.Effects of the 6VS/6AL translocation chromosome on agronomic characteristics of wheat [J].JournalofPlantGeneticResources,2011,12(5):744.
[10] 蘇亞蕊,李玉閣,李鎖平.小麥-黑麥1BL/1RS易位系在小麥育種中的應用及改良[J].河南農業(yè)科學,2006,35(3):12.
SU Y R,LI Y G,LI S P.Application and improvement of wheat-rye 1BL/1RS translocation line in wheat breeding [J].JournalofHenanAgriculturalSciences,2006,35(3):12.
[11] 何中虎,夏先春,陳新民,等.中國小麥育種進展與展望[J].作物學報,2011,37(2):202.
HE Z H,XIA X C,CHEN X M,etal.Progress of wheat breeding in China and the future perspective [J].ActaAgronomicaSinica,2011,37(2):202.
[12] 李 瓊,王長有,劉新倫,等.小偃6號及其衍生品種(系)遺傳多樣性的SSR分析[J].麥類作物學報,2008,28(6):950.
LI Q,WANG C Y,LIU X L,etal.Genetic diversity of Xiaoyan 6 and its deritives by SSR [J].JournalofTriticeaeCrops,2008,28(6):950.
[13] LAW C N,WORLAND A J.The control of adult-plant resistance to yellow rust by the translocated chromosome 5BS-7BS of bread wheat [J].PlantBreeding,1997,116(1):59.
[14] BADAEVA E D,DEDKOVA O S,GAY G,etal.Chromosomal rearrangements in wheat:their types and distribution [J].Genome,2007,50(10):907.
[15] 亓增軍.冬小麥種質“矮孟牛”的分子細胞遺傳學研究[D].南京:南京農業(yè)大學,2000:2.
QI Z J.Molecular cytogenetic analysis of winter wheat germplasm Aimenniu [D].Nanjing:Nanjing Agricultural University,2010:2.
[16] 亓增軍,劉大鈞,陳佩度,等.冬小麥種質 “矮孟牛” 的分子細胞遺傳學研究[J].植物學報(英文版),2001,43(5):469.
QI Z J,LIU D J,CHEN P D,etal.Molecular cytogenetic analysis of winter wheat germplasm Aimenniu [J].ActaBotanicaSinica(EnglishEdition),2001,43(5):469.
[17] 亓增軍,劉大鈞.利用染色體C-分帶和雙色熒光原位雜交技術鑒定普通小麥-黑麥-簇毛麥雙重易位系1RS·1BL,6VS·6AL [J].遺傳學報,2001,28(3):267.
QI Z J,LIU D J.Development and identification ofT.aestivum-S.cereal-H.villosadouble translocation line 1RS·1BL,6VS·6AL via chromosome C-banding and dual color FISH [J].ActaGeneticaSinica,2001,28(3):267.
[18] 王蘇玲.普通小麥-簇毛麥-小傘山羊草雙重易位系的篩選[D].南京:南京農業(yè)大學,2006:1.
WANG S L.Development and identifying ofT.aestivum-H.villosa-Ae.umbellulatadouble translocation line 6AL·6VS,6BS·6BL-6US [D].Nanjing:Nanjing Agricultural University,2006:1.
[19] BELAN I A,ROSSEEVA L P,ROSSEEV V M,etal.Study of adaptive and agronomic characters in lines of common wheat Omskaya 37 carrying 1RS·1BL and 7DL-7Ai translocations [J].RussianJournalofGenetics:AppliedResearch,2015,5(1):41.
[20] SHLEGEL R,WERNER T,HLGENHOF E.Confirmation of a 4BL/5RL wheat-rye chromosome translocation line in the wheat cultivar 'Viking' showing high copper efficiency [J].PlantBreeding,1991,107(3):226.
[21] HAN F P,LAMB J C,BIRCHLER J A.High frequency of centromere inactivation resulting in stable dicentric chromosomes of maize [J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica,2006,103(9):3238.
[22] TANG Z X,YANG Z J,FU S L.Oligonucleotides replacing the roles of repetitive sequences pAs1,pSc119.2,pTa-535,pTa71,CCS1,and pAWRC.1 for FISH analysis [J].JournalofAppliedGenetics,2014,55(3):313.
[23] FU S L,CHEN L,WANG Y Y,etal.Oligonucleotide probes for ND-FISH analysis to identify rye and wheat chromosomes [J].ScientificReports,2015,5:10552.
[24] 任 勇,李生榮,周 強,等.134份四川小麥品種(系) 的條銹病抗性評價[J].麥類作物學報,2014,34(6):847.
REN Y,LI S R,ZHOU Q,etal.Evalution of resistance to stripe rust of 134 wheat cultivars and lines from Sichuan province [J].JournalofTriticeaeCrops,2014,34(6):847.
[25] 李艷麗,張 軍,魯 敏,等.67 份引進美國小麥種質材料的農藝性狀調查和抗病性鑒定[J].麥類作物學報,2013,33(4):777.
LI Y L,ZHANG J,LU M,etal.Evaluation of agronomical characteristics and disease resistance in wheat germplasm introduced from American [J].JournalofTriticeaeCrops,2013,33(4):777.
[27] SEPSI A,MOLNR I,SZALAY D,etal.Characterization of a leaf rust-resistant wheat-Thinopyrumponticumpartial amphiploid BE-1,using sequential multicolor GISH and FISH [J].TheoreticalandAppliedGenetics,2008,116(6):825.
[28] KOMURO S,ENDO R,SHIKATA K,etal.Genomic and chromosomal distribution patterns of various repeated DNA sequences in wheat revealed by a fluorescenceinsituhybridization procedure [J].Genome,2013,56(3):131.
[29] AGENBAG G M,PRETORIUS Z A,BOYD L A,etal.Identification of adult plant resistance to stripe rust in the wheat cultivar Cappelle-Desprez [J].TheoreticalandAppliedGenetics,2012,125(1):109.
[30] CAO A Z,XING L P,WANG X Y,etal.Serine/threonine kinase geneStpk-V,a key member of powdery mildew resistance gene Pm21,confers powdery mildew resistance in wheat [J].ProceedingsoftheNationalAcademyofSciences,2011,108(19):7727.

