小劑量長療程糖皮質激素治療高疾病活動度類風濕關節炎的觀察研究
周 進 付 林
四川省宜賓市第二人民醫院風濕免疫科,四川宜賓 644000
類風濕關節炎(rheumatoid arthritis,RA)是一種以關節滑膜受累為主的全身免疫性疾病,病因不明確。美國風濕病協會(ACR)在2008年指定的治療RA推薦中將MTX﹑來氟米特(LEF)共同列為一線用藥[1]。但這兩種藥物起效較慢,而且有部分患者療效不甚理想。生物制劑尤其是腫瘤壞死因子拮抗劑治療可以有效改善類風濕關節炎患者的關節腫痛﹑晨僵等癥狀和體征,減緩或阻止關節骨質破壞的發生和發展,提高患者的功能狀態和生活質量[2]。但因其昂貴的價格限制了在宜賓地區的應用。而激素具有強大的抗炎作用,可在較短時間內改善患者關節腫痛癥狀,有學者認為小劑量激素可作為一種慢作用藥物使用。有文獻報道[3]顯示:小劑量潑尼松聯合甲氨蝶呤治療類風濕關節炎患者效果理想,值得推廣應用。但糖皮質激素長期應用爭議較大,不過在疾病活動期控制癥狀或等待其他藥物發揮作用期間過渡性應用激素是提倡的[4]。本文旨在觀察小劑量激素長療程聯合來氟米特及甲氨喋呤的臨床療效及安全性,現報道如下。
1 資料與方法
1.1 一般資料
選取2016年3月~2017年2月符合條件的我院門診及住院的復治或處治的高疾病活動度(即DAS28>5.1)的RA患者67例,本研究經醫院倫理委員會通過,按照自愿原則分為:治療組3l例,包括男9例,女22例;年齡 24~55歲,平均(51.96±11.01)歲,病程0.3~6年,;對照組36例,包括男11例,女25例;年齡22~57歲,平均(47.69±11.82)歲,病程0.3~5.8年。診斷標準參照1987年美國風濕病學會(ACR)修訂的RA的診斷標準[5]。納入標準:(1)年齡22~57歲,不限性別,無生育需求。(2)所選患者均為高疾病活動度RA患者,即DAS28>5.1分,聯合組治療前疾病活動度DAS28 (7.43±1.58)分,對照組治療前疾病活動度DAS28 (7.15±0.94)分,兩組無顯著差異。(3)簽署研究知情同意書,告知患者注意不良反應的發生,若出現時及時就診。(4)入選前1個月未使用影響本試驗觀察指標的藥物,如MTX與LEF慢作用藥物聯合使用﹑生物制劑等藥物。排除標準:(1)哺乳期病患或備孕狀態患者。(2)有活動性感染者。(3)腫瘤患者。(4)伴發或合并其他系統疾病的患者。(5)有藥物過敏史和過敏體質者。(6)有使用免疫抑制劑及生物制劑相關禁忌證者。兩組患者在年齡﹑性別﹑病程及疾病活動度方面比較差異無統計學意義(P>0.05),具有可比性。
1.2 方法
聯合組:潑尼松片(天津力生制藥股份有限公司,H2020123)7.5mg/d;MTX(上海信誼藥廠有限公司,H31020644)7.5~ 15mg,1次 /周;LEF(欣凱制藥有限公司,H20000550)10mg/d。對照組:MTX7.5~ 15mg,1次 /周,LEF 10 mg,1次 /d,1種非甾體抗炎藥(NSAIDS),所有患者在服用甲氨喋呤后第2天服用葉酸(天津力生制藥股份有限公司,H12020215)10mg,以拮抗甲氮蝶呤不良反應。據患者病情反應調整強的松及MTX劑量,治療開始時均口服潑尼松7.5mg/d,4周后癥狀緩解,調整潑尼松用量為5mg/d,三個月后再評估如癥狀持續緩解將潑尼松進一步減量為2.5mg/d,療程均為24周,每1~3個月風濕科門診隨訪一次,如6個月患者癥狀仍無滿意緩解,可選擇生物制劑(腫瘤壞死因子拮抗劑,如依那西普25mg,ih,biw),如出現不良反應,則根據情況調整藥物劑量。
1.3 觀察指標
基于C反應蛋白(CRP)計算的28個關節疾病活動指數DAS28[6]﹑患者疼痛視覺模擬評分(VAS)﹑血沉(ESR)及生物制劑的使用比例,同時監測患者肝腎功﹑血尿常規﹑血糖﹑骨密度及體重變化。
1.4 統計學方法
采用統計學軟件SPSS19.0版對數據進行統計分析,計量資料以(±s)表示,采用t檢驗,計數資料以百分數(%)表示,采用χ2檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者療效指標比較
治療12﹑24周后,治療組患者DAS28﹑VAS的改善均優于對照組,差異有統計學意義(P<0.05);生物制劑的使用比例治療組明顯低于對照組,差異有統計學意義(P<0.05)。見表1。

表1 治療12、24周后兩組患者DAS28、VAS指標比較
2.2 兩組患者不良反應比較
完成觀察的67例患者。其中31例潑尼松平均用量為4.85mg/d。聯合組與對照組共5例患者血清丙氨酸轉氨酶輕度升高(低于參考值上限2倍),停用甲氨蝶呤及來氟米特兩周并給予口服保肝藥后轉氨酶均恢復正常;聯合組體重增加比例高于對照組,白細胞降低的比例低于對照組,差異均有統計學意義(P<0.05),余各項不良反應指標比較差異無統計學意義(P>0.05),見表2。
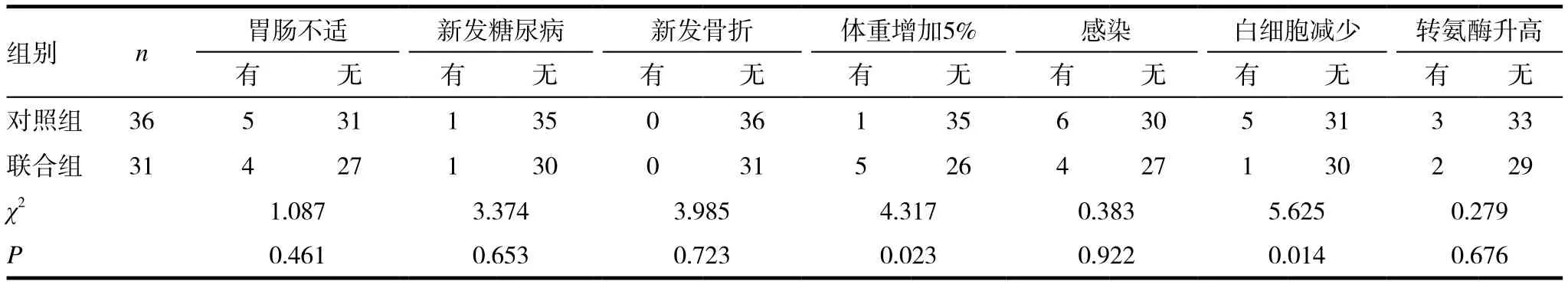
表2 兩組患者不良反應比較
3 討論
類風濕關節炎目前發病機制尚不明確,控制患者的炎性反應及疾病的發展是當前臨床治療類風濕關節炎的重要原則。慢作用抗風濕藥是當前臨床治療類風濕關節炎的主要藥物,但在實際臨床應用中物起效時間相對較慢,直接影響了患者的主觀感受和治療依從性。近年來,將小劑量糖皮質激素聯合慢作用抗風濕藥活動期應用于類風濕關節炎的早期治療已被廣泛認可[7]。 歐洲風濕病協會在2016年修訂的類風濕關節炎的治療指南[8]指出:將每日低于7.5mg的醋酸潑尼松定義為小劑量,同時將小劑量激素聯合慢作用抗風濕藥物作為類風濕關節炎的有效橋接治療,可以初始階段使用,也可以在慢作用抗風濕藥治療失敗后聯合使用,甚至有部分工作組主張小劑量激素可不必嚴格限制使用時間地慢性長期使用[9]。
在本研究中,針對高疾病活動度類風濕關節炎患者的早期,嘗試應用小劑量糖皮質激素聯合慢作用抗風濕藥物治療后,觀察到同一時期治療組在關節腫脹﹑壓痛﹑自我疼痛評分及DAS28評分等方面,均明顯優于同期對照組,同時因其可進入胞漿,與胞漿內糖皮質激素受體相結合,激活受體,從而抑制相應炎性因子的表達和釋放[10],有效抑制炎性反應。既往的報告[11]多是糖皮質激素使用三個月的研究,本研究的創新點在于針對類風濕關節炎患者規律減量使用糖皮質激素聯合慢作用抗風濕藥三個月后仍有部分患者不能停掉激素,而又因為大部分RA患者收入不高,無力支付生物制劑的高昂費用,故嘗試延長激素的使用療程至六個月,證明治療組有更低的DAS28﹑更低的VAS及更低的生物制劑使用率。
在宜賓地區,大部分風濕科醫生因擔心糖皮質激素對糖脂代謝﹑骨代謝﹑感染﹑心腦血管系統及胃腸黏膜不良事件發生的影響等,而對糖皮質激素在類風濕關節炎的應用采取較為保守的態度。本研究長療程小劑量使用糖皮質激素未觀察到上述不良反應,聯合組與對照組中差異無統計學意義(P>0.05),僅聯合組體重增加與白細胞降低的比例差異有統計學意義(P< 0.05)。Petersons等[12]研究發現關節炎患者超過6個月療程的使用小劑量強的松(6.3±2.2)mg/d與外周胰島素敏感性呈負相關,不會影響患者的動脈僵硬度,與不使用強的松者相比有更好的血管內皮功能,從而減少心血管意外的風險。以前一直認為成人的骨壞死與使用強的松有明確的相關性,但最新英國的研究[13]發現關節炎﹑炎癥性腸病及狼瘡患者本身即是骨壞死的獨立危險因素,而與服用小劑量潑尼松(<7.5mg/d)的相關性極低。因此,給予小劑量長療程糖皮質激素聯合慢作用抗風濕藥物,不僅可以快速有效地緩解患者痛苦,降低臨床炎性指標,還能增加患者治療的依從性,改善患者預后,同時降低患者的治療成本,值得臨床推廣。
本研究也有欠缺的地方,如樣本太少,隨訪時間不夠長,另外在不良反應監測方面未注意到腎上腺皮質功能的抑制問題,因相關研究[14]發現即使每日5mg持續6個月的強的松用于類風濕關節炎患者,也會約有1/3的患者發生腎上腺皮質功能不全,這一高發生率在我們以后的臨床工作中需要多加注意并常規排查。另外,本研究也提示即使很小劑量的糖皮質激素,也會導致患者體重增加,這與Ruyssen-Witrand[15]的研究一致,所以我們盡可能短期小劑量使用,且僅用于那些經濟承受能力有限而又處于高疾病活動度的類風濕患者。
[1] Singh JA.2012 update of the 2008 American College of Rheumatology recommendations for the use of diseasemodifying antirheumatic drugs and biologic agents in the treatment of rheumatoid arthritis[J].Arthritis care&research,2012,64(5):625-639.
[2] 張卓莉.生物制劑治療類風濕關節炎經驗與共識[J].2012,32(9):687-688.
[3] 中國實用內科雜志,江珂,馮士廣等.小劑量潑尼松聯合甲氨蝶呤對類風濕關節炎炎性細胞因子的影響[J].檢驗醫學與臨床,2017,6(14):1553-1555.
[4] 石亞妹.糖皮質激素治療早期關節炎/類風濕關節炎六項建議[J].中華風濕病學雜志,2011,15(1):64.
[5] 中華醫學會風濕病學分會.RA診斷及治療指南[J].中華風濕病學雜志,2010,14(4):265-269.
[6] 路曉燕,李春,等.2011年ACR/EULAR類風濕關節炎緩解標準與其他常用標準的比較[J].北京大學學報(醫學版),2013,45(2):260-263.
[7] 鄧雪蓉,周煒,等.類風濕關節炎在不同治療方案下的達標情況及影響因素分析[J].中華風濕病學雜志,2014,18(6):365-368.
[8] Chatzidionysiou K,Emamikia S.Efficacy of glucocorticoids,conventional and targeted synthetic disease-modifying antirheumatic drugs:a systematic literature review informing the 2016 update of the EULAR recommendations for the management of rheumatoid arthritis[J].Ann Rheum Dis,2017,76(6):1102-1107.
[9] Smolen JS,Landewé R,Bijlsma J,et al.EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs:2016 update[J].Ann Rheum Dis,2017,76(6):960-977.
[10] Rainer HS.Rheumatoid arthritis-a neuroendocrine immune disorder:glucocorticoid resistance,relative glucocorticoid deficiency,low-dose glucocorticoid therapy,and insulin resistance [J].Straub Arthritis Res Ther,2014,16(Suppl 2):I1.
[11] 丁從珠,汪悅,等.來氟米特和甲氨蝶呤聯合糖皮質激素治療類風濕關節炎不良反應的臨床分析[J].中華風濕病學雜志,2010,14(4):252-255.
[12] Petersons CJ,Mangelsdorf BL,Poljak A,et al.Low dose prednisolone and insulin sensitivity differentially affect arterial stiffness and endothelial function:An open interventional and cross-sectional study.[J]Atherosclerosis,2017,258:34-39.
[13] Borresen SW,Klose M1,Baslund B,et al.Adrenal insufficiency is seen in more than one-third of patients during ongoing low-dose prednisolone treatment for rheumatoid arthritis[J].Eur J Endocrinol,2017,177(4):287-295.
[14] Horton DB,Haynes K,Denburg MR,et al.Oral glucocorticoid use and osteonecrosis in children and adults with chronic inflammatory diseases:a population-based cohort study[J].BMJ Open,2017,7(7):e016788.
[15] Ruyssen-Witrand A,Constantin A.Controversies in rheumatoid arthritis glucocorticoid therapy[J].Joint Bone Spine,2017,1016-1022.

