固態發酵玉米黃粉飼料復合菌種的篩選
江成英,王 松,李 琰,徐婷婷,郭宏文,張文學,韓國棟,姜未公
(1.齊齊哈爾大學 食品與生物工程學院,黑龍江 齊齊哈爾 161006;2.齊齊哈爾大學 農產品加工黑龍江省普通高校重點實驗室,黑龍江 齊齊哈爾 161006)
玉米黃粉是濕法生產玉米淀粉在麩質分離過程中的副產物,其蛋白含量為31%~60%,有的甚至達到70%,可以作為蛋白質添加劑添加到飼料中,能有效提高飼料的蛋白質含量[1-3]。但由于玉米黃粉中的蛋白主要為醇溶蛋白,水溶性差,動物很難將其有效利用,從而造成了蛋白質原料的浪費[4-6]。為了提高玉米黃粉蛋白的利用率,可采用微生物發酵法改善玉米黃粉中蛋白的溶解性[7-9]。
復合菌種發酵指的是包括兩種或兩種以上多種菌株共生發酵的過程。大多數試驗表明,復合菌發酵中的微生物生長狀況優于單菌發酵體系,可以利用復合菌協同互補作用共同提高發酵效果[10-11]。張建華[12]將白地霉(Geotrichum candidum)、熱帶假絲酵母(Candida tropicalis)、綠色木霉(Trichoderma viride)以1∶1∶1的比例混合,按5%的接種量接入酒糟于28℃條件下發酵3 d,與單菌種發酵比較,產物中的單細胞蛋白含量增加了6.16%;王曉凡等[13]以菜籽粕為原料,選擇植物乳桿菌(Lactobacillus plantarum)、枯草芽孢桿菌(Bacillus subtilis)、米曲霉(Aspergillus oryzae)進行單菌和混菌的固態發酵,研究其對菜籽粕硫苷和粗蛋白含量的影響,結果表明,多菌種復合發酵效果優于單菌發酵;潘鋒等[14]以稻草為原料,利用酵母菌和真菌混合發酵生產蛋白飼料,結果表明,與單菌發酵相比,經產纖維素酶菌與酵母菌混合發酵可大幅提高產品的蛋白質含量。雖然復合菌種發酵的優勢已得到了充分肯定,但對混合菌系中菌間相互關系和作用機制研究尚不夠深入。因此,目前對于具有協同作用關系的菌株篩選和組合還是一個重要的研究方向。
本研究選用農業部許可用于發酵飼料的產蛋白酶較高的6種菌株:凝結芽孢桿菌(Bacillus coagulans)、枯草芽孢桿菌(Bacillus subtilis)、嗜酸乳酸桿菌(Lactobacillus acidophilus)、嗜熱乳酸桿菌(Lactobacillus thermophilus)、納豆芽孢桿菌(Bacillus natto)、地衣芽孢桿菌(Bacillus licheni formis),以各菌種對玉米黃粉的利用能力、共生狀況及復合發酵能力為評價指標,篩選出固態發酵玉米黃粉飼料的適宜復合菌種。以期提高玉米黃粉蛋白的可溶性,相應地提高玉米黃粉作為飼料的動物消化利用率,促進玉米蛋白質資源的有效利用,對于有效緩解由于蛋白質資源來源不足制約畜牧業發展的現狀具有重要意義。
1 材料與方法
1.1 材料與試劑
1.1.1 菌種和原料
凝結芽孢桿菌(Bacillus coagulans)、枯草芽孢桿菌(Bacillussubtilis)、嗜酸乳酸桿菌(Lactobacillus acidophilus)、嗜熱乳酸桿菌(Lactobacillus thermophilus)、納豆芽孢桿菌(Bacillus natto)、地衣芽孢桿菌(Bacillus licheniformis)均為齊齊哈爾大學生物工程實驗室保藏。
玉米黃粉、麩皮:市售。
1.1.2 化學試劑
無水乙醇、胰蛋白胨、瓊脂粉、氫氧化鈉、氯化鈉、葡萄糖、濃鹽酸、碳酸鈉、鎢酸鈉、鉬酸鈉、液體溴、磷酸氫二鈉、磷酸二氫鉀、濃硫酸、三氯乙酸、硫酸鎂、檸檬酸氫二銨等(均為分析純):天津市凱通化學試劑有限公司。
1.1.3 培養基
LB培養基:胰蛋白胨1%、氯化鈉1%、酵母粉0.5%、pH 7.0~7.4,121℃蒸汽滅菌20 min,用于培養納豆芽孢桿菌。
MRS乳酸細菌培養基:蛋白胨1%、牛肉膏1%、酵母膏0.5%、檸檬酸氫二銨0.2%、葡萄糖2%、吐溫-80 0.1%、乙酸鈉0.5%、磷酸氫二鉀0.2%、硫酸鎂0.05%、硫酸錳0.02%,pH 6.2~6.6,121℃蒸汽滅菌20 min,用于培養嗜熱乳酸桿菌和嗜酸乳酸桿菌。
營養瓊脂(nutrient agar,NA)培養基:蛋白胨1%、牛肉粉0.3%、氯化鈉0.5%、pH 7.2~7.4,121℃蒸汽滅菌20 min,用于培養枯草芽孢桿菌和地衣芽孢桿菌。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培養基:酵母膏1%、蛋白胨2%、葡萄糖2%、pH自然,121℃蒸汽滅菌20 min,用于培養凝結芽孢桿菌。
玉米黃粉瓊脂培養基:玉米黃粉20%,瓊脂2%,pH 6.5~7.5,121℃蒸汽滅菌20 min,用于平板點種和平板點種刺激圈試驗,測定微生物對玉米黃粉的利用情況。
固體發酵培養基:玉米黃粉70%,麩皮30%,料水比1∶1.2(g∶mL),瓊脂2%,121 ℃蒸汽滅菌20 min,用于測定微生物對玉米黃粉的發酵能力。
1.2 儀器與設備
PYX-DHS隔水式電熱恒溫培養箱:上海躍進醫療器械廠;ZHJ-C2109C超凈工作臺:上海智城分析儀器有限公司;BS224S型電子天平:北京塞多利斯儀器廠;TV1901紫外可見分光光度計:北京譜析通用儀器有限公司;PHS-25數顯PH計:上海精密科學儀器有限公司。
1.3 試驗方法
1.3.1 菌種的活化
將配制好的培養基分別于121℃蒸汽滅菌20 min后,冷卻至室溫,分別將6種試驗菌種接入到其對應的最適固體培養基上,置于培養箱內30℃條件下培養48 h,備用。
1.3.2 液體菌種擴大培養
挑取一環活化好的菌種接入相應的液體培養基中,置于30℃培養箱中培養48 h,備用。
1.3.3 平板點種
為確定所選6種菌種是否能利用玉米黃粉的營養生長,將液體擴大培養的菌種點種在玉米黃粉瓊脂培養基上,觀察菌圈的大小和生長趨勢,判斷其利用玉米黃粉的能力[15]。
1.3.4 固體發酵試驗
將單菌種或混合菌種接種于固體發酵培養基上,置于30℃條件下發酵84 h或120 h,每隔12 h或24 h測定其蛋白酶活力或可溶性蛋白含量。
1.3.5 平板點種刺激圈試驗
將篩選出來的指示菌株涂布在玉米黃粉固體培養基中,分別將其他幾種待測菌種以每種2 μL的量點種在培養基中央,于30℃條件下培養約48 h觀察其生長狀態和刺激圈情況,篩選出雙菌組合[16]。
1.3.6 分析檢測
可溶性蛋白含量的測定采用福林酚法[17];蛋白酶活力的測定采用福林酚法[18],在pH 7.0、40℃條件下,每分鐘水解酪蛋白產生1 μg酪氨酸定義為一個蛋白酶活力單位;總蛋白測定采用凱氏定氮法[18]。
2 結果與分析
2.1 待用菌株的初篩
將凝結芽孢桿菌(B.coagulans)、枯草芽孢桿菌(B.subtilis)、嗜酸乳酸桿菌(L.acidophilus)、嗜熱乳酸桿菌(L.thermophilus)、納豆芽孢桿菌(B.natto)以及地衣芽孢桿菌(B.licheniformis)這6種菌株制成的菌懸液,以每種2 μL的菌量分別點種在玉米黃粉固體平板培養基上,于30℃培養48 h,觀察每種菌的生長狀況,初步篩選出能用于發酵玉米黃粉的菌種,結果見圖1。

圖1 平板點種法培養各菌株的菌落形態Fig.1 Colony morphology of strains cultured by dot-inoculation
由圖1可知,在玉米黃粉固體培養基上嗜酸乳酸桿菌基本沒有生長,而其他菌均長勢良好,說明嗜酸乳酸桿菌不能利用玉米黃粉的營養生長,而凝結芽孢桿菌、枯草芽孢桿菌、嗜熱乳酸桿菌、納豆芽孢桿菌、地衣芽孢桿菌都可很好地利用玉米黃粉。因此,初步篩選出凝結芽孢桿菌、枯草芽孢桿菌、嗜熱乳酸桿菌、納豆芽孢桿菌、地衣芽孢桿菌為發酵玉米黃粉飼料的待用菌株。
2.2 指示菌的篩選
將篩選出的待用菌株凝結芽孢桿菌、枯草芽孢桿菌、地衣芽孢桿菌、嗜熱乳酸桿菌、納豆芽孢桿菌分別接種于相應的液體培養基中進行擴培,以5%的接種量接入固體發酵培養基中,于30℃恒溫培養箱中發酵培養。從培養24 h后開始每12 h取樣測定蛋白酶活力,篩選出用于發酵玉米黃粉的指示菌種,結果見表1。
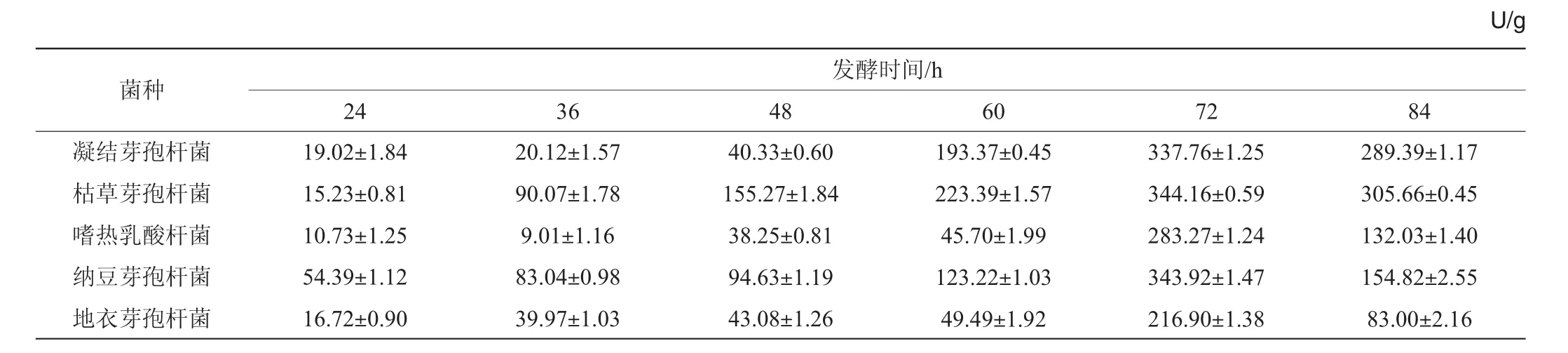
表1 待選菌株在發酵過程中的蛋白酶活力Table 1 Protease activities of screening strains during the fermentation process
由表1可知,各種菌在發酵玉米黃粉過程中,蛋白酶活力均隨發酵時間的延長而逐漸增強,當發酵72 h時蛋白酶活力均達到最大;繼續延長發酵時間,各種菌的蛋白酶活力均出現下降。其原因可能是由于發酵前期,發酵物料中營養豐富,使菌種快速生長并大量產酶;隨著發酵時間的延長,發酵物料中營養大量消耗,導致菌體產酶量降低,這與朱平軍等[19-20]研究結果基本一致。各種菌種的產酶趨勢雖然是一致的,但產酶能力差異較大,其中枯草芽孢桿菌的產酶能力最強,在72 h時達到最大,為(344.16±0.59)U/g。因此,選擇枯草芽孢桿菌作為指示菌進行后續試驗。
2.3 共生菌株的篩選
將初篩得到的5種菌株分別接入相應的液體培養基中30℃活化培養48 h。以篩選出的枯草芽孢桿菌作為指示菌與其他4種菌進行平板點種刺激圈試驗,篩選出能與其協同共生的菌株,結果如圖2所示。
將每種待選菌株點種在涂布枯草芽孢桿菌的玉米黃粉培養基平板的正中央,通過觀察點種菌及周圍指示菌的生長狀況,判斷兩種菌種生長關系。若生長趨勢較弱,則相互抑制;若生長趨勢較強,則相互促進。由圖2可知,點種納豆芽孢桿菌的平板上點種菌周圍的指示菌基本沒有生長,而點種嗜熱乳酸桿菌、凝結芽孢桿菌、地衣芽孢桿菌的平板上點種菌及周圍指示菌均能生長,其中點種凝結芽孢桿菌的平板上點種菌及周圍指示菌均長勢旺盛。因此,選枯草芽孢桿菌與凝結芽孢桿菌作為下一步試驗的共生菌株。

圖2 點種刺激圈法培養各菌株的菌落形態Fig.2 Colony morphology of each strain by dot-inoculating stimulus circle method
2.4 發酵用復合菌種的篩選
以篩選出來的共生菌株枯草芽孢桿菌與凝結芽孢桿菌的混合菌作為基礎菌,分別與嗜熱乳酸桿菌和地衣芽孢桿菌以1∶1∶1的比例混合,以5%接種量接種到發酵培養基中,置于30℃恒溫培養箱中培養,每24 h取樣測定可溶性蛋白含量,以確定發酵玉米黃粉的復合菌種,結果見表2。
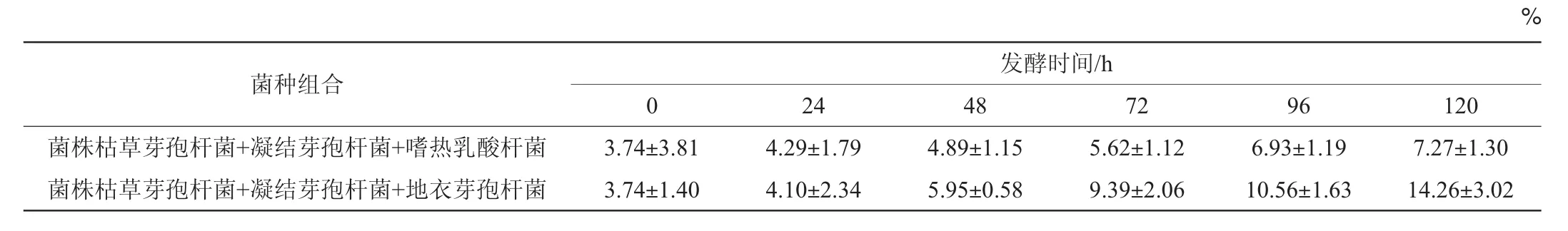
表2 不同復合菌發酵過程中的可溶性蛋白含量檢測結果Table 2 Detection results of soluble protein contents during the fermentation process
由表2可知,隨著發酵時間的延長,兩種復合菌種發酵玉米黃粉的可溶性蛋白含量均不斷提高,但利用復合菌種枯草芽孢桿菌+凝結芽孢桿菌+地衣芽孢桿菌發酵的玉米黃粉的可溶性蛋白含量提高幅度更大,當發酵時間為120 h時,可溶性蛋白含量達到14.26%。因此,通過篩選確定發酵玉米黃粉的復合菌種為枯草芽孢桿菌+凝結芽孢桿菌+地衣芽孢桿菌。
2.5 發酵驗證試驗
將活化好的枯草芽孢桿菌、凝結芽孢桿菌、地衣芽孢桿菌以1∶1∶1的比例混合,按5%接種量接入固態發酵培養基中于30℃條件下發酵120 h,進行三組平行。測定發酵前及發酵結束后其干基中可溶性蛋白質及粗蛋白質含量,以驗證所篩選菌種發酵玉米黃粉生產蛋白飼料的效果,結果見表3。

表3 發酵前后飼料中可溶性蛋白及粗蛋白含量比較Table 3 Comparison of soluble protein and crude protein contents in the feed before and after fermentation
由表3可知,發酵后飼料中粗蛋白含量僅有少量的提高,而可溶性蛋白的含量提高幅度較大,由發酵前的3.78%提高至14.26%。根據物質守恒定律,在發酵過程中,總氮含量基本不變,出現的少許增加可能是發酵濃縮效應引起的,這與韓佳東等[21-22]的研究結果相似;而發酵飼料中可溶性蛋白含量的增加是由于微生物生長繁殖過程中產生的蛋白酶將玉米黃粉中的水不溶性蛋白質分解成溶于水的小肽等物質引起的,魏炳棟等[23]在此理論指導下以多肽得率為指標研究了發酵玉米蛋白粉的條件。
3 結論
本試驗通過平板點種、點種刺激圈和多菌種混合固態發酵3種主要方法篩選出能發酵玉米黃粉生產飼料的優良復合菌種。試驗分析結果表明,以玉米黃粉為主要原料,采用固態發酵法生產蛋白飼料時,選用枯草芽孢桿菌+凝結芽孢桿菌+地衣芽孢桿菌作為復合菌種效果較好。將枯草芽孢桿菌、凝結芽孢桿菌和地衣芽孢桿菌以1∶1∶1的比例混合,按5%接種量接入固態發酵培養基中,于30℃條件下發酵120 h時其可溶性蛋白含量可高達14.26%,較發酵之初提高了10.52%。因此,利用該復合菌種發酵玉米黃粉生產飼料,可大大提高玉米黃粉的動物消化利用率,促進玉米蛋白質資源的有效利用。
[1]辛 欣,郭雪松,狄 蕊,等.玉米黃粉替代魚粉在鯉魚飼料中的效果評價[J].飼料工業,2014,35(4):27-30.
[2]李 麗,崔波玉.玉米蛋白粉的綜合利用及研究進展[J].糧食科技與經濟,2010,35(3):45-47,50.
[3]張艷銘,甄二英,宋智娟.玉米蛋白粉的營養價值及其應用[J].飼料博覽,2006(5):18-20.
[4]王曉杰,鄭喜群,劉曉蘭,等.玉米黃粉預處理方法對醇溶蛋白提取率及組分的影響[J].中國釀造,2011,30(10):38-40.
[5]李秀梅,鄭喜群,劉曉蘭,等.濃醪發酵玉米蛋白粉飼料生產工藝的研究[J].糧食與飼料工業,2009(3):38-40.
[6]賈祥祥,郭興鳳.玉米蛋白粉的應用研究進展[J].糧食加工,2011(2):60-67.
[7]韓秋菊,張倩倩.蛋白酶產生菌LN02發酵玉米黃粉蛋白的條件優化[J].化學與生物工程,2011,28(6):74-76.
[8]劉麗波,孫 迪,劉景圣,等.鼠李糖乳桿菌發酵玉米黃粉提高水解性能的研究[J].食品工業,2012(9):5-7.
[9]王 燕,文奇男,陳偉康,等.納豆芽孢桿菌和好食性脈胞霉混合固態發酵玉米黃粉飼料[J].飼料工業,2014(15):19-23.
[10]劉建學,于海漫,韓四海,等.酒糟多菌種發酵提高蛋白轉化率的研究進展[J].農產品加工,2017(1):88-91.
[11]楊玉新,任 花,李 丹.辣椒醬復合菌種發酵工藝的研究[J].中國釀造,2011,30(8):162-164.
[12]張建華.酒糟發酵菌種組合篩選的研究[J].糧食與飼料工業,2010(8):46-48.
[13]王曉凡,王海濱,熊光權,等.多菌種復合固態發酵對菜籽粕硫甙去除效果的研究[J].糧食與油脂,2012,37(3):196-200.
[14]潘 鋒,史小麗,楊樹林,等.多菌種混合發酵稻草生產蛋白飼料的研究[J].糧食與飼料工業,2001(8):25-26.
[15]吳窈畫,李正華,談書華.一種簡單準確的微生物活菌計數方法[J].生物技術,2013,23(2):65-69.
[16]BENZ M,SCHINK B,BRUNE A.Humic acid reduction byPropionibacterium freudenreichiiand other fermenting bacteria[J].Appl Environ Microbiol,1998,64(11):4507-4512.
[17]王永華.食品分析[M].北京:中國輕工業出版社,2010:127-128.
[18]吳國峰,李國全.工業發酵分析[M].北京:化學工業出版社,2006:43-46.
[19]朱平軍.多菌種固態生料仿生發酵豆粕的研究[D].合肥:安徽農業大學,2011.
[20]楊彩艷.液態發酵豆粕制備大豆肽發酵條件的優化[D].濟南:山東輕工業學院,2010.
[21]韓佳東.永川豆豉蛋白水解產物與黑色素形成機理的研究[D].重慶:西南大學,2013.
[22]富中菲.酵母單細胞固態發酵系統中氮素變化的研究[J].吉林農業大學學報,2002,24(1):92-97.
[23]魏炳棟,苗國偉,陳 群,等.復合菌發酵玉米蛋白粉的條件優化[J].中國畜牧獸醫,2017,44(10):2944-2950.

