外源H2O2處理對燕麥種子活力的影響
夏方山,王婷婷,董秋麗,毛培勝,朱慧森,杜利霞,佟莉蓉
(1.山西農業大學動物科技學院,山西 太谷 030801;2.中國農業大學動物科技學院,草業科學北京市重點實驗室,北京 100193;3.山西農業大學林學院,山西 太谷 030801)
燕麥(Avenasativa)具有耐旱、耐寒、耐鹽堿及耐瘠薄等優良特性,是干旱和半干旱地區廣泛種植的傳統優質糧飼兼用作物,其種植面積僅次于小麥(Triticumaestivum)、水稻(Oryzasativa)和玉米(Zeamays)[1-2]。青綠燕麥柔嫩多汁、適口性好,其秸稈含有的粗蛋白、粗脂肪及無氮浸出物等營養成分遠高于谷子(Setariaitalica)、小麥和玉米等秸稈,而難消化的粗纖維含量遠低于這些農作物秸稈[3-4]。因此,燕麥是制作青干草和優質青貯飼草料的重要材料來源,對高寒地帶的畜牧業發展和生態建設具有重要意義[5]。此外,燕麥還是重要的綠色營養保健作物,其籽實含有對人類健康至關重要的均衡蛋白質、可溶性膳食纖維β-葡聚糖及不飽和脂肪酸等營養成分[6]。燕麥籽實油脂含量可達3.1%~11.6%,其不飽和脂肪酸達80%以上[7]。由于脂肪衍生物容易酸敗或劣變,燕麥種子更容易發生劣變,從而降低其利用價值[8]。因此,研究燕麥種子活力對種質資源的利用與保存具有重要意義。
種子在發育形成及貯藏過程中不斷地進行有氧代謝,并產生各種有害的活性氧(reactive oxygen species,ROS)[9]。種子活力喪失的主要原因就是ROS過量積累導致了脂質過氧化損傷的發生[10],但目前為止,ROS影響種子活力的具體機理仍不清楚[11]。H2O2是植物體內ROS產生和清除的核心,其含量高低與種子的活力水平密切相關[12-13]。H2O2還是植物體內重要的信號分子,可以調控植物生長發育及對逆境脅迫的應答過程[14]。因此,H2O2長期以來被作為種子發芽促進劑。研究發現,適宜濃度的外源H2O2處理可打破小麥[15]和大豆(Glycinemax)[16]等種子的休眠,促進其萌發。此外,適宜濃度的H2O2處理還可提高種子萌發的抗旱性和耐鹽性等[17]。然而,高濃度H2O2處理會引起種子外滲率的升高,并導致種子萌發過程中代謝途徑的改變,從而抑制種子的萌發[18-19]。目前,H2O2處理對種子萌發的影響已在小麥[15]、大豆[16]、臭椿(Ailanthusaltissima)[19]、刺槐(Robiniapseudoacacia)[19]、莖瘤芥(Brassicajuncea)[20]、水稻[21]等植物中有報道。但外源H2O2處理對種子萌發的影響與植物種或品種有關,其作用機理仍然模糊。而且燕麥種子活力與其內源H2O2含量的關系報道較多,但與外源H2O2處理的關系至今未見報道。因此,試驗以燕麥種子為材料,分析H2O2處理濃度和時間對其活力水平的影響,以期探究外源H2O2調控種子活力的關系,為系統地揭示外源H2O2影響種子活力的機理研究提供理論基礎。
1 材料與方法
1.1 材料來源
供試燕麥(品種:太陽神)種子由北京正道生態科技有限公司提供,2016年進口于惠特蘭種子有限責任公司(Wheatland seed LLC),在-20 ℃保存至2016年11月進行試驗。種子自然含水量7.8%。
1.2 H2O2處理
將燕麥種子用不同濃度的H2O2(0,0.24,0.48,0.96,1.92和3.84 mol·L-1)分別于20 ℃黑暗條件下浸種處理0(CK),3,6,9和12 h,迅速用蒸餾水沖洗3次,并移至光照培養箱中進行標準發芽試驗。每個處理重復4次。
1.3 發芽試驗及指標測定
參照國際種子檢驗協會(International Seed Testing Association,ISTA)的種子檢驗規程(2015)[22]規定的發芽條件。選取均勻飽滿的種子100粒放入培養皿中,設4次重復,在20 ℃恒溫條件下培養。初次計數第5天,末次計數第10天,最終統計正常種苗數,并測定其平均苗鮮重,按以下公式計算種子發芽率(germination percentage,Gp)、發芽指數(germination index,Gi)、平均發芽時間(mean germination time,MGT)及幼苗活力指數(seedling vigor index,SVI)。
1)Gp的測定參照ISTA的種子檢驗規程(2015)[22]進行,Gp=(G10/N)×100%,式中:G10為第10天正常發芽種子數,N為發芽種子總數。
2)Gi的測定參照Abdul-Baki等[23]的方法進行,Gi=∑(Gi/t),式中:Gi為第t天發芽種子數,t為發芽天數。
3)MGT的測定參照Ellis等[24]的方法進行,MGT(d)=∑(Gi×t)/∑Gi,式中:Gi為第t天發芽(胚根突破種皮2 mm)種子數,t為發芽天數。
4)SVI的測定參照Abdul-Baki等[23]的方法進行,SVI=[Gp(100%)×平均苗鮮重(g)]/100,式中:Gp為種子發芽率。
1.4 數據處理與統計分析
采用Excel 2010和SAS 8.0統計分析軟件處理試驗數據,采用Duncans法進行多重比較,結果以平均值±標準誤表示。
2 結果與分析
2.1 H2O2處理對燕麥種子Gp的影響
隨著H2O2濃度的增加,燕麥種子Gp均呈下降的趨勢(表1)。處理3和6 h的燕麥種子Gp在濃度為0~0.96 mol·L-1時差異不顯著(P>0.05),在濃度大于1.92 mol·L-1時開始顯著下降(P<0.05);處理9 h的燕麥種子Gp在濃度為0~0.48 mol·L-1時差異不顯著(P>0.05),在濃度大于0.96 mol·L-1時開始顯著下降(P<0.05);處理12 h的燕麥種子Gp在濃度為0和0.24 mol·L-1時差異不顯著(P>0.05),在濃度大于0.48 mol·L-1時開始顯著下降(P<0.05)。濃度為0時,僅處理3 h的燕麥種子Gp顯著(P<0.05)低于CK,且與其他處理時間差異不顯著(P>0.05);濃度為0.24 mol·L-1時,處理3和6 h的燕麥種子Gp顯著(P<0.05)低于其他處理時間;濃度為0.48 mol·L-1時,處理3和12 h的燕麥種子Gp顯著(P<0.05)低于CK,其他處理時間均與CK差異不顯著(P>0.05);濃度為0.96 mol·L-1時,燕麥種子Gp均顯著(P<0.05)低于CK,但各處理時間之間差異不顯著(P>0.05);濃度為1.92和3.84 mol·L-1時,燕麥種子Gp隨處理時間的延長呈顯著(P<0.05)下降趨勢。
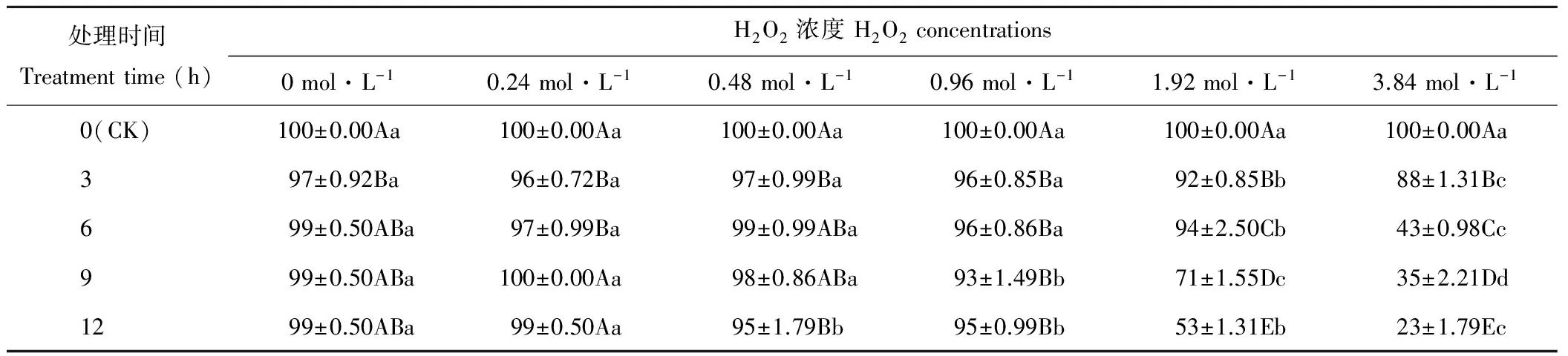
表1 H2O2處理后燕麥種子發芽率的變化Table 1 Changes of germination percentage in oat seeds with H2O2 treatments (%)
注:同列不同大寫字母表示差異顯著(P<0.05),同行不同小寫字母表示差異顯著(P<0.05)。下同。
Note: Means in the same column with different capital letters are significant difference (P<0.05), in the same row with different small letters are significant difference (P<0.05). The same below.
2.2 H2O2處理對燕麥種子Gi的影響
隨著H2O2濃度的增加,燕麥種子Gi均呈下降趨勢(表2),處理3和9 h的燕麥種子Gi在濃度為0~0.48 mol·L-1時差異不顯著(P>0.05),濃度為0.96~3.84 mol·L-1時顯著下降(P<0.05);處理6 h的燕麥種子Gi在濃度為0~0.24 mol·L-1時差異不顯著(P>0.05),濃度為0.48~3.84 mol·L-1時顯著下降(P<0.05);處理12 h的燕麥種子Gi呈顯著下降趨勢(P<0.05)。濃度為0時,處理3 h的燕麥種子Gi顯著低于CK及其他處理時間(P<0.05),其他處理時間與CK差異不顯著(P>0.05);濃度為0.24 mol·L-1時,處理6和9 h的燕麥種子Gi與CK差異不顯著(P>0.05),處理3 h的燕麥種子Gi顯著低于其他處理時間(P<0.05);濃度為0.48 mol·L-1時,處理3和12 h的燕麥種子Gi顯著低于其他處理時間(P<0.05),處理6和9 h時與CK差異不顯著(P>0.05);濃度為0.96 mol·L-1時,處理0~9 h的燕麥種子Gi顯著(P<0.05)下降,處理12 h時與處理6和9 h差異不顯著(P>0.05);濃度為1.92和3.84 mol·L-1時,燕麥種子Gi隨處理時間的增加呈顯著(P<0.05)下降趨勢。
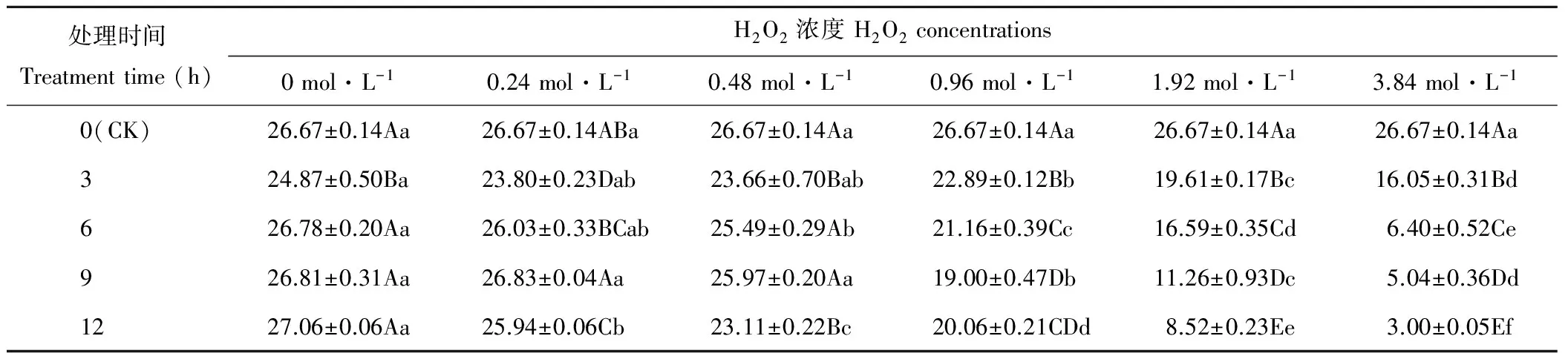
表2 H2O2處理后燕麥種子發芽指數的變化Table 2 Changes of germination index in oat seeds with H2O2 treatments
2.3 H2O2處理對燕麥種子MGT的影響
隨H2O2濃度增加,處理3~9 h的燕麥種子MGT均在濃度為3.84 mol·L-1時顯著(P<0.05)大于其他處理(表3),而在濃度為0~0.48 mol·L-1時顯著(P<0.05)小于濃度為0.96~3.84 mol·L-1時;處理12 h的燕麥種子MGT隨H2O2濃度增加呈顯著(P<0.05)上升趨勢。濃度為0時,燕麥種子MGT處理3 h時顯著(P<0.05)大于其他浸種時間,但與CK差異不顯著(P>0.05);濃度為0.24 mol·L-1時,燕麥種子MGT在浸種3 h時顯著(P<0.05)大于其他浸種時間,而其他處理之間差異不顯著(P>0.05);濃度為0.48 mol·L-1時,燕麥種子MGT在處理3和12 h時顯著(P<0.05)大于其他浸種時間,而在處理6和9 h時與CK差異不顯著(P>0.05);濃度為0.96和3.84 mol·L-1時,燕麥種子MGT在浸種6~9 h時顯著大于浸種3 h和CK;濃度為1.92 mol·L-1時,燕麥種子MGT在處理9和12 h時顯著(P<0.05)大于其他浸種時間,處理3~12 h時均顯著(P<0.05)大于CK。
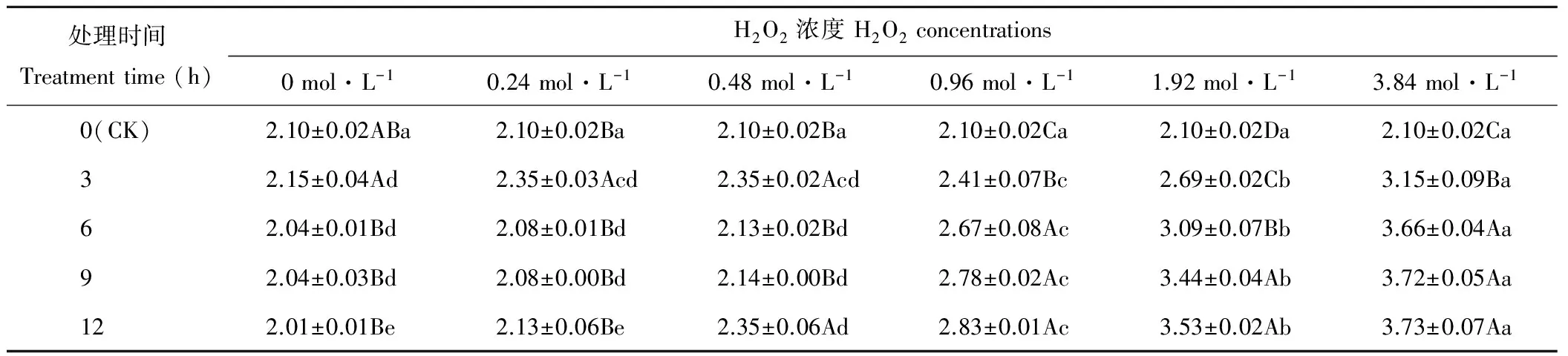
表3 H2O2處理后燕麥種子平均發芽時間的變化Table 3 Changes of mean time of germination in oat seeds with H2O2 treatments (d)
2.4 H2O2處理對燕麥種子SVI的影響
隨H2O2濃度的增加,燕麥種子SVI呈下降趨勢(表4)。處理3 h的燕麥種子SVI在濃度為0~0.96 mol·L-1時差異不顯著(P>0.05),濃度為1.92和3.84 mol·L-1時顯著(P<0.05)低于其他濃度;處理6 h的燕麥種子SVI在濃度為0~0.48 mol·L-1時差異不顯著(P>0.05),濃度為0.96~3.84 mol·L-1時顯著(P<0.05)下降;處理9和12 h的燕麥種子SVI在濃度為0和0.24 mol·L-1時顯著(P<0.05)大于其他濃度,在濃度為0.48~3.84 mol·L-1時顯著(P<0.05)下降。H2O2長時間浸種處理的燕麥種子SVI均顯著低于CK。濃度為0和0.24 mol·L-1時,處理3 h時顯著(P<0.05)低于其他處理時間;濃度為0.48 mol·L-1時,燕麥種子SVI在處理12 h時顯著(P<0.05)低于其他處理時間;濃度為0.96和1.92 mol·L-1時,燕麥種子SVI隨浸種時間延長顯著(P<0.05)下降;濃度為3.84 mol·L-1時,處理3 h的燕麥種子SVI顯著(P<0.05)低于CK,而處理6~12 h之間差異不顯著(P>0.05)。
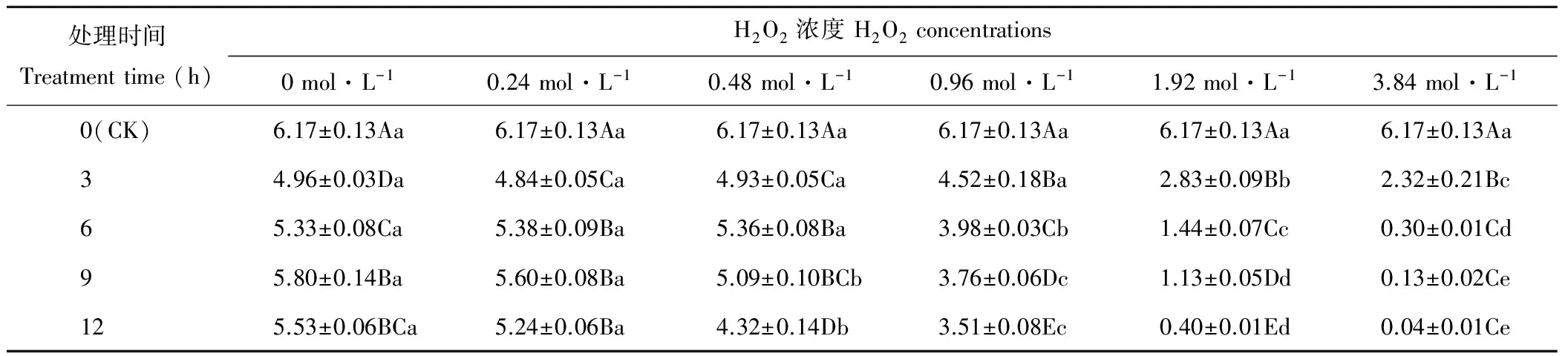
表4 H2O2處理后燕麥種子幼苗活力指數的變化Table 4 Changes of seedlings vigor index in oat seeds with H2O2 treatments
2.5 H2O2濃度和浸種時間對燕麥種子活力的雙因素方差分析
雙因素方差分析表明(表5),不同H2O2濃度、處理時間及兩者的交互作用對燕麥種子Gp,Gi,MGT及SVI的影響均差異極顯著(P<0.01)。
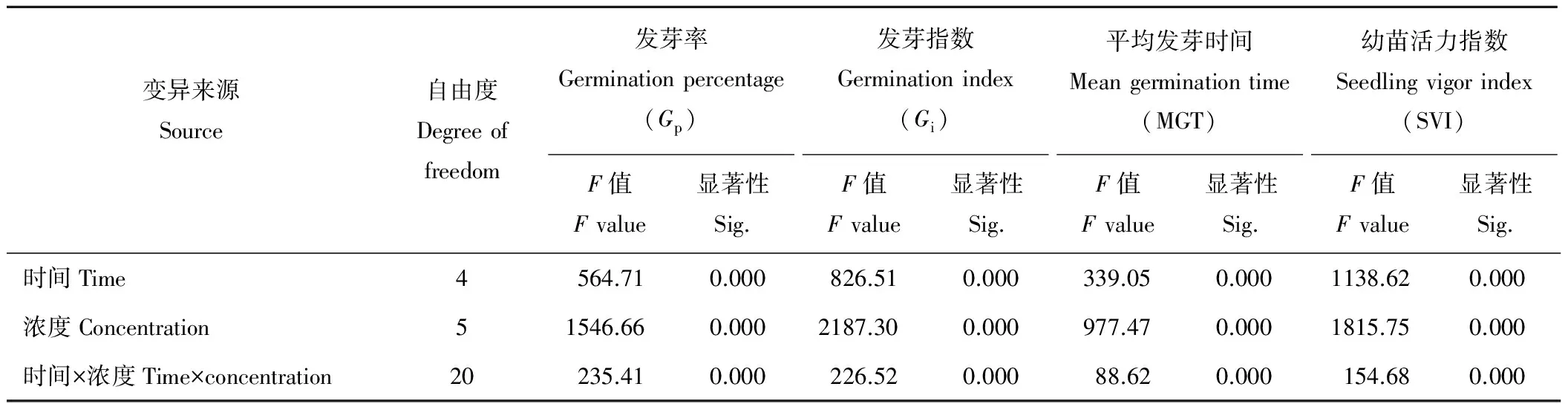
表5 H2O2處理時間和濃度對燕麥種子活力影響的雙因素方差分析Table 5 Variance analysis of H2O2 concentration and treatment time on oat seed vigor
3 討論
外源H2O2對種子萌發的影響與其濃度有關,本試驗發現,H2O2濃度對燕麥種子Gp、Gi、MGT和SVI的影響差異極顯著(P<0.01)。研究小麥[15]、大豆[16]、臭椿[19]、莖瘤芥[20]及水稻[21]等植物種子發現,低濃度H2O2處理可提高其活力水平,促進其發芽。這是因為H2O2選擇誘導了大量萌發相關基因的表達,從而提高了其免疫能力及代謝水平,為其萌發及幼苗生長提供更多的必需物質和能量[20]。然而,本試驗發現,低濃度H2O2處理對燕麥種子Gp、Gi、SVI和MGT幾乎沒影響,這可能與種子初始活力較高有關。本試驗中CK的發芽率達100%,種子本身免疫能力及代謝水平較高,因而H2O2的誘導效果不明顯,但前人研究所用小麥[15]、大豆[16]、臭椿[19]、莖瘤芥[20]及水稻[21]種子的發芽率分別為85.6%、90%、40.67%、50%~80%、80.9%,所以其較好地表現了H2O2誘導增加的相關免疫及代謝反應。但高濃度H2O2處理則顯著(P<0.05)降低了燕麥種子的Gp、Gi和SVI,并顯著(P<0.05)增加了MGT。這與對小麥[15]、大豆[16]、臭椿[19]、莖瘤芥[20]、水稻[21]及沙棘(Hippophaerhamnoides)[25]等種子的研究結果相一致。研究發現,高濃度H2O2處理使其在種子細胞內快速地大量積累,不能被及時轉換或轉移,降低了抗氧化酶的活性,并導致細胞膜發生脂質過氧化作用,使種子電解質的外滲率增加,造成種子體內大量代謝物質外滲,從而不利于種子的萌發[18,26]。目前不同濃度H2O2處理調控種子活力的機理還很模糊,但是高濃度H2O2處理造成種子活力喪失的原因,可能與貯藏種子內H2O2過量積累的損害相似。貯藏種子內H2O2的過量積累是導致其活力喪失的重要原因[27]。H2O2過量積累會降低燕麥種子內抗氧化酶活性,并導致其細胞脂質過氧化損傷的發生,表現為丙二醛(MDA)含量增加,甚至造成種子細胞超微結構的損傷[12,28]。因此,高濃度H2O2處理造成的脂質過氧化損傷可能是導致種子活力喪失的主要原因。
前人的研究主要針對H2O2濃度對種子活力的影響,本試驗發現,H2O2處理時間及其與濃度的交互作用對燕麥種子Gp、Gi、MGT和SVI的影響差異極顯著(P<0.01)。濃度為3.84 mol·L-1的H2O2處理12 h時,燕麥種子Gp、Gi及SVI最小,而MGT卻最大。這表明H2O2處理對燕麥種子活力的影響不僅與其濃度有關,還與其處理時間關系密切。H2O2濃度越低,導致燕麥種子Gp、Gi、SVI下降及其MGT增加的處理時間就越長;而H2O2濃度越高,導致燕麥種子Gp、Gi、SVI下降及其MGT增加的處理時間就越短。對于同一植物品種的種子而言,其細胞所能承受的H2O2含量可能是固定的,一旦過量就會造成細胞損傷的發生,從而降低種子的活力水平。H2O2濃度越低,達到損傷細胞的H2O2量所需要的處理時間就越長;相反,H2O2濃度越高,達到損傷細胞的H2O2含量所需要的時間就越短。因此,闡明不同植物品種的種子所能承受的H2O2含量,可為種子劣變機理的研究及最大限度地延長種子貯藏壽命提供理論依據。
4 結論
H2O2浸種降低了燕麥種子的活力水平,且這種下降影響與其濃度、浸種時間及兩者的交互作用有關, H2O2濃度越大,浸種時間越長,燕麥種子活力下降越明顯。
References:
[1] Liu F Q, Liu J L, Zhu R F,etal. Physiological responses and tolerance of four oat varieties to salt stress. Acta Prataculturae Sinica, 2015, 24(1): 183-189.
劉鳳歧, 劉杰淋, 朱瑞芬, 等. 4種燕麥對NaCl脅迫的生理響應及耐鹽性評價. 草業學報, 2015, 24(1): 183-189.
[2] Liu W H, Zhang Y J, Shi S L,etal. Soil enzyme activities in alpine naked oat-artificial grassland in response to fertilizer and Legume mix levels. Acta Prataculturae Sinica, 2017, 26(1): 23-33.
劉文輝, 張英俊, 師尚禮, 等. 高寒區施肥和豆科混播水平對燕麥人工草地土壤酶活性的影響. 草業學報, 2017, 26(1): 23-33.
[3] Zheng X, Wei Z W, Wu Z N,etal. Adaptability evaluation of differentAvenasativavarieties in Yangzhou area. Acta Agrestia Sinica, 2013, 21(2): 272-279.
鄭曦, 魏臻武, 武自念, 等. 不同燕麥品種(系)在揚州地區的適應性評價. 草地學報, 2013, 21(2): 272-279.
[4] Qin F C, Zhao G Q, Jiao T,etal. Effects of different moisture contents and additives on the quality of baled oat silage. Acta Prataculturae Sinica, 2014, 23(6): 119-125.
覃方銼, 趙桂琴, 焦婷, 等. 含水量及添加劑對燕麥捆裹青貯品質的影響. 草業學報, 2014, 23(6): 119-125.
[5] Xie Z L, Zhang T F, Chen X Z,etal. A study on the nutrient value of oat and its influences on soil fertility of winter fallow fields. Acta Prataculturae Sinica, 2013, 22(2): 47-53.
謝昭良, 張騰飛, 陳鑫珠, 等. 冬閑田種植2種燕麥的營養價值及土壤的肥力研究. 草業學報, 2013, 22(2): 47-53.
[6] Claudine C, Tom S, Susan R V,etal. Comparison of two headspace sampling techniques for the analysis of off-flavour volatiles from oat based products. Food Chemistry, 2012, 134: 1592-1600.
[7] Qi X Y, Cao S Q, Liu H S,etal. Studies on the lipid of different oat varieties and its relationship with the other nutrients. Journal of Chinese Institute of Food Science and Technology, 2014, 14(5): 63-71.
戚向陽, 曹少謙, 劉合生, 等. 不同品種燕麥的油脂組成及與其它營養物質相關性研究. 中國食品學報, 2014, 14(5): 63-71.
[8] Pekka L, Katja K, Ilkka L,etal. Effect of heat treatment on lipid stability in processed oats. Journal of Cereal Science, 2003, 37: 215-221.
[9] Xia F S, Yan H F, Zhu Y Q,etal. Review on the non-enzymatic scavenging agent of reactive oxygen species in aged seeds. Pratacultural Science, 2016, 33(6): 1126-1135.
夏方山, 閆慧芳, 朱艷喬, 等. 活性氧非酶促清除劑對老化種子的影響. 草業科學, 2016, 33(6): 1126-1135.
[10] Yin G K, Xin X, Song C,etal. Activity levels and expression of antioxidant enzymes in the ascorbate-glutathione cycle in artificially aged rice seed. Plant Physiology and Biochemistry, 2014, 80: 1-9.
[11] Zhu Y Q, Yan H F, Xia F S,etal. The relationship between mitochondria and seed aging. Pratacultural Science, 2016, 33(2): 290-298.
朱艷喬, 閆慧芳, 夏方山, 等. 線粒體與種子老化的關系. 草業科學, 2016, 33(2): 290-298.
[12] Xia F S, Chen L L, Sun Y,etal. Relationships between ultrastructure of embryo cells and biochemical variations during ageing of oat (Avenasativa) seeds with different moisture content. Acta Physiologiae Plantarum, 2015, 37(4): 1-11.
[13] Xia F S, Chen L L, Yan H F,etal. Antioxidant and ultrastructural responses to priming with PEG in aged, ultra-dry oat seed. Seed Science and Technology, 2016, 44: 1-13.
[14] Liu J X, Wang J C, Wang R J,etal. The physiological mechanisms through which exogenous H2O2increase the resistance ofAvenanudato salt stress. Acta Prataculturae Sinica, 2016, 25(2): 216-222.
劉建新, 王金成, 王瑞娟, 等. 外源過氧化氫提高燕麥耐鹽性的生理機制. 草業學報, 2016, 25(2): 216-222.
[15] Zhang D X, He Y L, Zheng W H,etal. Effects of hydrogen peroxide on seed vigour and some physiological characteristics of wheat. Journal of Qiqihar Teachers’College (Natural Science), 1996, 16(4): 48-50.
張東向, 赫延齡, 鄭蔚虹, 等. 過氧化氫對小麥種子活力及某些生理特性的影響. 齊齊哈爾師范學院學報(自然科學版), 1996, 16(4): 48-50.
[16] He S M, Bai Z M, Qin J S. Study of H2O2on promoting germination of soybean seed. Seed, 2007, 26(8): 32-35.
何士敏, 白珍明, 秦家順. H2O2促進大豆種子萌發的研究. 種子, 2007, 26(8): 32-35.
[17] Ellouzi H, Sghayar S, Abdelly C. H2O2seed priming improves tolerance to salinity, drought and their combined effect more than mannitol inCakilemaritimawhen compared toEutremasalsugineum. Journal of Plant Physiology, 2017, 210: 38-50.
[18] He S M, Wang J H, Bai Z M,etal. Effect of H2O2seed soaking on physiological and biochemical characters of soybean germinating. Soybean Science, 2008, 27(1): 176-180.
何士敏, 汪建華, 白珍明, 等. 過氧化氫浸種對大豆種子萌發的生理生化效應. 大豆科學, 2008, 27(1): 176-180.
[19] Song L H, Tao L G, Xu Y. Promotion of several growth stimulants on “ZANA” grape seedless and prematurity. Journal of Ningxia Agricultural College, 2004, 25(1): 40-42.
宋麗華, 陶利剛, 許揚. 雙氧水對臭椿、刺槐種子發芽的影響. 寧夏農學院學報, 2004, 25(1): 40-42.
[20] He S M, Li C M, Yu W B. Effects of seed treatment with H2O2tumorous stem seed germination. Journal of Changjiang Vegetables, 2012, (1): 22-26.
何士敏, 李昌滿, 于文博. 過氧化氫浸種對莖瘤芥種子萌發的影響. 長江蔬菜, 2012, (1): 22-26.
[21] Tan Z J, Huang Y Q, Wang G Y,etal. Effect of hydrogen peroxide on germination and growth of polyembryonic rice. Chinese Journal of Rice Science, 1991, 5(1): 41-44.
譚志軍, 黃逸強, 王桂元, 等. 過氧化氫對多胚水稻種子萌發和生長的影響. 中國水稻科學, 1991, 5(1): 41-44.
[22] ISTA. International rules for seed testing. Bassersdorf: Zurich, 2015.
[23] Abdul-Baki A A, Anderson J D. Vigour determination in soybean seed multiple criteria. Crop Science, 1973, 13(6): 630-633.
[24] Ellis R H, Roberts E H. The influence of genotype, temperature and moisture on seed longevity in chickpea, cowpea and soybean. Annals of Botany, 1982, 50(1): 69-82.
[25] Zheng W H, Leng J M. Effect on germination of seed and growth of seeding by penieillin, hydrogen peroxide and potassium permanganate toHippohaerhamnoides. Seed, 2003, 132(6): 21-22, 29.
鄭蔚紅, 冷建梅. 青霉素、過氧化氫和高錳酸鉀浸種對沙棘種子萌發及幼苗生長的影響. 種子, 2003, 132(6): 21-22, 29.
[26] Lu J, Yang Y L, Jia P X,etal. Effects of exogenous H2O2on the osmotic regulations in wheat. Journal of Lanzhou University (Natural Sciences), 2012, 48(1): 79-85.
盧金, 楊穎麗, 賈鵬翔, 等. 外源H2O2處理對小麥滲透性調節物的影響. 蘭州大學學報(自然科學版), 2012, 48(1): 79-85.
[27] Pasquini S, Mizzau M, Petrussa E,etal. Seed storage in polyethylene bags of a recalcitrant species (Quercusilex): analysis of some bio-energetic and oxidative parameters. Acta Physiologiae Plantarum, 2012, 34: 1963-1974.
[28] Kong L Q, Mao P S, Yu X D,etal. Physiological changes in oat seeds aged at different moisture contents. Seed Science and Technology, 2014, 42: 190-201.

