肝臟原發性未分化多形性肉瘤的CT及MRI表現
趙才勇,崔 鳳,施 偉,胡紅杰
(1.杭州市中醫院放射科,浙江 杭州 310007;2.浙江大學醫學院附屬邵逸夫醫院病理科,3.放射科,浙江 杭州 310016)
未分化多形性肉瘤(undifferentiated pleomorphic sarcoma, UPS)是起源于間葉組織的軟組織肉瘤,既往被稱為惡性纖維組織細胞瘤(malignant fibrous histiocytoma, MFH),原發于肝臟者僅約占肝臟原發惡性腫瘤的1%[1]。本文報道8例肝臟原發性UPS的CT與MRI表現。
1 資料與方法
1.1 一般資料 回顧性分析2006年1月—2015年12月于我院經病理證實的8例肝臟UPS患者,男5例,女3例,年齡40~62歲,中位年齡57.5歲;5例因不同程度上腹脹痛就診,其中1例伴發熱、消瘦;2例因短期內明顯消瘦就診;1例為體檢偶然發現。5例有乙型肝炎病史,其中4例合并肝硬化。實驗室檢查:天冬氨酸轉氨酶升高3例,谷氨酰轉肽酶升高3例,堿性磷酸酶升高2例。免疫組化:甲胎蛋白(+)2例,CA199(+)1例,CA125(+)2例,CEA(-)8例。
1.2 儀器與方法 對8例均行CT軸位平掃及動脈期、門靜脈期增強掃描,5例同時行延遲期增強掃描;對3例行MR掃描。
1.2.1 CT 采用Siemens Definition AS40及Siemens Sensation 16 CT掃描儀。參數:管電壓120 kV,管電流260 mA,層厚5 mm,層間距5 mm。對比劑采用碘海醇(300 mgI/ml)1.5 ml/kg體質量,注射流率2.5~3.0 ml/s,分別經肘靜脈注射后30、60、180 s行動脈期、靜脈期和延遲期掃描。
1.2.2 MR 采用GE Signa HDx 3.0T和GE Signa Excite 1.5T MR掃描儀。掃描序列及參數:常規軸位快速擾相梯度回波(fast spoiled gradient recalled, FSPGR)T1W,TR 150~290 ms,TE 2~3 ms;快速自旋回波(fast spin echo, FSE)T2W,TR 6 000~7 500 ms,TE 80~90 ms;層厚8 mm,層間距0.8 mm,矩陣512×512,激勵次數2。對比劑采用Gd-DTPA 0.2 mmol/kg體質量,注射流率2.5~3.0 ml/s,三期增強掃描方案同CT。
1.3 圖像分析 由2名影像診斷醫師盲法獨立觀察圖像,意見不一時經協商統一。觀察腫瘤數目、部位、大小、形態、邊界、密度/信號、有無壞死、鈣化、出血、動態強化特點、周圍侵犯及遠處轉移。
2 結果
8例中,7例病灶為單發,1例病灶周圍多個子灶;病灶位于肝右葉6例,位于肝左葉、尾狀葉各1例;瘤體最大徑4.20~11.60 cm,平均(8.43±2.45)cm。
2.1 CT表現 6例病灶呈不規則形、邊界模糊;2例呈類圓形,邊界尚清。與周圍正常肝組織相比,8例腫瘤均呈低密度,7例密度不均,1例密度較均勻。8例病灶均可見低密度囊變壞死區,但均無出血灶,其中1例壞死區內可見結節狀鈣化。
動脈期 8例腫瘤邊緣及實質部分呈輕度不均勻強化;5例腫瘤邊緣可見紆曲強化血管影,其中3例延伸至瘤內。靜脈期腫瘤強化程度、范圍進一步增加,逐漸向內填充,囊變壞死區無強化。3例腫瘤邊緣實質部分呈偽足狀向病灶中心壞死區延伸;4例瘤內呈片絮狀、條索狀強化;1例瘤內可見不均勻強化分隔結構。延遲期4例腫瘤持續明顯不均勻強化,1例對比劑少量退去(圖1)。
2.2 MRI表現 3例中,2例腫瘤T1WI以混雜等低信號為主,其中1例低信號壞死區內可見沿門靜脈右支走行稍高信號癌栓;1例呈均勻低信號。2例腫瘤T2WI呈混雜高信號,1例呈均勻高信號。3例瘤體內可見不同程度囊變壞死區,但出血信號不明顯;病灶整體呈漸進性強化,動脈期、靜脈期病灶強化幅度與CT相似,延遲期腫瘤持續明顯不均勻強化2例,對比劑少量退去1例(圖2A~2C)。
2.3 侵犯及轉移 2例病灶直接侵犯下腔靜脈且并發癌栓,其中1例同時伴肝靜脈及右心房癌栓;2例并發門靜脈癌栓,其中1例伴右側腎上腺結節狀轉移。上述4例同時伴肝門區和/或后腹膜淋巴結腫大(圖2D)。
2.4 手術及病理學所見 5例接受手術切除、3例接受穿刺活檢,病理證實腫瘤均為多形性MFH/UPS。5例腫瘤呈灰白色或灰黃色、質硬,病灶內均有不同程度壞死,其中1例伴少量出血。鏡下見瘤細胞及細胞核具有多形性,核大異型明顯,易見核分裂象;可見多核瘤巨細胞,梭型、長梭形瘤細胞排列成束狀、編席狀及漩渦狀,伴慢性炎癥細胞浸潤,部分區域膠原化(圖2E)。1例病灶與周圍肝組織間有厚層纖維包膜。免疫組化:8例波形蛋白(+),5例CD68(+),4例甲胎蛋白(-),7例S-100(-)。
3 討論
UPS由O'Brien等[2]于1964年被首先報道和描述。2013年版WHO最新軟組織腫瘤分類[3]將MFH歸為UPS。UPS是中老年人中最常見的軟組織肉瘤[4],多見于四肢及后腹膜,原發于肝臟較罕見。Yao等[5]發現MFH男女發病率為1.9∶1,平均年齡51歲,本組結果與之相符。
UPS是一組無明確分化方向的多形性異質性間葉性腫瘤,其原始間葉細胞具有向成纖維樣細胞和組織樣細胞分化的特點[6]。2002年,WHO軟組織腫瘤分類將其分為3個亞型:多形性MFH/UPS,巨細胞MFH/伴有巨細胞UPS,炎癥性MFH/伴有顯著炎癥UPS,以多形性MFH/UPS最為常見且惡性程度最高[7]。肝臟UPS臨床表現缺乏特異性。研究[8-9]報道少數肝臟UPS患者可有乙型肝炎病史,合并肝硬化者少見。本組UPS合并乙型肝炎(n=5)、肝硬化(n=4)的發生率較高,可能與本組研究對象均為多形性UPS有關。本組8例波形蛋白、5例CD68均呈陽性,4例甲胎蛋白、7例S-100均呈陰性,其中Vimentin、CD68有助于UPS診斷[10]。
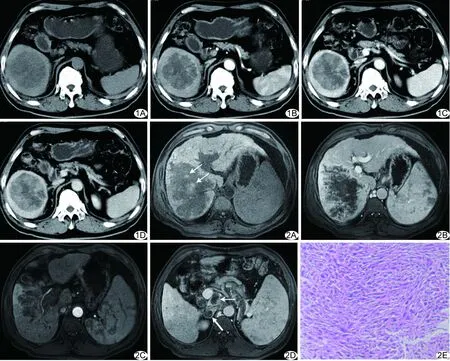
圖1 患者男,62歲,肝右葉UPS A.CT平掃示肝右葉混雜低密度,邊界尚清; B~D.CT增強動脈期(B)、靜脈期(C)及延遲期(D)示病灶實性部分呈不均勻漸進性強化,瘤內片絮狀強化 圖2 患者男,56歲,肝右葉UPS,肝硬化,脾大,食管靜脈曲張 A.T1WI示肝右葉混雜等低信號,邊界不清,瘤內沿門靜脈右支走行稍高信號癌栓(箭); B.MR增強掃描靜脈期示病灶實性部分不均勻漸進性強化,呈偽足狀向病灶中心延伸; C.MR增強掃描動脈期示瘤內腫瘤血管顯影; D.MR增強掃描靜脈期示后腹膜淋巴結腫大(細箭)、右側腎上腺轉移(粗箭); E.鏡下示腫瘤細胞呈梭形,核大異型,呈漩渦狀、束狀排列(HE,×20)
肝臟UPS好發于肝右葉,多單發,瘤體一般較大,86.8%最大徑超過5 cm[5]。本組結果與既往報道[5]相符。本組8例中,6例腫瘤形態不規則,與周圍肝組織分界不清,呈浸潤性生長,具有侵襲性;2例呈膨脹性生長,邊界清楚,其中1例病理上可見纖維包膜。既往研究[8,11]指出,UPS腫塊密度/信號欠均勻,可見不同程度囊變壞死,部分瘤內可見出血灶;少數腫瘤較小時,壞死囊變不明顯。本組8例腫瘤囊變壞死明顯,且壞死區占瘤體大部分;影像學上瘤內出血不明顯,8例腫瘤僅1例手術標本病理顯示少許出血,與戴平豐等[11]報道的腫瘤(最大徑9.4 cm、13.3 cm)易出血不符,可能與本組腫瘤最大徑[平均(8.43±2.45)cm]較小有關。鈣化多見于后腹膜及軟組織UPS,肝臟UPS鈣化少見[9],本組僅1例病變可見鈣化結節。
研究[12-13]報道,肝臟UPS實質部分動脈期呈不均勻輕中度強化,延遲期病灶仍明顯強化。本組8例UPS動脈期強化與之相符,腫瘤邊緣及內部實質輕度不均勻強化,靜脈期持續強化,瘤內囊變壞死區殘留的腫瘤組織偽足狀、絮狀及分隔樣強化更顯著;6例延遲期進一步強化,2例對比劑少量退去;分析原因,延遲期強化差異可能與束狀、編席狀排列的梭型、長梭形腫瘤細胞及膠原纖維比例差異有關,纖維成分比例較高時致對比劑延緩流出。Bivek等[14]發現少數肝臟UPS的強化模式與肝細胞癌的“快進快出”相似,動脈期明顯強化可能與腫瘤富含血竇及炎性細胞浸潤相關,且炎癥性UPS更符合此強化特點。何明燕等[15]報道肝臟UPS未見強化巨大囊性改變,瘤內僅見少許條索狀無強化分隔,推測可能與腫瘤液化壞死徹底相關。有學者[11]提出肝臟UPS血管造影動脈期可見腫瘤推移血管所致“抱球狀”改變,本組病例動脈期掃描瘤周(5/8)及瘤內(3/8)亦可見紆曲腫瘤血管影,提示腫瘤內外血管顯影有助于診斷肝臟UPS。
肝臟UPS惡性程度高,易侵犯鄰近組織及遠處轉移,但較少侵犯門靜脈及膽道系統,區域淋巴結轉移少見[8,12]。本組2例直接侵犯下腔靜脈且并發癌栓,2例并發門靜脈癌栓,上述4例同時伴肝門區和/或后腹膜腫大淋巴結,可能由于本組病例均為多形性UPS,較其他亞型惡性表現更顯著。
本病應與肝細胞癌、肝膽管囊腺癌、膽管細胞癌及其他肉瘤等鑒別。肝細胞癌:巨塊型、結節型肝癌邊界清晰,多表現為典型的“快進快出”強化現象,瘤體較大時多出現裂隙狀壞死;而肝臟UPS多浸潤性生長、漸進性強化,囊變壞死與腫瘤實性成分相互交錯。有學者[8,12]提出肝臟UPS不易侵犯門靜脈系統,淋巴結轉移少見,較少合并肝炎、肝硬化以及AFP陰性,以此可作為與肝癌的鑒別點。但本組約50%肝臟UPS具有上述肝癌表現,故當腫瘤伴有上述表現時不能完全排除UPS。肝膽管囊腺癌:多見于中年女性,惡性程度低,多數囊壁較清晰、可有壁結節及伴囊壁鈣化,遠端膽管常擴張。而肝臟UPS好發于中老年男性,惡性程度較高,邊界欠清,囊壁鈣化少見,累及周圍膽管罕見。膽管細胞癌:患者常有肝內膽管結石病史,瘤內可見結石/鈣化,腫瘤周圍可見擴張膽管或腫瘤包埋膽管表現,常見附近肝葉萎縮。肝臟UPS瘤內鈣化/結石少見,膽管擴張或膽管被腫瘤包埋等征象較罕見。UPS與血管肉瘤、平滑肌肉瘤、癌肉瘤等鑒別困難,最終確診仍需依靠病理學檢查。
[1] Dong J, An W, Ma W, et al. Primary hepatic malignant fibrous histiocytoma mimicking hepatocellular carcinoma: A report of two cases. Oncol Lett, 2014,8(5):2150-2154.
[2] O'Brien JE, Stout AP. Malignant fibrous xanthomas. Cancer, 1994,17(11):51-52.
[3] World Health Organization. WHO classification of tumours of soft tissue and bone: WHO Classification of Tumours, vol. 5. 4th ed. Lyon: IARC Press, 2013,46(2):95-104.
[4] 王東,陳韻,劉文慈,等.惡性纖維組織細胞瘤的CT表現及病理特征.中國介入影像與治療學,2013,10(1):45-48.
[5] Yao D, Dai C. Clinical characteristics of the primary hepatic malignant fibrous histiocytoma in China: Case report and review of the literature. World J Surg Oncol, 2012,10(1):2.
[6] Harman M, Nart D, Acar T, et al. Primary mesenchymal liver tumors: Radiological spectrum, differential diagnosis, and pathologic correlation. Abdom Imaging, 2015,40(5):1316-1330.
[7] 薛瑞峰,方志偉.惡性纖維組織細胞瘤研究進展.實用腫瘤雜志,2011,26(3):311-314.
[8] Cong ZJ, Gong JS. Primary malignant fibrous histiocytoma of the liver: CT findings in five histopathological proven patients. Abdom Imaging, 2011,36(5):552-556.
[9] Li YR, Akbari E, Tretiakova MS, et al. Primary hepatic malignant fibrous histiocytoma: Clinicopathologic characteristics and prognostic value of ezrin expression. Am J Surg Pathol, 2008,32(8):1144-1158.
[10] 付軍,施長鷹,耿利,等.肝惡性纖維組織細胞瘤10例臨床分析.中華肝膽外科雜志,2015,21(2):128-129.
[11] 戴平豐,孟延鋒,鄧麗萍,等.肝臟惡性纖維組織細胞瘤的影像學表現.中華放射學雜志,2005,39(8):855-859.
[12] 祁佩紅,史大鵬,鄭紅偉,等.肝臟原發性惡性纖維組織細胞瘤的CT表現.中華肝膽外科雜志,2015,21(10):654-657.
[13] Jan W, Ying C, Kuo L, et al. Primary hepatic undifferentiated pleomorphic sarcoma: CT and angiographic findings in two cases. J Radiol Sci, 2013,38(1):15-19.
[14] Bivek K, Xu YK, Wu YK, et al. Primary malignant fibrous histiocytoma of the abdominal cavity: CT findings and pathological correlation. World J Radiol, 2012,4(4):151-158.
[15] 何明燕,黃進軍,楊秋霞,等.腹部惡性纖維組織細胞瘤的CT表現.中國醫學影像技術,2014,30(1):82-86.

