2種復合微生態制劑對大海馬幼魚生長存活及水質影響
羅杰,李鋒,劉皓,曹伏君,王中鐸,袁吉貴
(廣東海洋大學南海水產經濟動物增養殖廣東普通高校重點實驗室,廣東 湛江 524025)
海馬是一種小型海洋魚類,分布于內海海藻、海草生長繁茂的地方,以攝食小型甲殼類動物為主,我國沿海常見有大海馬、線紋海馬、三斑海馬、小海馬和刺海馬5種[1]。海馬由于個體較小,其經濟價值主要體現在藥用方面,在我國素有“北方人參,南方海馬”之稱。隨著近海污染的加劇和人類對近岸海域過度開發,導致天然餌料數量減少及棲息環境惡化,而更為嚴重的是人類對海馬需求量日益增多而過度捕撈,其自然資源數量急劇減少[2],世界生物保護組織把所有已知的33種海馬均列入瀕危野生動植物種[3],我國2004年5月把海馬列入Ⅱ級保護動物。因此,進行海馬人工繁育及養殖技術研究尤為重要。大海馬(Hippocampus kuda)是我國海馬養殖的主要養殖品種,經多年研究,在海馬人工繁育和養殖技術[4-12]、形態及生理生態學[13-18]、分子生物學[19-20]等方面研究取得較大進展,但其人工育苗及養殖成活率偏低的問題仍未得到有效的解決,而養殖過程中由于殘餌、管理不科學等原因造成水體中 pH、化學需氧量(COD)、氨氮(NH4+-N)、亞硝酸鹽等有害物質的大量積累,導致水體惡化,誘導疾病的發生,是大海馬人工育苗及養殖成活率偏低的原因之一。
微生態制劑(probiotics)也叫活菌制劑(bigone)或益生菌,是一類能夠調整微生態失調,保持微生態平衡,提高宿主健康水平的正常菌群及其代謝產物和選擇性促進宿主正常菌群生長的制劑總稱[21]。用于水產養殖的微生態制劑主要有芽孢桿菌、乳酸菌、酵母菌、光合細菌、硝化細菌、反硝化細菌、EM菌等,具有抗病、促生長、凈化水質、提高免疫功能、無毒無不良作用、無殘留、成本低、效果顯著、不污染環境等優點[22-23],對養殖水體修復[24]、提高水產動物人工育苗及養殖成活率、病害防控[25-32]等方面效果顯著。本文在大海馬人工育苗及養殖期間,通過投放在水產養殖中廣泛使用的2種復合微生態制劑AQ菌和EM菌,研究二者對大海馬幼魚生長、存活及水質的影響,以期為微生態制劑在海馬人工養殖中的應用提供更為詳實的資料。
1 材料與方法
1.1 實驗材料與設施
實驗在湛江溢鑫源水產科技有限公司水產種苗繁育基地進行,所用的大海馬幼魚由基地提供,體長(1.13±0.07)cm,試驗海水溫度 28.5~29.2 ℃、鹽度(30.0±0.5)、pH 值 8.2,經沉淀、砂濾后使用。
二種復合微生態制劑分別為AQ菌和EM菌,其中AQ菌為上海綠奧生物科技有限公司生產,粉末狀,包括Bacillus mageterium、硝化細菌、芽孢桿菌等多種有益菌及復合酶、營養劑,有效活菌含量不低于 20×108CFU/g;EM菌由山東寶來利來生物工程股份有限公司生產,主要成分為乳酸菌、酵母菌、放線菌、沼澤紅假單胞菌、絲狀菌等有益菌,活菌總數大于30×108CFU/mL。AQ菌加水配制成菌液后使用,配制比例為1 g/m3(固體粉末)=1 mL/m3(液體菌液)。
實驗所用的水泥池大小為1.0 m×1.0 m×1.0 m,每池安放2個氣石,微沖氣。
1.2 實驗方法
1.2.1 實驗設計 實驗在小水泥池中進行,水泥池經消毒處理,加入經砂濾的海水90 cm。設1個沒有投放復合微生態制劑的空白對照組和2個試驗組,其中試驗組A加入微生態制劑AQ菌4.5 mL,試驗組B加入EM菌3.0 mL,使養殖水體中有益菌濃度約為1×104CFU/mL,每個試驗組設3個重復。每個小水泥池投放大小為(1.13±0.07)cm的大海馬幼魚250尾,實驗時間為35 d。
1.2.2 日常管理 每天上午用虹吸方法把池中的臟物、殘餌吸掉,死魚及時撈出,然后換水,換水量為50%~60%,換的水溫盡量與原水溫保持一致,防止溫差變化太大造成應激反應,根據換水量的多少追加投放適量的微生態制劑,使水體中的有益菌濃度維持在1×104CFU/mL左右。餌料主要為鹵蟲幼體、糠蝦等,每天投餌3次,每次以水中有少量剩餌為宜。
1.3 生長及水質指標測定
實驗結束后,每組取15尾海馬幼魚用游標卡尺測量體長,統計存活的幼魚數量,最后計算體長特定生長率R(%/d)及成活率A(%):
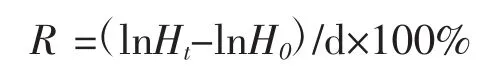
式中Ht、H0分別為實驗結束時幼魚的平均體長、起始體長,d為實驗時間。
A=(實驗各階段或結束時幼魚存活數/實驗起始幼魚總數)×100%。
每隔5 d,在換水前測定試驗池中的pH值、COD、NH4+-N和NO2--N含量,測定儀器及方法分別采用美國OHRUS ST10型酸度計、高錳酸鉀法、次溴酸鈉氧化法(以722s紫外分光光度計測定吸光值)、鹽酸萘乙二胺比色法[33]。
1.4 數據處理
采用SPSS17.0統計軟件對數據進行分析處理,利用Duncan進行多重分析比較,統計學意義差異水平規定為P<0.05。實驗數據均表示為平均值±標準差(Mean±SE)。
2 結果
2.1 不同微生態制劑對大海馬幼魚生長的影響
經過35 d實驗,投放AQ菌、EM菌和對照組的大海馬幼魚生長、存活結果見表1。從表1中可以看到,對照組的幼魚體長特定生長率最低,而投放AQ菌、EM 菌組的分別為 (12.79±1.87)%/d、(13.22±1.52)%/d,EM菌組幼魚比對照組的體長增加了5.8%。Duncan多重顯分析比較,投放微生態制劑的A、B組的大海馬幼魚體長特定生長率與對照組差異具有統計學意義(P<0.05),而A、B兩組之間差異不具有統計學意義(P>0.05)。在成活率方面,A、B組相差不大,對照組最低,只有51.6%,但與A、B組相比較,成活率差異不具有統計學意義(P>0.05)。
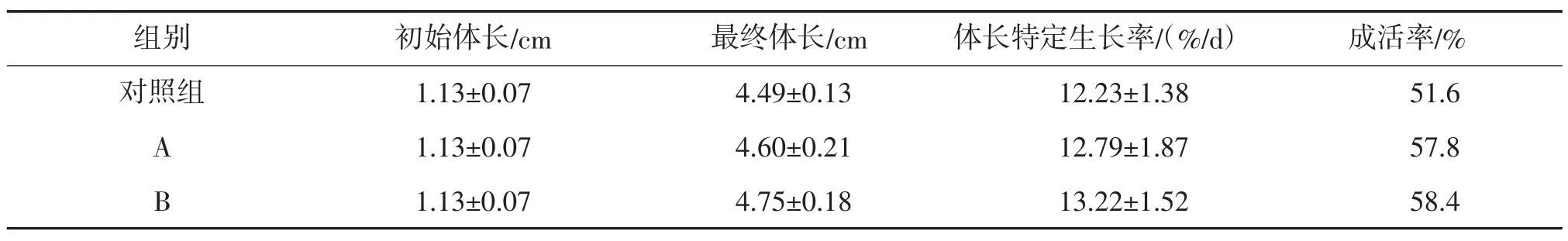
表1 不同實驗組對大海馬幼魚生長與存活的影響
2.2 不同微生態制劑對養殖水質的影響
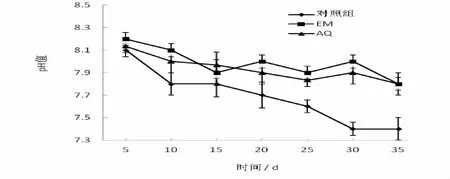
圖1 不同微生態制劑處理水體中pH的變化
2.2.1 pH值含量的影響 從圖1中看出,兩種微生態制劑對養殖水體的pH值具有明顯的提高作用。試驗到第5天,pH值的差異就逐漸顯示出來,實驗結束時對照組的pH值下降至7.4,而兩種微生態制劑AQ、EM的pH值始終處于7.7~8.2之間,保持在動物較佳生長范圍。多重分析比較,對照組與實驗組之間均無統計學意義差異(P>0.05)。
2.2.2 水體中化學需氧量(COD)含量的影響 對照組、投放微生態制劑的實驗組對養殖過程中化學需氧量(COD)含量影響見圖2,投放微生態制劑對水體中的化學需氧量具有明顯的降低作用。沒有施放微生態制劑的對照組,從第5天開始到實驗結束,COD始終處于上升狀態,結束時達到4.68 mg/L,與實驗組均有統計學意義差異(P<0.05);而EM、AQ組,水體中COD的含量保持在較低水平,尤其是EM組效果更好,實驗結束時只有3.23 mg/L,比對照組降低了31%。但兩組間無統計學意義差異(P>0.05)。
2.2.3 水體中氨氮(NH4+-N)含量的變化 微生態制劑對水中NH4+-N含量的影響見圖3。實驗組EM、AQ水體中NH4+-N的含量只是緩慢上升,始終維持在0.118~0.204 mg/L,沒有統計學意義差異(P>0.05);而對照組的NH4+-N含量變化幅度較大,結束時其含量達到0.423 mg/L,與加入復合微生態制劑組最低相比,水體中NH4+-N含量增加了107.4%,而且表現出統計學意義差異(P<0.05)。
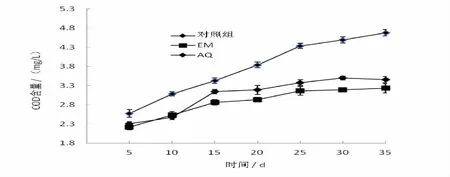
圖2 水體中化學需氧量(COD)含量的變化
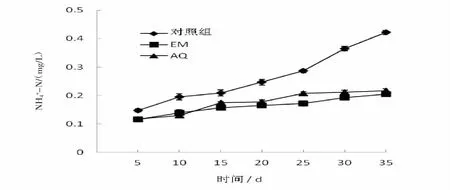
圖3 水體中氨氮(NH4+-N)含量的變化
2.2.4 水體中亞硝酸鹽氮(NO2--N)含量的變化從圖4中可見,微生態制劑可明顯降低水體中亞硝酸鹽氮(NO2--N)的含量。實驗第5天,對照組與實驗組水中NO2--N含量相差不大,而隨著實驗的繼續,微生態微制劑組與對照組水中NO2--N的含量表現出統計學意義差異(P<0.05),至實驗結束時沒有加入微生態制劑的對照組水中NO2--N為0.183 mg/L,是含量最低(只有0.058 mg/L)的微生態制劑AQ的3倍多。
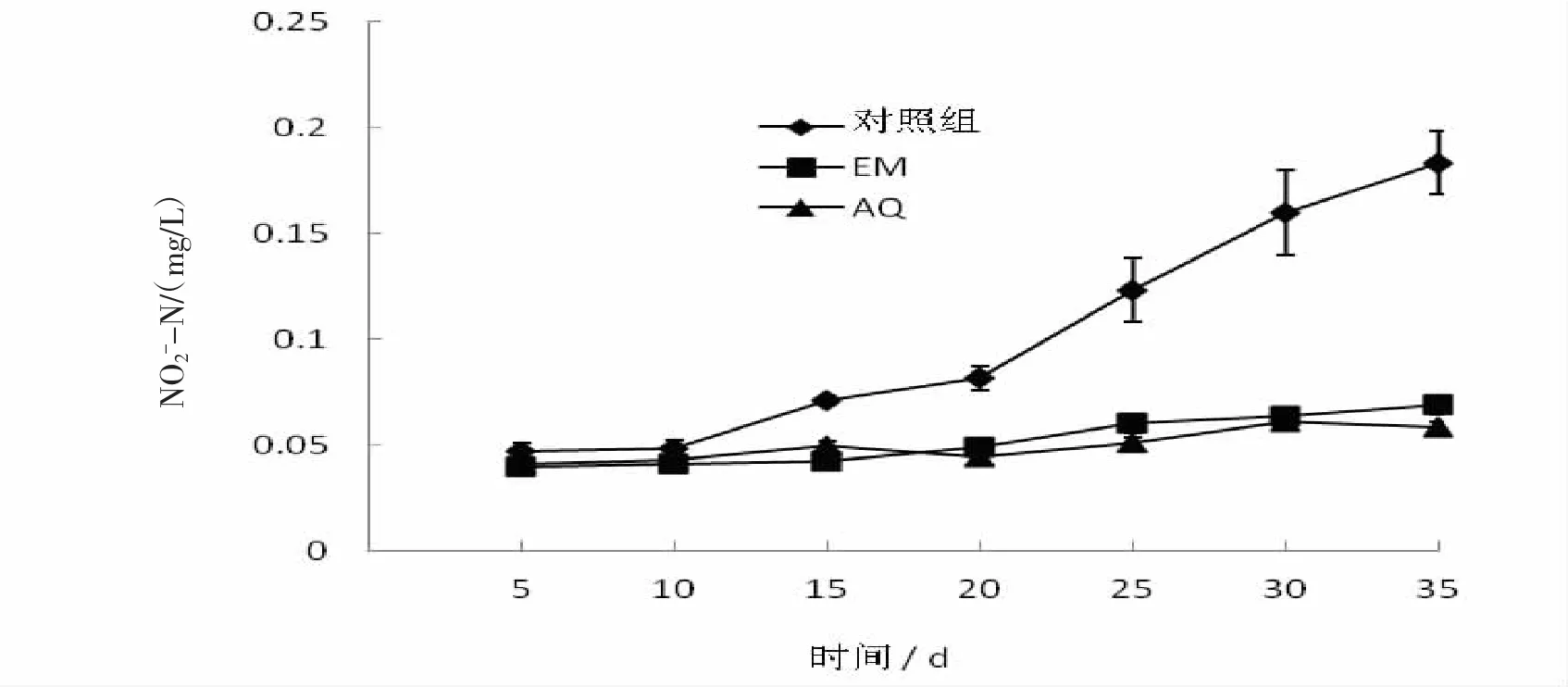
圖4 水體中亞硝酸鹽氮(NO2--N)含量的變化
3 結論與討論
水生動物在養殖過程中,由于自身的排泄、人工投餌等諸多因素影響,致使水體中氨氮、H2S、亞硝酸鹽等有害物質的含量不斷積累,增加了水產動物患病的風險。水產動物傳統的防病治病常常采用投放過量的抗生素,實踐證明,過多使用抗生素,一些常見的水產動物病害已產生抗藥性及可導致動物自身免疫力下降,破壞養殖水體的生態系統,同時抗生素對環境容易造成污染、影響水產動物的風味等。因此,微生態制劑在水產養殖中的應用受到越來越多的養殖者青睞,它具有無毒、無不良作用、無殘留和不產生抗藥性等特點,能夠有效改善養殖生態環境,調節水體質量、消除氨氮等污染、增強養殖對象的免疫力,在健康水產養殖中發揮十分重要的作用。
3.1 微生態制劑對大海馬幼魚生長與存活的影響
由于微生態制劑本身含有大量的營養物質,同時隨著它們在動物消化道內的定植、繁衍和代謝,可產生動物生長所需的維生素、氨基酸、促生長因子以及蛋白酶、脂肪酶、淀粉酶、纖維酶等多種酶,從而增強養殖對象的營養代謝,增加機體對養分的消化利用,促進其生長。
另一方面,微生態制劑還可通過競爭抑制以及產生抑菌物質等方式抑制有害細菌,從而起到預防病害的作用[25]。大量的研究結果表明,在養殖水體中施加微生態制劑可促進水生動物生長及增加其免疫力。武鵬等[25]研究了3種微生態制劑對水質及刺參幼參生長的影響,微生態制劑均能提高幼參的特定生長率,同時提高幼參體腔液中的酸性磷酸酶、過氧化氫酶、溶菌酶活力;在凡納濱對蝦育苗中,投放微生態制劑可縮短幼體變態時間和提高成活率[34];在牙鲆幼魚養殖中加入微生態制劑,可顯著提高牙鲆幼魚消化道的蛋白酶活性,對牙鲆幼魚生長有顯著的促進作用[35]。本試驗從表1中可以看出,同一規格的大海馬幼魚經過35 d的養殖試驗,在加入微生態制劑的A、B組,大海馬幼魚的特定生長率均比對照組的高,有統計學意義差異(P<0.05);兩種微生態制劑都可以提高大海馬幼魚的成活率,但與對照組比較,差異無統計學意義(P>0.05)。微生態制劑能夠提高水產動物的成活率,在相關研究文獻中已經得到證實[36-37]。
3.2 微生態制劑對養殖水體中pH、COD、NH4+-N和NO2--N含量影響
在水體中加入微生態制劑,其中的有益微生物能夠發揮其氧化、氨化、反硝化、解磷、硫化、固氮等作用,迅速分解水中的排泄物、殘餌、動植物殘骸等有機物,降低氨態氮、硫化氫、COD等有害物質的含量,并可通過反硝化作用去除亞硝酸鹽等污染物,間接增加水中的溶氧量。另外,通過加入有益微生物形成優勢種群,與有害病原菌形成競爭,限制其生長,而且部分有益微生物的代謝產物具有殺菌抑菌作用,從而達到預防水產疾病的作用。還有,微生態制劑可促進養殖水體中原生動物、輪蟲、枝角類等動物性餌料大量繁殖,實現浮游植物的結構由單一種群向多種群轉變,優勢種類轉變為單細胞藻類。在降解淤泥、抑制有害微生物和有害藻類的繁殖、平衡養殖水體的微生態環境等方面可起到積極作用。微生態制劑通過以上途徑實現改善水質。
試驗中,無論是對照組還是加入微生態制劑的實驗組,水體中pH、COD、NH4+-N和NO2--N的含量均隨著養殖時間的延長而增加,只不過實驗組的增加比較緩慢,而對照組增加較快(見圖 1、2、3、4),可見微生態制劑可延緩水中pH下降,使其維持在一個適宜的范圍。同樣,微生態制劑對水體中的COD、NH4+-N和NO2--N只是起到一定的降解作用,并不能完全消除水中的有害物質。2種微生態制劑EM菌和AQ菌由于其所含的有益菌種類不同,故二者對水中的COD、NH4+-N和NO2--N降解效果也有所差別,EM菌對降低COD、NH4+-N的含量效果較好,而AQ菌由于含有硝化細菌,其對NO2--N的降解效果更好。從上述實驗結果來看,無論對大海馬幼魚的生長還是對水中 pH、COD、NH4+-N和NO2--N含量的影響,EM菌和AQ菌的效果相差不大。在實際生產養殖中由于微生態制劑使用量較大,從經濟效益出發,在二者中可以選擇價廉的進行使用,以提高經濟效益。
[1]張璐,李靜,魏萬權.海馬的生物學特性及其增養殖技術[J].中國水產,2004(7):62-63.
[2]呂軍儀,許實波.海馬工廠化健康養殖成果及開發前景[J].中藥材,2001,24(9):629-631.
[3]Cites.Seahorses and other members of the family Syngnathidae (decision 12.54)[R].Report of the working group.AC20 Doc.17.Convention on internationaltrade in endangered species of wild fauna and flora (CITES),twentieth meeting of the animals committee Johannesbur(South Africa),2004.
[4]杜慶紅,陳栩,朱長壽,等.大海馬人工繁殖和育苗技術研究[J].臺灣海峽,2004,23(2):186-191.
[5]Koldewey H J,Martin Smith K M.A global review of seahorse aquaculture[J].Aquaculture,2010(302):131-152.
[6]魏祥東,葉長明,陳東紅.餌料對幼海馬生長的影響[J].中山大學學報,2003,42(3):60-63.
[7]趙平孫,文子能,周生祿.人工養殖條件下大海馬幼魚的生長[J].海洋水產研究,2003,24(3):15-19.
[8]Iin Q,Zhang D,Lin J D.Effects of light intensity,stocking density,feeding frequency and salinity on the growth of sub adult seahorses Hippocampus erectus Perry[J].Aquaculture,2009(292):111-116.
[9]呂軍儀,吳金英,楊大偉,等.大海馬在人工養殖條件下的生長速率[J].中國水產科學,2001,8(1):59-63.
[10]戴廣譜,徐永健,孫彬.大海馬幼苗人工養殖條件的研究[J].漁業科學進展,2011,32(4):62-66.
[11]李景,徐永健.大海馬交配和孵化適宜環境條件研究[J].生態科學,2014,33(4):730-734.
[12]王韓信,劉曉東,張東,等.冷凍和鮮活糠蝦對灰海馬繁殖力的影響[J].水產科技情報,2012,39(1):6-9.
[13]王子暉,徐永健,李響.大海馬(Hippocampus kuda Bleeker)幼體口吻部骨骼形態觀察及其對攝食的影響[J].漁業科學進展,2015,36(5):126-130.
[14]林強,呂軍儀,張彬,等.大海馬消化系統胚后發育的形態學及組織學研究[J].熱帶海洋學報,2007,26(6):46-51.
[15]Woods C.M.C.Effects of varying Artemia enrichment on growth and survival of juvenile seahorses,Hippocampus abdominalis[J].Aquaculture,2003(220):537-548.
[16]尹飛,唐保軍,張東.營養強化對灰海馬幼體氨基酸組成的影響及品質的評價[J].海洋漁業,2011,33(3):310-318.
[17]席寅峰,張東,施兆鴻.投喂頻率對雌雄分化后灰海馬生長發育、餌料轉換效率及消化酶活力的影響[J].海洋漁業,2013,35(1):77-85.
[18]尹飛,唐保軍,張東,等.投喂不同密度鹵蟲無節幼體對灰海馬幼體生長和存活的影響 [J].應用與環境生物學報,2012,18(4):617-622.
[19]吳平,周開亞,張朝暉,等.海馬類藥材的分子遺傳標記鑒定研究[J].藥學學報,1998,33(3):226-233.
[20]Teske P.R,Hamilton H,Palsboll P J,et al.Molecular evidence for long-distance colonization in an Indo-Pacific seahorse lineasg[J].Marine Ecology Progress Series,2005(286):249-260.
[21]吳保承,沈國強,楊春霞,等.微生態制劑在水質凈化中的應用現狀及展望[J].環境科學與技術,2010,33(12):408-410.
[22]田功太,劉飛,段登選,等.EM菌對海參養殖水體理化因子的影響[J].水生態學雜志,2012,33(1):75-79.
[23]李加雙,劉彤,黃忠剛,等.水質凈化芽孢桿菌的篩選及培養條件優化[J].大連工業大學報,2014,33(6):404-408.
[24]張連水,張青松,孟會賢,等.高效復合微生態制劑對養殖水體修復效應的研究[J].河北漁業,2015(9):16-18.
[25]武鵬,趙大千,蔡歡歡,等.3種微生態制劑對水質及刺參幼參生長的影響 [J].大連海洋大學學報,2013,28(1):21-26.
[26]王吉橋,張凱,袁成玉,等.不同比例微藻和微生態制劑對仿刺參幼參生長的影響[J].水產科學,2013,23(9):524-530.
[27]吉遠軍,李家勝,陸峰,等.復合微生態制劑AQ在南美白對蝦養殖中應用效果[J].水產養殖,2012(5):15-16.
[28]李曉英,董志國,閻斌倫,等.復合微生態制劑對中國對蝦養殖池塘水質和生長性能的影響 [J].中國飼料,2007(19):27-29.
[29]周可,謝鳳行,張峰峰,等.水產養殖復合微生態制劑使用技術研究[J].天津農業科學,2016,22(5):50-53.
[30]郝佳,蔡明城,陳文博,等.幾種微生態制劑對刺參生長和養殖水體水質的影響[J].經濟動物學報,2015,19(2):67-73.
[31]胡京,董琦,張春巖,等.兩種EM菌劑對養殖水體水質及幼刺參生長性能的影響 [J].大連工業大學學報,2016,35(2):79-83.
[32]白海鋒,于麗娜,劉鐵鋼,等.微生態制劑對幼刺參越冬成活率及生長的影響[J].河北漁業,2012(1):5-8.
[33]雷衍之.養殖水環境化學實驗[M].北京:中國農業出版社,2006:31-72.
[34]劉建勇.復合微生物制劑在凡納濱對蝦育苗中的應用[J].海洋科學,2005,29(4):36-40.
[35]馮俊榮,陳營,杜榮斌,等.微生態制劑對牙鲆幼魚蛋白酶和生長的影響[J].糧食與飼料工業,2005(12):36-38.
[36]劉曉東,張琴,王韓信,等.芽孢桿菌微生態制劑對灰海馬幼體生長、成活率及消化酶活力的影響[J].水產科技情報,2015,42(3):119-123.
[37]白海鋒,于麗娜,劉鐵鋼,等.微生態制劑對幼刺參越冬成活率及生長的影響[J].河北漁業,2012(1):5-8.

