不同品質(zhì)濃香型窖泥的酶活與微生物群落的相關(guān)性
吳樹坤,劉梅,鄧杰,衛(wèi)春會(huì),黃治國(guó)
(四川理工學(xué)院,釀酒生物技術(shù)及應(yīng)用四川省重點(diǎn)實(shí)驗(yàn)室,四川 自貢,643000)
窖池作為中國(guó)白酒的發(fā)酵場(chǎng)所,窖泥的品質(zhì)尤為重要,直接關(guān)乎著白酒的質(zhì)量。窖泥中微生物對(duì)酒質(zhì)的影響是通過多種酶促反應(yīng)實(shí)現(xiàn)的,分析窖泥酶活性是鑒定窖泥質(zhì)量的一個(gè)重要方面[1]。窖泥微生物群落經(jīng)長(zhǎng)期的富集與馴化并改善著窖泥的品質(zhì),由于用理化指標(biāo)來反映窖泥的品質(zhì)具有一定的局限性,而窖泥中的酶是由窖泥微生物代謝釋放于窖泥中,因此用窖泥的酶活指標(biāo)反映窖泥菌群結(jié)構(gòu)從而表征窖泥質(zhì)量能很好地彌補(bǔ)前者的不足。但目前對(duì)窖泥中酶的相關(guān)報(bào)道還較少,且單個(gè)樣品研究的酶種類少。土壤是制作窖泥的主要原料,因此窖泥中酶的研究主要參考土壤學(xué)中酶的研究方法。本項(xiàng)目以不同品質(zhì)的濃香型窖泥為樣品,應(yīng)用高通量測(cè)序技術(shù)研究窖泥中微生物群落的多樣性,并分析測(cè)定了5種對(duì)白酒釀造具有重要作用酶系的活力,再利用SPSS軟件和Mothur軟件將不同品質(zhì)窖泥的微生物多樣性與窖泥酶活進(jìn)行相關(guān)性分析以得到其規(guī)律。
1 材料與方法
1.1 材料
1.1.1 實(shí)驗(yàn)材料
窖泥樣品,四川地區(qū)某濃香型白酒廠生產(chǎn)窖池,且窖池連續(xù)生產(chǎn)使用在5年以上,根據(jù)酒廠常年的生產(chǎn)情況,將全廠窖池分為一等、二等、三等3個(gè)質(zhì)量等級(jí)進(jìn)行取樣。取樣部位為每口窖池窖底中心部位,相同品質(zhì)的窖泥樣品取3個(gè)平行樣,并按照窖泥等級(jí)由高到低的順序依次進(jìn)行1~9編號(hào)。取回的窖泥樣品分成兩部分保藏,一部分用于測(cè)定酶活,4 ℃冷藏;另一部分用于提取DNA,-20 ℃冷凍保存。
1.1.2 主要試劑
苯酚、甲醇、次氯酸鈉、尿素、硫酸銨、甘氨酸、茚三酮、酪素、無水乙醇、磷酸苯二鈉(分析純,成都科龍化工),氯代二溴對(duì)苯醌亞胺(分析純,貝斯特試劑),甲苯、高錳酸鉀、過氧化氫、三羥甲基氨基甲烷、連二亞硫酸鈉(分析純,中國(guó)醫(yī)藥集團(tuán)),亞硫酸鈉、氯化三苯基四氮唑、甲醛(分析純,重慶川東化工集團(tuán))。DNA提取純化試劑:PowerSoil DNA Isolation Kit(MOBIO,美國(guó)),Gel Extraction Kit(康為世紀(jì),中國(guó)),Quant-iT PicoGreen DNA Kit(Invitrogen,美國(guó));PCR試劑:buffer、MgCl2、EXTaq酶、dNTPs、DNA Marker(Takara,日本),正反向引物(上海生工,中國(guó));高通量測(cè)序試劑由美國(guó)Roche公司提供。
1.1.3 主要儀器
高速低溫離心機(jī)(Thermo,美國(guó)),酶標(biāo)儀(Thermo,美國(guó)),高速離心機(jī)(Eppendorf,德國(guó)),電泳儀(Bio-rad,美國(guó)),均質(zhì)機(jī)(SCILOGEX,美國(guó)),熒光分光光度計(jì)(Promaga,美國(guó)),高通量測(cè)序儀(Roche,美國(guó))。
1.2 實(shí)驗(yàn)方法
1.2.1 窖泥酶活測(cè)定方法
采用靛酚比色法測(cè)定脲酶活性[2];采用茚三酮比色法測(cè)定酸性蛋白酶活性[3];采用磷酸苯二鈉比色法測(cè)定窖泥中酸性磷酸酶活性[4];采用高錳酸鉀滴定法測(cè)定窖泥中過氧化氫酶活性;采用TTC(氯化三苯基四氮唑)法測(cè)定窖泥中脫氫酶酶活[5]。
1.2.2 微生物群落結(jié)構(gòu)檢測(cè)方法
1.2.2.1 窖泥總DNA的提取
窖泥中的腐殖酸是干擾DNA提取及后續(xù)PCR擴(kuò)增反應(yīng)的主要因素,因此采用MOBIO公司PowerSoil DNA Isolation Kit提取窖泥微生物總DNA,提取后的DNA樣品取5 μL于1%的瓊脂糖凝膠電泳檢測(cè)其完整性。DNA樣品于-20 ℃保存。
1.2.2.2 窖泥DNA PCR擴(kuò)增
選用通用引物968F-1401R。PCR反應(yīng)體系為25 μL,體系包括:2.5 μL 10×Buffer,2 μL 25 mmol/L dNTP,2 μL MgCl2,正反向引物10 μmol/L各0.5μL,0.5 μL 5 U/μL的EXTaq酶,DNA模板用量為0.3 μL(原液DNA稀釋 20倍),最后用雙蒸水補(bǔ)充至25 μL。反應(yīng)程序?yàn)椋?4 ℃ 3 min;30個(gè)循環(huán):94 ℃ 15 s,56 ℃ 30 s,72 ℃ 90 s;72 ℃ 10 min。對(duì)擴(kuò)增后DNA進(jìn)行瓊脂糖凝膠電泳,檢測(cè)有無PCR產(chǎn)物。
1.2.2.3 PCR擴(kuò)增產(chǎn)物純化及定量
采用康為世紀(jì)Gel Extraction Kit對(duì)PCR擴(kuò)增目的產(chǎn)物進(jìn)行回收純化以除去引物二聚體,回收后取5 μL產(chǎn)物用1%瓊脂糖凝膠電泳檢測(cè)。經(jīng)純化后的產(chǎn)物濃度是否滿足測(cè)序要求,測(cè)序前需采用Quant-iT PicoGreen Kit對(duì)純化后對(duì)PCR產(chǎn)物進(jìn)行定量。
1.2.2.4 高通量測(cè)序
由于涉及對(duì)微生物群落定量分析,因此測(cè)序前需對(duì)DNA樣品進(jìn)行均一化;微乳滴PCR使DNA在獨(dú)立反應(yīng)空間進(jìn)行擴(kuò)增,以降低外界條件的干擾。emPCR反應(yīng)條件為:94 ℃ 4 min;94 ℃ 30 s,58 ℃ 4.5 min,68 ℃ 30 s,反應(yīng)循環(huán)50次;10 ℃保溫;將emPCR擴(kuò)增產(chǎn)物從微乳滴中分離出來,將準(zhǔn)備好的PicoTiterPlate反應(yīng)板裝入高通量測(cè)序儀進(jìn)行測(cè)序。
1.3 數(shù)據(jù)分析
酶活指標(biāo)的測(cè)定結(jié)果用x±Sd表示。高通量測(cè)序數(shù)據(jù)分析:利用Mothur軟件對(duì)測(cè)序數(shù)據(jù)進(jìn)行總體分析后,再用測(cè)序序列與Silva數(shù)據(jù)庫(kù)進(jìn)行比對(duì),獲得OTU(Operational Taxonomic Units)分類,確定序列對(duì)應(yīng)微生物的分類學(xué)地位。利用SPSS 20軟件對(duì)窖泥酶活數(shù)據(jù)進(jìn)行方差分析,并將其和微生物群落結(jié)構(gòu)進(jìn)行相關(guān)性分析。
2 結(jié)果分析與討論
2.1 窖泥酶活測(cè)定結(jié)果與分析
本試驗(yàn)研究了脲酶、蛋白酶、酸性磷酸酶、過氧化氫酶、脫氫酶的活性。結(jié)果發(fā)現(xiàn):不同品質(zhì)的窖泥各酶活指標(biāo)呈現(xiàn)不同趨勢(shì)和差異。如圖1所示,不同等級(jí)窖泥的脲酶活性差異顯著(p<0.05),隨窖泥品質(zhì)的提升而呈現(xiàn)出降低的趨勢(shì)。一級(jí)窖泥的脲酶平均活性分別比二級(jí)和三級(jí)窖泥低50.0%和77.0%,這表明品質(zhì)越好的窖泥,尿素越不易被催化分解,而尿素作為有機(jī)氮源可能有利于某些窖泥微生物的生長(zhǎng)代謝。蛋白酶、酸性磷酸酶、過氧化氫酶的酶活隨窖泥品質(zhì)的提升而升高。
圖1 脲酶測(cè)定結(jié)果Fig.1 Result of urease determination 注:不同字母表示差異顯著(p<0.05)圖2~圖5與此相同。
如圖2所示,一級(jí)品質(zhì)窖泥中蛋白酶酶活顯著高于另外兩個(gè)等級(jí)的窖泥,其中一級(jí)窖泥蛋白酶酶活比二級(jí)窖泥高61.8%,二級(jí)窖泥蛋白酶活性比三級(jí)窖泥高70%。品質(zhì)越好的窖泥蛋白酶酶活越高,可能意味著窖泥微生物能有更多的由蛋白質(zhì)分解帶來的營(yíng)養(yǎng)物質(zhì)。
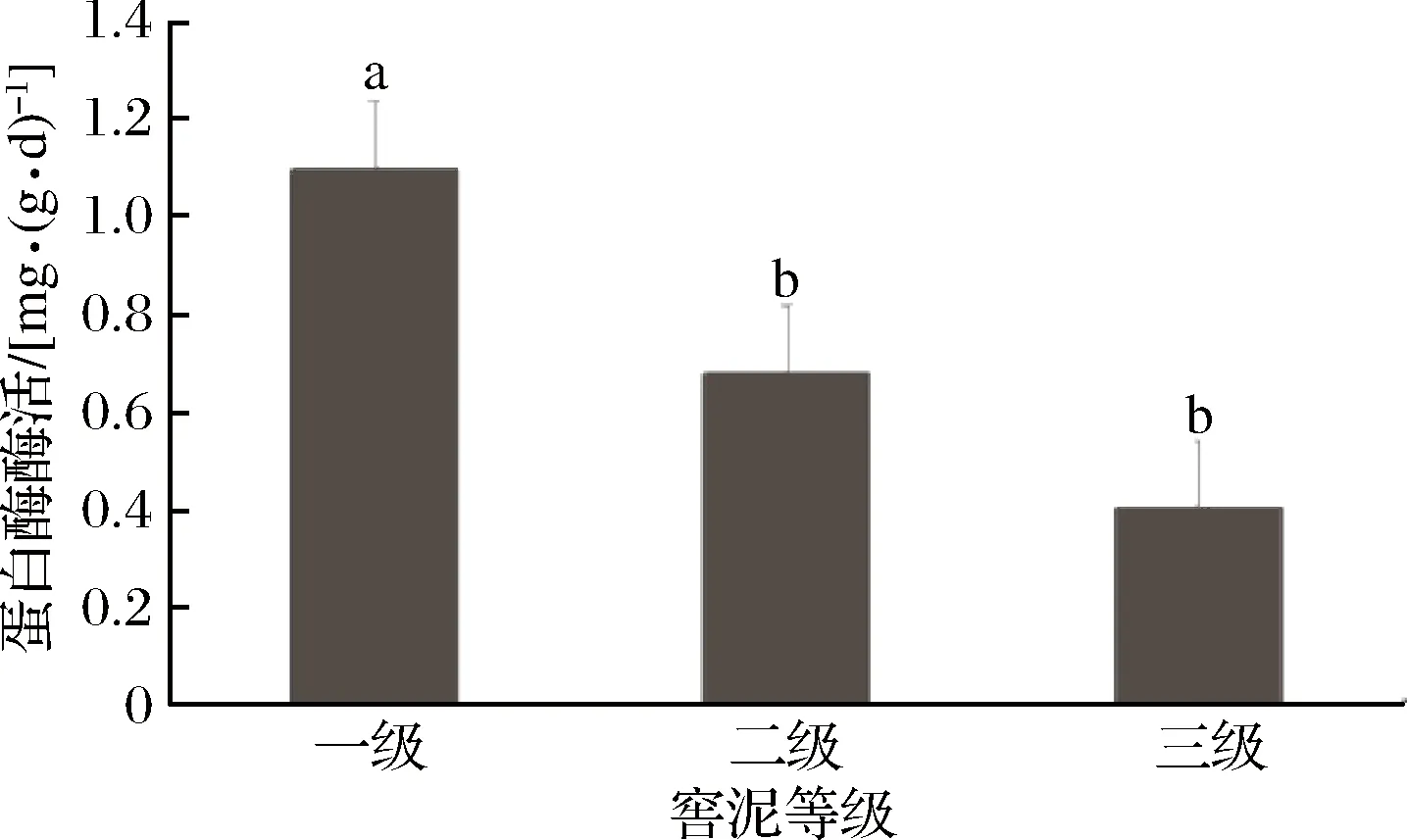
圖2 蛋白酶測(cè)定結(jié)果Fig.2 Result of protease determination
如圖3所示,一、二級(jí)窖泥中的酸性磷酸酶酶活顯著(p<0.05)高于三級(jí)窖泥。一級(jí)窖泥酸性磷酸酶酶活分別比二級(jí)窖泥、三級(jí)窖泥高35.5%和250.0%。
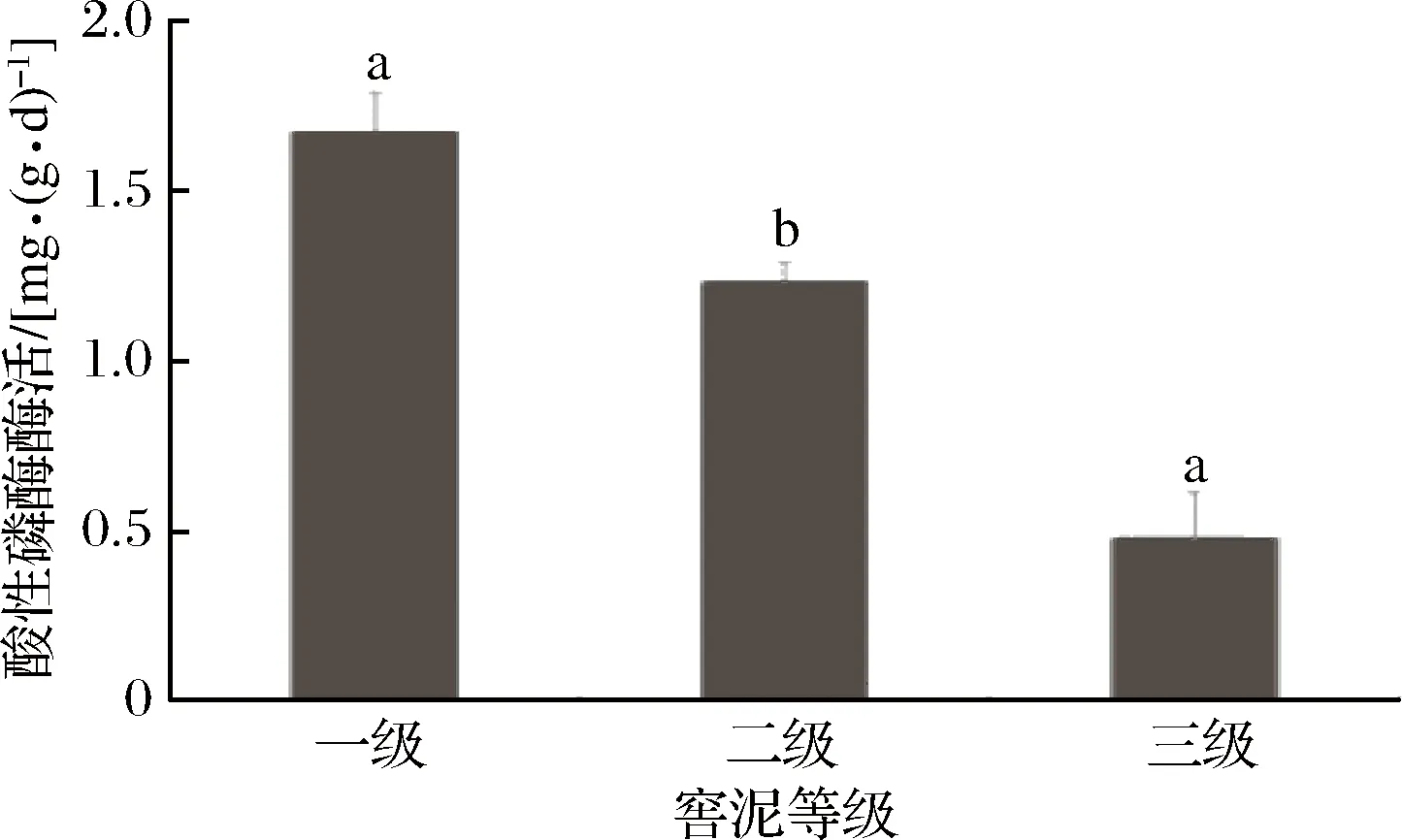
圖3 酸性磷酸酶測(cè)定結(jié)果Fig.3 Result of acid phosphatase determination
如圖4所示,一級(jí)窖泥過氧化氫酶酶活分別比二級(jí)窖泥、三級(jí)窖泥高93.8%和689.3%,過氧化氫酶酶活隨窖泥品質(zhì)的升高而呈現(xiàn)出上升趨勢(shì)。有研究表明[6],過氧化氫酶的活性與pH密切相關(guān),pH值越接近中性,過氧化氫酶活性越高,而一級(jí)窖泥的過氧化氫酶酶活高是否是由于窖泥pH更接近中性,需進(jìn)一步驗(yàn)證。

圖4 過氧化氫酶測(cè)定結(jié)果Fig.4 Result of catalase determination
如圖5所示,一級(jí)窖泥中脫氫酶活與二、三級(jí)窖泥差異顯著(p<0.05),且酶活明顯低于其他兩種品質(zhì)的窖泥,表明其氧化還原反應(yīng)的強(qiáng)度明顯較弱。一級(jí)窖泥脫氫酶酶活分別比二、三級(jí)窖泥低80.5%和80.9%。白酒發(fā)酵的過程,特別是產(chǎn)香階段,是一個(gè)緩慢的過程,而王秀菊[7]認(rèn)為脫氫酶活性高低與有機(jī)質(zhì)降解速率呈正相關(guān),表明優(yōu)質(zhì)窖泥脫氫酶活性上的特點(diǎn)較一般窖泥而言可能更有利于香氣成分的生成。
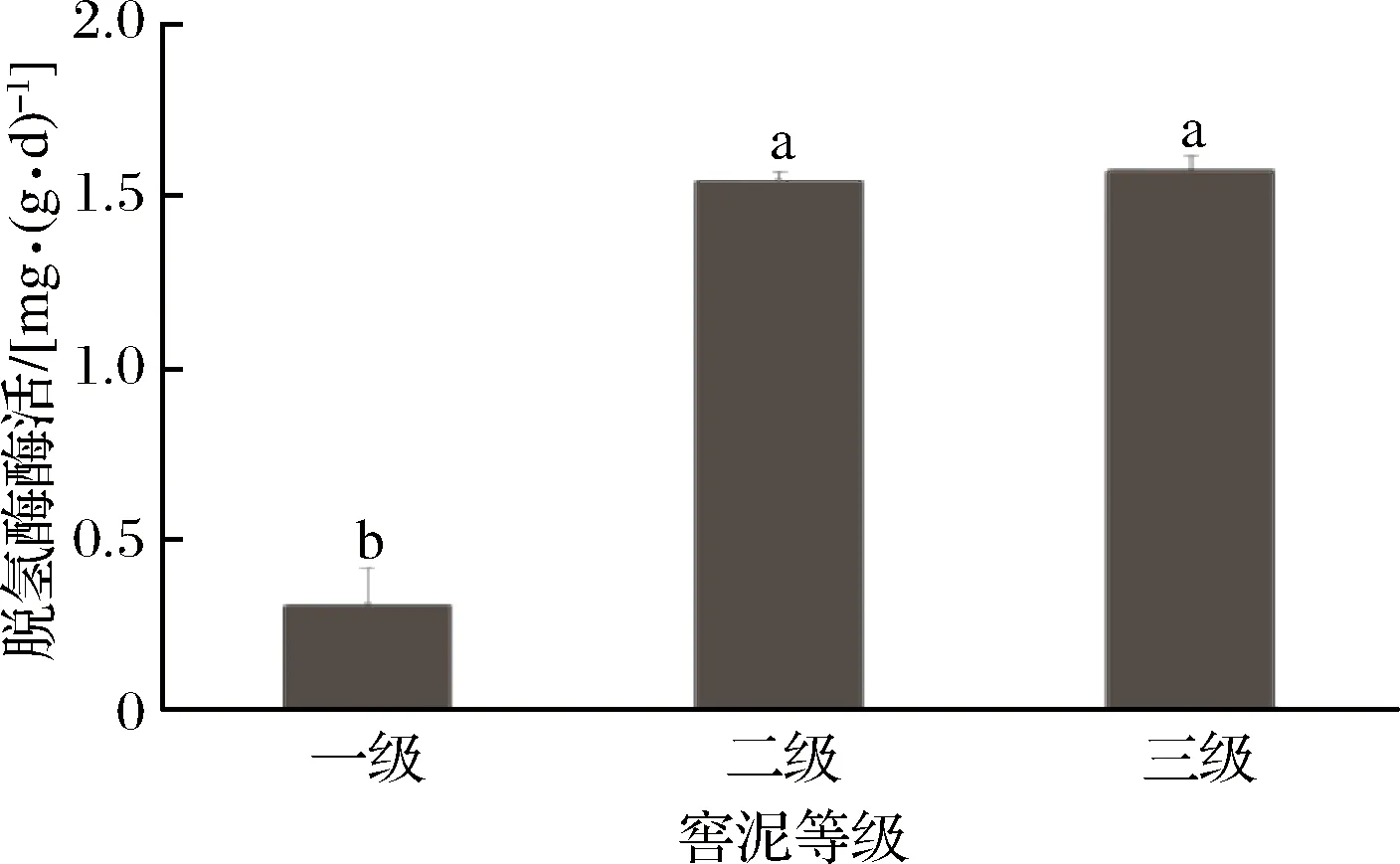
圖5 脫氫酶測(cè)定結(jié)果Fig.5 Result of dehydrogenase determination
2.2 微生物群落結(jié)構(gòu)檢測(cè)結(jié)果
2.2.1 窖泥總DNA提取及PCR擴(kuò)增結(jié)果
MIBIO公司的PowerSoil DNA Isolation Kit能有效除去窖泥中的腐殖酸和蛋白質(zhì)等雜質(zhì),獲得純度較高的DNA。所得窖泥總DNA均采用1 %的瓊脂糖凝膠電泳檢測(cè),結(jié)果如圖6所示。使用2%的瓊脂糖凝膠獲取PCR擴(kuò)增產(chǎn)物,以便后續(xù)純化。PCR擴(kuò)增結(jié)果如圖7所示。純化后的DNA使用1%的瓊脂糖凝膠電泳進(jìn)行檢測(cè),結(jié)果如圖8所示。
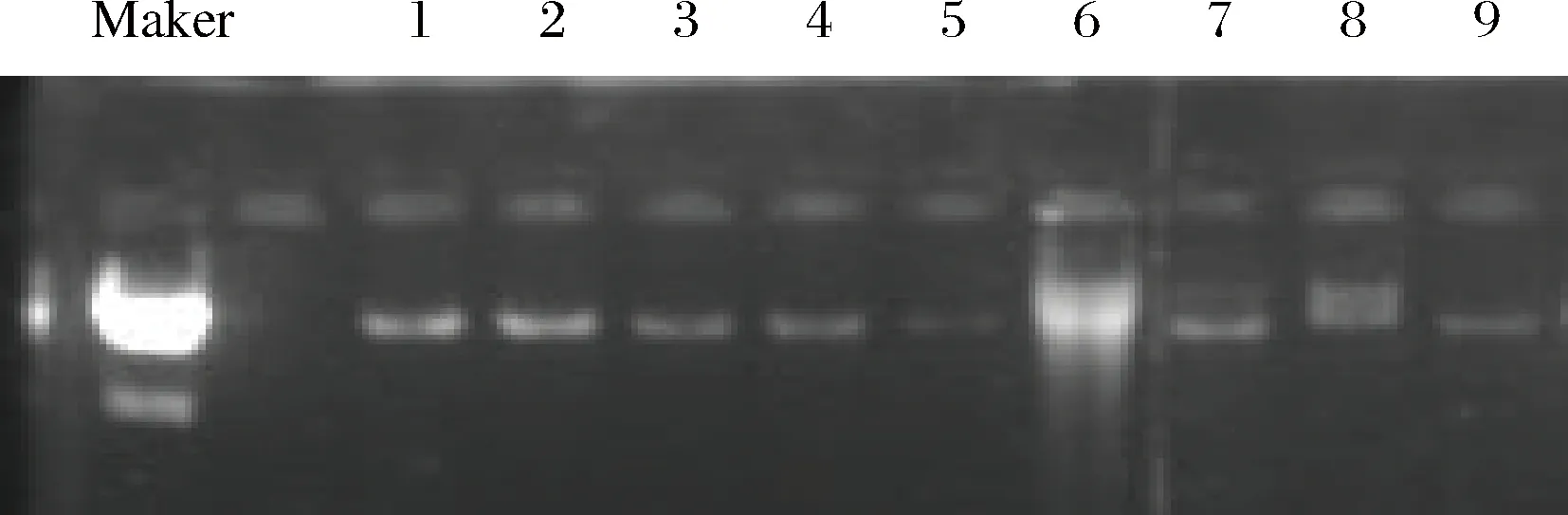
圖6 窖泥總DNA電泳圖Fig.6 Electrophoretogram of total DNA samples
圖7 窖泥DNA PCR擴(kuò)增電泳圖Fig.7 Electrophoretogram of PCR products

圖8 純化后PCR擴(kuò)增產(chǎn)物電泳圖Fig.8 Electrophoretogram of purified PCR products
2.2.2 窖泥微生物群落多樣性分析
2.2.2.1 窖泥樣品中細(xì)菌OTU分類
通過Mothur軟件對(duì)測(cè)序數(shù)據(jù)處理,在基于3%的非相似度條件下,一共分成了2 050個(gè)可操作分類單元(OTU)分類。8號(hào)樣品的測(cè)序序列數(shù)在2 000條左右。5號(hào)樣品的測(cè)序序列最多,超過了5 200條。窖泥樣品的OTU數(shù)量方面,一級(jí)窖泥樣品1、2、3號(hào)OTU數(shù)分別是249、297、492個(gè);二級(jí)窖泥樣品4、5、6號(hào)OTU數(shù)分別是195、61、305個(gè);三級(jí)窖泥樣品7、8、9號(hào)OTU數(shù)分別是178、63、210個(gè)。其中一級(jí)窖泥獲得的OTU數(shù)占總OTU數(shù)的50.6%,其中二級(jí)窖泥的OTU數(shù)占總OTU數(shù)的27.4%,三級(jí)窖泥的OTU數(shù)占總OTU數(shù)的22.0%。不難發(fā)現(xiàn),窖泥中細(xì)菌OTU數(shù)隨著窖泥品質(zhì)的提升而呈現(xiàn)出上升趨勢(shì)。
2.2.2.2 窖泥中細(xì)菌門的分類
將窖泥樣品的OTU用Mothur軟件進(jìn)一步分析處理,獲得微生物不同的門分類。如圖9所示,在9個(gè)窖泥樣品中一共劃分出了9個(gè)門,分別是Firmicutes(厚壁菌門)、Bacteroidetes(擬桿菌門)、Chlorflexi(綠彎菌門)、Synergistetes(互養(yǎng)菌門)、Proteobacteria(變形菌門)、Actinobacteria(放線菌門)、Tenericutes(無壁菌門)、Spirochaetes(螺旋體門)、Lebtisphaeria。這幾個(gè)門中既有厭氧菌,又有好氧菌,也有兼性厭氧菌,說明白酒發(fā)酵并不是處在一個(gè)單一的嚴(yán)格厭氧環(huán)境中。
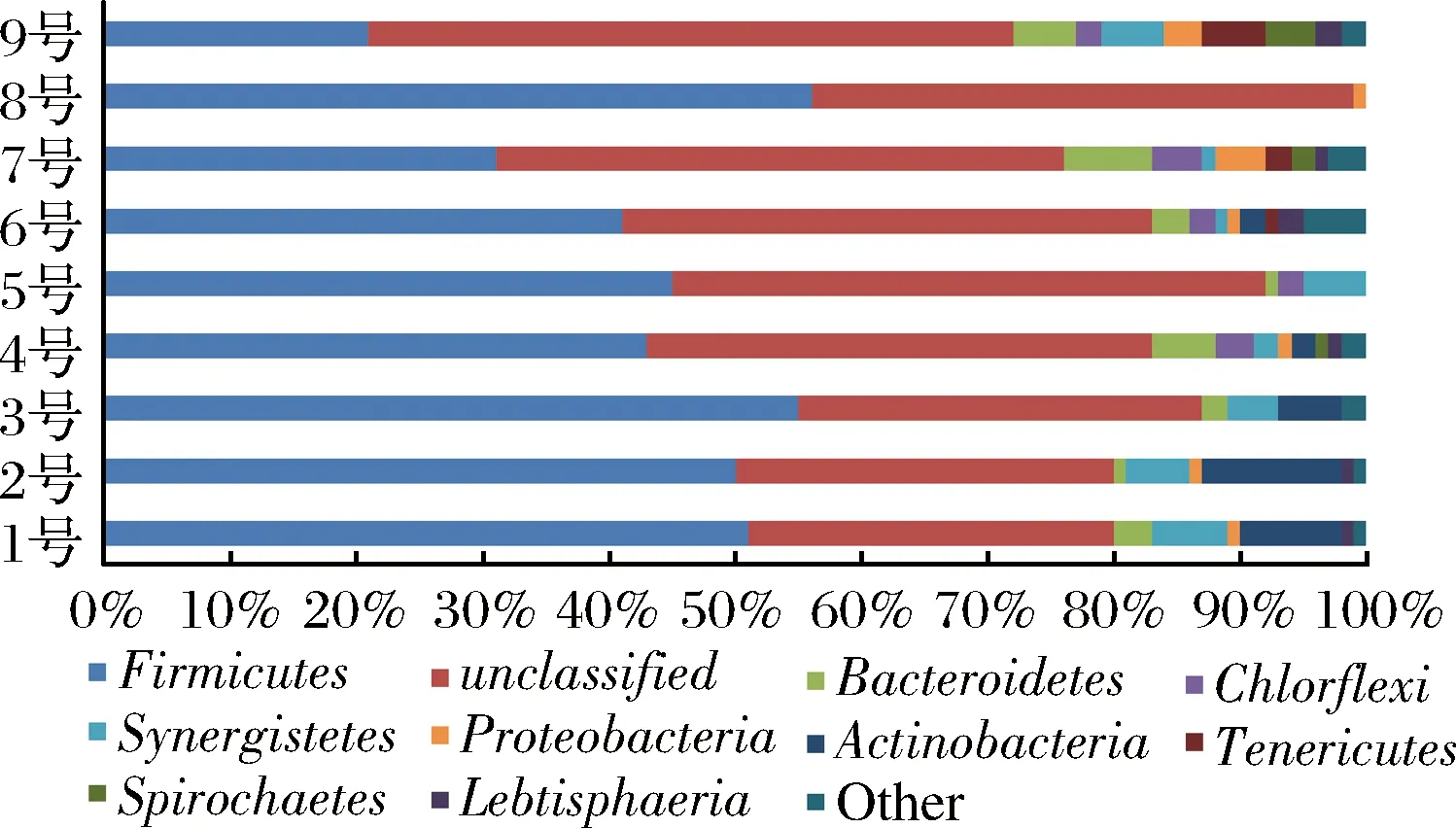
圖9 不同品質(zhì)窖泥微生物群落門分類Fig.9 Phylum of microbial community in pit mud of different qualities
在所有對(duì)比出的細(xì)菌序列中(除去unclassified)可以發(fā)現(xiàn),每個(gè)窖泥樣品細(xì)菌群落中,占主導(dǎo)地位的都是Firmicutes(厚壁菌門),這類菌具有細(xì)胞壁結(jié)構(gòu),并且大多數(shù)能夠產(chǎn)生內(nèi)生孢子抵抗極端環(huán)境。其中一級(jí)窖泥樣品(1、2、3號(hào))厚壁菌門占50%~55%,二級(jí)窖泥樣品(4、6號(hào))厚壁菌門占41%~43%,三級(jí)窖泥樣品(7、9號(hào))厚壁菌門占21%~31%。可見,隨著窖泥品質(zhì)的提升,厚壁菌門所占比例也有所增大。而擬桿菌門、無壁菌門和螺旋體門所占比例隨著窖泥品質(zhì)的提升有一定程度減少。綠彎菌門是一類通過光合作用產(chǎn)生能量的細(xì)菌,是兼性厭氧微生物。在一級(jí)窖泥中未發(fā)現(xiàn)有綠彎菌門的存在,而在二、三級(jí)窖泥中綠彎菌門約占2%~3%。互養(yǎng)菌門有降解氨基酸能力,部分為專性厭氧,且能耐60 ℃的高溫[8]。互養(yǎng)菌門在一級(jí)窖泥中所占比例為4%~6%,比二、三級(jí)窖泥高許多,這與優(yōu)質(zhì)窖泥能促進(jìn)提高酒質(zhì)是相對(duì)應(yīng)的。變形菌門是細(xì)菌中最大的一門,大多數(shù)具有固氮能力,兼性或?qū)P詤捬酰舶ê芏嗖≡F湓谄焚|(zhì)較低的窖泥中變形菌門所占比例較高。放線菌門大多數(shù)為好氧,在不同品質(zhì)窖泥中所占比例差異較大,尤其在一級(jí)窖泥中的比例頗高。Lebtisphaeria在不同品質(zhì)窖泥中所占比例比較一致,都在1%左右。
2.2.2.3 窖泥中細(xì)菌屬的分類
在獲得窖泥中細(xì)菌門的分類基礎(chǔ)上,進(jìn)一步對(duì)窖泥中細(xì)菌進(jìn)行屬的分類。如圖10所示,9個(gè)窖泥樣品中一共獲得39個(gè)屬。利用SPSS軟件對(duì)窖泥樣品的菌屬進(jìn)行主成分分析,提取出對(duì)窖泥品質(zhì)劃分有較大影響的菌屬,對(duì)其隨窖泥品質(zhì)的變化情況進(jìn)行研究分析。
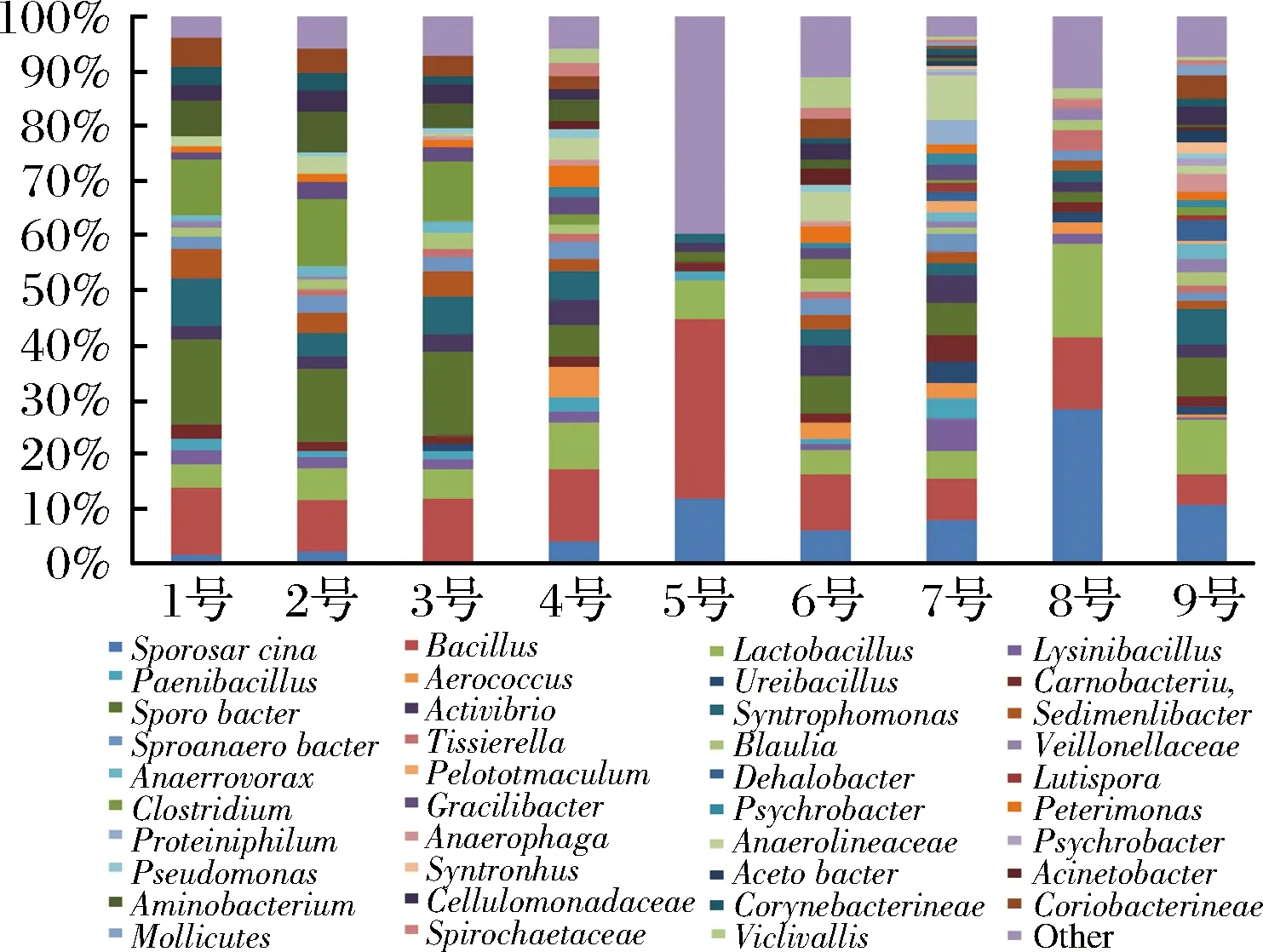
圖10 不同品質(zhì)窖泥微生物群落屬分類Fig.10 Genus of microbial community in pit mud of different qualities
選取特征值大于5的成分,如表1所示,成分1、成分2、成分3、成分4特征值分別為10.414、10.094、7.634、5.446,累積貢獻(xiàn)達(dá)到83.97%,說明成分劃分合理。如圖11所示,散點(diǎn)圖中窖泥樣品1、2、3號(hào),4、6號(hào),7、9號(hào)分別聚為一組,基本按窖泥品質(zhì)一級(jí)、二級(jí)、三級(jí)劃分,5、8號(hào)窖泥樣品聚為一組原因是測(cè)序序列都較少,微生物覆蓋率較低的緣故。因此按照成分1和成分2對(duì)窖泥中細(xì)菌的屬進(jìn)行分析。成分1中,載荷值較高的細(xì)菌屬為Sporobacter、Coriobacterineae、Clostridium、Cellulomonadaceae、Sedimenlibacter、Aminobacterium、Corynebacterineae、Sporosarcina,載荷值分別為0.974、0.924、0.919、0.913、0.856、0.855、0.814、-0.808。成分2中,載荷值較高的細(xì)菌屬為Mollicutes、Dehalobacter、Acetobacter、Syntronhus、Psychrobacter,載荷值分別為0.970、0.970、0.970、0.970、0.881。
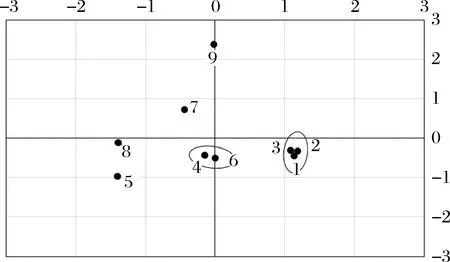
圖11 按成分1和成分2劃分的窖泥樣品分布圖Fig.11 Distribution map of pit mud samples according to PCA
各個(gè)菌屬在不同品質(zhì)窖泥中的分布有以下特點(diǎn)。從成分1看:Sporobacter、Coriobacterineae、Clostridium、Cellulomonadaceae、Sedimenlibacter、Aminobacterium、Corynebacterineae在窖泥中所占比例與窖泥品質(zhì)呈現(xiàn)出一定的正相關(guān)關(guān)系。由于Sporobacter能在厭氧條件下代謝產(chǎn)生有機(jī)酸和芳香族化合物[9-10];Clostridium(梭菌屬)是一類嚴(yán)格厭氧菌,能在發(fā)酵過程中代謝產(chǎn)生有機(jī)酸和醇類[11];Cellulomonadaceae(纖維素單胞菌)能夠產(chǎn)生纖維素酶[12],能夠提高釀酒原料的利用率;Aminobacterium(氨基桿菌屬)能夠在厭氧條件下降解氨基酸[13];故品質(zhì)越高的窖泥越有利于白酒發(fā)酵過程,提高酒質(zhì)。而Sporosarcina在窖泥中所占比例卻與窖泥品質(zhì)呈現(xiàn)出一定的負(fù)相關(guān)關(guān)系。成分2看:Mollicutes(柔膜菌屬)、Dehalobacter(脫鹵素桿菌屬)、Acetobacter(醋酸桿菌屬)、Syntronhus、Psychrobacter(嗜冷菌屬)幾類菌都只在三級(jí)窖泥中發(fā)現(xiàn)有一定比例的分布,而在一、二級(jí)窖泥中均未檢測(cè)出。
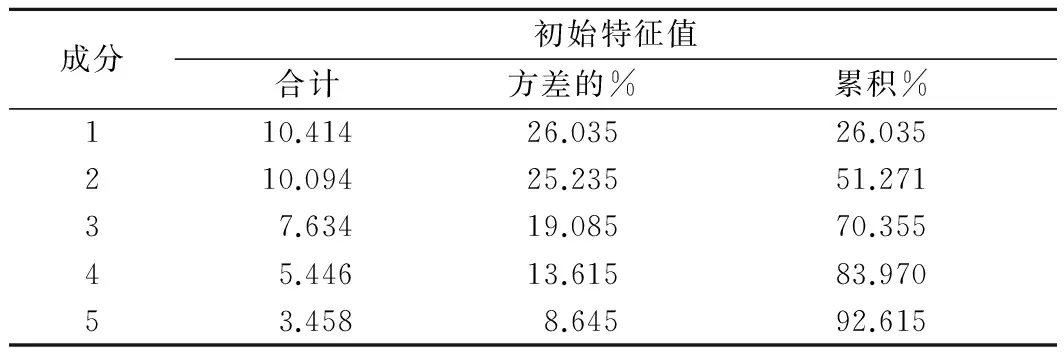
表1 細(xì)菌的主成分特征值
2.3 窖泥酶活與微生物群落的相關(guān)性分析
窖泥微生物群落與酶活性相關(guān)性分析結(jié)果如表2所示,放線菌門、變形菌門、互養(yǎng)菌門、厚壁菌門、綠彎菌門與窖泥中酶活性關(guān)系較為密切。說明這些菌門更多地參與了窖池中的生化反應(yīng)。厚壁菌門分別與蛋白酶、酸性磷酸酶的活性呈顯著正相關(guān)。綠彎菌門與脫氫酶活性呈顯著正相關(guān)(p<0.05),互養(yǎng)菌門分別與蛋白酶活性和過氧化氫酶活性呈顯著正相關(guān)(p<0.05),與脫氫酶活性呈顯著負(fù)相關(guān)(p<0.05)。變形菌門分別與蛋白酶活、磷酸酶性呈顯著負(fù)相關(guān)(p<0.05)。放線菌分別與蛋白酶和過氧化氫酶的活性呈極顯著正相關(guān)(p<0.01),與酸性磷酸酶呈顯著正相關(guān)(p<0.05),與脫氫酶呈極顯著負(fù)相關(guān)(p<0.01)。窖泥中微生物和脲酶活性的相關(guān)性都沒有達(dá)到顯著水平(p>0.05)。
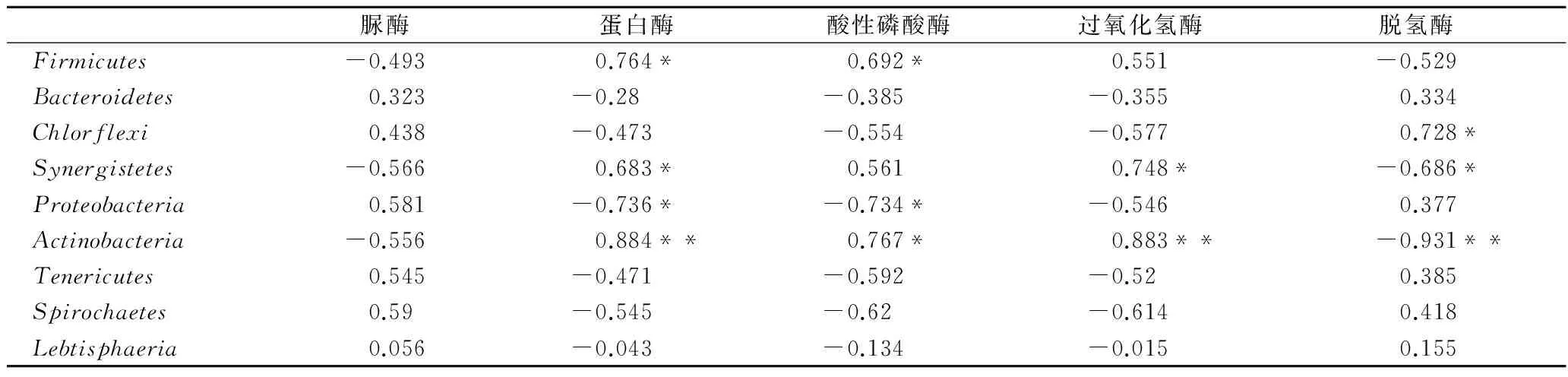
表2 窖泥微生物群落與酶活相關(guān)性分析
注:*表示差異顯著(p<0.05);**表示差異極顯著(p<0.01)。
脲酶是土壤中重要的酶類,分解尿素為微生物提供氮源,而相關(guān)性分析結(jié)果表明窖泥中微生物氮源來自于蛋白酶作用。窖泥原料雖來源于土壤,但經(jīng)過釀酒環(huán)境的長(zhǎng)時(shí)間馴化,窖泥中微生物的群落結(jié)構(gòu)和生理活動(dòng)特點(diǎn)相對(duì)于土壤中的微生物已經(jīng)發(fā)生了一定的變化。窖泥品質(zhì)的優(yōu)劣主要是因?yàn)榻涯嘀形⑸锶郝浣Y(jié)構(gòu)的差異,進(jìn)而表現(xiàn)出不同的酶活力。通過進(jìn)行相關(guān)性分析,得到不同酶的活力與微生物群落的相關(guān)性,在一定程度上能反映出窖泥酶活與微生物群落之間的關(guān)系進(jìn)而表征窖泥的品質(zhì)。故本研究對(duì)于更深入地進(jìn)行窖泥品質(zhì)的劃分與評(píng)定具有一定的意義。
3 小結(jié)
本試驗(yàn)通過測(cè)定不同品質(zhì)窖泥的酶活,了解了蛋白酶、酸性磷酸酶等酶在不同品質(zhì)窖泥中酶活力的變化趨勢(shì);利用高通量測(cè)序技術(shù)對(duì)不同品質(zhì)窖泥的微生物群落進(jìn)行研究,表明了不同品質(zhì)窖泥中細(xì)菌種類的多樣性及其規(guī)律性。通過對(duì)窖泥酶活指標(biāo)與微生物群落結(jié)構(gòu)的相關(guān)性分析,發(fā)現(xiàn)窖泥微生物群落結(jié)構(gòu)與蛋白酶、酸性磷酸酶、過氧化氫酶、脫氫酶活性的相關(guān)性達(dá)到了顯著或者極顯著的水平。由此可以得出,不同品質(zhì)窖泥的酶活力和微生物群落結(jié)構(gòu)都呈現(xiàn)一定的規(guī)律性,窖泥的酶活可作為反映窖泥品質(zhì)的指標(biāo)以做深入研究。
[1] 張強(qiáng),沈才洪,劉清斌,等.窖泥質(zhì)量評(píng)價(jià)研究進(jìn)展[J].釀酒科技,2013(7):84-86.
[2] 黃娟,李稹,張健.改良靛酚藍(lán)比色法測(cè)土壤脲酶活性[J].土木建筑與環(huán)境工程,2012,34(1):106-111.
[3] 蔡紅,沈仁芳.改良茚三酮比色法測(cè)定土壤蛋白酶活性的研究[J].土壤學(xué)報(bào),2005,42(2):131-138.
[4] 關(guān)松蔭.土壤酶及其研究法[M].北京:農(nóng)業(yè)出版社,1986:376.
[5] 戴濡伊,吳季榮,徐劍宏,等.小麥根際土壤脫氫酶活性測(cè)定方法的改進(jìn)[J].江蘇農(nóng)業(yè)學(xué)報(bào),2013,29(4):88-92.
[6] 朱銘莪,白紅英,代偉.陜西幾種土壤過氧化氫酶的動(dòng)力學(xué)和熱力學(xué)特征[J].西北農(nóng)林科技大學(xué)學(xué)報(bào),1989(1):20-26.
[7] 王秀菊.脫氫酶與產(chǎn)氫微生物之間關(guān)系的研究[D].昆明:云南師范大學(xué),2007.
[8] 黃曉艷.高含固率高氮污泥厭氧消化工藝的研究[D].青島:中國(guó)海洋大學(xué),2014.
[9] JEONG H, LIM Y W, YI H, et al.Anaerosporobactermobilisgen. nov. sp. nov. isolated from forest soil[J]. International Journal of Systematic & Evolutionary Microbiology, 2007, 57(8):1 784-1 787.
[10] GRECHMORA I, FARDEAU M L, PATEL B K C, et al. Isolation and characterization ofSporobactertermitidisgen. nov. sp. nov. from the digestive tract of the wood-feeding termiteNasutitermeslujae[J]. International Journal of Systematic Bacteriology, 1996, 46(2):512-518.
[11] 張善亭,史燕,張淑麗,等.丁酸梭菌的研究應(yīng)用進(jìn)展[J].生物技術(shù)通報(bào),2013(9):27-33.
[12] 郭愛蓮,楊琳,劉梅,等.產(chǎn)黃纖維單胞菌纖維素酶的培養(yǎng)條件[J].西北大學(xué)學(xué)報(bào),1999,29(6):575-577.
[13] BAENA S, FARDEAU M L, LABAT M, et al.Aminobacteriummobilesp. nov. a new anaerobic amino-acid-degrading bacterium[J]. International Journal of Systematic & Evolutionary Microbiology, 2000, 50(1):259-264.

