FAK 基因沉默對人舌鱗癌細胞CAL?27增殖與遷移能力的影響
陳凱 劉濤 李張維 李梁 潘宣
廣東藥科大學附屬第一醫院口腔科(廣州 510080)
舌癌是口腔頜面部常見的惡性腫瘤之一,其多數為鱗癌。近年來,舌鱗癌的發病率有不斷升高的趨勢,且發病年齡趨于年輕化[1-2]。舌鱗癌的一般惡性程度高,生長快,浸潤性強;舌體本身活動頻繁,具有豐富的淋巴管供應和血液循環,常發生較高的頸部淋巴結轉移,這些因素均直接影響舌癌患者的預后及生存。因此,關于舌鱗癌的形成、侵襲及轉移機制成為了當下的研究重點。
黏著斑激酶(focal adhesion kinase,FAK)是整合素信號通路中的關鍵分子,與細胞的黏附功能關系密切。近年來的相關研究表明,FAK可通過多條信號通路參與腫瘤細胞的黏附、增殖、侵襲及凋亡等生物學過程。然而,目前有關FAK基因與舌鱗癌的相關性的研究較少,其確切分子機制尚不清楚。本研究通過采用RNA干擾(RNA interfer?ence,RNAi)技術對人舌鱗癌細胞株 CAL?27進行FAK基因沉默,探討FAK基因干擾對舌鱗癌細胞株CAL?27增殖及遷移能力的影響,以期為進一步深入研究FAK基因在舌鱗癌細胞中異常表達的分子機制提供新的思路。
1 材料與方法
1.1 材料 舌鱗癌細胞株CAL?27由李勁松教授(中山大學附屬孫逸仙紀念醫院口腔頜面外科)惠贈。DMEM培養基購自美國Gibco公司;胎牛血清FBS購自杭州四季青公司;LipofectamineTM2000購自美國Life Technologies公司;Trizol試劑盒購自美國TIANGEN公司;GoScript反轉錄系統和GoTaq qPCR Master Mix試劑盒購自美國Promega公司;噻唑藍(MTT)和二甲基亞砜(DMSO)購自美國Sigma公司;兔抗人FAK單克隆抗體購自英國Abcam公司。
1.2 方法
1.2.1 FAK siRNA基因序列及其引物的設計和合成 在本課題組前期的預實驗研究中,針對FAK設計三條siRNA,經過細胞轉染,用熒光定量PCR方法篩選出其中具有最佳抑制效果的FAK siR?NA,由廣州賽哲生物科技股份有限公司合成。選用的特異性FAK siRNA基因序列為:正義鏈:CAG?GUGAAGAGCGAUUAUATT;反義鏈:UAUAAUCG?CUCUUCACCUGTT。FAK siRNA序列引物由廣州賽哲生物科技股份有限公司設計合成,上游:5′?TGTGGGTAAACCAGATCCTGC?3′;下游:5′?CT?GAAGCTTGACACCCTCGT?3′。同時設計了 GAP?DH 作為內參物,上游:5′?TCATGAAGTGTGACGT?GGACATC ?3′;下 游 :5′?CAGGAGGAGCAAT?GATCTTGATCT?3′。
1.2.2 細胞培養 用0.25%胰蛋白酶消化CAL?27細胞,以含10%血清的DMEM培養基調整細胞密度后,按照每孔5×105個細胞接種到六孔板中,置于置于37℃,5%CO2培養箱培養,16~24 h后待細胞密度生長到60%~70%時即可用于轉染。
1.2.3 分組和轉染 本試驗設空白對照組、陰性對照組和實驗組。實驗組使用FAK siRNA干擾質粒進行轉染;空白對照組未轉染任何RNA;陰性對照組使用無關序列RNA進行轉染。準備好細胞后,按照LipofectamineTM2000轉染試劑盒說明書進行轉染。
1.2.4 qPCR檢測FAK mRNA的表達 (1)RNA的提取:取處于對數生長期且狀態良好的細胞,按照Trizol試劑盒操作說明書,通過細胞處理,分相及RNA沉淀、清洗、溶解5個步驟提取總RNA,檢測總RNA的濃度和純度。(2)逆轉錄反應:根據GoScript反轉錄系統試劑盒操作說明書,總RNA通過逆轉錄反應獲取cDNA。(3)進行qPCR反應:PCR反應條件為:95℃預變性10 min后,再95℃變性15 s,60℃退火20 s,72℃延伸20 s,總共40個循環。反應完成后,結果在PCR儀器中自動讀取和生成,儀器配套攜帶的軟件系統直接對所得結果進行比較分析。
1.2.5 Western blotting檢測FAK蛋白的表達(1)總蛋白提取:在細胞中加入細胞裂解液,冰上裂解,離心,收集上清。(2)測定蛋白濃度:制備1 mg/mL的標準蛋白溶液及考馬斯亮藍G?250反應液,595 nm測定光吸收值,繪制標準曲線,換算樣品的蛋白濃度。(3)上樣:根據Wes 12~ 230 kDa Rabbit Master kit試劑盒和Wes 12~230 kDa Master kit with split Buffer試劑盒說明書,完成加樣。將樣品放入Proteinsimple Wes儀器。其中,FAK一抗及內參GAPDH一抗均為1∶50稀釋,二抗為試劑盒自帶。設置相關運行參數,運行后得出結果。
1.2.6 MTT實驗檢測細胞增殖能力的改變 將細胞按接種于孔板,37℃、5%CO2培養箱中培養;隔天待細胞貼壁后,轉染實驗組及陰性對照組;分別于轉染后24、48和72 h加入含量為5 mg/mL的MTT溶液,37 °C、5%CO2培養箱中孵育4 h;吸盡各孔內培養液,加入DMSO,水平震蕩10 min,用酶標儀測定492 nm處吸光值。
1.2.7 Transwell小室法檢測細胞遷移能力 轉染48 h后,將細胞消化成單個懸液,配制濃度為4×105個/mL的細胞懸液;預先將transwell小室置于無血清DMEM培養液中平衡1 h;上室中加入細胞懸液,下室加入10%FBS的DMEM培養液,置于37℃,5%CO2培養箱中培養20 h;0.1%結晶紫常溫固定染色30 min,用棉棒輕輕擦去上室上表面的細胞;顯微鏡下隨機選取5個視野拍照、計數。
1.3 統計學方法 利用SPSS 19.0統計分析軟件對相關數據進行統計學處理,實驗數據采用均數±標準差表示,多組間比較采用單因素方差分析。P<0.05為統計學差異顯著,P<0.01為統計學差異極顯著。
2 結果
2.1 轉染siRNA對CAL?27細胞FAK mRNA表達的影響 3組中FAK mRNA相對含量如圖1所示。實驗組表達量分別為上述2個對照組的23.32%和21.25%,干擾效率為76.68%和78.75%。實驗組中FAK mRNA的表達顯著下調,明顯低于空白對照組和陰性對照組,差異有統計學意義(F=1 060.91,P< 0.01)。
2.2 轉染siRNA對CAL?27細胞FAK蛋白表達的影響 三組中FAK蛋白的表達量如圖2和圖3所示。實驗組表達量分別為上述2個對照組的40.46%和49.59%。實驗組中FAK蛋白的表達顯著下調,明顯低于空白對照組和陰性對照組,差異有統計學意義(F=8.07,P<0.05)。
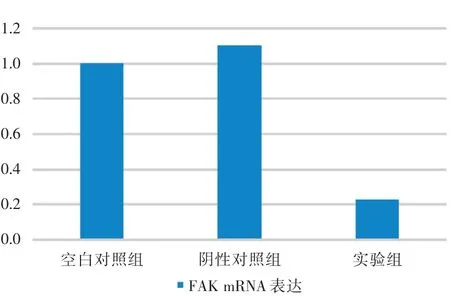
圖1 各組細胞FAK mRNA表達變化Fig.1 The expression of FAK mRNA in each group
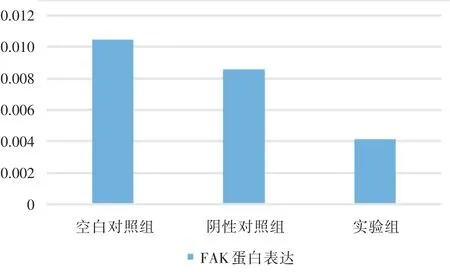
圖2 各組細胞FAK蛋白表達變化Fig.2 The expression of FAK protein in each group

圖3 各組細胞FAK蛋白表達水平Fig.3 The level of FAK protein expression in each group
2.3 轉染siRNA對CAL?27細胞增殖能力的影響 MTT增殖曲線反映了各個時間點細胞的增殖情況(圖4)。在48和72 h,兩個對照組的吸光度值均明顯高于實驗組,差異具有統計學意義(F48h=558.32,P48h< 0.01;F72h=120.52,P72h< 0.01)。而在24 h三組間差異無顯著性(F24h=1.32,P24h>0.05)。沉默FAK基因,舌鱗癌細胞的增殖能力明顯受到抑制。
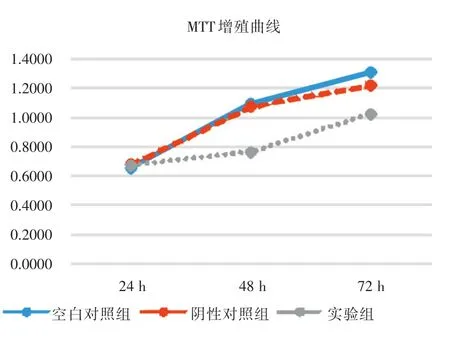
圖4 各組細胞增殖能力的變化Fig.4 The proliferation ability of cells in each group
2.4 轉染siRNA對CAL?27細胞遷移能力的影響 Transwell小室實驗顯示,在空白對照組、陰性對照組及實驗組,每個視野中穿過聚碳酸酯膜遷移至下室的細胞數分別為47.27±5.10,49.80±6.80及34.13±3.30(圖5)。實驗組的遷移細胞個數明顯少于兩個對照組,差異有統計學意義(F=7.6414,P<0.05)。沉默FAK基因,舌鱗癌細胞的遷移能力明顯受到抑制。
3 討論
FAK也被稱為PTKⅡ,是整合素信號通路中的關鍵分子,與細胞的黏附功能關系密切。FAK結構較為特殊,其本質上是一種非受體酪氨酸激酶,缺乏跨膜區,是純粹的細胞質酪氨酸激酶,但又不含有胞質酪氨酸激酶常有的SH2和SH3結構域[3]。FAK能夠催化多種底物蛋白,在細胞生長、增殖、分化中具有重要作用。在生理狀態下,FAK廣泛分布于人體的表皮細胞、單核細胞及成纖維細胞等細胞中;但近年來,越來越多的研究表明,在病理狀態下,FAK的高表達與多種不同組織起源腫瘤的分化程度及轉移狀態密切相關[4-6]。在口腔鱗狀細胞癌中,已有研究發現FAK和p53的表達呈負相關,推測FAK可能參與調控了p53表達的下調,進而遏制了腫瘤細胞的凋亡過程[7]。對舌鱗狀細胞癌的研究發現,通過抑制FAK Tyr397和AKT Ser473位點的磷酸化,可以在極大程度上降低舌鱗癌細胞的增殖、遷移和侵襲能力,進而有效地抑制腫瘤的發生和發展[8]。
本研究運用RNAi介導FAK基因沉默,分析對舌鱗癌CAL?27細胞增殖與侵襲能力的影響。實驗結果顯示,在轉染siRNA的CAL?27細胞中,FAK的mRNA和蛋白的表達量均明顯下降,這表明FAK在mRNA水平表達和蛋白水平表達上具有一致性,siRNA轉染能有效抑制FAK mRNA和FAK蛋白的表達水平。
同時,本研究結果還顯示,與空白對照組及陰性對照組比較,siRNA轉染的CAL?27細胞增殖能力和遷移能力均受到了明顯抑制,這與上述文獻[7-8]的報道基本一致。FAK是多條信號轉導通路的關鍵節點,FAK通過激活PI3K?AKT等信號通路增加細胞DNA合成和加快G/S期的轉換,促進細胞的增殖[9-11];還可在轉錄水平上調控細胞周期蛋白CyclinD 1的表達[12]。細胞遷移過程包括細胞前沿偽足的形成,新黏附的建立、細胞體的收縮和尾部的分離。在遷移過程中,FAK可以作為一種接近整合素和生長因子受體的蛋白,發揮調節細胞遷移的作用;FAK還能通過各種信號通路激活Rac、ERK或Rho,調節肌動蛋白組裝和細胞骨架結構,參與細胞遷移的調控[13-16]。FAK沉默后,可能影響了這些信號通路的激活及調控蛋白功能的發揮,進而引起腫瘤細胞增殖能力和遷移能力的下降。
綜合上述,本實驗通過RNAi技術沉默FAK,發現FAK表達的下調可以抑制舌鱗癌細胞CAL?27的增殖和遷移能力;提示FAK有望成為抑制舌鱗癌生長和轉移的新靶點。但目前關于FAK在舌鱗癌發生、發展及轉移中的具體功能、所處地位的研究正處于起步階段,其對舌鱗癌細胞生物學行為調控的具體機制仍未完全闡明,仍需進一步的實驗探索。

圖5 沉默FAK基因對CAL?27細胞遷移能力的影響Fig.5 Effect of silencing FAK gene on migration of CAL?27 cells
[1]WARNAKULASURIYA S.Global epidemiology of oral and oro?pharyngeal cancer[J].Oral Oncol,2009,45(4/5):309?316.
[2]WADE J,SMITH H,HANKINS M,et al.Conducting oral ex?aminations for cancer in general practice:what are the barri?ers?[J].Fam Pract,2010,27(1):77?84.
[3]RUSTAD K C,WONG V W ,GURTNER G C,et al.The role of focal adhesion complexes in fibroblast mechanotransduction during scar formation[J].Differentiation,2013,86(3):87?91.
[4]THANAPPRAPASR D,PREVIS R A,HU W,et al.PTEN ex?pression as a predictor of response to focal adhesion kinaseinhi?bition in uterine cancer[J].Mol Cancer Ther,2015,14(6):1466?1475.
[5]GóMEZ DEL PULGAR T,CEBRIáN A,FERNáNDEZ ?ACE?ERO M J,et al.Focal adhesion kinase:predictor of tu?mour response and risk factor forrecurrence after neoadjuvant chemoradiation in rectal cancer[J].J Cell Mol Med,2016,20(9):1729?1736.
[6]ZENG X Q,LI N,MA L L,et al.Prognostic value of focal ad?hesion kinase(FAK)in human solid carcinomas:A Meta?anal?ysis[J].PLoS One,2016,11(9):e0162666.
[7]ROSADO P,LEQUERICA?FERNANDEZ P,PENA I,et al.In oral squamous cell carcinoma,high FAK expression is correlat?ed with low P53 expression[J].Virchows Arch,2012,461(2):163?168.
[8]KURIO N,SHIMO T,FUKAZAW T,er al.Anti?tumor effect of a novel FAK inhibitor TAE226 against human oral squamous cell carcinoma[J].Oral Oncology,2012,48(11):1159?1170.
[9]LI Y,CHEN Y M,SUN M M,et al.Inhibition on apoptosis in?duced by elevated hydrostatic pressure in retinal ganglion cell?5 via laminin upregulatingβ1?integrin/focal adhesion kinase/pro?tein kinase B signaling pathway[J].Chin Med J(Engl),2016,129(8):976?783.
[10]楊艷麗,李鵬鴿,葛玉婷,等.黏著斑激酶與腫瘤發生、發展及預后的關系[J].中國細胞生物學學報,2011,33(1):55?58.
[11]CHIKANO Y,DOMOTO T,FURUTA T,et al.Glycogen syn?thase kinase 3βsustains invasion of glioblastoma via the focal adhesion kinase,Rac1,and c?Jun N?terminal kinase?mediated pathway[J].Mol Cancer Ther,2015,14(2):564?574.
[12]ZHAO J,PESTELL R,GUAN J L.Transcriptional activation of cyclinDI promoter by FAK contributes to cell cycle progres?sion[J].Mol Biol Cell,2001,12(12):4066?4077.
[13]HOSKIN V,SZETO A,GHAFFARI A,et al.Ezrin regulates focal adhesion and invadopodia dynamics by altering calpain ac?tivity to promote breast cancer cell invasion[J].Mol Biol Cell,2015,26(19):3464?3479.
[14]吳冰,林天驥,阮仕娟,等.STIM1對乳腺癌細胞移動的作用及機制[J].實用醫學雜志,2017,33(9):1373?1376.
[15]謝曉慧,崔銀星,游紫聰,等.乳腺癌PRL?R表達陽性隨年齡變化規律探究[J].現代醫院,2015,15(12):44?46.
[16]高寧,張靜,杜娟,等.沉默黏著斑激酶促進人胃癌SGC7901細胞骨架蛋白解聚及細胞形態損傷[J].中國組織化學與細胞化學雜志,2017,26(1):7?12.

