萬壽菊生物熏蒸對連作蘋果幼苗和土壤微生物的影響*
王曉芳 徐少卓 王 玫 段亞楠 王海燕 盛月凡 毛志泉?
(1 作物生物學國家重點實驗室/山東農業大學園藝科學與工程學院,山東泰安 271018)
(2 山東省果樹研究所,山東泰安 271000)
連作障礙(Hazard posed by continuous cropping to replanting)在全世界蘋果主產區普遍發生[1]。近年來,越來越多的研究證實土傳病蟲害是導致連作障礙的主要原因,如真菌中的柱孢屬(Cylindrocarpon)、絲核菌屬(Rhizoctonia)、疫霉屬(Phytophthora)、腐霉屬(Pythium)及鐮刀菌屬(Fusarium)等[2-4],各主產區的致病菌種差異很大;某些線蟲也可能與連作障礙相關,如穿刺根腐線蟲(Pratylenchus penetrans)[5]。因此,研究建立防治土傳病蟲害的措施是緩解蘋果連作障礙的根本。土壤熏蒸(消毒)是破解連作障礙這一難題的有效措施,目前主要依靠化學熏蒸劑,如溴甲烷、棉隆和氯化苦等。溴甲烷能高效、廣譜地殺死各種有害生物,但其嚴重影響地球環境和人類健康,已被淘汰;其他化學藥劑雖尚未淘汰,但長期大量使用會對環境和農作物產生污染,危害人類健康[6],而且化學熏蒸導致土壤酶活性顯著下降,極大地降低了農業土壤的可持續生產力[7-8]。因此,發展可行的替代技術抑制土傳病蟲害并進行有效病蟲害管理成為當前研究的熱點,生物熏蒸(Biofumigation)應運而生。
生物熏蒸是利用動植物的有機質在分解過程中產生的揮發性殺生氣體抑制或殺死土壤中有害生物的方法。Smolinska等[9]研究表明,埃塞俄比亞芥菜(Brassica carinata)、黑芥子(B. nigra)和芥菜(B. juncea)含有較高的硫代葡萄糖苷(GSLs)能釋放出異硫氰酸酯(ITCs),對土壤中的尖孢鐮孢菌(Fusarium oxysporum)病原體有很好的抑制作用。目前,菊科植物、綠肥、家禽糞便等均被用作生物熏蒸材料以有效防治土傳病害及植物根結線蟲[10-11],但關于生物熏蒸的報道主要是使用蕓薹屬植物。本研究前期室內抑菌試驗發現萬壽菊(Tateges erecta)具有較強的抑菌效果。萬壽菊為菊科萬壽菊屬一年生草本植物,其含有的揮發性成分具有抗菌、抑菌及殺蟲等多種生物活性。范志宏等[12]研究表明,萬壽菊根提取物對西瓜枯萎病菌有明顯的抑制作用,其中以精油類的抑菌效果最好,且能促進植株生長,有效減輕西瓜枯萎病菌對植株的毒害作用。作為一種商業化色素的新來源,萬壽菊的種植面積日益增長,對于萬壽菊鮮花的利用研究較多,并已用于工業生產中。但對于萬壽菊秸稈及葉子,采收后的萬壽菊植株大部分被隨意拋棄或就地焚燒,造成資源浪費且焚燒產生大量有害氣體,對環境造成嚴重的污染[13]。尋求高效、經濟的萬壽菊廢棄植株利用途徑是值得研究的課題,用萬壽菊作為生物熏蒸劑克服蘋果連作障礙尚未見報道。本研究用萬壽菊風干粉末對老齡蘋果園土壤進行熏蒸,探討萬壽菊生物熏蒸對蘋果幼苗及連作土壤環境的影響,以期為生產中利用生物熏蒸防治蘋果連作障礙提供理論依據。
1 材料與方法
1.1 試驗材料
試驗于2015年4月—2016年12月在山東農業大學園藝科學與工程學院、國家蘋果工程技術研究中心及作物生物學國家重點實驗室進行。
試驗用土取自山東省泰安市滿莊鎮小王莊村25 a生老齡蘋果園,取自距樹干80 cm,去表層土后深10~40 cm的區域,多點隨機取樣,混勻備用。土壤類型為棕壤。土壤基本理化性質如下:硝態氮銨態氮有效磷9.3 mg kg-1,速效鉀90.6 mg kg-1,有機質5.3 g kg-1。
供試植物材料為實生平邑甜茶(M a l u shupehensisRehd.)蘋果幼苗,種子于4℃層積30 d左右,待種子露白后,于2015年12月9日播種于育苗基質中,幼苗長至6片真葉,備用。
熏蒸用萬壽菊(Tateges erecta)為播種繁育的盆栽試材,于2015年4月中旬播種,8月中旬收集全株,用自來水沖洗干凈后,自然風干,以粉碎機粉碎,過30目篩,裝入封口袋備用。
1.2 試驗設計
試驗設置5個處理,分別為:①老齡蘋果園土壤對照(未作處理,CK);②覆膜(未拌入萬壽菊,F);③萬壽菊1.5 g kg-1+覆膜(1.5T+F);④萬壽菊6.0 g kg-1+覆膜(6.0T+F);⑤萬壽菊15.0 g kg-1+覆膜(15.0T+F)。
2016年1月10日進行熏蒸處理,在每個泥瓦盆盆底(盆直徑23 cm,高18 cm)放置濾紙,將不同添加量的萬壽菊(0、1.5、6、15 g kg-1)與老齡蘋果園土壤拌勻后裝盆,每盆裝3.0 kg混合土,澆透水,覆膜熏蒸,15 d后,去膜晾7 d。選取長勢一致的6葉平邑甜茶幼苗進行移栽。每處理20盆,每盆2株幼苗,隨機排列,正常肥水管理,每個月施1次復合肥(氮磷鉀復混肥料15-15-15),每盆施用6 g,施肥后澆水,每3天澆水1次,每次澆水500 ml。
栽植幼苗生長120 d取樣測定相關指標。土壤樣品采集:每個處理取3盆作為3次重復,去掉表層土壤和盆周圍的土壤,取根際土,并將土壤裝入黑色塑料袋帶回實驗室,過12目篩(1.70 mm)取大約500 g分裝至3個封口袋保存,一份4℃冷藏備用,用于土壤微生物數量的測定;一份風干,用于土壤酶測定;一份-20℃冰箱保存,用于提取DNA,進行末端限制性片段長度多態性(Terminal restriction fragment length polymorphism,T-RFLP)分析及實時熒光定量分析。植物樣品整株采集,輕輕抖落根部土壤,用清水沖洗干凈,將樣品及時帶回實驗室進行處理,測定株高、干重等指標。
1.3 測定指標及方法
生物量測定采用常規稱重方法。
根系形態指標測定:將平邑甜茶幼苗根系用清水洗凈,放于盛有水的硬塑料盒中,在水中平鋪展開,使用專業版WinRHIZO(2007年版)根系分析系統處理樣品圖像,記錄根長度、根系表面積和根體積。
土壤酶測定參照關松蔭[14]的方法。脲酶測定采用比色法,以24 h后1 g土壤中NH3-N的質量(mg)表示脲酶活性,用NH3-N mg g-1d-1表示。過氧化氫酶采用容量法,以1 g土壤的 0.1 mol L-1高錳酸鉀毫升數表示過氧化氫酶活性,用ml g-1表示。磷酸酶采用磷酸苯二鈉比色法,以1 g土壤的酚毫克數表示磷酸酶活性,用mg g-1d-1表示。蔗糖酶測定采用比色法,以24 h后1 g土壤中葡萄糖的質量(mg)表示蔗糖酶活性,用mg g-1d-1表示。
土壤微生物測定:細菌、真菌、放線菌均用平板涂抹法測定,測定前計算水分系數。細菌采用牛肉膏蛋白胨培養基,真菌采用馬丁氏培養基,放線菌采用高氏一號培養基[15]。
樣品基因組總DNA的提取及純化按照E. Z.N.A. Soil DNA Kit說明書進行操作,用于T-RFLP技術分析和實時熒光定量核酸擴增檢測系統(qPCR)。
T-RFLP分析:①ITS-PCR擴增。用于內轉錄間隔區(Internal transcribed spacer,ITS)片段擴增的引物采用帶羧基熒光素(FAM)熒光標記的真菌通用引物ITS1-F-FAM和ITS4,由上海生工生物工程技術服務有限公司合成。ITS1-F-FAM(5′→3′):CTTGGTCATTTAGAGGAAGTAA;ITS4(5′→3′):TCCTCCGCTTATTGATAGC。ITS擴增反應體系為:12.5 μl 2 × Taq MasterMix,1 μl DNA模板,ITS1-F和ITS4(10 μmol L-1)各1.5 μl,加dd H2O至25 μl。PCR反應條件:94℃預變性3 min;94℃變性60 s,51℃退火60 s,72℃延伸60 s,共34個循環;最后72℃延伸10 min。取5 μl ITS-PCR擴增產物經2%瓊脂糖凝膠電泳檢測,按照 PCR產物純化試劑盒說明書進行PCR產物純化,-20℃保存備用。②酶切。用限制性內切酶Hha I對上述PCR純化產物進行酶切。酶切反應體系為30 μl:含10 μl ITS-PCR純化產物、2 μl Hha I(10 U μl-1)、2 μl 10×Buffer,加dd H2O至30 μl。置于37℃水浴中溫育4 h,酶切完畢后65℃水浴20 min終止反應。將酶切產物送至生工生物工程(上海)股份公司進行測序。對測序結果進行真菌群落多樣性分析(多樣性指數、優勢度指數、均勻度指數和豐富度指數)、聚類分析和主成分分析[16]。
實時熒光定量采用CFX ConnectTMReal-Time System(Bio-Rad,美國)對土壤中層出鐮孢菌基因拷貝數進行絕對定量分析。實時熒光定量PCR體系依據SYBR Premix Ex TaqTMKit TaKaRa試劑盒說明步驟完成。25 μl PCR反應體系:DNA模板1.5 μl;SYBR Premix Ex Taq Ⅱ 12.5 μl;引物各1 μl;ddH2O 9 μl。層出鐮孢菌PCR擴增反應程序:95℃預變性30 s;95℃變性5 s;60℃退火30 s;共計40個循環[17]。
1.4 數據分析
試驗數據采用Microsoft Excel 2003進行計算和作圖,通過SPSS 19.0進行方差分析,采用鄧肯(Duncan’s)新復極差法進行差異顯著性檢測,用Origin 8.5完成對試驗數據的制圖。
2 結 果
2.1 萬壽菊生物熏蒸對平邑甜茶幼苗生長的影響
與對照相比,不同添加量的萬壽菊生物熏蒸處理均對蘋果幼苗生長有促進作用,均使平邑甜茶幼苗生物量有所增加(表1)。其中以6.0T+F處理的效果最好,其株高、地徑、地上部及根系干重分別為對照的3.6倍、1.5倍、8.1倍和13.1倍,與對照差異顯著。1.5T+F處理的分別為對照的2.1倍、1.1倍、3.9倍、5.8倍;15.0T+F處理的分別為對照的1.9倍、1.3倍、4.8倍、6.4倍(表1)。單獨覆膜處理對平邑甜茶幼苗生長有促進作用,各項指標分別為對照的1.3倍、1.2倍、2.2倍和3.1倍。
2.2 萬壽菊生物熏蒸對平邑甜茶幼苗根系的影響
與對照相比,不同添加量的萬壽菊生物熏蒸處理均對蘋果幼苗根系生長起到明顯促進作用(表2)。其中以6.0T+F處理的效果最好,平邑甜茶幼苗的根長度、根表面積、根體積及根尖數顯著增加,分別較對照增加了226.5%、333.0%、548.4%和142.7%,與對照差異顯著。1.5T+F處理的分別增加了52.4%、45.9%、82.8%、43.9%;15.0T+F處理的分別增加了42.4%、98.3%、178.9%、18.4%。單獨覆膜處理對平邑甜茶幼苗根系生長也有促進作用,各項指標分別較對照增加33.4%、41.4%、73.9%和3.2%,但與對照差異不顯著。
2.3 萬壽菊生物熏蒸對蘋果連作土壤酶活性的影響
與對照相比,不同添加量的萬壽菊生物熏蒸處理顯著提高了連作土壤酶活性(圖1)。其中,脲酶、磷酸酶活性以6.0T+F處理的效果最好,分別較對照高103.6%、77.6%(圖1A、圖1B);蔗糖酶活性以15.0T+F處理的最高,較對照高302.0%,6.0T+F處理的較對照高200.4%(圖1C)。過氧化氫酶活性以6.0T+F和15.0T+F處理的活性最高,均較對照高64.6%(圖1D)。單獨覆膜處理使脲酶、磷酸酶、蔗糖酶、過氧化氫酶活性分別提高37.7%、20.3%、88.9%和10.8%。

表1 萬壽菊生物熏蒸下平邑甜茶幼苗生長指標Table 1 Growth indices of Malus hupehensis Rehd. seedlings in soils biofumigated with Tateges erecta powder

表2 萬壽菊生物熏蒸下平邑甜茶單株幼苗根系的生長Table 2 Growth of Malus hupehensis Rehd. seedling roots in soils biofumigated with Tateges erecta powder
2.4 萬壽菊生物熏蒸對土壤微生物數量的影響
與對照相比,連作土壤中加入不同量的萬壽菊熏蒸后,各處理土壤中的真菌數量明顯減少,細菌、放線菌數量顯著增加,細菌/真菌比值變大(表3)。以6.0T+F處理的效果最好,細菌/真菌比值為219.9,是對照的5.6倍;其次是15.0T+F處理的(137.0),為對照的3.5倍。說明萬壽菊生物熏蒸明顯改善了土壤微生物群落結構,使連作土壤真菌減少、細菌增加,向細菌型土壤轉化,微生物環境優化,有利于根系生長發育和植株生長。
2.5 不同處理土壤真菌群落結構
通過多樣性指數、聚類分析和主成分分析(PCA)比較萬壽菊生物熏蒸對土壤真菌多樣性的影響,了解連作蘋果園土壤真菌的群落結構特征變化。與對照相比,老齡蘋果園土壤加入萬壽菊生物熏蒸處理后,土壤真菌群落的多樣性、均勻度和豐富度指數均有所下降,但優勢度指數明顯增加(表4)。由此可見,萬壽菊生物熏蒸處理改變了土壤真菌的群落結構,使土壤真菌群落的豐富度、多樣性和均勻度降低,某種真菌優勢度明顯增加。
由圖2聚類分析可以看出,不同添加量萬壽菊生物熏蒸的土壤真菌群落結構與連作土壤完全獨立開來,說明萬壽菊生物熏蒸處理后明顯改變了連作蘋果園土壤的真菌群落結構。其中,6.0T+F處理和15.0T+F處理間關系較近,F和1.5T+F間關系較近。

圖1 萬壽菊生物熏蒸對連作條件下脲酶(A)、磷酸酶(B)、蔗糖酶(C)和過氧化氫酶(D)活性的影響Fig. 1 Effects of biofumigation with Tateges erecta powder on soil enzyme activities(urease activity(A),phosphatase activity(B),invertase activity(C),and catalase activity(D))in soils under continuous cropping

表3 萬壽菊生物熏蒸下土壤微生物數量Table 3 Population of soil microorganisms in soils biofumigated with Tateges erecta powder

表4 萬壽菊生物熏蒸對土壤真菌多樣性的影響Table 4 Effects of biofumigation with Tateges erecta powder on the soil fungal diversity
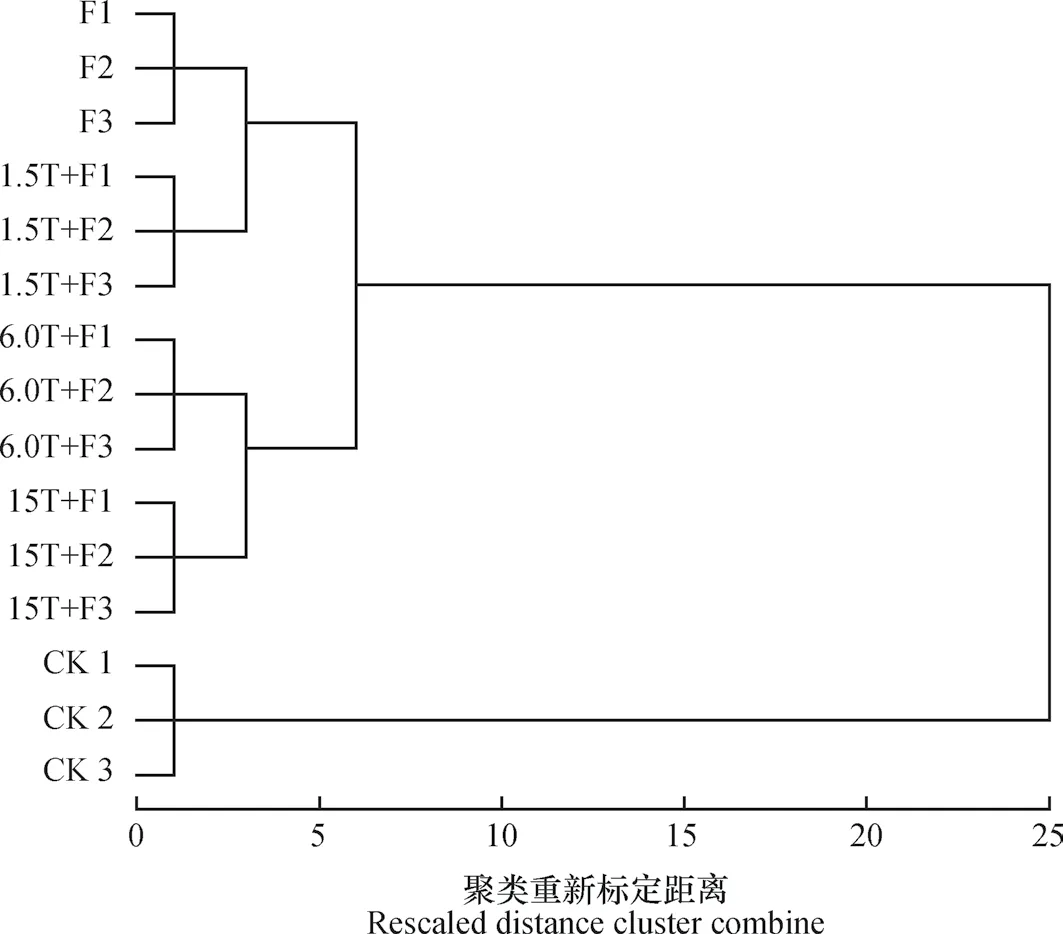
圖2 不同處理間真菌末端限制性片段長度多態性(T-RFLP)圖譜的聚類分析Fig. 2 Cluster analysis of T-RFLP patterns of fungi in the soil relative to treatment
根據不同處理間的末端限制性片段(T-RFs)在圖譜中的分布及豐度進行主成分分析(PCA)。根據主成分的提取原則,被選的主成分所代表的主軸總長度占所有主軸長度之和的大約85%即可,對各樣品獲得的所有數據進行主成分分析,前2個主成分特征值的貢獻率總和為 99.16%,所以選取2個主成分來進行分析。從圖3可以看出,萬壽菊生物熏蒸處理與老齡蘋果園土壤對照完全分開,說明萬壽菊生物熏蒸處理明顯改變了老齡蘋果園土壤的真菌群落結構。
2.6 不同處理土壤層出鐮孢菌數量
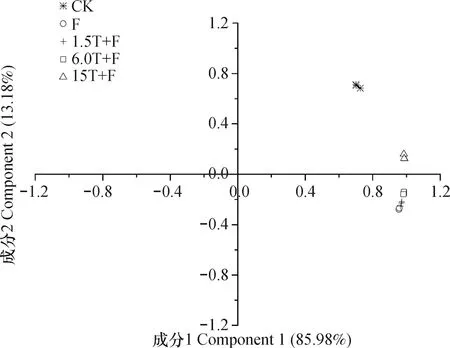
圖3 不同處理間真菌T-RFLP 圖譜的主成分分析Fig. 3 Principal component analysis of T-RFLP patterns of fungi in the soil relative to treatment
徐文鳳[18]在中國環渤海蘋果重茬園中分離出大量鐮孢屬真菌,分別為尖孢鐮孢菌(Fusarium oxysporum)、層出鐮孢菌(F. proliferatum)、腐皮鐮孢菌(F. solani)和串珠鐮孢菌(F. moniliforme)。致病性測定結果表明,層出鐮孢菌和串珠鐮孢菌致病性最強[18]。利用實時熒光定量技術(Real-time PCR)對層出鐮孢菌(F. proliferatum)的基因拷貝數進行絕對定量分析(圖4)。結果表明,萬壽菊生物熏蒸處理的層出鐮孢菌基因拷貝數均低于CK,1.5T+F、6.0T+F、15.0T+F處理分別較對照低49.3%、57.9%、50.6%。單獨覆膜處理較對照降低了27.2%。說明萬壽菊生物熏蒸能夠顯著減少層出鐮孢菌的數量。

圖4 不同處理層出鐮孢菌的基因拷貝數Fig. 4 Gene copy number of Fusarium proliferatum in the soil relative to treatment
3 討 論
土壤添加劑可以改善土壤結構,影響土壤微生物群落,促進植物生長發育,增強植物自身抗性,提高農作物的品質與產量,所以,在農業生產過程中使用土壤添加劑已成為作物土傳病蟲害生態防治的重要措施之一[19-20]。蘋果連作土壤中添加芥菜籽粉和白芥子粉等綠肥后,能明顯促進嘎拉/M26幼樹生長[21]。本研究發現,添加6.0 g kg-1的萬壽菊粉末進行生物熏蒸可顯著增加平邑甜茶幼苗的株高及生物量,尤其是對根系生長促進作用明顯。Arnault等[22]發現以洋蔥和韭菜加工廢料作為土壤生物熏蒸劑可明顯改善土壤結構,促進草莓和蘆筍生長,可使草莓和蘆筍增產15%~20%,與芥菜處理的效果相當。研究中發現萬壽菊低濃度(1.5 g kg-1)和高濃度(15.0 g kg-1)添加量的促生效果略差,1.5 g kg-1因為添加量不足,熏蒸效果不理想,15.0 g kg-1雖然添加量大,但效果卻不是最理想的,室內的抑菌試驗發現萬壽菊粉末加水后黏性較大,因此,施入土壤的量太大會導致土壤透氣性不良,土壤黏結,不利于根系生長。
土壤酶是土壤中動植物殘體分解、植物根系分泌和土壤微生物代謝的產物,是一類具有生物化學催化活性的特殊物質,參與土壤中許多重要的生物化學過程,是土壤中最活躍的部分,直接影響著土壤的代謝性能,且能活化土壤有機質,將其轉化為植物可吸收的無機物,其活性大小在一定程度上代表土壤肥力的高低,較高的酶活性水平,能在一定程度上保證作物在土壤肥力貧瘠的土地上生長良好[23]。谷巖等[24]研究發現,大豆重茬使土壤脲酶和轉化酶活性均顯著降低。蘋果連作土壤的過氧化氫酶、脲酶、蔗糖酶和中性磷酸酶活性降低,可能是連作使土壤環境惡化的表現之一,而澆灌3%濃度的有機物料發酵液可提高蘋果連作土壤的酶活性[25]。本研究中,老齡蘋果園土壤中加入萬壽菊粉末生物熏蒸后,土壤酶活性顯著提高,綜合蔗糖酶、脲酶、磷酸酶、過氧化氫酶活性測定結果看,以6.0 g kg-1處理的效果最好,這說明適宜量的萬壽菊粉末施入土壤后不僅具有良好的抑菌或滅菌作用,而且其植物組織腐爛分解后可能改良土壤的理化性質特別是持水性、有機質含量、肥力及通透性等,改善土壤的營養條件,促進植物生長和增產。這與王艷芳等[26]在連作土壤中添加適量甲殼素能提高土壤中蔗糖酶、脲酶、磷酸酶和過氧化氫酶活性的研究結果較為一致。
土壤微生物是土壤中活的有機體,是最活躍的土壤肥力因子之一[27]。土壤微生物種群在很大程度上決定著土壤中營養物質的分解、循環和能量流動,通過調節土壤環境可以改變土壤微生物的種群組成和多樣性,影響土壤生態系統的功能[28]。植物連作后,由于長期受同一類根系分泌物的影響,土壤微生物群落會發生選擇性富集,導致土壤微生物群落數量發生變化,擾亂了土壤微生物生態平衡,連作后土壤中細菌的數量總體下降,真菌的數量顯著上升,病原菌數量急劇增加,土壤微生物從細菌主導型向真菌主導型轉化,使病原菌更容易侵染植物而引發各種土傳病害[29]。因此,尋找適宜的控制土傳病蟲害措施可有效防控連作障礙。隨著環保意識的增強,各國學者致力于研究環保型熏蒸措施對土壤中致病病原菌或線蟲的抑制或殺生作用。Lazzeri等[30]研究發現,芥子科植物(芥菜、芝麻菜等)作為殺生性綠肥顯著減少了腐霉菌屬繁殖體的數目。將高GSLs含量的蕓薹屬植物組織風干制成殺生小球,施入土壤澆水熏蒸處理后發現,該處理與用純硫代葡萄糖苷和黑芥子酶處理同樣對腐霉菌(Pythiumspp.)和立枯絲核菌(Rhizoctonia solani)有很好的熏蒸效果[31]。
本研究用平板涂布法結合末端限制性片段長度多態性(T-RFLP)技術研究萬壽菊生物熏蒸對連作蘋果園土壤中微生物數量和真菌群落結構的影響。基于T-RFLP圖譜,運用多樣性指數和主成分分析比較了不同處理間真菌多樣性及群落結構。結果發現,老齡蘋果園土壤采取萬壽菊生物熏蒸處理后土壤中的真菌數量明顯減少而細菌、放線菌數量顯著增加,細菌/真菌比值顯著增加,以6.0 g kg-1處理的效果最好,細菌/真菌比值為219.9,土壤類型由真菌型向細菌型轉變。同時,萬壽菊生物熏蒸對連作土壤中真菌種類及豐度均產生了一定的影響,萬壽菊生物熏蒸使老齡蘋果園土壤中真菌的多樣性、均勻度和豐富度降低,優勢度增加,這與本實驗室以往的研究結果[26]不一致,可能是因為萬壽菊生物熏蒸使某些真菌數量明顯增加,處于優勢地位,也可能是因為萬壽菊植株內存在著具有殺菌效果的內生真菌。有研究[32]表明,有些植物內生真菌具有顯著的生物熏蒸效果,具體原因有待于進一步深入研究。Hollister等[33]最早利用高通量測序法分析芥菜籽粕(SM,釋放烯丙基異硫氰酸酯)對土壤真菌和細菌群落的影響,發現芥菜籽粕顯著影響土壤真菌和細菌群落結構,使真菌多樣性降低60%,與真菌病害相關的細菌類群豐富度增加(如芽孢桿菌屬、假單胞桿菌屬和鏈霉菌屬等),有效抑制了真菌病害發生。Hu等[34]研究發現,烯丙基型異硫氰酸酯使真菌數量減少85%,不同類型的異硫氰酸酯使真菌群落組成發生明顯改變,如烯丙基型異硫氰酸酯處理土壤后腐質霉屬(Humicola)真菌增加,丁基型異硫氰酸酯處理土壤后被孢霉屬(Mortierella)真菌增加,但不同的異硫氰酸酯化合物對細菌群落結構影響較小。Weerakoon等[35]研究也發現,芥菜籽粉不僅對連作蘋果園土壤中腐霉屬(Pythiumspp.)病原菌具有抑制作用,而且改變連作土壤中真菌群落結構,這種土壤中原有真菌群落結構的調整,很可能有助于芥菜籽粉抑制腐霉菌對蘋果根系的侵染,進而緩解蘋果連作障礙 。Yim等[36]研究發現,芥菜生物熏蒸能夠促進連作土壤中蘋果樹的生長,且改變了土壤微生物群落結構,對真菌的影響較細菌明顯。Ascencion等[37]研究發現,在三種試驗土壤中施用蕪菁、甘藍型油菜、芥菜熏蒸均能有效抑制白菜立枯絲核菌,抑制率分別為96.7%~100%、86.7%~100%、40%~100%,同時顯著改變了土壤中微生物的數量和種群結構,3種物質熏蒸后土壤中的細菌數量明顯增加,真菌數量減少。
本研究在設置試驗時,同時設置了單獨覆膜處理,單獨覆膜處理有一定的熏蒸作用,對幼苗及根系生長有促進作用,但促進效果不明顯,與對照差異不顯著。因此,在生產應用中,連作土壤中添加適量的萬壽菊粉澆水覆膜可使連作土壤由真菌型向細菌型轉變,而且也有利于維持土壤微生物群落結構的多樣性,緩解連作障礙,促進連作條件下蘋果幼苗生長發育。
萬壽菊風干粉末生物熏蒸對緩解蘋果連作障礙有較好的效果,為使生產上操作性更強,應對萬壽菊適宜劑型進行試驗,并配套相應的技術措施。近年發展起來的高通量測序技術,對深入研究連作對土壤微生物群落組成和功能變化是較好的技術手段,該技術能夠分析某些特定的菌群,如細菌、氨氧化細菌、真菌及一些植物病原菌(鐮刀菌類、茄科勞爾氏菌)的變化情況,測定的微生物種類和數量更加多樣、豐富,結果也會更加可靠[27]。因此,下一步應采用該測定技術深入研究萬壽菊生物熏蒸處理后土壤微生物群落結構的變化和萬壽菊的抑菌機理。
4 結 論
老齡蘋果園土壤中添加適量的萬壽菊進行熏蒸有助于增加有益細菌的數量,抑制土壤中病原真菌的繁殖,且有利于維持土壤微生物群落結構的多樣性,這些變化有利于連作土壤朝著穩定健康的方向發展,促進連作條件下蘋果幼苗生長發育,達到緩解蘋果連作障礙的目的。
[1] Weiβ S,Bartsch M,Winkelmann T. Transcriptomic analysis of molecular responses in Malus domestica‘M26’roots affected by apple replant disease. Plant Molecular Biology,2017,94(3):303—318
[2] Mazzola M,Manici L M. Apple replant disease:Role of microbial ecology in cause and control. Annual Review of Phytopathology,2012,50:45—65
[3] Kelderer M M,Manici L,Caputo F,et al. Planting in the‘inter-row’to overcome replant disease in apple orchards:A study on the effectiveness of the practice based on microbial indicators. Plant and Soil,2012,357(1/2):381—393
[4] Tewoldemedhin Y T,Mazzola M,Labuschagne I,et al. A multi-phasic approach reveals that apple replant disease is caused by multiple biological agents,with some agents acting synergistically. Soil Biology and Biochemistry,2011,43(9):1917—1927
[5] Franke-Whittle I H,Manici L M,Insam H,et al.Rhizosphere bacteria and fungi associated with plant growth in soils of three replanted apple orchards. Plant and Soil,2015,395(1/2):317—333
[6] Klose S,Acosta-Martínez A,Ajwa H A. Microbial community composition and enzyme activities in a sandy loam soil after fumigation with methyl bromide or alternative biocides. Soil Biology and Biochemistry,2006,38(6):1243—1254
[7] 劉星,張書樂,劉國鋒,等. 土壤生物消毒對甘肅省中部沿黃灌區馬鈴薯連作障礙的防控效果. 應用生態學報,2015,26(4):1205—1214 Liu X,Zhang S L,Liu G F,et al. Control of continuous potato monoculture barrier via biological soil disinfestation method in Yellow River irrigation areas of central Gansu Province,Northwest China(In Chinese). Chinese Journal of Applied Ecology,2015,26(4):1205—1214
[8] Nicola L,Turco E,Albanese D,et al. Fumigation with dazomet modifies soil microbiota in apple orchards affected by replant disease. Applied Soil Ecology,2017,113:71—79
[9] Smolinska U,Morra M J,Knudsen G R,et al.Isothiocyanates produced by Brassicaceae species as inhibitors ofFusarium oxysporum. Plant Disease,2003,87(4):407—412
[10] 盧志軍. 蔬菜根結線蟲病生物熏蒸控制作用研究. 北京:中國農業大學,2016 Lu Z J. Control effeciency of biological fumigation against vegetable root-knot nematodes(In Chinese).Beijing:China Agricultural University,2016
[11] 曹坳程,劉曉漫,郭美霞,等. 作物土傳病害的危害及防治技術. 植物保護,2017,43(2):6—16 Cao A C,Liu X M,Guo M X,et al. Incidence of soilborne diseases and control measures. (In Chinese)Plant Protection,2017,43(2):6—16
[12] 范志宏,郭春絨,王金勝. 萬壽菊根提取物對西瓜枯萎病菌的抑菌活性成分及作用機理研究. 植物病理學報,2010,40(2):195—201 Fan Z H,Guo C R,Wang J S. Active antifungal component of extracts fromTagetes patularoot againstFusarium oxysporumf. sp. niveum and its mechanism(In Chinese). Acta Phytopa Thologica Sinica,2010,40(2):195—201
[13] 秦沖. 萬壽菊秸稈制備活性炭及其應用的初步研究. 北京:北京林業大學,2015 Qin C. Preparation and applied research of activated carbon from marigold straw(In Chinese). Beijing:Beijing Forestry University,2015
[14] 關松蔭. 土壤酶及其研究法. 北京:農業出版社,1986:274—340 Guan S Y. Soil enzyme and its research methods(In Chinese). Beijing:Agriculture Press,1986:274—340
[15] 程麗娟,薛泉宏. 微生物學實驗技術. 西安:世界圖書出版公司,2000 Chen L J,Xuan Q H. Microbiology laboratory technology(In Chinese). Xi’an:World Publishing Corporation,2000
[16] 尹承苗,王功帥,李園園,等. 連作蘋果園土壤真菌的T-RFLP分析. 生態學報,2014,34(4):837—846 Yin C M,Wang G S,Li Y Y,et al. Assessment of fungal diversity in apple replanted orchard soils by T-RFLP analysis(In Chinese). Acta Ecologica Sinica,2014,34(4):837—846
[17] 吳濤,馮歌林,曾珍,等. 生物質炭對盆栽黑麥草生長的影響及機理. 土壤學報,2017,54(2):525—534 Wu T,Feng G L,Zeng Z,et al. Effect of biochar addition on ryegrass growth in a pot experiment and its mechanism(In Chinese). Acta Pedologica Sinica,2017,54(2):525—534
[18] 徐文鳳. 環渤海灣地區重茬蘋果園土壤真菌群落多樣性及生防真菌的篩選. 山東泰安:山東農業大學,2011 Xu W F. Diversity analysis of soil fungi from Bohai Bay apple replanted orchard and the screening of the antagonistic fungi(In Chinese). Tai’an,Shandong:Shandong Agricultural University,2011
[19] 王艷芳. 蘋果連作土壤中根皮苷含量的年動態及其調控措施研究. 山東泰安:山東農業大學,2015 Wang Y F. Studies on the dynamic changes and regulating measures of phlorizin in replant soil(In Chinese). Tai’an,Shandong:Shandong Agricultural University,2015
[20] 王光飛,馬艷,郭德杰. 不同用量秸稈生物炭對辣椒疫病防控效果及土壤性狀的影響. 土壤學報,2017,54(1):204—215 Wang G F,Ma Y,Guo D J. Application-rate-dependent effects of straw biochar on control of Phytophthora blight of chilli pepper and soil properties(In Chinese). Acta Pedologica Sinica,2017,54(1):204—215
[21] Mazzola M,Zhao X.Brassica junceaseed meal particle size influences chemistry but not soil biology-based suppression of individual agents inciting apple replant disease. Plant and Soil,2010,337(1):313—324
[22] Arnault I,Fleurance C,Vey F,et al. Use of Alliaceae residues to control soil-borne pathogens. Industrial Crops and Products,2013,49:265—272
[23] 張旭龍,馬淼,吳振振,等. 慧油葵與光果甘草間作對根際土壤酶活性及微生物功能多樣性的影響. 土壤,2016,48(6):1114—1119 Zhang X L,Ma M,Wu Z Z,et al. Effects ofHelianthus annuusandGlycyrrhiza glabraintercropping on rhizosphere soil enzyme activities and soil microbes functional diversity(In Chinese).Soils,2016,48(6):1114—1119
[24] 谷巖,邱強,王振民,等. 連作大豆根際微生物群落結構及土壤酶活性. 中國農業科學,2012,45(19):3955—3964 Gu Y,Qiu Q,Wang Z M,et al. Effeccts of soybean continuous cropping on microbial and soil enzymes in soybean rhizosphere(In Chinese). Scientia Agricultura Sinica,2012,45(19):3955—3964
[25] 尹承苗,陳學森,沈向,等. 不同濃度有機物料發酵液對連作蘋果幼樹生物量及土壤環境的影響. 植物營養與肥料學報,2013,19(6):1450—1458 Yin C M,Chen X S,Shen X,et al. Effect of different irrigating concentrations of fermented organic fluid on the young apple tree biomass and the soil properties in replant soil(In Chinese). Journal of Plant Nutrition and Fertilizer,2013,19(6):1450—1458
[26] 王艷芳,付風云,李家家,等. 甲殼素對連作條件下平邑甜茶幼苗生長及土壤環境的影響. 生態學報,2016,36(19):1—8 Wang Y F,Fu F Y,Li J J,et al. Effects of chitin on the growth ofMalus hupehensisRehd. seedlings and soil environment under replant condition(In Chinese).Acta Ecologica Sinica,2016,36(19):1—8
[27] 李鑫,張秀麗,孫冰玉,等. 烤煙連作對耕層土壤酶活性及微生物區系的影響. 土壤,2012,44(3):456—460 Li X,Zhang X L,Sun B Y,et al. Effects of continuous cropping in flue-cured tobacco on soil enzyme activities and microbial flora in arable layers of soils(In Chinese). Soils,2012,44(3):456—460
[28] 張紅,呂家瓏,曹瑩菲,等. 不同植物秸稈腐解特性與土壤微生物功能多樣性研究. 土壤學報,2014,51(4):743—752 Zhang H,Lü J L,Cao Y F,et al. Decomposition characteristics of different plant straws and soil microbial functional diversity(In Chinese). Acta Pedologica Sinica,2014,51(4):743—752
[29] 薛超,黃啟為,凌寧,等. 連作土壤微生物區系分析、調控及高通量研究方法. 土壤學報,2011,48(3):612—618 Xue C,Huang Q W,Ling N,et al. Analysis,regulation and high-throughput sequencing of soil microflora in mono-cropping system(In Chinese).Acta Pedologica Sinica,2011,48(3):612—618
[30] Lazzeri L,Tacconi R,Palmieri S. In vitro activity of some glucosinolates and their reaction products toward a population of the nematodeHeterodera schachtii.Journal of Agricultural & Food Chemistry,1993,41(5):825—829
[31] Lazzeri L,Manici L M. Allelopathic effect of glucosinolate-contaning plant green manure onPythiumsp. and total fungal population in soil. Hortscience,2001,36(7):1283—1289
[32] 王維華,陳巧,任俊生,等. 一種新的生物熏蒸劑原料—內生真菌Muscodor albus. 江蘇農業科學,2012,40(10):19—20,54 Wang W H,Chen Q,Ren J S,et al. A new raw material of biofumigation-Endophytic fungiMuscodor albus(In Chinese). Jiangsu Agricultural Sciences,2012,40(10):19—20,54
[33] Hollister E B,Hu P,Wang A S,et al. Differential impacts of brassicaceous and nonbrassicaceous oilseed meals on soil bacterial and fungal communities. FEMS Microbiology Ecology,2012,83(3):632—641
[34] Hu P,Hollister E B,Somenahally A C,et al. Soil bacterial and fungal communities respond differently to various isothiocyanates added for biofumigation.Frontiers in Microbiology,2015,5:729—738
[35] Weerakoon D M N,Reardon C L,Paulitz T C,et al.Long-term suppression ofPythium abappressoriuminduced byBrassica junceaseed meal amendment is biologically mediated. Soil Biology and Biochemistry,2012,51:44—52
[36] Yim B,Hanschen F S,Wrede A,et al. Effects of biofumigation usingBrassica junceaandRaphanus satiνusin comparison to disinfection using Basamid on apple plant growth and soil microbial communities at three field sites with replant disease. Plant and Soil,2016,406(1/2):389—408
[37] Ascencion L C,Liang W J,Yen T B. Control ofRhizoctonia solanidamping-off disease after soil amendment with dry tissues ofBrassicaresults from increase in Actinomycetes population. Biological Control,2015,82:21—30

