銀杏蜜環口服溶液對多發性腦梗死大鼠模型的影響
徐 立 宋文婷 姚明江 王益民 王 勇 王光蕊 劉建勛
(1 中國中醫科學院西苑醫院基礎醫學研究所,中藥藥理北京市重點實驗室,北京,100091; 2 西安步長中醫心腦病醫院,西安,710082)
銀杏葉提取物具有清除自由基,調整循環系統,抑制血小板活化因子,抑制血小板聚集,改善血液粘度和血流動力學等作用,臨床用于腦部及周圍血流循環障礙。天麻蜜環菌是與天麻伴生的真菌,有類似于天麻的藥理作用,具有定驚熄風,鎮靜安神、抗眩暈和鎮痛的作用,臨床用于治療眩暈頭痛,驚風癲癇,肢體麻木,腰膝酸痛等癥。
銀杏蜜環口服溶液系由銀杏葉提取物和天麻蜜環菌粉組成,臨床上用于治療缺血性心腦血管疾病。有研究表明該藥可明顯改善腦血流動力學和血液流變學指標[1],減少NIHSS評分[2],但兩者配伍使用的藥理學優勢鮮見報道。本研究建立多發性腦梗死大鼠模型,觀察銀杏葉提取物和天麻蜜環菌及兩者配伍的藥理學作用及機制。
1 材料與方法
1.1 材料
1.1.1 動物 SD大鼠,雄性,180~220 g,由北京維通利華實驗動物技術有限公司提供,許可證號:SCXK(京)2012-0001,合格證號:11400700163978。
1.1.2 藥物 銀杏蜜環口服溶液(邛崍天銀制藥有限公司生產,批號:160312),銀杏葉提取物(邛崍天銀制藥有限公司生產,批號:160402),天麻蜜環菌粉(邛崍天銀制藥有限公司生產,批號:20151027);金納多(銀杏葉提取物片,德國威瑪舒培博士藥廠生產,批號:5260613);天麻蜜環菌片(江蘇神華藥業有限公司生產,批號:20160602)。
1.1.3 試劑與儀器 谷氨酸(Glu,≥99%),-氨基丁酸(GABA,≥99.5%),50%氫氧化鈉溶液(NaOH),85%磷酸(H3PO4),鄰苯二甲醛(OPA),均為HPLC級;硼酸(H3BO3),ACS級,均為Fluka公司產品;β-巰基乙醇(βME,≥99.5%),BR級,磷酸氫二鈉(Na2HPO4),ACS級,均為美國Sigma Aldrich公司產品;甲醇(MeOH),乙腈(Acn),HPLC級,美國Fisher Scientific公司產品;高氯酸85%(HClO4),AR級,北京化工試劑二廠產品;水合氯醛,上海國藥集團化學試劑有限公司產品;注射用青霉素鈉粉針,華北制藥股份有限公司產品。TNF-α試劑盒,批號:GR2995505-1,由abcam公司提供。抗體CD34,GFP,NeuN,均由abcam公司提供,批號分別為GR305367-3,GR129953-4和GR249899-29。CoulArray-5600型高效液相-電化學工作站、5600A電化學檢測器、582液相泵、542自動進樣器、6210碳石墨電極、CTO-324可控溫元件箱,美國ESA公司產品。AG2245電子天平,瑞士梅特勒托利多公司產品。UVPMS-BY2 ?180~212 μm熒光微球,美國Cospheric公司產品,批號:100309-7。YLS-13A大小鼠抓力測定儀,北京眾實迪創科技發展有限責任公司。臺式MIKRO 22R離心機,德國Hettich公司產品。超聲破碎儀,VCX150PB型,美國SONICS公司。針筒式微孔濾膜過濾器:水系(0.22 μm),天津騰達過濾器廠產品。TELTA 320 pH計,上海Mettler Toledo儀器公司產品。
1.2 方法
1.2.1 分組與模型制備 參考文獻[3-4]進行改良,建立多發性腦梗死大鼠模型。動物4.0%水合氯醛腹腔注射麻醉(400 mg/kg),保溫毯上仰臥位固定,分離右側頸總動脈(CCA)、頸內動脈(ICA)及頸外動脈(ECA),結扎ECA并剪斷,CCA用絲線打活結暫時阻斷,用動脈夾夾閉ICA后,于ECA剪開切口,注射熒光微球混懸血清,致使大腦動脈多發性阻塞。假術組只分離CCA結扎ECA,不注射微球。實驗過程中保溫毯設定溫度37~37.5 ℃,保持大鼠體溫。術后24 h動物進行神經學評分,剔除0分及4分大鼠,其余隨機分組:假手術組,模型組,金納多組(18 mg/kg),銀杏葉提取物組(9 mg/kg),天麻蜜環菌素片組(600 mg/kg),天麻蜜環菌粉組(300 mg/kg),銀杏蜜環口服溶液組(618 mg/kg),銀杏蜜環口服溶液組(309 mg/kg)。
1.2.2 給藥方法 術后2 d開始灌胃給藥,給藥體積為5 mL/kg(銀杏蜜環口服溶液高劑量組給藥體積為6 mL/kg),連續給藥28 d。末次給藥后動物進行神經功能評分,并測定左前爪抓力。麻醉取血,分離血清冷凍保存,并迅速取出大腦,離后緣4 mm處冠狀切一刀,分離紋狀體,液氮固化,-80 ℃保存,高效液相-電化學法測定中樞氨基酸類神經遞質,后腦區福爾馬林固定,經脫水、包埋、切片、HE染色,分析腦組織的病理變化,免疫組化觀察微血管、膠質細胞和神經元的修復情況。
1.2.3 行為學檢測 術后24 h采用單盲法觀察神經行為學。以Longa 5分制評分,其標準為:無神經損傷癥狀,0分;不能完全伸展左側前爪,1分;向非缺血側轉圈,2分;行走時向非缺血側傾倒,3分;不能自發行走,意識昏迷,4分。給藥28 d后再次評分
1.2.4 抓力檢測 右手抓持大鼠后按放在抓力測定儀的抓力板上,左手向前推住抓力板,然后右手向后滑至鼠尾部,左手輕輕松開抓力板,待大鼠用左側前爪用力抓住抓力板時及時加力后拉,測定大鼠的最大抓力。每個動物測定3次,取平均值作為該大鼠的抓力值。
1.2.5 Glu/GABA測定
1.2.5.1 色譜條件 Waters XTerra MS C18色譜柱(3.0 mm×50 mm,2.5 μm),流動相:100 mM磷酸氫二鈉,20%甲醇,3.5%乙腈,pH值(6.70±0.02)。ESA 582液相泵流速為0.4 mL/min;電勢+150,+650 mV;柱溫30 ℃。氨基酸衍生程序 4 ℃,吸取50 μL衍生工作液,加入25 μL腦勻漿樣品中,混合3次,30 μL/次,靜置1 min,進樣20 μL分析。
1.2.5.2 氨基酸衍生試劑儲備液的配制 27 mg OPA,溶于1 mL甲醇,加入5 μL βME,加入9 mL,0.1 mol/L硼酸溶液(NaOH調至pH 9.3),4 ℃保存,5 d內使用。
1.2.5.3 衍生工作液的配制 取2.5 mL氨基酸衍生試劑儲備液,加入7.5 mL,0.1 mol/L硼酸溶液(NaOH調至pH 9.3),每日現用現配。
1.2.6 病理學檢查 HE染色,光鏡下觀察腦組織梗死灶、神經元數目、病變程度、小膠質細胞增生程度等形態學指標。
1.2.7 免疫組化 脫水10%中性福爾馬林固定,再行梯度脫水(70%酒精60 min×1、80%酒精60 min×1、90%酒精60 min×1、95%酒精60 min×1、100%酒精30-50 min×1、100%酒精60 min×1),透明(二甲苯60 min×2),浸蠟(蠟Ⅰ60 min×1、蠟Ⅱ60 min×1、蠟Ⅲ30 min×1)。包埋:用干凈的石蠟融化后澆注組織。切片:切片厚度5 μm。指標檢測及檢測方法采用PV-6000二步法免疫組化法。采集圖像及圖像分析:CREB抗體著色表達細胞核,其余抗體著色表達細胞胞質,高倍鏡下拍攝3個視野,將采集的圖像應用Image-pro Plus 5.1圖像分析系統進行分析,所得數據作免疫組織化學染色陽性信號累積光密度(IOD),以IOD值作為組織表達的定量標準。累積光密度(IOD)=平均光密度(AOD)×陽性面積(A)。
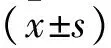
2 結果
2.1 對MCI大鼠神經功能評分和抓力的影響 術后24 h進行為學評分,假手術組動物神經行為未發現異常;手術造成大鼠肢體行為學異常,可見明顯的神經功能損傷,主要表現為左肩內收、屈曲,前肢無力,向非缺血側轉圈,行走時向非缺血側傾倒等。按評分標準進行評分,去掉4分和0分大鼠并隨機分組,使組間差異沒有統計學意義,但與假手術組比較,差異均有統計學意義(P<0.01)。給藥28 d后,模型組行為學功能變化不大,與模型組比較,對照藥金納多18 mg/kg劑量組和銀杏蜜環口服溶液618 mg/kg和309 mg/kg均有改善神經癥狀的作用,其中銀杏蜜環口服溶液618 mg/kg作用最強,309 mg/kg次之,但與金納多組比較差異無統計學意義(P>0.05)。給藥28 d后,與假手術組大鼠比較,MCI模型組大鼠抓力顯著減小,差異有統計學意義(P<0.01);與模型組大鼠比較,對照藥金納多組、銀杏葉提取物組以及銀杏蜜環口服溶液618 mg/kg和309 mg/kg組大鼠抓力均明顯增加,差異有統計學意義(P<0.05~0.01),與蜜環菌片及蜜環菌粉比較,差異有統計學意義(P<0.05~0.01)。見表1。
2.2 對MCI大鼠腦組織谷氨酸(Glu)、γ-氨基丁酸(GABA)的影響 模型組大鼠腦組織內腦內谷氨酸(Glu)、γ-氨基丁酸(GABA)水平有所增加,與假手術組大鼠比較,差異有統計學意義(P<0.01)。與模型組大鼠比較,銀杏蜜環口服溶液618 mg/kg組大鼠腦組織中Glu水平顯著降低;蜜環菌片600 mg/kg組、銀杏蜜環口服溶液618 mg/kg組及309 mg/kg組的GABA水平顯著降低,差異有統計學意義(P<0.05~0.01),金納多、銀杏葉提取物和天麻蜜環菌粉因大鼠個體差異較大,數據無統計學意義(P>0.05)。銀杏蜜環口服溶液618 mg/kg組與金納多組比較,Glu水平比較,差異有統計學意義(P<0.05),銀杏蜜環口服溶液618 mg/kg組與金納多、銀杏葉提取物組比較,GABA水平下降,差異有統計學意義(P<0.05)。見表2。

表1 對MCI大鼠神經功能評分和抓力的影響
注:與假手術組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05,△△P<0.01;與銀杏葉提取物比較,▲P<0.05,▲▲P<0.01;與天麻蜜環菌片比較,□P<0.05,□□P<0.01;與天麻蜜環菌粉比較,■P<0.05,■■P<0.01

表2 對MCI大鼠腦組織Glu、GABA的影響
注:與假手術組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05,△△P<0.01;與金納多組比較,▲P<0.05,▲▲P<0.01;與銀杏葉提取物比較,□P<0.05,□□P<0.01

表3 對MCI大鼠血清TNF-α的影響
注:與假手術組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05,△△P<0.01;與金納多組比較,▲P<0.05,▲▲P<0.01;與銀杏葉提取物比較,□P<0.05,□□P<0.01;與天麻蜜環菌片比較,■P<0.05,■■P<0.01;與天麻蜜環菌粉比較,#P<0.05,##P<0.01
2.3 對MCI大鼠血清TNF-α的影響 模型組大鼠血清TNF-α水平升高,與假手術組比較差異有統計學意義(P<0.05)。與模型組比較,金納多18 mg/kg組,天麻蜜環菌片600 mg/kg組,銀杏蜜環口服溶液618 mg/kg和309 mg/kg組大鼠血清TNF-α水平均顯著降低(P<0.05~0.01),以天麻蜜環菌片600 mg/kg組,銀杏蜜環口服溶液618 mg/kg和309 mg/kg組最優,天麻蜜環菌片600 mg/kg組與金納多組、銀杏葉提取物組以及天麻蜜環菌粉組比較,差異均有統計學意義(P<0.05~0.01);銀杏蜜環口服溶液618 mg/kg和309 mg/kg組與金納多組、銀杏葉提取物組、天麻蜜環菌片組以及天麻蜜環菌粉組比較,差異均有統計學意義(P<0.01)。見表3。

圖1 各組腦組織病理形態比較
注:A假手術組,B模型組,C金納多組,D銀杏葉提取物組,E天麻蜜環菌片組,F天麻蜜環菌粉組,G銀杏蜜環口服溶液高劑量組,H銀杏蜜環口服溶液低劑量組。HE染色,×40
2.4 對MCI大鼠腦組織病理形態的影響 假手術組:腦組織均未見明顯異常,未見組織壞死灶及神經元變性/壞死。模型組腦組織標本均可見腦組織壞死灶,發生區域以單側丘腦區壞死灶最為常見,其次為大腦皮質和海馬區;主要表現為丘腦組織局灶性、多灶性或片狀壞死,壞死區可見組織細顆粒樣崩解或中央液化性壞死,神經元變性/壞死(皺縮濃染)或消失,可伴炎細胞浸潤,以及壞死區和周圍組織膠質細胞增生、組織空泡形成等壞死后修復反應;大腦皮質可見明顯組織壞死所致組織溶解缺失。與模型組比較,金納多組、銀杏蜜環口服溶液309 mg/kg組和618 mg/kg組腦組織壞死發生率均明顯降低,程度亦有明顯減輕,這3組腦組織均以壞死后組織修復反應為主要表現,壞死急性期的反應如組織崩解和液化性壞死發生率較低或程度較輕,大腦皮質均未見明顯組織壞死,可明顯緩解和改善動物腦梗死狀態;天麻蜜環菌片組腦組織壞死發生率和病變程度亦有降低,但不如上述3組明顯;天麻蜜環菌粉組腦組織壞死發生率略有降低,但病變程度無明顯降低;銀杏葉提取物9 mg/kg組腦組織壞死發生率和病變程度均無明顯降低,對緩解和改善動物腦梗死狀態效果不顯著。見圖1。

表4 對MCI大鼠腦CD34、GFAP和NeuN表達的影響
注:與假手術組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05,△△P<0.01
2.5 對MCI大鼠腦CD34、GFAP和NeuN表達的影響 免疫組化結果顯示,模型組CD34、GFAP陽性細胞數增多,表明壞死組織在修復;銀杏蜜環口服溶液309 mg/kg組和618 mg/kg組腦組織的CD34和蜜環菌粉組、銀杏蜜環口服溶液309 mg/kg組和618 mg/kg組腦組織的GFAP著色更重,與假手術組比較,差異有統計學意義(P<0.05),表明修復作用強于模型組。模型組NeuN正常著色減少,壞死程度較重,與假手術組比較,差異有統計學意義(P<0.01);天麻蜜環菌片600 mg/kg組,天麻蜜環菌粉300 mg/kg組,銀杏葉提取物9 mg/kg組及銀杏蜜環口服溶液618 mg/kg組的NeuN著色加強,與模型組比較,差異均有統計學意義(P<0.05)。提示銀杏蜜環口服溶液對緩解和改善動物腦梗死狀態有促進作用,對血管內皮、膠質細胞以及神經元均有修復作用。見表4,圖2~4。

圖2 各組腦組織CD34表達的比較
注:A假手術組,B模型組,C金納多組,D銀杏葉提取物組,E天麻蜜環菌片組,F天麻蜜環菌粉組,G銀杏蜜環口服溶液高劑量組,H銀杏蜜環口服溶液低劑量組。×400

圖3 各組腦組織GFAP表達的比較
注:A假手術組,B模型組,C金納多組,D銀杏葉提取物組,E天麻蜜環菌片組,F天麻蜜環菌粉組,G銀杏蜜環口服溶液高劑量組,H銀杏蜜環口服溶液低劑量組。×400

圖4 各組腦組織NeuN表達的比較
注:A假手術組,B模型組,C金納多組,D銀杏葉提取物組,E天麻蜜環菌片組,F天麻蜜環菌粉組,G銀杏蜜環口服溶液高劑量組,H銀杏蜜環口服溶液低劑量組。×400
3 討論
Glu是哺乳動物中樞神經系統主要的興奮性神經遞質,研究發現Glu可以有效促使培養的成人脊髓神經元以及成人海馬神經元恢復神經電生理活動。不僅如此,生理狀態下Glu通過激活興奮性氨基酸受體對神經元的分化、中樞神經系統的發育、神經元-膠質細胞耦聯以及長時程增強效應和記憶的形成都有重要作用。只有在腦缺血缺氧急性損傷等病理情況下,Glu過度釋放,在神經元外周間隙大量積聚時,可造成神經元損傷。正常情況下,GABA受體的激活起到抑制興奮毒性、鎮靜、催眠、抗驚厥、降血壓等生理作用,但在腦缺血時,其過度激活卻對神經細胞有毒性作用[5]。本研究結果顯示,模型大鼠腦組織內谷氨酸(Glu)、γ-氨基丁酸(GABA)水平顯著升高,銀杏蜜環口服溶液經口給藥28 d,腦內Glu和GABA水平顯著降低。
腦缺血發生后,會有一列的細胞因子介導炎性反應,腫瘤壞死因子(TNF-α)就是其中之一。TNF-α是一種多肽類細胞因子,主要是由激活的單核巨噬細胞分泌產生的細胞因子,T細胞、B細胞、血管內皮細胞、星形膠質細胞、小膠質細胞和神經元都是其分泌細胞[6]。腦缺血發生時,TNF-α能介導白介素-1(IL-1)、白介素-6(IL-6)和前列腺素E2(PGE2)等多種炎性遞質的產生。TNF-α還可以通過上調血管內皮細胞和白細胞上的黏附因子(ICAM-1)的表達加劇腦內炎性反應,增加血管通透性[7];TNF-α還可刺激前列環素(PGI2)和血栓素B2(TXB2)的釋放,引起血管收縮和血小板聚集。TNF-α的水平與腦梗死以及行為障礙程度呈正相關[8]。本研究觀察到模型組大鼠血清TNF-α水平升高,銀杏蜜環口服溶液組血清TNF-α水平顯著下降。
CD34、GFAP、NeuN這3種抗體均可用來評價腦組織壞死后血管內皮、膠質細胞及神經元的修復反應[9-11],CD34和GFAP染色越強,說明組織修復越明顯,在組織壞死及修復早期,這2種抗體染色較強,在組織修復后期會逐漸減弱。本研究觀察到模型組大鼠CD34、GFAP染色強于假手術組,表明腦損傷后腦組織有自修復的作用,灌胃給藥后,銀杏蜜環口服溶液組大鼠腦組織中CD34、GFAP染色強于模型組,表明血管內皮、膠質細胞的修復作用進一步增強。NeuN正常著色減少越明顯,說明腦組織壞死越嚴重,壞死周圍組織NeuN加深,可能提示壞死組織有修復趨勢。本研究觀察到模型組NeuN著色減輕,銀杏蜜環口服溶液組著色加深,表明有明顯的組織修復作用。
此外,銀杏蜜環口服溶液對神經功能的改善和抑制腦內Glu、GABA過度釋放作用顯著優于銀杏葉提取物;增加抓力作用顯著優于天麻蜜環菌;降低血清TNF-α水平程度則同時優于兩者。結論:銀杏蜜環口服溶液有保護腦缺血,改善神經功能的作用,復方優于單一組份,且有一定的協同增效的作用。
[1]孔偉.銀杏蜜環口服溶液對于腦缺血性疾病治療的臨床探究[J].世界最新醫學信息文摘,2017,17(54):73-74.
[2]周欣滿,宋寶林.銀杏蜜環口服液治療缺血性腦血管疾病療效觀察[J].世界最新醫學信息文摘,2016,16(23):163.
[3]Takagi K,Miyake K,Taguchi T,et al.Failure in learning task and loss of cortical cholinergic fibers in microsphere embolized rats[J].Exp Brain Res,1997,114(2):279-287.
[4]Kaneko D,N akamura N,Ogaw a T.Cerebral infarction in rats using homologous blood emboli:Development of a new experi mentalmodel[J].Stroke,1985,16(1):76-84.
[5]徐立,宋文婷,林成仁,等.塞絡通膠囊對大鼠多發性腦梗死恢復期Glu和GABA合成以及NMDA受體亞型表達的影響[J].藥學學報,2012,47(7):870-877.
[6]楊金升.腫瘤壞死因子在腦卒中時的表達及作用[J].國外醫學腦血管疾病分冊,1996,4(2):77-80.
[7]楊延林,武繼彪,隋在云.腫瘤壞死因子與腦缺血[J].浙江中西醫結合雜志,2009,19(1):60-61.
[8]張明義,韓俊英,張蘊,等.血清腫瘤壞死因子-α對急性缺血性腦卒中患者預后的影響[J].中國現代神經疾病雜志,2007,7(3):234-237.
[9]朱惠斌,陳懿,譚琥,等.腦泰方提取物對局灶性腦缺血大鼠CD34表達的影響[J].中藥新藥與臨床藥理,2011,22(2):141-144.
[10]閆世軍,何曉明,李昕華,等.局灶性腦缺血預處理星形膠質細胞GFAP表達變化[J].中國實驗診斷學,2009,13(10):1345-1346.
[11]耿倩,鄒玉,薛茜.康腦液對腦缺血再灌注大鼠GFAP和NeuN表達的影響[J].中國臨床藥理學雜志,2012,28(11):843-845.

