芍藥內酯苷、芍藥苷對慢性束縛應激肝郁模型大鼠海馬單胺類神經遞質及cAMP、cGMP的影響
趙丹萍 張建軍 王 旭 王小花 王成龍 王玉杰 王林元
(北京中醫藥大學,北京,100029)
白芍(PaeonialactifloraPall.),味苦、酸,性微寒,歸肝、脾經。甘補酸收,有補血斂陰,柔肝緩急之功,既能養肝血,又能柔肝體,最能順應肝之特性,為養血柔肝的代表[1]。芍藥內酯苷、芍藥苷為白芍的2種有效成分[2],研究表明,白芍提取物、芍藥苷、芍藥內酯苷均具有抗抑郁作用[3-5],其中白芍提取物、芍藥苷作用機制多與調節相關信號通路[6]、下丘腦-垂體-腎上腺皮質軸(HPA軸)和增強單胺類神經遞質[7]等相關,但關于芍藥內酯苷的作用機制則報道較少。本研究通過復制大鼠慢性束縛應激肝郁模型,通過觀察海馬組織中單胺類神經遞質以及cAMP、cGMP水平變化和芍藥內酯苷、芍藥苷對其干預作用,側重研究神經系統的變化,以期深入探討芍藥內酯苷、芍藥苷作用機制及白芍“柔肝解郁”功效物質基礎。
1 材料與方法
1.1 材料
1.1.1 動物 清潔級健康雄性SD大鼠96只,體質量180~200 g,購自斯貝福(北京)實驗動物科技有限公司[許可證號:SCXK(京)2016-0002]。飼養于北京中醫藥大學SPF級動物房,室溫20~22 ℃,相對濕度為60%~70%,燈照周期為12 h(7:00-19:00燈照,19:00-7:00黑暗)。實驗符合相關倫理學要求。
1.1.2 藥物 受試藥:芍藥內酯苷(自制,純度>96%)、芍藥苷(自制,純度>98%)制成所需濃度的溶液。陽性藥:鹽酸氟西汀分散片(百憂解)(生產批號:5169AA,禮來蘇州制藥有限公司);逍遙丸(濃縮丸)(生產批號:201510006,購自九芝堂股份有限公司),經本室高效液相測定,本品芍藥苷水平為4.19 mg/g,符合2015版藥典逍遙丸(濃縮丸)規定要求。
1.1.3 試劑與儀器 蔗糖(批號:20150303,北京化工廠),蒸餾水,超純水,甲醇(批號:126273),氯化鉀(批號:J23R026),磷酸二氫鈉(批號20071214);磷酸(批號:20120412),高氯酸(批號:20121111);辛烷磺酸鈉(批號:J06T019);乙二胺四乙酸二鈉(批號:G05R019);去甲腎上腺素(NE)、腎上腺素(E)、多巴胺(DA)、5-羥吲哚乙酸(5-HIAA)標準品(美國Sigma公司);環核苷酸放免試劑盒(批號:20151130)由北京華英生物技術研究所提供。大鼠束縛器(自制):筒長20 cm、內徑6 cm,可通過移動底板調節其長度;Agilent 1100LC型高效液相色譜儀(美國Agilent);Biofuge Stratos高速冷凍離心機(德國HERAEUS);VCX130型超聲破碎儀(美國SONICS);STAT FAX 2100全自動酶標儀(Awareness Technology Inc.美國)。
1.2 方法
1.2.1 分組與模型制備 80只大鼠適應性喂養5 d后,隨機分成8組,即空白組,模型組,逍遙丸組,氟西汀組,芍藥苷高劑量組,芍藥苷低劑量組,芍藥內酯苷高劑量組,芍藥內酯苷低劑量組。正式開始實驗時,除正常組外其余各組每天不定時束縛3 h,連續21 d,束縛以不影響大鼠正常晝夜節律為前提,調節束縛筒長度,使動物無損傷完全固定,限制大鼠進退和掉頭,以不產生壓迫感,不影響呼吸和排泄為度。
1.2.2 給藥方法 實驗第一天以灌胃的方式進行給藥,各組的給藥劑量依次為逍遙丸組4.032 g/kg(按2015版藥典規定人體用藥劑量換算成大鼠等效劑量作為大鼠用藥量,灌胃容積為10 mL/kg),氟西汀組2.0 mg/kg,芍藥苷高劑量組30 mg/kg、芍藥苷低劑量組15 mg/kg,芍藥內酯苷高劑量組30 mg/kg、芍藥內酯苷低劑量組15 mg/kg,空白組和模型組灌胃等量的純水,連續21 d。
1.2.3 檢測指標與方法 1)一般觀察:每日給藥前,觀察各組大鼠的口唇、眼睛、皮毛、尾巴的顏色、精神狀態、活動度、對束縛的反應、糞便等情況。2)體質量測試:各組大鼠于第0、7、14、21天稱重,記錄并分析各組大鼠體質量變化情況。3)糖水消耗量:實驗開始前,對大鼠進行1%蔗糖水攝取訓練,即先用蔗糖水喂養48 h,隨后禁食禁水24 h,再于次日早上8—9時對大鼠進行正式糖水實驗,測量大鼠1 h內的糖水消耗量。于實驗第0、14、21天測定蔗糖水攝取量,最后計算糖水消耗率(%)=糖水消耗量(mL)/(去離子水+糖水消耗量)(mL)×100%。4)海馬內單胺類神經遞質水平測定:各組大鼠在實驗第22天斷頭處死,迅速在冰上剝離海馬,稱重后置組織冷凍管中用液氮快速冷凍后,放入-70 ℃冰箱保存至測定。根據海馬質量,加入含有1.5%DHBA的裂解液(海馬質量×5 000)(內含0.001 g/mL半胱氨酸,1.6%高氯酸,0.000 18 g/mL乙二胺四乙酸二鈉),超聲勻漿,14 000 r/min離心30 min,上清液用于神經遞質測定。采用高效液相色譜-電化學檢測器系統(HPLC-ECD)進行測定,色譜條件為:色譜柱4.6 mm×150,Diamonsil C185u;流動相為10%甲醇(13.8 g/L磷酸二氫鈉,160 mg/L辛烷磺酸鈉,10 mg/L乙二胺四乙酸二鈉,Ph值為3),流速為1 mL/min,3,4-二羥芐胺為內標物,樣品中各主要組分用內標法進行定量。5)海馬內cAMP、cGMP水平測定:將已制備好的海馬組織勻漿上清液,參照說明書,用酶聯免疫吸附測定試驗(ELISA)按試劑盒操作,測定大鼠海馬中cAMP、cGMP水平。
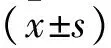
2 結果
2.1 大鼠的一般觀察 造模前各組大鼠毛色光澤、飲食及排便等活動正常,無明顯差異,隨著造模時間的延長模型組大鼠逐漸出現毛發枯黃、進食量及飲水量減少,形體消瘦,對外界的刺激反應減少,大便稀溏等一系列表現。芍藥內酯苷和芍藥苷各組大鼠毛發整齊,眼睛口唇顏色正常,對外界刺激反應靈敏,活動度良好。
2.2 芍藥內酯苷、芍藥苷對慢性束縛應激肝郁模型大鼠體質量的影響 造模第1周,模型組大鼠增長質量較正常組減少,各給藥組體質量增長也較少;造模第2~3周,模型組大鼠體質量明顯降低(P<0.01或P<0.01),各給藥組與模型組比較,體質量均有不同程度的增加(P<0.05或P<0.01)。見表1。
2.3 芍藥內酯苷、芍藥苷對慢性束縛應激肝郁模型大鼠糖水消耗量的影響 與空白組比較,實驗3周,模型組大鼠糖水消耗量顯著降低(P<0.01);與模型組比較,陽性藥組、芍藥苷高劑量組、芍藥內酯苷高劑量組大鼠糖水消耗率顯著增加(P<0.05),其他給藥組糖水消耗量亦高于模型組,但差異無統計學意義(P>0.05)。見表2。
2.4 芍藥內酯苷、芍藥苷對慢性束縛應激肝郁模型大鼠海馬內單胺類神經遞質水平的影響 與空白組比較,模型組大鼠海馬內NE、E、DA、5-HIAA水平明顯降低(P<0.01或P<0.001),與模型組比較,芍藥苷、芍藥內酯苷高低劑量組海馬內神經遞質水平均有不同程度的升高(P<0.05)。見表3。
2.5 芍藥內酯苷、芍藥苷對慢性束縛應激肝郁模型大鼠海馬內cAMP、cGMP水平的影響 與空白組比較,模型組大鼠海馬內cAMP水平明顯降低,cGMP水平明顯升高(P<0.001或P<0.01),與模型組比較,芍藥苷高劑量組海馬內cAMP水平明顯升高(P<0.05)、芍藥內酯苷高劑量組和芍藥苷低劑量組cGMP水平明顯降低(P<0.05)。見表4。

表1 芍藥內酯苷、芍藥苷對慢性束縛應激肝郁模型大鼠體質量的影響
注:與空白組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05,△△P<0.01

表2 芍藥內酯苷、芍藥苷對慢性束縛應激肝郁模型大鼠糖水消耗率的影響
注:與空白組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05

表3 芍藥內酯苷、芍藥苷對慢性束縛應激肝郁模型大鼠海馬內單胺類神經遞質水平的影響
注:與空白組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05

表4 芍藥內酯苷、芍藥苷對慢性束縛應激肝郁模型大鼠海馬內cAMP、cGMP水平的影響
注:與空白組比較,*P<0.05,**P<0.01;與模型組比較,△P<0.05
3 討論
《本草經集注》云:“白芍,其花純白,大而美麗,根亦白色,故名。”《本草求真》:“...白者味酸微寒無毒,功專入肝經血分斂氣。”白芍是臨床上柔肝解郁的代表藥,以血養肝、柔肝,保證肝臟疏泄正常。王景霞等實驗結果表明白芍提取物[3]可調節慢性應激抑郁模型大鼠中樞單胺類神經遞質水平,具有抗抑郁作用。芍藥苷[4]能明顯縮短小鼠懸尾不動時間,起到抗抑郁作用。在小鼠自主活動實驗[5]中證明了芍藥內酯苷的抗抑郁作用。逍遙散出自宋朝《太平惠民和劑局方》,由柴胡、當歸、白芍、茯苓等8味藥組成,具有疏肝解郁、養血健脾之功效,臨床上廣泛用于精神系統疾病的防治[6]。我們采用其成方丸劑作為陽性對照藥,大鼠每日給藥劑量為4.032 g/kg,經本室高效液相水平測定,該丸劑中芍藥苷水平為4.19 mg/g(相當于每日芍藥苷用量16.89 mg/kg,與本實驗芍藥苷低劑量組水平相當),芍藥內酯苷水平為2.68 mg/g(相當于每日芍藥內酯苷用量10.80 mg/kg),符合2015版中華人民共和國藥典對其水平的要求。氟西汀是一種選擇性5-羥色胺(5-HT)再攝取抑制劑類抗抑郁藥,臨床上常用于治療抑郁癥[7]。
肝郁證是由情志抑郁,所思不遂引起的一類證候,有學者認為,肝郁證是在抑郁、焦慮、悲痛等負性情緒心理應激狀態下,以高級神經中樞調節機制紊亂為前提,神經、內分泌、免疫、循環、消化、感覺、運動等多個系統的某些病理改變、病證表現的有機概括[8]。而中醫學的七情理論與現代醫學心理應激概念基本一致[9],本研究采用孤養和慢性束縛應激相結合的方法復制大鼠肝郁證模型,利用嚙齒類動物對甜味溶液敏感這一特征,通過被認為是衡量中醫肝郁的指標之一[10]的糖水消耗實驗來反應大鼠的肝郁狀態,此外大鼠體質量變化也是本實驗觀測的重要指標之一。實驗結果表明,模型組大鼠體質量增長緩慢,而芍藥內酯苷和芍藥苷各劑量組大鼠體質量有不同程度的升高。從造模第2周開始,模型組大鼠糖水消耗量逐漸減少,第3周最為明顯,這也提示肝郁的形成是一個漸變的過程。同時,從第3周開始,芍藥內酯苷和芍藥苷組能夠增加大鼠糖水消耗量且作用與逍遙丸組和氟西汀類似。
單胺類神經遞質也稱為生物胺類神經遞質,是調節機體情緒、行為狀態、精神活動的重要物質,主要包括兒茶酚胺和5-HT,前者主要指去甲腎上腺素(NE)、腎上腺素(E)和多巴胺(DA),越來越多的實驗研究證明單胺類神經遞質在抑郁癥、焦慮癥等精神類疾病中的發病機制中占有重要地位[11]。NE是E去N-甲基后形成的一種神經遞質,主要由交感節后神經元和腦內腎上腺素能神經末梢合成和分泌,是E釋放的主要神經遞質。DA作為下丘腦和腦垂體中關鍵性的神經遞質,能直接影響人的情緒[12]。5-HIAA是5-HT經A型單胺氧化酶(MAO)作用生成5-羥吲哚乙醛,在醛脫氫酶的催化下生成的酸性代謝終產物,腦內5-HT的減少直接與精神及情緒變化有關[13]。實驗結果提示,模型組大鼠海馬內NE、E、DA水平明顯低于正常組,芍藥內酯苷、芍藥苷劑量組可增加其水平,提示肝郁大鼠外周交感神經興奮性降低,而芍藥內酯苷、芍藥苷能增強其興奮性。實驗中5-HIAA水平檢測結果表明,與模型組比較芍藥內酯苷、芍藥苷可明顯提高,但實驗過程中未檢測到或檢測到極少量的五羥色胺,因此未做統計分析,可能的原因是在本研究條件下5-HT代謝分解生成五羥吲哚乙酸。此外,本實驗中神經遞質各項指標結果比相關文獻報道中數值偏高,考慮可能是受環境因素等影響。據此提示,肝郁模型大鼠海馬組織內存在單胺類神經遞質代謝異常,芍藥內酯苷、芍藥苷通過增加海馬組織中單胺類神經遞質的水平,抵抗大鼠肝郁狀態。
單胺類神經遞質發揮作用主要是與體內相應受體結合,其中的關鍵環節受體后效應主要通過cAMP-PKA通路、cGMP-PKG通路介導機體神經遞質、激素等信號轉導途徑發揮生物效應。環核苷酸(cAMP、cGMP)是中樞神經系統細胞的第2信使,對中樞神經系統活動起重要調節作用[14],二者具有相互拮抗、相互制約的生物學效應[15],cAMP水平增加可以逆轉學習記憶能力的減退[16],且臨床研究發現[17],cAMP水平和PKA水平在抑郁患者腦內及慢性應激動物模型海馬、前額葉皮質中明顯降低。王景霞等[4]采用小鼠懸尾急性應激模型(TST),運用上調或下調NO/cGMP通路的工具藥,得出芍藥苷的抗抑郁作用與NO-cGMP通路有關,并在血虛肝郁模型中通過研究芍藥苷對大鼠海馬中cGMP水平及其合成酶蛋白表達的干預作用,再次驗證其作用機制與降低 cGMP水平,下調NO/cGMP通路相關。本實驗肝郁模型組大鼠海馬內 cAMP水平降低、cGMP水平升高,與相關研究報道一致,而芍藥苷高劑量組可明顯升高cAMP水平,芍藥苷高低劑量組和芍藥內酯苷高低劑量組可明顯降低cGMP水平,提示芍藥內酯苷、芍藥苷做為白芍主要有效成分,其“柔肝解郁”作用與對海馬組織中cAMP、cGMP水平的調控有關。
致謝:感謝北京中醫藥大學科研實驗中心李偉老師對本實驗的指導幫助。
[1]高學敏.臨床中藥學[M].石家莊:河北科學技術出版社,2006.
[2]張建軍,李偉,王麗麗,等.赤芍和白芍品種、功效及臨床應用述評[J].中國中藥雜志,2013,38(20):3595-3601.
[3]王景霞,張建軍,李偉,等.白芍提取物對慢性應激抑郁模型大鼠行為學及大腦皮質單胺類神經遞質的影響[J].中華中醫藥雜志,2010,25(11):1895-1897.
[4]王景霞,張建軍,李偉,等.芍藥苷抗抑郁作用與NO/cGMP通路相關性研究[J].中藥與臨床,2012,3(1):27-28.
[5]張建軍,王景霞,李偉,等.芍藥內酯苷抗抑郁作用的實驗研究[J].中藥與臨床,2011,2(6):35-37.
[6]梁媛,郭曉玲,岳廣欣,等.逍遙散對肝郁脾虛證模型大鼠行為學變化的調節作用[J].北京中醫藥大學學報,2010,33(5):317-322.
[7]吳海銀,張晶.海馬神經元型一氧化氮合酶神經元再生通路介導5-羥色胺類抗抑郁藥作用[J].中國臨床藥理學與治療學,2013,18(3):252-257.
[8]陳家旭,楊維益.神經-內分泌-免疫網絡研究概況及其與中醫肝臟關系的探討[J].北京中醫藥大學學報,1995,18(4):7-11.
[9]金衛東.肝郁與抑郁癥關系探討[J].中醫研究,2009,22(11):1-3.
[10]劉子旺,趙海濱,張秀靜,等.電針肝俞、期門對肝氣郁結模型大鼠行為學及HPA軸相關激素的影響[J].針灸臨床雜志,2011,27(12):46-48.
[11]Racagni G,Brunello N.Physiology to functionality:the brain and neurotransmitter activity[J].Int Clin Psychopharmacol,1999,14 Suppl 1:S3-7.
[12]Tye KM,Mirzabekov JJ,Warden MR,et al.Dopamine neurons modulate neural encoding and expression of depression-related behaviour[J].Nature,2013,493(7433):537-541.
[13]和昱辰,張波,瞿瑋,等.血清單胺類神經遞質及其代謝產物在重度抑郁癥及抑郁共病焦慮障礙診斷中的應用[J].第三軍醫大學學報,2014,36(8):806-810.
[14]朱曉琴.川芎嗪對癲癇大鼠海馬內cAMP、cGMP含量的影響[J].河南中醫藥學刊,2002,17(5):16-17.
[15]王瑞萍,唐方,藿香與陳皮不同比例合煎水提物對大鼠胃腸運動的影響[J].中國實驗方劑學雜志,2010,16(15):98.
[16]楊夏,彭生,劉功儉.cAMP/PKA/CREB信號通路及相關調控蛋白PDE-4和ERK對學習記憶的影響[J].醫學綜述,2011,17(15):2241-2243.
[17]張榮,董世芬,倪博然,等.白金膠囊對CUMS誘導的抑郁癥大鼠模型行為學及腦內單胺類神經遞質的影響[J].中國比較醫學雜志,2015,25(7):46-52.

