青蛤凝集素CSL對釀酒酵母細胞形態的影響
,,,,*, ,*
(1.東北林業大學鹽堿地生物資源環境研究中心,東北油田鹽堿植被恢復 與重建教育部重點實驗室,黑龍江哈爾濱 150040; 2.河套學院農學系,內蒙古巴彥淖爾 015001; 3.大連海洋大學食品科學與工程學院,遼寧大連 116032)
釀酒酵母(Saccharomycescerevisiae)是人類最早利用的真核單細胞微生物,早在公元前3000年,人類就已經開始利用酵母制作食品。目前人們對釀酒酵母進行的研究,尤其是對其細胞壁結構的研究早已建立在分子水平[1]。研究酵母細胞壁,對更好地利用酵母有著重要的作用[2-6]。酵母細胞壁約占細胞干重的20%~30%,主要由D-葡萄糖和D-甘露糖兩類多糖組成,酵母細胞壁會隨著周圍環境發生變化而發生自我調節,從而適應或抵抗不良環境,保護酵母細胞[7]。
青蛤凝集素(CSL)是一種能夠凝集酵母細胞的Ca2+依賴型凝集素,其凝集活性可以被D-甘露糖和N-乙酰-D-半乳糖胺抑制[8]。CSL通過與釀酒酵母細胞壁上的甘露糖相互作用,能夠提高釀酒酵母單位時間內的乙醇產量[9]。酵母細胞壁含有肽聚糖,其對維持細胞形態具有重要作用[1]。但目前為止,對于凝集素作用對酵母形態影響的研究還未有報道。本文通過對CSL與酵母相互作用時,分析酵母體積的變化,了解酵母細胞壁的變化規律,并分析CSL與酵母細胞壁肽聚糖的相互作用,有助于了解凝集素與酵母相互作用的機理。
1 材料與方法
1.1 材料與儀器
青蛤凝集素(CSL) 由實驗室前期制備所得;釀酒酵母 安琪酵母股份有限公司;辣根過氧化物酶(Horse radish peroxidase,HRP)、牛血清蛋白(BSA) 北京索萊寶公司;肽聚糖(peptidoglycan)、甘露糖(D-Mannose)、N-乙酰-D-半乳糖胺(N-acetyl-D-galactosamine) 美國sigma公司;鈣離子定量試劑盒 AAT Bioquest Inc;其他試劑 均為分析純。
YPD液體培養基(Yeast Extract Peptone Dextrose Medium) 分別取葡萄糖2.0 g、酵母浸粉1.0 g、蛋白胨2.0 g溶于100 mL去離子水中,121 ℃條件下滅菌20 min。
LDZX-30KBS型立式壓力蒸氣滅菌器 上海申安醫療器械廠;HZQ-C型空氣浴振蕩器 哈爾濱市東聯電子技術開發有限公司;ZDP-A2160A型曲線控制恒溫培養箱 上海智城分析儀器制造有限公司;ZHJH-C1109B型超凈工作臺 上海智城分析儀器制造有限公司;Multiskan MK3型酶標儀 美國Thermo公司;S-4800型掃描電鏡 日本Hitachi公司;Q150R ES型離子濺射鍍膜儀 英國Quorum公司。
1.2 實驗方法
1.2.1 CSL-HRP酶聯物的制備 凝集素酶聯物制備采用高碘酸鈉法[10]。取10.0 mg CSL溶解于1 mL 0.01 mol/L磷酸鹽緩沖溶液(pH5.5)備用。取5.0 mg HRP溶解于1 mL超純水中,再加入0.2 mL 0.1 mol/L高碘酸鈉溶液,避光攪拌20 min,在1 mmol/L醋酸鈉緩沖溶液(pH4.4)中4 ℃透析12 h。透析結束后,在透析液中加入20 μL 0.2 mol/L 碳酸鹽緩沖溶液(pH9.5),之后加入全部CSL備用液,避光攪拌2 h。再加入0.1 mL 4.0 mol/mL硼氫化鈉溶液,4 ℃靜置2 h。最后在0.2 mol/L磷酸鹽緩沖溶液(pH7.4)中透析12 h,制得CSL-HRP。
1.2.2 肽聚糖包被96孔酶標板 將3.0 mg酵母菌肽聚糖溶解于8 mL 0.1 mol/L 碳酸鹽緩沖溶液(pH9.5)中,并在每孔中加入肽聚糖溶液100 μL,4 ℃過夜。用含有0.05% Tween 20的0.02 mol/L磷酸鹽緩沖溶液(pH7.2)洗滌3次,每次3 min。洗滌后,在每孔中加入200 μL含有0.1% BSA的磷酸鹽緩沖溶液(pH7.2),4 ℃過夜。最后再用相同方式洗滌3次,備用[10]。
1.2.3 CSL-HRP固相吸附實驗 將1.2.1方法所得的CSL-HRP溶液用超純水分別稀釋至2、1、0.5、0.25、0.125 mg/mL。取各稀釋液100 μL加入到1.2.2方法所得的96孔板中,37 ℃反應1 h后,以PBS洗滌3次。加入100 μL含有0.4 mg/mL鄰苯二胺及0.01% H2O2的磷酸-檸檬酸緩沖液(pH5.0),37 ℃進行顯色反應10 min,用2 mol/L H2SO4終止反應,在492 nm處測定吸光值[10]。
1.2.4 pH對CSL-HRP結合肽聚糖的影響 取90 μL 0.05 mol/L的HAc-NaAc(pH5.0)、NaH2PO4-Na2HPO4(pH6.0)、NaH2PO4-Na2HPO4(pH7.0)、Tris-HCl(pH8.0)、Gly-NaOH(pH9.0)溶液加入到1.2.2方法所得的96孔板中,再加入90 μL CSL-HRP,37 ℃反應1 h后,以PBS洗滌3次后,按照1.2.3顯色反應和終止反應方法進行,并測吸光值[10]。
1.2.5 D-Mannose與GalNAc的濃度對CSL-HRP結合肽聚糖的影響 分別取50 μL 0.625、1.25、2.5、5、10 mg/mL的D-Mannose溶液和GalNAc溶液,加入到1.2.2方法所得的96孔板中,再加入50 μL CSL-HRP,37 ℃反應1 h后,以PBS洗滌3次后,按照1.2.3顯色反應和終止反應方法進行,并測吸光值[10]。
1.2.6 酵母菌活化 將活性干酵母1.0 g加入到100 mL含2%葡萄糖的無菌水中,35 ℃條件下,活化30 min,得到酵母菌懸液。
1.2.7 釀酒酵母與CSL結合后表面積變化測定 由于對數生長期的酵母細胞新陳代謝水平以及各種代謝物的積累水平都比較穩定,所以本實驗選用對數生長期的中間階段,即酵母生長到12 h時對其進行NaCl和CSL浸泡處理,盡量縮小由取樣時間帶來的偏差。
將活化后的酵母溶液10 mL加入到100 mL YPD液體培養基中,在30 ℃、150 r/min條件下培養12 h(對數生長期)得到酵母菌懸液。將進入對數生長期的釀酒酵母懸液按照1∶1體積比加入到6種不同濃度的NaCl溶液中,溶液中含有的NaCl終濃度分別為0、20、40、60、80、100 mg/mL,30 ℃浸泡30 min后,置于室溫15 min后,利用顯微鏡測量酵母細胞直徑大小,并計算其表面[11]。每個濃度重復3次,每次隨機選取5個細胞進行測量。
取進入對數生長期的酵母懸液100 μL分別加入到100 μL不同濃度CSL溶液中,得到CSL最終濃度分別為3.37、6.73、13.45 mg/mL的酵母菌懸液,30 ℃浸泡30 min后,置于室溫15 min后,利用顯微鏡測量酵母細胞直徑大小,并計算其表面積。每個濃度重復3次,每次隨機選取5個細胞進行測量。
由圖2可知,鮮肉泥的紅度值隨腌制時間的延長而下降,因此,選取腌制3 h時紅度值較高的生鮮肉泥用于制作肉脯。
酵母細胞表面積計算,假設酵母細胞為球體。
表面積S=4πR2(R為球體半徑)
1.2.8 酵母細胞內鈣離子濃度測定 鈣離子標準曲線:取300 mmol/L鈣離子標準溶液10 μL加入到990 μL稀釋緩沖液中,制得3 mmol/L鈣離子標準液。再取50 μL 3 mmol/L鈣離子標準液加入到950 μL稀釋緩沖液中,制得150 μmol/L鈣離子標準液,1∶2梯度稀釋分別得到濃度為75、37.5、18.75、9.375、4.68、2.34、0 μmol/L的鈣離子標準液,在96孔板中分別每孔加入鈣離子標準液50 μL及顯色液50 μL,室溫下避光反應5~10 min,于650 nm處測吸光度值。
酵母細胞裂解緩沖液:分別取EDTA 1.46 g,β-巰基乙醇35 μL,NaCl 0.585 g,甘油10 mL,PMSF(100×)0.5 mL,溶于0.1 mol/L 的Tris-HCl(pH7.5)并定容至50 mL。
苯甲基磺酰氟(PMSF)(100×):取0.1742 g PMSF溶于10 mL異戊醇,室溫保存。
取按1.2.6方法所得的菌懸液以及終濃度為13.45 mg/mL CSL浸泡30 min的菌懸液,用0.05 mol/L pH7.4 PBS清洗3次,然后用PBS將菌液調整至OD600值為0.85±0.005,各取75 mL離心收集酵母細胞,懸浮于1 mL酵母細胞裂解緩沖液中,超聲破碎30 min(超聲功率300 W,工作1 s,間歇0.5 s)。4 ℃ 10000 r/min離心15 min,取上清液使用鈣離子定量試劑盒于650 nm處測吸光度[12]。鈣離子濃度標準曲線的繪制及樣品中鈣離子濃度的測定均平行3次實驗。
1.2.9 掃描電鏡觀察 按1.2.6方法所得的菌懸液及終濃度為13.45 mg/mL CSL浸泡30 min的菌懸液,于4 ℃ 4000 r/min條件下離心10 min,所得菌體用0.05 mol/L pH7.4的PBS清洗3次,之后沉淀物用1 mL 2.5%戊二醛固定液,于4 ℃固定12 h。固定后的菌懸液,以0.05 mol/L pH7.4的PBS清洗3次,沉淀以0.05 mol/L pH7.4的PBS 制成菌懸溶。
取200 μL菌懸液滴加到蓋玻片上,在培養皿中自然沉降2 h。依次以50%、70%、80%、90%、100%叔丁醇溶液脫水,脫水間隔10 min。100%叔丁醇脫水2次后,再加入100%叔丁醇于4 ℃固化,真空冷凍干燥。將干燥后的菌體切割成3 mm×6 mm小塊,以導電雙面膠粘貼于銅臺上,用噴金儀進行噴金,置于掃描電鏡中進行觀察(10000倍)[13]。
2 結果與分析
2.1 CSL與肽聚糖的相互作用
2.1.1 固相吸附 將酵母細胞壁肽聚糖與新制備的不同濃度的CSL-HRP溶液在96孔板板上進行結合測試,結果見圖1。由圖1可知,CSL與肽聚糖可以結合,并隨著CSL濃度的增加,CSL與肽聚糖結合的量也在增加,具有濃度依賴關系。
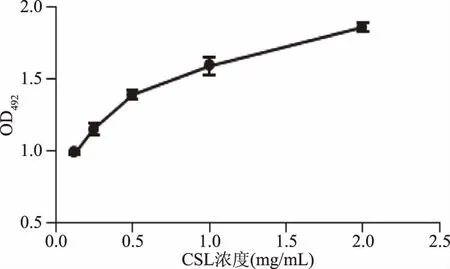
圖1 CSL固相吸附Fig.1 Binding ability of CSL to peptidoglycan
2.1.2 pH對CSL與肽聚糖結合的影響 pH對CSL與肽聚糖結合的影響結果見圖2。由圖2可知,當pH為6時,CSL結合肽聚糖的量最高,但隨著pH的上升,CSL與肽聚糖的結合能力逐步下降。結果表明,CSL與肽聚糖的結合受pH的影響,在pH為6時結合能力最強。
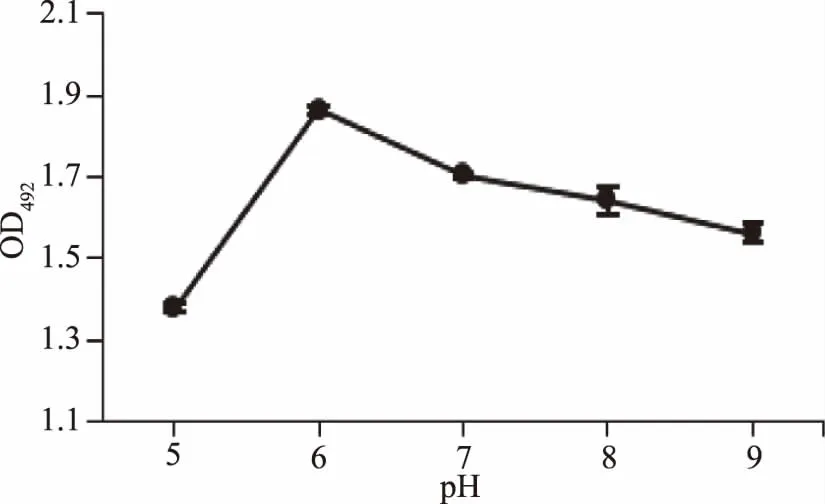
圖2 pH對CSL與肽聚糖結合的影響Fig.2 Effect of pH on binding ability of CSL to peptideglycan
2.1.3 GalNAc對CSL與肽聚糖結合的影響 GalNAc對CSL與肽聚糖結合的影響結果見圖3。由圖3可知,隨著GalNAc濃度的增加,CSL結合肽聚糖的能力逐漸下降。結果表明,CSL與酵母細胞壁肽聚糖的結合受到GalNAc的抑制,而CSL凝集活性又可以被GalNAc抑制,說明CSL上有GalNAc結合位點[13]。
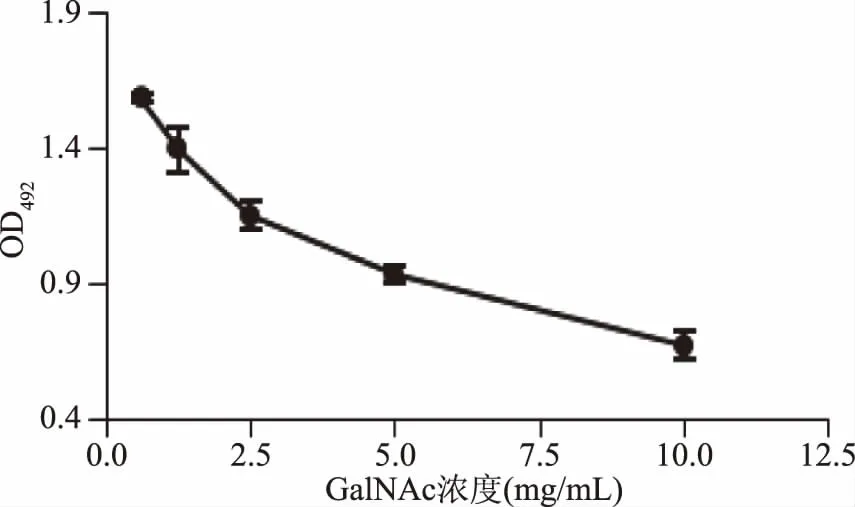
圖3 GalNAc對CSL與肽聚糖結合的影響Fig.3 Effect of GalNAc on binding ability of CSL to peptideglycan
2.1.4 D-Mannose對CSL與肽聚糖結合的影響 D-Mannose對CSL與肽聚糖結合的影響結果見圖4。由圖4可知,隨著D-Mannose濃度的增加,CSL結合肽聚糖的能力逐漸下降。結果表明,CSL與酵母細胞壁肽聚糖的結合受到D-Mannose的抑制,而CSL凝集活性又可以被D-Mannose抑制,說明CSL上有D-Mannose結合位點[13]。
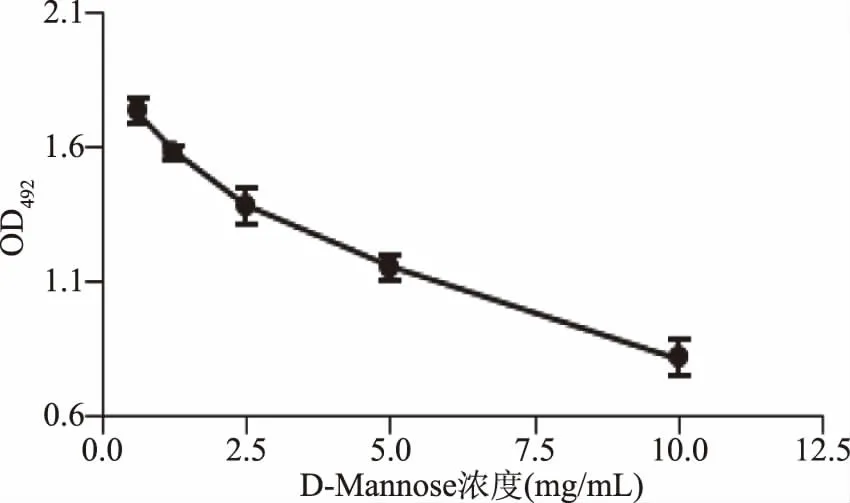
圖4 D-Mannose對CSL與肽聚糖結合的影響Fig.4 Effect of D-mannose on binding ability of CSL to peptideglycan
Tong等[14]研究凝集素MCL-T時發現,該凝集素結合OMP時,受到PSM及GalNAc的抑制。一般而言,凝集素具有專一的糖結合位點,而CSL與肽聚糖的結合受到GalNAc、D-Mannose的抑制說明,肽聚糖結合位點與GalNAc、D-Mannose的結合位點分別存在于凝集素上不同的結構域中,CSL與GalNAc、D-Mannose的結合導致了其與肽聚糖的結合,導致結合減少。
2.2 釀酒酵母細胞鹽脅迫條件下及青蛤凝集素CSL作用下表面積變化
釀酒酵母細胞在不同環境條件下其代謝行為發生改變,在這一應激過程中,酵母細胞可能發生了一系列的變化,包括細胞大小、表面積等的變化,因此本實驗設計了青蛤凝集素與釀酒酵母共培養以觀察細胞表面積變化。
將釀酒酵母細胞放大1000倍后,在100 mg/mL NaCl鹽脅迫條件下表面積變化如圖5所示。圖5A為在正常條件下酵母細胞大小,圖5B為在NaCl濃度100 mg/mL條件下酵母細胞大小。由圖5可見,NaCl在濃度為100 mg/mL時會導致釀酒酵母細胞表面積變小。

圖5 釀酒酵母細胞在100 mg/mL NaCl脅迫條件下細胞表面積(1000×)Fig.5 Surface area of the yeast against 100 mg/mL NaCl(1000×)注:A:對照組釀酒酵母細胞; B:100 mg/mL NaCl脅迫下的釀酒酵母細胞。
不同濃度NaCl環境中酵母細胞表面積大小見圖6。由圖6可見,NaCl濃度在小于20 mg/mL時,釀酒酵母細胞表面積無明顯變化。NaCl濃度在大于40 mg/mL時,釀酒酵母細胞隨著NaCl濃度的增加,酵母細胞收縮,液泡縮小,細胞的表面積縮小。
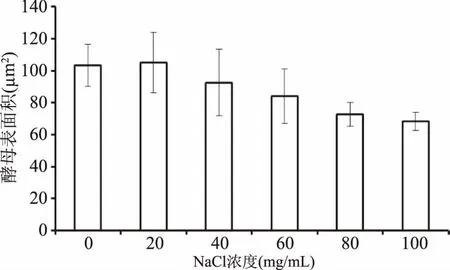
圖6 在NaCl脅迫條件下釀酒酵母細胞表面積的變化Fig.6 Surface area change of yeast cell during exposure to NaCl solution
釀酒酵母細胞在CSL作用下表面積變化如圖7所示。圖7A、7B、7C、7D分別為CSL濃度0、3.37、6.73、13.45 mg/mL條件下的酵母細胞顯微鏡下照片。結果表明,CSL可以致使釀酒酵母細胞表面積發生改變。
不同濃度CSL環境中酵母細胞表面積的大小見圖8。由圖8可知,正常條件下,酵母細胞表面積的平均值約為89.21 μm2。在CSL的作用下,釀酒酵母細胞表面積明顯縮小,并隨CSL濃度增加而減小,在CSL濃度增加到3.37、6.73、13.45 mg/mL條件下,細胞表面積平均值分別為81.16、72.94及69.94 μm2,這表明CSL促使釀酒酵母細胞壁發生了改變,導致了釀酒酵母細胞的表面積隨著CSL濃度的增加而變小。
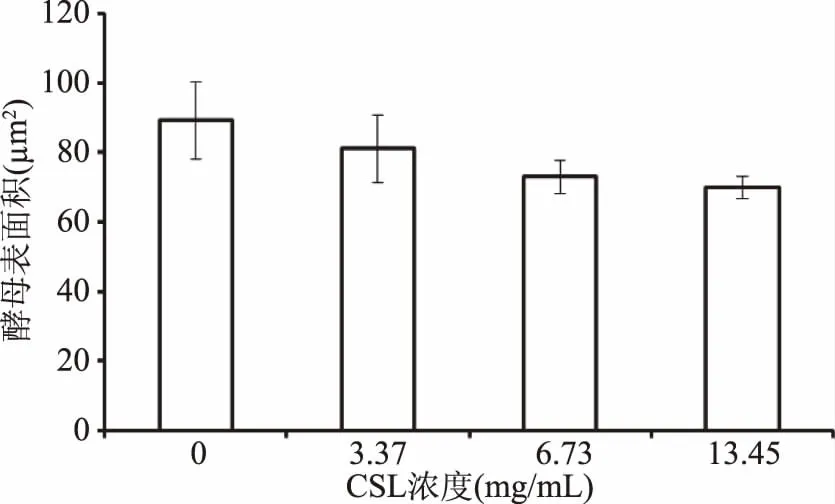
圖8 不同CSL濃度條件下酵母細胞表面積的變化Fig.8 Surface area change of yeast cell during exposure to different concentration of CSL solution
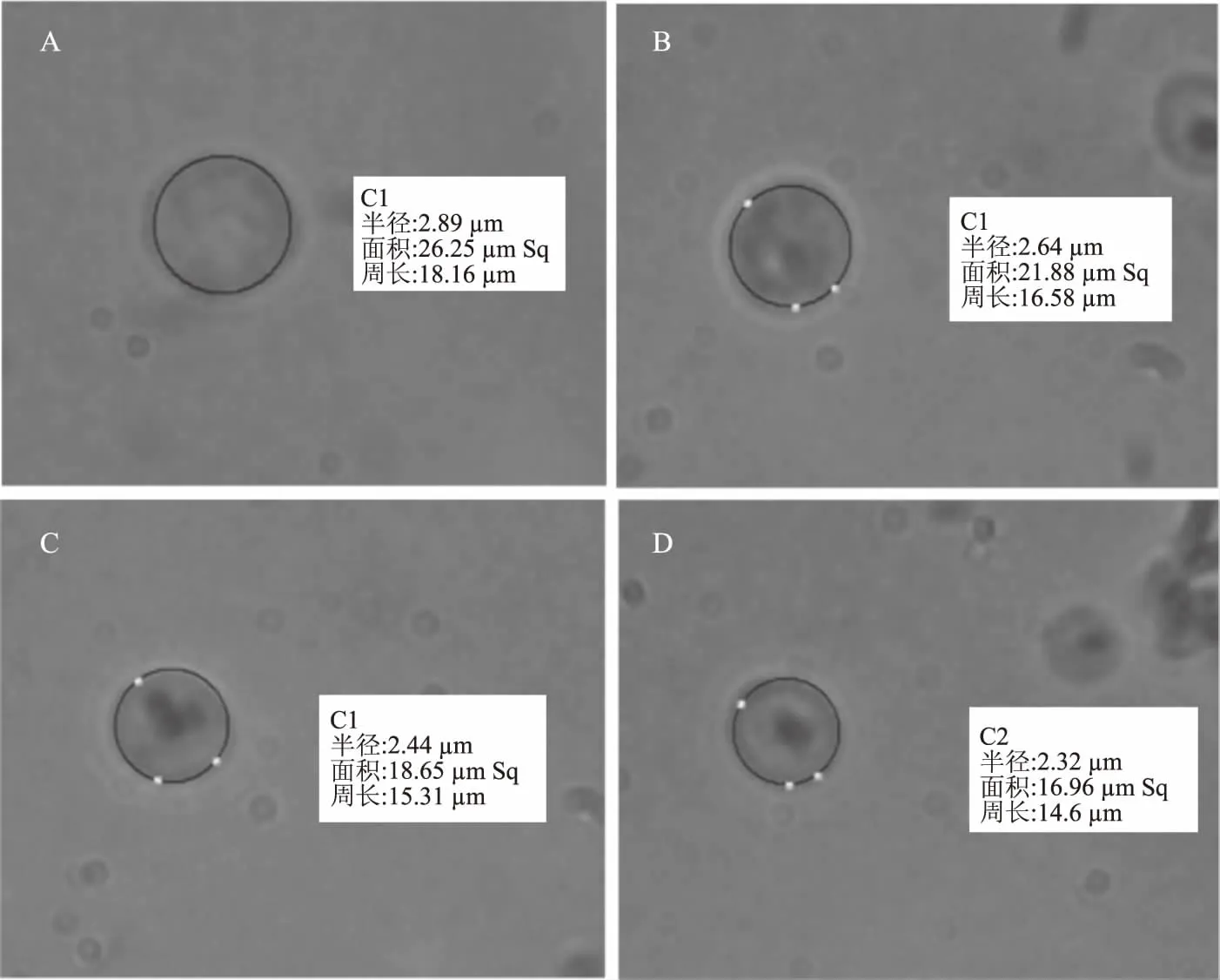
圖7 CSL對釀酒酵母細胞表面積的影響(1000×)Fig.7 Effect of CSL on surface area of Saccharomyces cerevisiae(1000×)注:A:對照組釀酒酵母細胞;B:CSL為3.37 mg/mL時的釀酒酵母細胞; C:CSL為6.73 mg/mL時的釀酒酵母細胞;D:CSL為13.45 mg/mL時的釀酒酵母細胞。
NaCl濃度的增加會導致酵母細胞體積減小,說明此種酵母細胞的體積及表面積會在周圍環境發生變化的條件下進行適應性改變。Tong等與Liu等已證明在釀酒酵母發酵過程中加入CSL能夠凝集釀酒酵母細胞、促進其增殖和提高乙醇產量[8-9]。本實驗加入CSL導致酵母細胞體積及表面積減小,說明CSL與釀酒酵母細胞壁相互作用,使釀酒酵母的細胞壁發生了變化,從而使外源信號傳遞到釀酒酵母胞內,使代謝途徑產生了相應的響應,提高了酵母細胞產生乙醇能力。
2.3 酵母細胞內鈣離子濃度
鈣離子濃度標準曲線見圖9。由圖9可知,使用鈣離子定量試劑盒繪制的鈣離子濃度標準曲線濃度范圍為0~75 μmol/L,其濃度和吸光度呈良好的線性關系,相關系數R2大于0.994。通過該方法測得對照組Ca2+濃度為24.0949 μmol/L,凝集素添加組鈣離子濃度為24.3513 μmol/L,與對照組相比,無顯著性差異(p<0.05)。
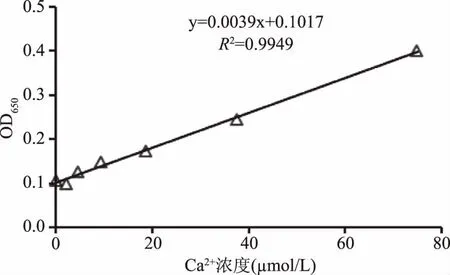
圖9 鈣離子濃度標準曲線Fig.9 The standard curve of calcium ion
酵母細胞中包括鹽、環境壓力和營養物感應等許多方面的Ca2+信號已被充分研究,Ca2+作為真核細胞內廣泛存在的細胞內信使調控許多細胞過程。酵母細胞外Ca2+一般情況下是通過一個未知的轉運蛋白X(transporter X)進入到細胞質內,當外界環境中Ca2+濃度較高時還會有轉運蛋白M(transporter M)參與[15]。通過研究添加CSL后,酵母細胞內Ca2+濃度變化來考察CSL信號的傳遞途徑。
本實驗通過鈣離子定量試劑盒,對單位時間內乙醇產量發生變化的對照組與CSL添加組兩組酵母菌內的Ca2+含量進行了測定,發現兩組酵母菌內的鈣離子含量未發生明顯變化,說明CSL刺激酵母菌產乙醇可能與酵母細胞內鈣離子通路相關性不強,CSL與釀酒酵母細胞壁的相互作用可能并未影響到transporter X。
2.4 電鏡掃描結果
通過電鏡掃描觀察對照組與CSL添加組的酵母形態見圖10,發現這兩者具有較明顯差異。由圖10A能觀察到對照組酵母細胞表面較圓潤光滑,而圖10B中CSL添加組酵母細胞表面有較多贅附凸起。電鏡掃描結果提示,CSL使釀酒酵母的細胞壁表面形態發生了變化,這一變化與CSL促進了酵母細胞的發酵能力的提高[8-9]有一定的內在聯系。

圖10 酵母電鏡掃描照片Fig.10 Scanning electron micrographs of yeast 注:A:對照組釀酒酵母細胞;B:CSL組釀酒酵母細胞。
3 結論
通過研究發現,CSL可與酵母細胞壁肽聚糖結合且兩者的結合具有濃度依賴關系,該結合位點受甘露糖(D-Mannose)及N-乙酰-D-半乳糖胺(N-acetyl-D-galactosamine)的抑制。顯微鏡觀察釀酒酵母細胞在鹽脅迫條件和青蛤凝集素CSL作用下的細胞狀態研究發現,鹽脅迫和CSL分別與釀酒酵母細胞壁相互作用,均會導致釀酒酵母細胞的表面積發生改變,說明鹽脅迫和CSL均會改變釀酒酵母細胞的細胞壁。對照組與CSL添加組兩組酵母菌內的Ca2+含量未發生明顯變化,說明CSL刺激酵母菌產乙醇可能與酵母細胞內鈣離子通路相關性不強。通過電鏡掃描觀察對照組與CSL添加組的酵母形態,發現對照組酵母細胞表面較圓潤光滑,CSL添加組酵母細胞表面有較多贅附凸起。研究結果為CSL促進酵母發酵能力的提高機理提供了基礎數據。
[1]Klis FM,Boorsma A,De Groot PWJ. Cell wall construction in Saccharomyces cerevisiae[J]. Yeast,2006,23(3):185-202.
[2]錢潘攀,李紅波,趙巖巖,等. 雙效型酵母細胞壁提取物及其對黃曲霉毒素B1吸附特性研究[J]. 食品工業科技,2017,(15):1-12.
[3]Mokhtari S,Jafari SM,Khomeiri M,et al. The cell wall compound of Saccharomyces cerevisiae as a novel wall material for encapsulation of probiotics[J]. Food Research International,2017,96:19-26.
[4]Sultana A,Miyamoto A,Hy QL,et al. Microencapsulation of flavors by spray drying usingSaccharomycescerevisiae[J]. Journal of Food Engineering,2017,199:36-41.
[5]楊婷,祝霞,李潁,等. 葡萄酒泥酵母β-葡聚糖提取工藝條件優化[J]. 食品工業科技,2015,36(18):286-289,309.
[6]王輝田,孫超,陳思,等. 酵母細胞壁多糖對肉仔雞生長性能及免疫力的影響[J]. 中國飼料,2013(13):11-14.
[7]Klis FM,Mol P,Hellingwerf K,et al. Dynamics of cell wall structure inSaccharomycescerevisiae[J]. FEMS Microbiology Reviews,2002,26(3):239-256.
[8]Tong C,Li W,Kong L,et al. A novel yeast-binding lectin from hemolymphCyclinasinensis(Gmelin)and its effects on yeast cells[J]. Process Biochemistry,2012,47(12):2166-2171.
[9]Liu S,Li L,Tong C,et al. Quantitative proteomic analysis of the effects of a GalNAc/Man-specific lectin CSL on yeast cells by label-free LC-MS[J]. International Journal of Biological Macromolecules,2016,85:530-538.
[10]Valentina M,Irina C,Li W,et al. New GlcNAc/GalNAc-specific lectin from the ascidian Didemnum ternatanum[J]. Biochimica et Biophysica Acta General Subjects,2005,1723(1-3):82-90.
[11]Morris GJ,Winters L,Coulson GE,et al. Effect of osmotic stress on the ultrastructure and viability of the yeastSaccharomycescerevisiae[J]. Journal of General Microbiology,1986,132(7):2023-2034.
[12]胡國武,李景川,元英進. 稀土對紅豆杉細胞內游離鈣含量的影響[J]. 天津大學學報,2000,33(1):17-20.
[13]佟長青. 兩種海洋雙殼貝類凝集素及其抑菌機制的研究[D]. 哈爾濱:東北林業大學,2013.
[14]佟長青,李琦,曲敏,等. 菲律賓蛤仔凝集素抑菌機制的研究[J]. 大連海洋大學學報,2014,29(5):508-513.
[15]趙運英,蔣伶活. 釀酒酵母細胞中鈣離子信號傳導途徑的研究進展[J]. 中國細胞生物學學報,2013,35(10):1504-1513.

