Thermus thermophilus分支酶的重組表達及其在抗性糊精制備中的應用
, ,, ,, ,,*
(1.江南大學食品科學與技術國家重點實驗室,江蘇無錫 214122; 2.江南大學生物工程學院,江蘇無錫 214122)
分支酶(Branching Enzyme,簡稱BE,EC 2.4.1.18),屬于糖苷水解酶家族GH13[1]。它的主要作用一方面催化供體線性α-1,4葡聚糖鏈的降解(直鏈淀粉和支鏈淀粉),另一方面又可以通過α-1,6糖苷鍵將降解分子片段連接到受體上,形成更多的支鏈,從而改變淀粉的支化程度,該酶可以廣泛應用于修飾淀粉,催化α-1,6糖苷鍵的生成,因此目前工業中主要用于制備高支化淀粉,在食品和醫藥行業用途廣泛[2-4]。
抗性糊精又稱難消化糊精,它是以淀粉為原料加工制成,擁有抗人體消化酶作用成分,具有持水性高,飽腹感強,在消化道內不易被吸收等重要作用,還可促進腸道蠕動和益生菌增殖[5]。此外,抗性糊精產品具有水溶性好、溶速快、無色無味等特性,在改善食品口感、優化食品加工性能等方面獨具優勢,因此在飲料、烘焙、乳制品等行業具有廣泛的應用[6]。抗性糊精的研究最早起源于日本,我國在20世紀九十年代才開始對抗性糊精進行研究,1995年林勤保等以淀粉為原料制備焦糊精,并將焦糊精用α-淀粉酶處理后再用葡萄糖淀粉酶處理制備抗性糊精[7]。2006年,廣東省食品研究所申請了一種抗性麥芽糊精的制備工藝的專利,它先對焦糊精用α-淀粉酶水解,然后用普魯蘭酶處理,后進行脫色離子交換和噴霧干燥得到抗性麥芽糊精[8]。
分支酶能夠進一步利用焦糊精里的α-1,4糖苷鍵,合成人體抗消化成分的α-1,6糖苷鍵,提高焦糊精中抗性成分的含量。目前國內外尚無利用分支酶來制備抗性糊精的相關報道。由于天然菌株的產酶能力較低,為了克服天然菌株的低生產能力,將其基因進行過量表達以提高產量是降低生產成本的有效途徑之一[2]。本文通過構建基因工程菌,將來源于Thermusthermophilus的淀粉分支酶(TtSBE)在大腸桿菌中過量表達,并研究此酶的酶學性質及其在抗性糊精制備過程中的應用。
1 材料與方法
1.1 材料與儀器
大腸桿菌E.coliBL21(DE3)、E.coliJM109、表達載體pET-24a(+) 本實驗室保藏;pMD18-T-simple載體、T4 DNA連接酶、堿性磷酸酶CIAP、DNA聚合酶PrimeSTAR?HS、限制性內切酶(NdeI、HindⅢ) 大連寶生物公司;瓊脂糖凝膠DNA回收試劑盒、PCR純化試劑盒、質粒小提試劑盒 北京天根生化科技有限公司;PCR引物 上海生工生物工程有限公司;異丙基-β-D-硫代半乳糖苷(Isopropylβ-D-1-Thiogalactopyranoside,IPTG)、氨芐青霉素(Ampicillin,Amp)、卡那霉素(Kanamycin,Kan) 上海捷瑞有限公司;蛋白質凝膠電泳試劑盒 碧云天生物技術(南通)有限公司;焦糊精 山東百龍創園生物科技有限公司;直鏈淀粉 美國Sigma公司;分子級酵母粉和蛋白胨 Oxoid公司;其它常規試劑 國藥集團化學試劑有限公司。
細胞超聲波破碎儀 寧波新芝生物科技股份有限公司;Unic 7200可見分光光度計 尤尼科(上海)有限公司;蛋白電泳儀、UVP凝膠成像系統 美國Bio-Rad公司;pH計 瑞士Mettler-Toledo公司;恒溫調速回轉式搖床 上海精密儀器儀表有限公司;恒溫水浴搖床 太倉市華利達實驗設備有公司;PTC-200型基因擴增儀 美國MJ Research公司;Eppendorf高速離心機 德國Eppendorf公司;DYY-6C型核酸電泳儀 北京六一電泳儀廠。
1.2 實驗方法
1.2.1 聚合酶鏈(PCR)反應體外擴增目的基因 以Thermusthermophilus的基因組為模板,分別設計正、反向引物,PCR擴增TtSBE基因。
正向引物含有NdeI酶切位:5′-CATATGATG GCGCGCTTCGCCCTG-3′,
反向引物含有HindIII酶切位:5′-AAGCTT TCACGCCTCCCGGAAAAGG-3′
PCR反應的體系:5×PS Buffer 10 μL,dd H2O 34 μL,dNTP Mix 4 μL,模板1 μL,正、反向引物各0.5 μL,PrimeSTAR? HS DNA Polymerase 0.5 μL。
PCR反應條件:DNA模板經過94 ℃預變性4 min之后,然后開始進入35個循環:先98 ℃變性10 s形成單鏈,然后在55 ℃下退火10 s使得引物分別與其同源序列相結合,之后72 ℃在PrimeSTAR? HS DNA聚合酶的作用下延伸2 min形成雙鏈,72 ℃再延伸10 min,最后4 ℃保存。
1.2.2 基因工程菌的構建 將PCR產物與pMD18-T simple載體相連接,將連接產物轉化大腸桿菌JM109,37 ℃培養3 h左右后涂布含有100 mg/L氨芐青霉素的LB平板。經37 ℃培養過夜,挑選菌落,接入LB液體培養基,8~10 h后提取質粒[9],命名為TtSBE/pMD18-T simple,采用質粒小提試劑盒來提取質粒DNA,具體參照操作按照試劑盒說明書,并稍作修改。
將該質粒與表達載體pET-24a(+)經雙酶切后用T4連接酶連接,得到重組表達質粒,連接產物轉化E.coliJM109感受態細胞,經37 ℃培養8 h,挑轉化子在含有100 mg/L卡那青霉素的LB中振蕩培養8~10 h[10],挑取基因工程菌到含有卡那青霉素的TB培養基中培養3 h后加入IPTG終濃度為0.2 mmol/L,誘導48 h后收集菌體[11]。
1.2.3 酶活測定 配制50 mmol/L,pH6.5的磷酸緩沖液(Na2HPO4.12H2O和NaH2PO4·2H2O)。
魯戈碘液(母液):0.26 g碘與2.6 g碘化鉀溶于10 mL的容量瓶中(提前3 d配制,確保碘完全溶解),避光室溫保存(6個月)[12]。
終止反應液:0.1 mL的魯戈碘液+50 μL的2 mol/L鹽酸溶液,定容到26 mL(現配現用)[12]。
底物:0.01 g直鏈淀粉(0.1 g支鏈淀粉)+0.2 mL 96%乙醇。3~4 min后加入0.5 mL,2 mol/L的NaOH溶液,加入10 mL的水,攪拌10 min溶解淀粉,再加入0.5 mL,2 mol/L的HCl溶液,加入pH6.5的緩沖液定容到10 mL調節pH。(現配現用)
50 μL的酶液+50 μL的底物,在60 ℃下水浴30 min,在加入2 mL的終止反應液,室溫放置20 min后660 nm處測吸光值。
酶活定義:常溫下在660 nm處,吸光值每分鐘降低1%為一個酶活單位。
1.2.4 TtSBE的分離純化 采用AKTA avant蛋白純化系統,具體步驟為:將發酵液裝入離心杯中配平,于4 ℃、12000 r/min條件下離心20 min收集菌體,用20 mmol/L pH6.5 Na2HPO4·12H2O-NaH2PO4·2H2O緩沖液懸浮菌體,在輸出功率為325 W,總工作時間為20 min,工作/間歇時間為2 s/3 s,超聲破碎后12000 r/min離心15 min,破壁上清即為TtSBE粗酶液。然后在60 ℃下熱處理0.5 h左右,采用60%的(NH4)2SO4鹽析,鹽析過夜,12000 r/min離心收集沉淀。然后將沉淀用pH6.5的緩沖液懸浮均勻,在pH7.5,20 mmol/L Na2HPO4·12H2O-NaH2PO4·2H2O緩沖液中,用透析袋4 ℃透析過夜,經過無機膜過濾后制成上樣樣品[13]。最后,用monoQ陰離子交換色譜柱進行純化(A液:20 mmol/L pH7.5 Na2HPO4·12H2O-NaH2PO4·2H2O緩沖液;B液:20 mmol/L pH7.5 Na2HPO4·12H2O-NaH2PO4·2H2O緩沖液+1 mol/L NaCl),280 nm紫外在線監測,分步收集含TtSBE的洗脫液。測定酶活并進行蛋白電泳檢測。
1.2.5 TtSBE的酶學性質研究
1.2.5.1 TtSBE的最適溫度和熱穩定性分析 以直鏈淀粉為底物,分別在30、40、50、60、70、80 ℃下測定活力,按照1.2.3酶活測定方法計算TtSBE的酶活,定義最高酶活力為100%,并計算各個溫度下的相對酶活,以此確定TtSBE的最適溫度,為了研究TtSBE的熱穩定性,將重組酶在60 ℃下保溫,定期取樣測定重組酶的殘留酶活(定義初始酶活力為100%)。

表1 重組TtSBE的純化過程參數Table 1 Purification process parameters of recombinant TtSBE
1.2.5.2 TtSBE的最適pH 用Na2HPO4·12H2O和NaH2PO4·2H2O配制不同pH的磷酸鈉緩沖液,按照1.2.3酶活測定方法計算TtSBE分別在pH為5.5、6、6.5、7.0、7.5下的酶活,定義最高酶活力為100%,并計算各個pH下的相對酶活,來確定TtSBE的最適pH[1]。
1.2.6 TtSBE在抗性糊精制備中的應用
1.2.6.1 抗性糊精的檢測方法 抗性糊精的純度測定參照國標GB/T22224-2008《食品中膳食纖維的測定-酶重量法》。
抗性糊精的得率(%)=干燥后物質重量/反應前焦糊精重量×100[11,14]。
1.2.6.2 TtSBE在不同溫度下對生成抗性糊精的影響 以2%的焦糊精為底物,溶于50 mmol,pH6.5的磷酸鈉緩沖液,加入TtSBE酶液,加酶量為最適加酶量,依次在40、50、60、70、80 ℃下酶催化反應,然后沸水浴滅酶10 min,用1.2.6.1方法測定抗性糊精的得率。
1.2.6.3 TtSBE在不同pH下對生成抗性糊精的影響 以2%的焦糊精為底物,溶于50 mmol,pH依次為5、5.5、6、6.5、7.0、7.5的磷酸鈉緩沖液中,加入TtSBE酶液,在最適酶轉化溫度下反應,然后沸水浴滅酶10 min,用1.2.6.1方法測定抗性糊精的得率。
1.2.6.4 TtSBE不同加酶量對生成抗性糊精的影響 以2%的焦糊精為底物,溶于50 mmol,pH6.5的磷酸鈉緩沖液,混合均勻后加入TtSBE酶液,加酶量依次為1000、2000、3000、4000、5000 U/g(焦糊精),進行酶催化反應,然后沸水浴滅酶10 min,用1.2.6.1方法測定抗性糊精的得率。
1.2.6.5 TtSBE在不同反應時間對生成抗性糊精的影響 以2%的焦糊精為底物,溶于50 mmol,pH6.5的磷酸鈉緩沖液,加入TtSBE酶液,加酶量為最適加酶量,在最適酶轉化溫度下催化時間依次為0、4、8、12、16 h,然后沸水浴滅酶10 min,用1.2.6.1方法測定抗性糊精的得率。
2 結果與討論
2.1 TtSBE的克隆表達
將Thermusthermophilus來源的淀粉分支酶基因克隆表達于E.coli中,搖瓶發酵培養后收集菌體,破壁離心取上清后測得TtSBE酶活為700 U/mL。然后將破壁上清液進行SDS-PAGE分析,重組TtSBE的分子量大小為59.2 kDa,如圖1所示,表明重組TtSBE在大腸桿菌中成功表達。
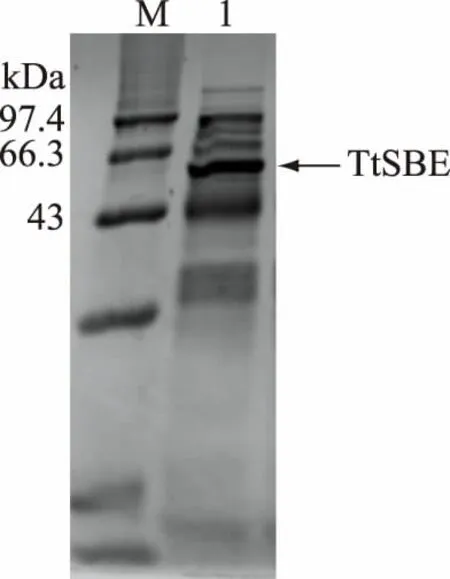
圖1 重組TtSBE破壁上清SDS-PAGE圖Fig.1 Intracellular soluble fraction SDS-PAGE of recombinant TtSBE注:M.標準蛋白樣品;1.重組酶TtSBE。
2.2 重組TtSBE的分離純化
經過60%(NH4)2SO4沉淀、monoQ陰離子交換色譜柱等步驟純化后重組TtSBE的比活由88.50 U/mg提高到773.27 U/mg(表1),純化后的重組TtSBE在SDS-PAGE電泳圖(圖2)中呈現單一條帶,表明得到電泳純的重組TtSBE。
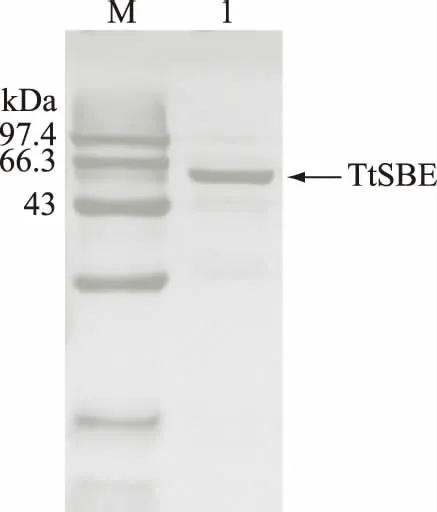
圖2 重組TtSBE的SDS-PAGE蛋白電泳圖Fig.2 SDS-PAGE of purified recombinant TtSBE注:M.標準蛋白樣品;1.純化重組酶TtSBE。
2.3 TtSBE酶學性質研究
2.3.1 重組TtSBE的最適溫度及溫度穩定性 酶受溫度的影響較大,溫度會對酶的結構產生影響,從而影響酶促反應的催化速率。為了研究重組TtSBE的最適溫度和熱穩定性,在不同溫度下測定重組TtSBE的酶活力,結果如圖3所示,發現溫度在60 ℃時,酶活達到最大,高于或低于60 ℃,酶活都有所下降,說明TtSBE的最適溫度為60 ℃;并在60 ℃進行熱穩定分析,發現該酶在60 ℃條件下半衰期接近40 h(圖4),60 ℃的熱穩定性較好。
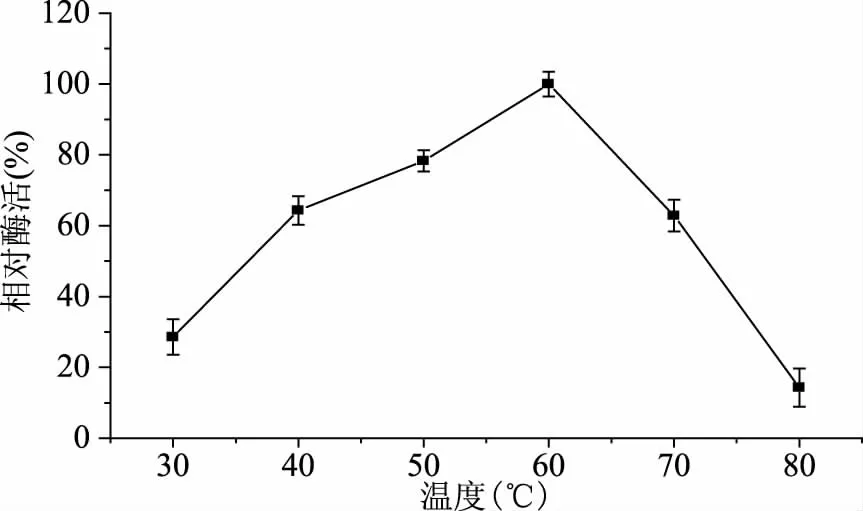
圖3 重組TtSBE的最適溫度Fig.3 The optimum temperature for recombinant TtSBE
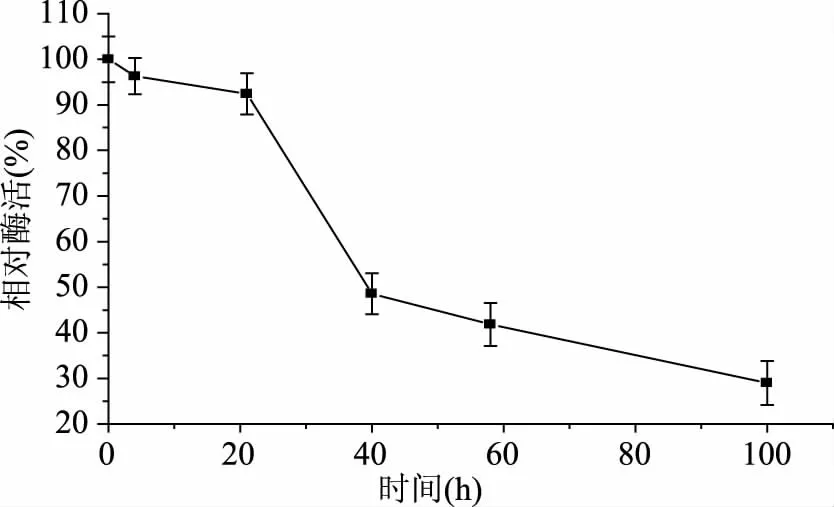
圖4 TtSBE在60 ℃的熱穩定性Fig.4 The temperature stability of recombinant TtSBE at 60 ℃
2.3.2 重組TtSBE的最適pH 酶的活性容易受到環境pH的影響,過酸或過堿都能使酶發生不可逆轉的失活(極端耐酸耐堿酶除外)[15],因此研究重組TtSBE的最適pH至關重要。測定重組TtSBE在不同pH緩沖液下的最適pH的酶活力,結果如圖5所示,重組TtSBE最適pH為6.5,且pH在6.0和7.0時,重組TtSBE的酶活均達到80%以上。
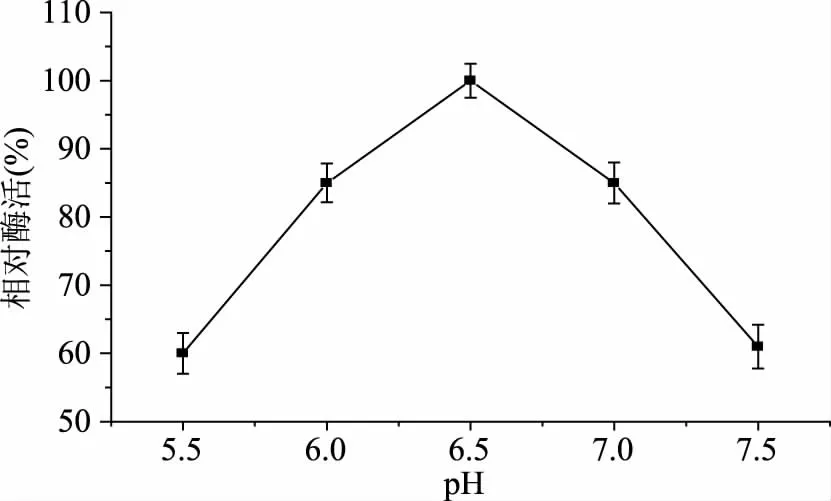
圖5 重組TtSBE最適pHFig.5 The optimum pH for recombinant TtSBE
2.4 重組TtSBE在抗性糊精制備中的應用
2.4.1 不同溫度對TtSBE生成抗性糊精的影響 酶催化反應速率存在最適反應溫度,高于或低于最適酶催化反應溫度,都會影響酶轉化效率[8]。結果發現,當TtSBE催化溫度為60 ℃時,生成抗性糊精的得率達到最大(圖6),為50.5%,比焦糊精中抗性成分提高了7%,而低于或者高于60 ℃時,抗性糊精得率都有所減少,因此選擇在60 ℃制備抗性糊精。
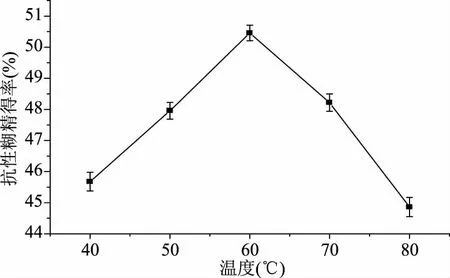
圖6 不同溫度對TtSBE生成抗性糊精的影響Fig.6 The influence of different temperature on TtSBE synthesis resistance dextrin
2.4.2 不同pH對TtSBE生成抗性糊精的影響 為了研究TtSBE酶轉化制備抗性糊精的最適pH,分別在不同pH下進行酶轉化,結果如圖7所示,重組TtSBE制備抗性糊精的最適pH為6.5,低于或者高于6.5時,抗性糊精得率都有所降低,因此選擇pH6.5為最佳酶轉化的初始pH。
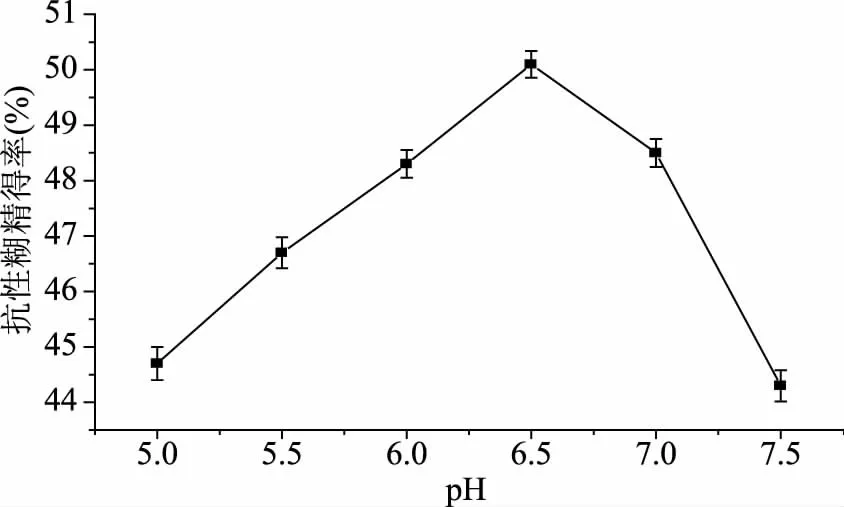
圖7 不同pH對TtSBE生成抗性糊精的影響Fig.7 The influence of different pH for TtSBE synthesis resistance dextrin
2.4.3 不同TtSBE加酶量對生成抗性糊精的影響 底物濃度一定時,隨著加酶量的增大,酶催化反應效率也會隨之增加,當加酶量達到某一數值時,繼續增大加酶量,催化效率不再增加,會保持在某一數值,此時催化效率達到最大值。探究加酶量對生成抗性糊精得率的影響,結果發現,當加入3000 U/g(焦糊精)的TtSBE時,抗性糊精得率達到最大值為49.5%(圖8),較焦糊精中抗性成分提高了5.5%,之后繼續增大加酶量,抗性糊精得率并沒有增加。
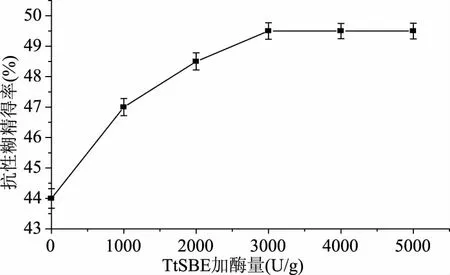
圖8 不同TtSBE加酶量對生成抗性糊精的影響Fig.8 Effects of different amounts of enzyme for TtSBE synthesis resistant dextrins
2.4.4 不同反應時間對TtSBE生成抗性糊精的影響 反應時間會影響抗性糊精的產率,隨著反應時間的延長,產率不斷提高,當達到平衡時,產率趨于穩定。為了研究在不同反應時間內TtSBE利用焦糊精生成抗性糊精的變化,分別在不同時間內檢測抗性糊精,結果發現,當反應時間為12 h時,抗性糊精得率達到最大(圖9),當繼續延長反應時間時,抗性糊精得率沒有變化,因此,選擇酶轉化反應時間為12 h來制備抗性糊精。
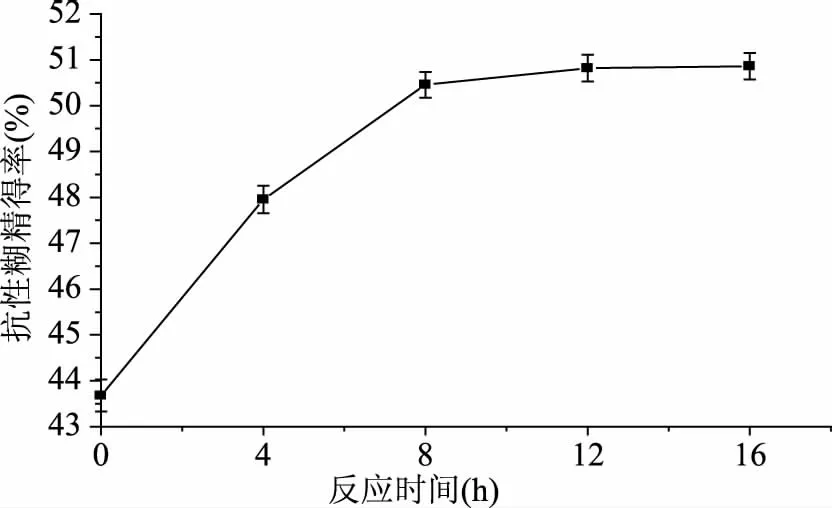
圖9 不同反應時間TtSBE對生成抗性糊精的影響Fig.9 The influence of different reaction time on TtSBE synthesis resistant dextrin
3 結論
本文通過構建基因工程菌將分支酶異源表達于大腸桿菌,發酵得到重組TtSBE的酶活達700 U/mL;在此基礎上對重組TtSBE進行了酶學性質研究,確定了TtSBE的最適pH為6.5,最適溫度為60 ℃,在60 ℃時的半衰期為40 h左右;并研究了分支酶制備抗性糊精的催化反應條件,發現當溫度為60 ℃,pH為6.5,反應時間為12 h,加酶量為3000 U/g(焦糊精)時,抗性糊精得率達到最大,為50%左右,比焦糊精原料提高約7%。該研究為利用分支酶制備抗性糊精提供了方法借鑒,具有潛在的工業化生產價值。
[1]Palomo M,Pijning T,Booiman T,et al. Thermus thermophilus glycoside hydrolase family 57 branching enzyme:crystal structure,mechanism of action,and products formed[J]. Journal of Biological Chemistry,2011,286(5):3520.
[2]Maarel,MjecvdLeemhuis H. Starch modification with microbial alpha-glucanotransferase enzymes[J]. Carbohydrate Polymers,2013,93(1):116.
[3]Dijkhuizen L. Properties of the glucan branching enzyme of the hyperthermophilic bacterium[J]. Biocatalysis and Biotransformation,2003,21(4-5):199-207.
[4]鮑春輝,顧正彪,李才明,等. 重組大腸桿菌產淀粉分支酶的發酵條件探索[J]. 食品工業科技,2014,35(15):155-162.
[5]Sonnenburg ED,Smitssa,Tikhonov M,et al. Diet-induced extinction in the gut microbiota compounds over generations[J]. Nature,2016,529(7585):212.
[6]Requena M,Gonzlezcna,Barragnlap,et al. Functional and physico-chemical properties of six desert-sources of dietary fiber[J]. Food Bioscience,2016,1(16):26-31.
[7]林勤保,楊連生. 以淀粉為原料制造難消化糊精[J]. 食品與發酵工業,1995,5(10):49-51.
[8]陳磊. 功能淀粉糊精的制備及其應用研究[D]. 廣州:華南理工大學,2014.
[9]張悅,宿玲恰,吳敬. 重組大腸桿菌生產海藻糖合酶發酵工藝優化[J]. 食品與生物技術學報,2016,35(9):913-919.
[10]姜歡. 4-α-葡萄糖基轉移酶、分支酶對淀粉的改性作用研究[D]. 無錫:江南大學,2014.
[11]Luebke W. branching glucosyltransferase from rhodothermus obamensis expressed in bacillus subtilis[J]. Perflavory,2009,93(1):115.
[12]段緒果. 淀粉脫支酶的重組表達及分子改造[D]. 無錫:江南大學,2013.
[13]汪紅,祁玉峰,魏紅. 酶重量法測定食品中膳食纖維含量方法的改進[J]. 食品工業科技,2007,28(9):203-205.
[14]楊玉路,王蕾,陳晟,等. 重組β-環糊精葡萄糖基轉移酶生產β-環糊精的工藝條件優化[J]. 生物技術通報,2014,12(8):175-181.

