纈沙坦抑制高糖環境下足細胞損傷的機制探究
朱伶俐+葉迅

[摘要] 目的 通過觀察纈沙坦對高糖環境下足細胞EMT過程中ILK、MMP9、NEPH1 mRNA表達的影響,探討纈沙坦保護受高糖損傷足細胞的可能機制。 方法 將培養分化成熟的足細胞隨機分為5 mmol/L 葡萄糖培養組(對照組)和25 mmol/L 葡萄糖培養組(高糖組),在25 mmol/L葡萄糖培養液中分別加入2×10-7 mol/L (低Val組)、2×10-6 mol/L (中Val組)和2×10-5 mol/L(高Val組)纈沙坦。體外培養48 h后,倒置顯微鏡觀察細胞形態,并采用PCR半定量分析技術檢測ILK、MMP9、NEPH1的表達。 結果 高糖組細胞NEPH1的表達較對照組顯著減少(P<0.01)。而各劑量纈沙坦干預組NEPH1的表達與高糖組相比均顯著升高。與對照組比較,高糖組足細胞ILK和MMP9的表達顯著升高,而各劑量纈沙坦干預組足細胞ILK和MMP9的表達對比高糖組均明顯減少(P<0.01),其中以高Val組的干預作用最顯著(P<0.01),高Val組ILK和MMP9的表達與對照組無明顯差異(P>0.05)。 結論 纈沙坦可能通過抑制ILK通路保護高糖環境下受損的足細胞。
[關鍵詞] 纈沙坦;足細胞;高糖;上皮-間充質轉分化
[中圖分類號] R587.2;R692 [文獻標識碼] B [文章編號] 1673-9701(2017)33-0035-05
[Abstract] Objective To observe the effect of valsartan on ILK, MMP9 and NEPH1 mRNA expression during the EMT process of podocytes under high glucose environment, and to explore the possible mechanism of valsartan in protecting the podocytes from high glucose. Methods The differentiated mature podocytes were randomly divided into 5 mmol/L glucose culture group (control group) and 25 mmol/L glucose culture group (high glucose group). 2×10-7 mol/L valsartan (low Val group), 2×10-6 mol/L valsartan (medium Val group) and 2×10-5 mol/L (high Val group) valsartan were added to 25 mmol/L glucose culture medium. After 48 hours of in vitro culture, the cell morphology was observed by inverted microscope, and the expression of ILK, MMP9 and NEPH1 were detected by PCR semi-quantitative analysis. Results The expression of NEPH1 in high glucose group was significantly lower than that in control group(P<0.01). The expression of NEPH1 in each dose of valsartan intervention group was significantly higher than that in high glucose group. Compared with the control group, the expression of ILK and MMP9 of podocytes in the high glucose group was significantly increased, and the expression of ILK and MMP9 of podocytes in each dose of valsartan intervention group was significantly lower than that in high glucose group(P<0.01). The intervention effect in high Val group was the most significant(P<0.01). The expression of ILK and MMP9 in high Val group was not significantly different from that in control group(P>0.05). Conclusion Valsartan may protect the podocytes from the high glucose environment by inhibiting the ILK pathway.
[Key words] Valsartan; Podocytes; High glucose; Epithelial-mesenchymal transdifferentiation
糖尿病腎病(diabetic nephropathy,DN)是糖尿病主要并發癥之一,屬于微血管病變的一種,以蛋白尿為主要表現。蛋白尿的形成,其組織學基礎可歸納為足細胞足突融合、脫落,致使腎小球濾過屏障受損。足細胞通過已分化上皮細胞向間充質細胞轉分化(epithelial-mesenchymal transition,EMT),失去nephrin、P-cadherin和NEPH1-3等上皮細胞特征性蛋白的表達,而上調間充質細胞樣表型標志蛋白如整合素連接激酶(ILK)、成纖維細胞特殊蛋白l(fibroblast-specific protein l,FSP-1)和基質金屬蛋白酶9(MMP-9)等的表達,是損傷腎小球濾過屏障的關鍵因素[1]。足細胞的EMT過程存在并影響著DN的進程[2]。研究[3]證實,當足細胞的EMT過程被抑制,足細胞其正常的上皮細胞表型能得以恢復,蛋白尿也隨之減少。如何逆轉該過程,是目前眾多學者的研究熱點。endprint
2016版《糖尿病腎病防治專家共識》中,推薦ACEI/ARB作為DN控制血壓的藥物應用,在肯定其降壓效果的同時,鑒于臨床文獻的缺乏,對其降低尿微量白蛋白的作用不置可否。纈沙坦作為ARB類代表性的藥物,在DN的治療中應用多年,其降低尿微量白蛋白的療效有目共睹。除降壓效果之外,纈沙坦是否能有效減少DN蛋白尿的形成、減慢腎小球濾過率的下降, 延緩DN的進展,從而保護腎臟功能,這值得我們進一步探討。
本文通過觀察ILK、MMP9、NEPH1在不同濃度纈沙坦干預高糖環境下足細胞中的表達變化,探討纈沙坦除降壓之外,治療DN的可能作用機制。
1 材料與方法
1.1材料來源
1.1.1 細胞與試劑 小鼠的腎小球足細胞由英國倫敦大學國王學院Guy' s 醫院贈送,纈沙坦原粉由諾華生物制藥有限公司提供;10%胎牛血清購自杭州四季青公司,RPMI 1640培養液購自美國Gibco公司,γ-干擾素購自美國 PEPRO Tech公司;SDS-PAGE凝膠試劑盒購自北京普利萊基因技術有限公司,RT-PCR試劑盒購自日本TaKaRa公司,Trizol提取試劑盒來自美國Invitrogen公司。引物合成PRIMER5.0引物軟件設計,由上海生物工程公司合成。
1.1.2 儀器 ABI7900 實時定量熒光 PCR 儀器(美國 ABI 公司);X70光學顯微鏡(日本Olympus公司);PowerPac Basic WB電泳儀(美國BIO-RAD公司產品),GEL DOC凝膠成像系統。
1.2方法
1.2.1 細胞培養 常規操作復蘇小鼠腎小球足細胞,加入含有5 mL 10% FCS1640培養液的25 cm2培養瓶中培養,每培養瓶中含有γ-干擾素500 U,培養箱孵育條件為33℃、5%CO2,細胞增殖后進行傳代,細胞傳代用0.25%胰蛋白酶-0.02%EDTA消化細胞,傳代至所需細胞數后,轉移入含有5 mL 10%FCS1640培養液的25 cm2培養瓶中培養,每瓶不加干擾素,培養箱孵育條件變為37℃、5%CO2,培養至細胞形態呈“樹枝狀”,即足細胞分化成熟。
1.2.2 實驗分組 取50 mL細胞培養瓶接種已分化成熟的足細胞,通過RandA 1.0軟件完全隨機分組法,將足細胞分為5 組,每組5 瓶,A組(對照組D-葡萄糖5 mmol/L)、B組(高糖組,D-葡萄糖25 mmol/L)、C組(低Val組,25 mmol/L D-葡萄糖+纈沙坦 2×10-7 mol/L)、D組(中Val組,25 mmol/L D-葡萄糖+纈沙坦 2×10-6 mol/L)和E組(高Val組,25 mmol/L D-葡萄糖+纈沙坦 2×10-5 mol/L)。在37℃、5%CO2的培養箱孵育48 h后,在倒置顯微鏡下觀察足細胞形態變化,并以RT -PCR 半定量法檢測各組足細胞相關蛋白的表達。
1.2.3 RT-PCR半定量法檢測相關蛋白RNA表達 先采用 Trizol 試劑和氯仿按照常規方法抽提腎小球足細胞總 RNA ,測定每個 RNA 樣品的濃度(單位為μg/mL)后,在逆轉錄酶M -MuLV 催化下合成 cDNA;在PCR儀上按照特定擴增條件進行 PCR擴增 反應。
25 μL反應體系配比:dNTP 0.5 μL ,10 ×buffer 2.5 μL,引物正反義鏈各10 pmol, TaqDNA 聚合酶1.5 u,cDNA 1 μL,加DEPH水至終體積25 μL。陰性對照即不加入cDNA。聚合酶鏈反應( PCR) 引物正反義鏈序列見表 1。
1.2.4 擴增反應條件 在94℃ 2 min進行預變性后,根據不同RNA產物采取預實驗中取定的退火溫度及循環數。見表2。
1.2.5 電泳及凝膠半定量分析 制取1.7%瓊脂糖凝膠(含0.5 μg/mL溴化乙錠),將各PCR產物與DNA Marker(購自上海生物工程公司)置入凝膠標本孔中,在0.5%TBE液中在100 V/cm下電泳 30 min,通過BIO-RAD凝膠成像分析系統分析成像,再以Quantity-one進行光密度值測定,將NEPH1、ILK、MMP9的條帶光密度值與內參GAPDH的條帶的光密度值進行比較,該光密度比值即代表各相關蛋白的mRNA表達的相對值,提示該種蛋白mRNA的表達情況。
1.3 統計學方法
利用SPSS 17.0統計軟件對實驗數據進行分析。計量資料以(x±s)表示,進行單因素方差分析(ANOVA),兩兩比較在方差齊時采用LSD檢驗,方差不齊時采用Tamhane檢驗。P<0.01為差異有統計學意義。
2 結果
2.1 小鼠足細胞的形態學改變
倒置顯微鏡下觀察,可見A組足細胞分布均勻,基本鋪滿視野,細胞形態多為“分支狀”,分化良好,細胞之間以“樹枝狀”足突相連,高糖刺激48 h后,足細胞部分凋亡,細胞數量減少,細胞形態發生變化,足突短少,部分呈橢圓形;C組即低劑量Val干預后,可見足細胞數量尚可,部分凋亡,足細胞足突較對照組短少;D組部分細胞聚集,貼壁一般,足細胞數量、形態尚可,足突粗短;E組足細胞數量與A組相似,未見明顯凋亡,形態也呈“分支狀”,足突細長。
由圖1可見,對照組(A組)的腎小球足細胞生長情況良好,形態分化成熟,具有基本的形態特征,呈“樹枝狀”;高糖組(B組)足細胞部分凋亡,且喪失基本的形態特征,足突短少。而Val干預后,各組(C組、D組、E組)細胞的細胞數量均有所恢復,形態上更接近對照組(A組)足細胞的特征形態,其中高劑量的Val干預后(E組)的數量、形態變化最明顯。
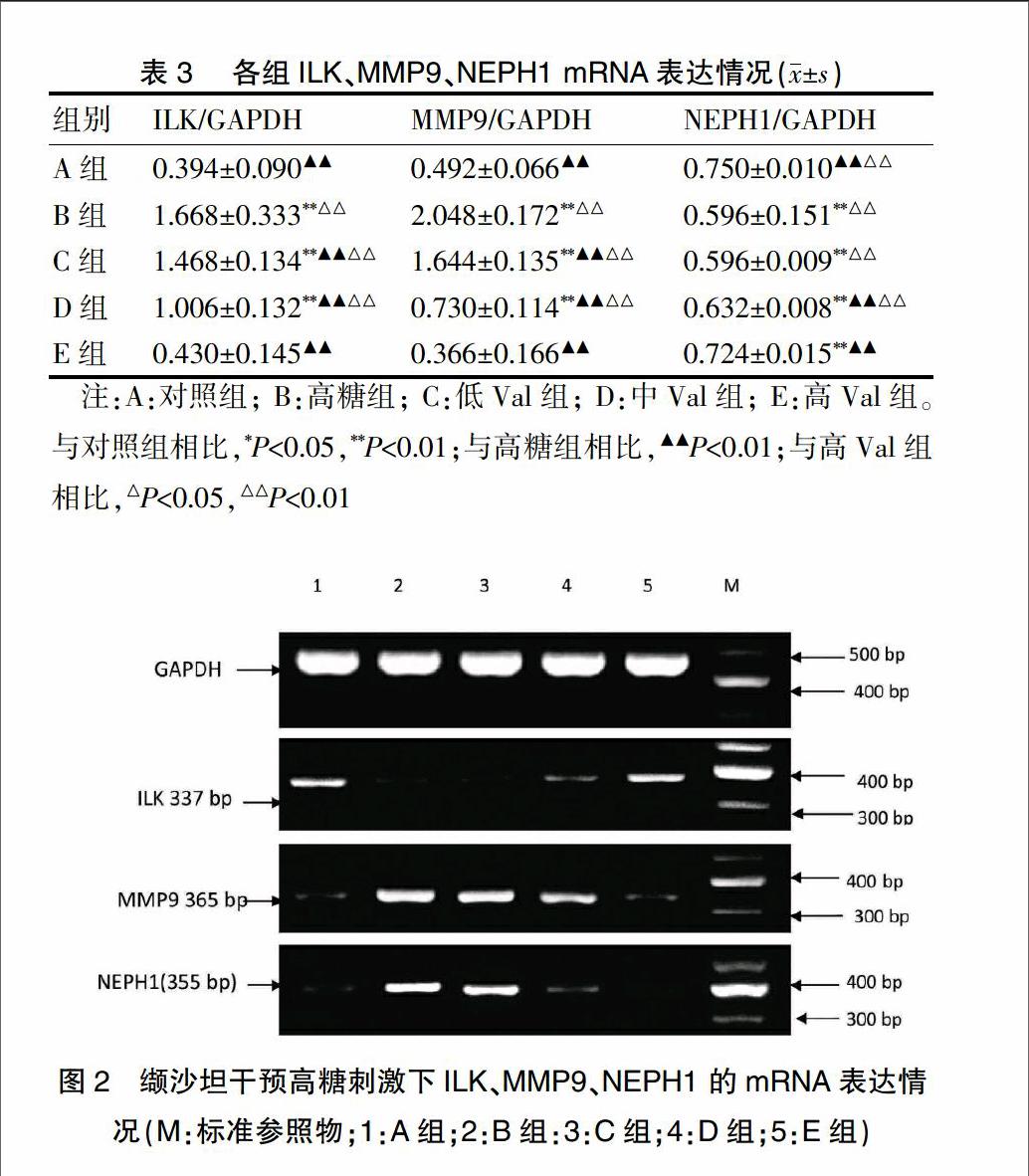
2.2 腎小球足細胞ILK、MMP9、NEPH1 mRNA 的表達情況
相較于對照組,高糖組的ILK和MMP9 mRNA的表達均顯著升高(P<0.01),而NEPH1 mRNA的表達顯著下降(P<0.01)。使用不同劑量Val干預的高糖環境刺激下的足細胞(C組、D組、E組),ILK和MMP9 mRNA的表達均較高糖組相比有不同程度下降,差異具有顯著性(P<0.01),而NEPH1 mRNA的表達卻顯著升高(P<0.01),其中高Val組干預作用最顯著,差異具有統計學意義(P<0.01)。而高Val組的ILK、MMP9 mRNA的表達與對照組相比,差異無統計學意義(P>0.05)。見表3、圖2、3。endprint
3 討論
足細胞損傷是糖尿病腎病的結構學基礎,而足細胞EMT則是足細胞損傷的重要機制之一。因而逆轉足細胞EMT過程,是治療糖尿病腎病,減少尿蛋白排泄的重要途徑。目前認為,誘導足細胞EMT的信號通路涉及TGF - β 信號通路、Wnt 信號通路、Hedgehog 信號通路、Notch 信號通路、ILK 信號通路、uPAR 信號通路等[4-9]。各類信號通路交互運作,共同維持間質細胞表型。目前關于足細胞損傷修復的研究,基本基于這些理論,探討通過抑制或刺激相關信號通路中的某一種蛋白的表達,以期逆轉足細胞EMT,恢復足細胞表型特征。
纈沙坦在糖尿病腎病的防治中占有重要地位。2016年美國ADA制定糖尿病診療標準中,建議糖尿病腎病患者在積極控制血壓、血糖,優化飲食結構的基礎上,在尿白蛋白/肌酐比值(≥30 mg/g)及估算腎小球濾過率異常的情況下,適當采用ACEI/ARB等藥物控制蛋白尿。
馬麗[10]證實大劑量纈沙坦確實能夠明顯減少糖尿病腎病患者尿蛋白的排泄量,推測可能與纈沙坦抑制血管緊張素Ⅱ(AngⅡ)手套水平、提高胰島素水平、降低血壓有關。另有學者[11]通過與氨氯地平的對照實驗證實,纈沙坦對糖尿病腎病確有獨立于降壓之外的療效,其機制可能與其在AngⅡ受體水平全面阻斷的效應有關。另有研究表明[12],纈沙坦能夠通過調控 NADPH 氧化酶表達,來干預高糖刺激后氧化應激水平,從而使細胞外基質發生變化,進而保護足細胞的功能,并減少蛋白尿的產生。高峰等[13]發現纈沙坦具有抑制Notch通路,減少足細胞丟失,降低尿蛋白排泄水平,延緩腎小球硬化的作用。魏靜等[14]證實,纈沙坦通過減緩內質網應激并可能通過抑制內質網特有的caspasel2凋亡途徑,減少足細胞的凋亡,從而發揮對糖尿病腎病的保護作用。弓慧杰[15]提出纈沙坦能有效延緩腎小管上皮細胞的纖維化進程,具體表現在抑制腎小管上皮細胞轉分化、減少高糖誘導的AP-1高表達、降低Periostin蛋白表達方面。纈沙坦是否存在延緩足細胞EMT的作用,及其作用機制,尚缺少相關研究。
腎小球足細胞相關蛋白1(NEPH1) 作為足細胞裂孔隔膜上的標志性蛋白,是足細胞濾過屏障的重要組成部分,維持裂孔隔膜的完整性。足細胞發生EMT時,NEPH1的表達明顯下調,故而NEPH1的表達情況,可用于評價足細胞EMT的程度。如何上調足細胞NEPH1的表達,成為保護足細胞的研究熱點[16]。
ILK是一種絲/蘇氨酸蛋白激酶,廣泛存在于細胞胞質中。其可能通過整合素途徑調整相關蛋白的表達,破壞基底膜的完整性,從而介導足細胞EMT過程[17]。ILK也是TGF-β/Smads信號傳導通路中重要的下游因子。ILK可直接磷酸化多種具有生物學功能的下游效應分子,如磷酸化GSK-3β,失活的GSK-3β可抑制細胞內β-catenin的降解,β-catenin核內聚積反過來又可以調節EMT進程中一列基因的表達[18]。Li Y等[19]提出,ILK表達的增加,可促進足細胞snail表達以及足細胞向間質細胞轉分化。研究證實,抑制 ILK的表達后,可明顯減少蛋白尿的產生。所以,靶向ILK信號可有效干預蛋白尿腎病[20]。
MMP9屬于基質金屬蛋白酶(MMPs),是腎小球足細胞發生EMT后的表面標志物之一。Ⅳ型膠原是構成腎小球基底膜的網絡狀框架的結構基礎,而MMP9的主要作用就是降解Ⅳ型膠原。正常情況下,基底膜Ⅳ型膠原的合成與分解呈現一種動態的平衡。而MMP9的表達上調,可以造成基底膜Ⅳ型膠原合成和分解的平衡打破,腎小球基底膜的網狀結構破壞,促進足細胞EMT過程[21]。大量研究表明,ILK與MMP9的表達關系密切,ILK可以上調MMP9的表達,而后者也能被ILK抑制劑所抑制,提示ILK可能通過上調MMP-9的表達進而誘導足細胞EMT過程[22]。
本研究證實,高糖環境(25 mmol/L葡萄糖)的誘導刺激下,足細胞NEPH1的表達與正常環境下相比明顯下降,而足細胞的ILK、MMP9的表達則與正常環境下相比顯著升高。說明高糖環境下,ILK通路過度激活可誘導足細胞EMT。纈沙坦干預后,高糖損傷的足細胞NEPH1的表達相較于正常足細胞有不同程度的升高,ILK、MMP9的表達相較于正常足細胞則有不同程度的減少,這點改變在高劑量纈沙坦組尤為明顯,提示Val的干預作用呈一定的濃度依賴性。
綜上所述,Val可能通過抑制ILK通路有效緩解高糖誘導的足細胞轉分化。這為其獨立于降壓作用之外通過緩解足細胞EMT的進程來靶向保護足細胞,減輕DN早期蛋白尿,提供了分子生物學依據。
[參考文獻]
[1] Durvasula RV,Shankland SJ. Podocyte injury and targeting therapy:An update[J].Curr Opin Nephrol Hypertens,2006,15(1):l-7.
[2] Louis K,Hertig A.How tubular epithelial cells dictate of renal fibrogenesis[J].World J Nphrol,2015,(4):367-373.
[3] Sam R,Wanan L,Gudehithlu KP,et al.Glomerlular epithelial cells transform to myofibroblasts:Early bat not late removal of TGF-Betal reverse transformation[J].Transl Res, 2006,148(3):142-148.
[4] Lamouille S,Xu J,Derynck R.Molecular mechanisms of epithelial-mesenchymal-transition[J].Nature Reviews Molecular Cell Biology,2014,15(3):178-196.endprint
[5] Garg M. Epithelial-mesenchymal transition- activating transcription factors-multifunctional regulators in cancer[J].World J Stem Cells,2013,5(4):188-195.
[6] Zong D,Yin L,Zhong Q,et al.ZNF 488 enhances the invasion and tumorigenesis in nasopharyngeal carcinoma via the Wnt signaling pathway involving epithelial mesenchymal transition[J].Cancer Res Treat,2016,48(1):334 -344.
[7] Candy PA,Phillips MR,Redfern AD,et al.Notch-induced transcription factors are predictive of survival and 5-fluorouracil response in colorectal cancer patients[J].Br J Cancer,2013,109(4):1023-1030.
[8] Zeisberg M,Neilson EG.Biomarkers for epithelial-mesenchymal transitions[J].J Clin Investi,2009,119(6):1429-1437.
[9] Wang Q,Wang Y,Zhang Y, et al. The role of uPAR in epithelial-mesenchymal transition in small airway epithelium of patients with chronic obstructive pulmonary disease[J].Respiratory Res,2013,(14):67.
[10] 馬麗.大劑量纈沙坦在治療糖尿病腎病中對患者尿蛋白排泄量和腎功能的影響[J].中國實用醫藥,2015,10(21):153-155.
[11] Viberti G,Wheeldon NM,MicroAlbuminuria Reduction With Valsartan(MARVAL) Study Investigators.Microalbuminuria reduction with valsartan inpatients with type 2 diabetes mellitus:a blood pressure-independent effect[J].Circulation,2002,106(6):672-678.
[12] 張瑩.纈沙坦對糖尿病腎病作用機制的實驗研究[D].協和臨床醫學院,2007.
[13] 高峰,姚敏,王曉梅,等.纈沙坦對糖尿病小鼠腎小球組織 Notch 通路活化及足細胞丟失的影響[J].河北大學學報,2015,36(1):1-4.
[14] 魏靜,趙建榮.纈沙坦抑制內質網應激對糖尿病腎損害大鼠足細胞的保護作用[J].武警醫學,2015,26(12):1224-1227.
[15] 弓慧杰.纈沙坦對糖尿病腎病腎間質纖維化的影響及其機制初探[D].瀘州醫學院,2013.
[16] Arif E,Rathore YS,Kumari B,et al.Slit diaphragm protein Neph1 and its signaling:A novel therapeutic target for protection of podocytes against glomerular injury[J].J Biol Chem, 2014,289(14):9502-9518.
[17] Wu H,Ren Y,Pan W,et al.The mammalian target of rapamycin signaling pathway regulates myocyte enhancer factor-2C phosphorylation levels through integrin-linked kinase in goat skeletal muscle satellite cells[J].Cell Biol Int,2015,39(11):1264-1273.
[18] Thornton TM,Pedraza-Alva G,Deng B,et al.Phosphorylation by p38 MAPK as an alternative pathway for GSK3beta inactivation[J].Science,2008,(320):667-670.
[19] Li Y,Tan X,Dai C,et al.Inhibition of integrin-linked kinase attenuates renal interstitial fibrosis[J].J Am Soc Nephrol,2009,20(9):1907-1918.
[20] Huber MA,Kraut N,Beug H.Molecular requirements for epithelialmesenchymal transtition during tumor pmgression[J].Curr Opin Cell Biol,2005,17(5):548-558.
[21] Bai Y,Wang L,YL,et al.High ambient glucose level smodulates the Production of MMP-9 and alPha5 collagen by cultured podocytes[J].Cell Physiol Biochem,2006, 17(l-2):57-68.
[22] Ito R Oue N,ZhuX,et al. Expression of integrin-linked kinase is closely correlated with invasion and metastasis of gastric carcinoma[J].Virchows Arch,2003,442(2):118-123.
(收稿日期:2017-08-17)endprint

