強直性脊柱炎患者血清和關節(jié)液中IL-17、IL-4水平變化及意義
孟景紅,趙海濤,陳海英
(河北醫(yī)科大學第三醫(yī)院,石家莊050051)
強直性脊柱炎患者血清和關節(jié)液中IL-17、IL-4水平變化及意義
孟景紅,趙海濤,陳海英
(河北醫(yī)科大學第三醫(yī)院,石家莊050051)
目的探討強直性脊柱炎(AS)患者血清和關節(jié)液中IL-17、IL-4水平變化及意義。方法選取初治AS患者42例(觀察組),體檢健康者20例(對照組)。采用ELISA法檢測兩組血清及觀察組關節(jié)液IL-17、IL-4,計算IL-17/IL-4;采用Pearson相關分析法分析AS患者血清IL-17、IL-4、IL-17/IL-4與血小板數(shù)量、白細胞數(shù)量、紅細胞沉降率(ESR)、CRP、Bath強直性脊柱炎病情活動指數(shù)(BASDAI)的相關性。結果觀察組血清IL-17水平及IL-17/IL-4均高于對照組,血清IL-4水平低于對照組,組間比較P均<0.01。觀察組關節(jié)液中IL-17、IL-4水平均高于血清(P均<0.01)。AS患者血清IL-17、IL-17/IL-4與血小板數(shù)量、ESR、CRP、BASDAI呈正相關(P<0.05或<0.01);IL-4與血小板數(shù)量、ESR、CRP、BASDAI呈負相關(P<0.05或<0.01);IL-17、IL-4、IL-17/IL-4與白細胞數(shù)量均無相關性(P均>0.05)。結論AS患者血清及關節(jié)液中均存在IL-17水平升高、IL-4水平降低、IL-17/IL-4失衡,檢測IL-17、IL-4水平變化有助于了解AS病情程度、疾病活動度及判斷患者預后。
強直性脊柱炎;白細胞介素17;白細胞介素4;血清;關節(jié)液
強直性脊柱炎(AS)是一種主要侵犯人體中軸骨關節(jié)系統(tǒng)及外周大關節(jié)的慢性進行性自身免疫性疾病,主要累及滑膜關節(jié)、軟骨關節(jié)以及肌腱、韌帶附著骨等部位,以骶髂關節(jié)炎為主要臨床表現(xiàn),致殘率較高。目前認為,AS的發(fā)生與免疫系統(tǒng)失調、炎癥反應、遺傳等因素有關,但確切發(fā)病機制尚未闡明。IL-17是由輔助性T細胞17(Th17)產(chǎn)生的前炎癥細胞因子,具有促進炎癥反應的作用;IL-4是由Th2細胞分泌的細胞因子,可抑制細胞免疫、促進體液免疫。目前,關于IL-17、IL-4與AS發(fā)生、發(fā)展關系的報道較少。本研究探討AS患者血清和關節(jié)液中IL-17、IL-4水平變化及意義。
1 資料與方法
1.1 臨床資料 選取2015年10月~2016年6月我院收治的初治AS患者42例(觀察組),診斷均符合1984年修訂的AS紐約標準。其中男33例、女9例,年齡18~52(32.4±9.3)歲,病程0.25~40(18.2±8.0)年,均累及膝關節(jié),白細胞數(shù)量[4~10(6.5±1.9)]×109/L,血小板數(shù)量[219~639(365.9±92.7)]×109/L,紅細胞沉降率(ESR)10~122(55.4±27.8)mm/h,CRP 8~99(42.6±26.0)mg/L,Bath強直性脊柱炎病情活動指數(shù)(BASDAI)2~9(4.8±2.0)。排除其他免疫相關性疾病及嚴重心、肝、腎等疾病患者。選擇同期體檢健康者20例為對照組,男16例、女4例,年齡19~47(29.5±8.4)歲。兩組性別、年齡具有可比性。
1.2 血清及關節(jié)液IL-17、IL-4檢測 分別采集兩組清晨空腹靜脈血3 mL,室溫靜置20 min,3 000 r/min離心20 min,收集血清,置于-80 ℃冰箱保存待測;抽取AS患者膝關節(jié)內關節(jié)液5 mL,靜置2 h,抽取上清液,置于-80 ℃冰箱保存待測。采用ELISA法檢測血清及關節(jié)液IL-17、IL-4,具體步驟參照試劑盒(RD生物科學公司)說明書。計算IL-17/IL-4。
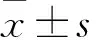
2 結果
2.1 血清和關節(jié)液IL-17、IL-4及IL-17/IL-4 觀察組血清IL-17水平及IL-17/IL-4均高于對照組,血清IL-4水平均低于對照組,組間比較P均<0.01,見表1。觀察組關節(jié)液IL-17、IL-4水平均高于血清(P均<0.01),見表2。
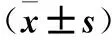
表1 兩組血清IL-17、IL-4水平及IL-17/IL-4比較
注:與對照組比較,*P<0.01。
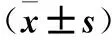
表2 觀察組血清和關節(jié)液中IL-17、IL-4水平及IL-17/IL-4比較
注:與血清比較,*P<0.01。
2.2 AS患者血清IL-17、IL-4、IL-17/IL-4與白細胞數(shù)量血小板數(shù)量、ESR、CRP、BASDAI的相關性 AS患者血清IL-17、IL-17/IL-4與血小板數(shù)量、ESR、CRP、BASDAI均呈正相關(P<0.05或<0.01);IL-4與血小板數(shù)量、ESR、CRP、BASDAI均呈負相關(P<0.05或<0.01);IL-17、IL-4、IL-17/IL-4與白細胞數(shù)量均無相關性(P均>0.05)。見表3。
3 討論
AS的主要發(fā)病機制可能是具有一定遺傳背景的易感個體出現(xiàn)免疫功能紊亂,導致細胞因子網(wǎng)絡失衡,開啟瀑布式炎癥反應,激活更為廣泛的效應機制,最終導致關節(jié)破壞及修復的病理過程[1]。Th17、調節(jié)性T細胞(Treg)是除Th1、Th2細胞亞群外的另一對免疫調控細胞。IL-17是由Th17細胞產(chǎn)生的前炎癥細胞因子,介導防御胞外病原微生物感染[2]。IL-4是由Th2細胞分泌的抗炎癥細胞因子。研究發(fā)現(xiàn),IL-17/IL-4失衡可能是關節(jié)炎的啟動環(huán)節(jié),糾正IL-17/IL-4失衡可能阻止疾病的進展[3]。

表3 AS患者血清IL-17、IL-4、IL-17/IL-4與白細胞數(shù)量血小板數(shù)量、ESR、CRP、BASDAI的相關性
IL-17與受體結合后被激活,促進趨化因子、集落刺激因子和黏附分子表達或釋放,招募炎癥細胞尤其是嗜中性粒細胞,刺激巨噬細胞產(chǎn)生IL-1β、TNF-α、IL-6和前列腺素E2(PGE2)等因子,誘導并促進炎癥反應,導致細胞浸潤和組織破壞,影響感染、腫瘤和自身免疫性疾病等病理過程[1]。研究發(fā)現(xiàn),在系統(tǒng)性紅斑狼瘡、類風濕關節(jié)炎、銀屑病、多發(fā)性硬化癥及幼年特發(fā)性關節(jié)炎等多種自身免疫性疾病中IL-17水平均升高,參與上述疾病的發(fā)生、發(fā)展[4~6]。在自身免疫性疾病動物模型中,IL-17缺乏可阻止疾病發(fā)生;在實驗性關節(jié)炎的發(fā)生過程中阻斷IL-17表達,可以阻止關節(jié)及骨質破壞[7],提示IL-17是多種自身免疫病重要的致病因子,具有增強病理性免疫反應和促進炎癥反應的作用。Mcinnes等[8]報道,IL-17可誘導破骨細胞生成,與破骨細胞IL-17受體結合,促進骨破壞的發(fā)生,在關節(jié)損傷中發(fā)揮重要作用。Koenders等[9]發(fā)現(xiàn),在關節(jié)炎癥發(fā)生的早期階段,IL-17和TNF-α對炎癥的發(fā)展及關節(jié)骨質的破壞具有協(xié)同誘導作用;但關節(jié)炎一旦發(fā)生,IL-17可以不依賴TNF-α而單獨發(fā)揮促炎及破壞骨質的作用。IL-17是關節(jié)炎和骨質破壞發(fā)生的獨立危險因素[10]。關節(jié)腔內持續(xù)注射IL-17可以促進關節(jié)炎的發(fā)生,其可能通過對病理性滑膜進行持續(xù)性的炎性刺激,并且激活滑膜細胞及炎性細胞的抗凋亡機制,從而使這些細胞聚集在關節(jié)腔,最終形成病理性損傷[10]。在動物關節(jié)炎病變組織局部分離出的單個核細胞高表達 IL-17,且病灶內IL-17表達量與疾病的嚴重程度密切相關[11]。
IL-4是由Th2細胞分泌的細胞因子,主要作用于B細胞、T細胞、巨噬細胞和肥大細胞等靶細胞,可抑制Th1和細胞毒T淋巴細胞(Tc1)增殖及產(chǎn)生細胞因子,抑制細胞免疫、促進體液免疫,增強殺傷細胞的特異性及非特異性殺傷功能[12]。IL-4能夠抑制單核-巨噬細胞產(chǎn)生IL-1β、TNF-α、IL-8、PGE等,下調活化的單核-巨噬細胞分泌氧自由基[13]。隨著IL-4水平逐漸降低,其抑制炎癥反應的能力逐漸減弱,自身的免疫穩(wěn)態(tài)遭到破壞,促進免疫相關性疾病的發(fā)生、發(fā)展。動物研究發(fā)現(xiàn),抗IL-4抗體可使小鼠膠原誘導性關節(jié)炎加重,系統(tǒng)給予IL-4可阻止小鼠關節(jié)炎癥進展及關節(jié)組織學改變,顯著減輕急性關節(jié)炎癥狀。IL-4還可通過抑制損傷性蛋白酶-基質金屬蛋白酶來降低關節(jié)損傷程度[14]。在膠原誘導性關節(jié)炎動物模型中通過腺病毒載體植入IL-4基因,可抑制炎性介質IL-6、IL-12、IL-17和滑膜骨蛋白原配體的產(chǎn)生,從而阻止軟骨及骨質的破壞[15,16]。去除IL-4基因的小鼠關節(jié)炎程度明顯加重[17]。但是,Wang等[18]研究發(fā)現(xiàn),AS患者血清IL-4水平明顯降低。上述研究結果提示,在免疫相關性關節(jié)炎的發(fā)病過程中IL-4可通過不同的機制阻止關節(jié)炎的發(fā)生及發(fā)展。在膠原誘導的關節(jié)炎發(fā)生初期,IL-4可通過T細胞抑制IL-17產(chǎn)生,進而減輕關節(jié)局部的炎癥反應,但在疾病后期卻不能發(fā)揮相似的作用[19,20]。
本研究結果顯示,AS患者血清IL-17水平及IL-17/IL-4均較健康對照者明顯升高,IL-4水平較健康對照者明顯降低,提示IL-17促進AS發(fā)生,IL-4則抑制AS發(fā)病,IL-17/IL-4失衡促進關節(jié)炎的發(fā)生。上述結果與動物實驗研究結果一致[21]。AS患者膝關節(jié)液中IL-17水平高于血清,且本研究AS患者病變均累及膝關節(jié),提示IL-17在關節(jié)病變和骨質破壞中可能占據(jù)更重要的地位;關節(jié)液中IL-4水平高于其血清水平,提示在關節(jié)炎發(fā)生時IL-4有向關節(jié)炎癥部位聚集的傾向,以恢復局部IL-17/IL-4平衡,控制局部炎癥反應。血小板數(shù)量、ESR、CRP、BASDAI均為評價AS患者病情程度、疾病活動度及預后的指標。AS患者血清IL-17水平均與血小板數(shù)量、ESR、CRP、BASDAI呈正相關,IL-4與血小板數(shù)量、ESR、CRP、BASDAI呈負相關,提示血清IL-17、IL-4水平可以反映AS疾病活動度,檢測二者水平有助于判斷患者預后。血清IL-17、IL-4水平均與白細胞數(shù)量無相關性,可能與白細胞數(shù)量受多種因素影響有關。
綜上所述,AS患者血清及關節(jié)液中均存在IL-17水平升高、IL-4水平降低、IL-17/IL-4失衡,檢測IL-17、IL-4水平變化有助于了解AS病情程度、疾病活動度及判斷患者預后。
[1] Harrington LE, Mangan PR, Weaver CT, et al. Expanding the effector CD4 T-cell repertoire: the Th17 lineage[J]. Curr Opin immunol, 2006,3(18):349-356.
[2] Lubberts E. Th17 cytokines and arthritis[J]. Semin Immunopathol, 2010,32(1):43-53.
[3] Lowesl MA, Kikuchil T, Fuentes-Duculanl J, et al. Psoriasis vulgaris lesions contain discrete populations of Th1 and Th17 T cells[J]. J Invest Dermatol, 2008,5(128):1207-1211.
[4] 武樹朋.血清GM-CSF、TNF-α及IL-17在類風濕關節(jié)炎中的表達及相關性[J].中華風濕病學雜志,2017,12(37):3041-3042.
[5] 白雪,高美華,王好玉等.TH17細胞相關細胞因子IL-17和IL-23在系統(tǒng)性紅斑狼瘡中的表達及其意義[J].現(xiàn)代生物醫(yī)學進展,2013,10(13):1937-1940.
[6] Agarwal S, Misra R, Aggarwal A. Interleukin 17 levels are increased in juvenile idiopathic arthritis synovial fluid and induce synovial fibroblasts to produce proinflammatory cytokines and matrix metalloproteinases[J]. J Rheumatol, 2008,3(35):515-519.
[7] Koenders MI, Lubberts E, Opper Walgreen B, et al. Blocking of
IL-17 during reactivation of experimental arthritis prevent joint inflammation and bone erosion by decreasing RANKL and IL-1[J]. Am J Pathol, 2005,167(1):141-149.
[8] Mcinnes IB, Liew FY. Cytokine networks-towards new therapies for rheumatoid arthritis[J]. Nat Rev Rhrumatol, 2005,1(1):31-39.
[9] Koenders MI, Lubberts E, Van de Loo FA, et al. Interleukin-17 acts independently of TNF-alpha under arthritic conditions[J]. J Immunol, 2006,176(10):626-629.
[10] Benedetti G, Miossec P. Interleukin 17 contributes to the chronicity of inflammatory diseases such as rheumatoid arthritis[J]. Eur J Immunol, 2014,2(44):339-347.
[11] Lubberts E. IL-17/Th17 targeting: on the road to prevent chronic destructive arthritis[J]. Cytokine, 2008,41(2):84-91.
[12] 劉秀娟,黃勝起,王阿妮,等.白細胞介素-17與細胞核因子-κB受體活化因子配體在強直性脊柱炎患者血清中表達的研究[J].中華風濕病學雜志,2013,11(17):769-771.
[13] Chen WS, Chang YS, Lin KC, et al. Association of serum interleukin-17 and interleukin-23 leves with disease activity in Chinese patients with ankylosing spondylitis[J]. J Chin Med Assoc, 2012,75(7):303-308.
[14] Sarah EW, Danielle D, Taher E, et al. Targeted delivery of cytokine therapy to rheumatoid tissue by a synovial targeting peptide[J]. Ann Rheum Dis, 2013,1(72):129-135.
[15] Lubberts E, Joosten LA, van Den Bersselaar L, et al. Adenoviral vector-mediated overexpression of IL-4 in the knee joint of mice with collagen-induced arthritis prevents cartilage destruction[J]. J Immunol, 1999,163(8):4546-4556.
[16] Joosten LA, Lubberts E, Helsen MM, et al. Protection against cartilage and bone destruction by systemic interleukin-4 treatment in established murine type Ⅱ collagen-induced arthritis[J]. Arthritis Res, 1999,1(1):1.
[17] CaoY, Brombacher F, Tunyoqi-Csapo M, et al. Interleukin-4 regulates proteoglycan-induced arthritis by specifically suppressing the innate immune response[J]. Arthritis Rheum, 2007,3(56):861-870.
[18] Wang J, Zhao Q, Wang G, et al. Circulating levels of Th1 and Th2 chemokines in patients with ankylosing spondylitis[J]. Cytokine, 2016(81):4-10.
[19] Morita Y, Yang J, Gupta R, et al. Dendritic cells genetically engineered to express IL-4 inhibit murine collagen-induced arthritis[J]. J Clin Invest, 2001,107(10):1275-1284.
[20] Sarkar S, Tesmer LA, Hindnavis V, et al. Interleukin-17 as a molecular target in immune-mediated arthritis: immunoregulatory properties of genetically modifed murine dendritic cells that secrete interleukin-4[J]. Arthritis Rheum, 2007,56(1):89-100.
[21] Miossec P, Kolls JK. Targeting IL-17 and T (H)17 cells in chronic inflammation[J]. Nat Rev Drug Discov, 2012,10(11):763-776.
河北省醫(yī)學科學研究重點課題計劃(20130222)。
趙海濤(E-mail: 38558956@qq.com)
10.3969/j.issn.1002-266X.2017.48.016
R593.23
B
1002-266X(2017)48-0051-03
2017-07-12)

