初發骨髓增生異常綜合征患者血清鐵蛋白水平變化及意義
劉超,秦浩人,冀虹霞,劉姚姚,楊向東
(1天津中醫藥大學,天津 300110;2天津中醫藥大學第一附屬醫院)
初發骨髓增生異常綜合征患者血清鐵蛋白水平變化及意義
劉超1,秦浩人1,冀虹霞1,劉姚姚1,楊向東2
(1天津中醫藥大學,天津 300110;2天津中醫藥大學第一附屬醫院)
目的探討初發骨髓增生異常綜合征(MDS)患者血清鐵蛋白(SF)水平變化及臨床意義。方法選取初發MDS患者50例,其中RA型6例、RARS型4例、RCMD型20例、RAEB-1型13例、RAEB-2型7例,極低危3例、低危8例、中危20例、高危15例、極高危4例。患者分別于輸血前及累計輸注紅細胞達10、20、30 U時取血,采用放射免疫法檢測血清SF水平,計算SF變化量(SFΔ);分析血清SFΔ與患者輸血量、臨床分型、危險分層的關系。輸注紅細胞達30 U時,將患者分為SFΔ≥2 000 ng/mL組和<2 000 ng/mL組,比較兩組預后。結果輸血前RARS、RAEB-1、RAEB-2型患者血清SF水平均高于RA、RCMD型患者(P均<0.05),高危、極高危患者均高于極低危、低危及中危患者(P均<0.05)。RAEB-1、RAEB-2型患者在輸注紅細胞量為20、30 U時血清SFΔ均低于其他各型(P均<0.05)。高危、極高危患者輸注紅細胞達30 U時血清SFΔ均低于其他危險度患者(P均<0.05)。兩組均隨訪至2016年6月,輸注紅細胞達30 U時SFΔ≥2 000 ng/mL組的MDS/急性髓系白血病(AML)轉化率低于SFΔ<2 000 ng/mL組(P<0.01),中位總體生存時間長于SFΔ<2 000 ng/mL組(P<0.01)。結論初發RARS、REAB-1、RAEB-2型及高危、極高危MDS患者血清SF水平均高于其他分型及危險度者;隨著輸血量的增加,RAEB-1、RAEB-2型及高危、極高危患者鐵過載程度均高于其他分型及危險度者;血清SF水平變化對MDS患者預后有一定的預測作用。
骨髓增生異常綜合征;鐵蛋白,變化量;輸血;急性髓系白血病
貧血是骨髓增生異常綜合征(MDS)患者的主要癥狀,輸血是其必要的支持治療方法。鐵蛋白(SF)是鐵代謝的重要指標之一,可用于判斷機體是否缺鐵或鐵負荷過量,也可作為部分血液系統疾病患者預后的評價指標[1]。臨床發現,隨著輸血量的增加,不同亞型、不同危度分層MDS患者血清SF水平差異較大,患者預后亦存在較大不同,但研究結論不完全相同[2~4]。本研究探討MDS患者血清SF水平變化及臨床意義。
1 臨床資料
1.1 基本資料 收集2010年6月~2016年6月天津中醫藥大學第一附屬醫院收治的初發MDS患者50例,男35例、女15例,年齡45~70歲、平均61歲;參照2008年WHO診斷分型標準分為RA型6例,RARS型4例,RCMD型20例,RAEB-1型13例,RAEB-2型7例;參照IPSS-R預后積分標準分為極低危3例,低危8例,中危20例,高危15例,極高危4例。納入標準:①符合2008年WHO關于MDS的診斷及分型標準,病例資料完整;②具有輸血史,輸注紅細胞≥30 U;③未進行去鐵治療;④生存期≥1年。排除標準:①合并長期活動性炎癥、肝病、實體腫瘤、溶血、長期消化道出血、月經量多;②疑似慢性出血;③應用鐵劑治療。患者入院后給予常規促造血、調節免疫等藥物治療,主要藥物為十一酸睪酮膠囊、達那唑膠囊、環孢素膠囊等;符合化療指征患者給予靜脈注射地西他濱去甲基化治療;根據衛生部《臨床輸血指南》及患者病情進行輸血治療,當Hb<60 g/L時輸注紅細胞。
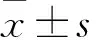
1.3 血清SF水平、SF變化量(SFΔ)檢測及相關性分析 分別于輸血前及累計輸注紅細胞達10、20、30 U時取血,離心后取血清,采用放射免疫法檢測SF。血清SF正常值:女性12~120 ng/mL,男性50~19 ng/mL。計算輸血前后血清SFΔ。SFΔ=SF輸血后-SF輸血前。
1.3.1 各型及各危險分層患者輸血前血清SF水平比較 輸血前RA、RARS、RCMD、RAEB-1、RAEB-2型MDS患者血清SF水平分別為(401±113)、(659±116)、(438±161)、(610±217)、(658±226)ng/mL,各型MDS患者間血清SF水平比較差異有統計學意義(P<0.01),其中RARS、REAB-1、RAEB-2型均高于RA、RCMD型(P均<0.05)。
輸血前極低危、低危、中危、高危、極高危MDS患者血清SF水平分別為(476±158)、(438±155)、(485±149)、(631±162)、(662±174) ng/mL,各危險分層MDS患者間比較差異有統計學意義(P<0.01),其中高危、極高危MDS患者高于極低危、低危及中危MDS患者(P均<0.05)。
1.3.2 各型MDS患者不同輸注紅細胞量時血清SFΔ水平比較 各型MDS患者在輸注紅細胞量為10 U時血清SFΔ比較差異無統計學意義(P>0.05);在輸注紅細胞量為20、30 U時,各亞型MDS患者血清SFΔ比較差異有統計學意義(P<0.05),其中RAEB-1、RAEB-2型低于其他各型(P均<0.05)。見表1。
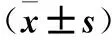
表1 各型MDS患者不同輸注紅細胞量時血清SFΔ比較
注:與RA型比較,*P<0.05;與RARS型比較,#P<0.05;與RCMD型比較,△P<0.05。
1.3.3 各危險分層MDS患者輸注紅細胞≥30 U時血清SFΔ比較 極低危、低危、中危、高危、極高危MDS患者輸注紅細胞≥30 U時血清SFΔ分別為(3 564±682)、(3 124±466)、(3 617±965)、(2 131±467)、(2 089±516)ng/mL,各危險分層MDS患者間比較P<0.05,其中高危、極高危MDS患者低于其他各危險分層患者(P均<0.05)。
1.4 血清SFΔ與MDS患者預后的關系 輸注紅細胞≥30 U時根據血清SFΔ將患者分為SFΔ≥2 000 ng/mL組(30例)及<2 000 ng/mL組(20例)。兩組均隨訪至2016年6月,統計隨訪截止時兩組急性髓系白血病(AML)發生例數及總體生存時間(OS),計算MDS/AML轉化率。OS為自確診之日起至隨訪截止日,死亡患者計算至死亡日止。
隨訪截止時SFΔ≥2 000 ng/mL組與SFΔ<2 000 ng/mL組分別確診AML 6例和15例,MDS/AML轉化率分別為20.0%、75.0%,確診中位時間分別為16(9~26)個月、 7(9~22)個月;中位OS分別為36(14~48)個月、24(12~28)個月。兩組MDS/AML轉化率及中位OS比較,P均<0.01。
2 討論
MDS患者造血系統的一個顯著特征是無效造血,是引起患者鐵代謝紊亂的基本原因[2]。楊英等[3]對38例新確診的MDS患者研究發現,非輸血依賴的MDS患者SF、轉鐵蛋白(Tf)、細胞內鐵、細胞外鐵等指標增高,說明MDS患者幼紅細胞對鐵的利用、儲存及排出存在異常。在無效造血的病理狀態下,大量幼稚紅細胞會釋放生長分化因子15(GDF15)和扭轉原腸胚形成同系物1(TWSG1)[4,5],二者均可抑制肝臟鐵調素合成,使腸道吸收鐵量增加。同時,由于幼紅細胞攜氧能力不足,機體處于缺氧狀態,促紅細胞生成素(EPO)分泌增加,進一步抑制鐵調素合成。MDS無效造血伴惡性克隆者其腫瘤負荷增大,可能進一步促進SF增高。部分MDS患者存在人遺傳性鐵色素沉著癥(HFE)基因突變[6]。HFE基因C282Y突變和H63D突變可以導致腸道過度吸收鐵。HFE蛋白表達于小腸上皮細胞基底側,能夠與Tf結合,將循環內的鐵離子轉運到上皮細胞,上皮細胞感應體內鐵離子變化,從而調節小腸絨毛膜管腔側Dcyr-b及Dmt1表達,調控腸道對鐵的吸收。HFE基因變異時Tf運送的鐵不能進入上皮細胞,上皮細胞內呈現鐵缺乏狀態,促進Dcyr-b及dmt1表達,增加鐵離子吸收。Várkonyi等[7]對50例MDS患者的研究結果顯示,HFE 基因C282Y突變率達10%,H63D突變率達44%,HFE基因突變率明顯高于正常對照者。其后Várkonyi等[8]將病例擴大至61例,仍得出相似結論。
本研究結果顯示, RARS、RAEB-1和RAEB-2型患者血清SF水平明顯高于其他各型,提示不同亞型MDS患者鐵代謝情況不同。Santini等[9]報道,RARS型MDS患者血清SF水平較高,腸道對鐵的過量吸收可能是導致SF增高的主要原因;RAEB型患者鐵調素水平最高,提示RAEB型患者血清SF增高不是由鐵的過量吸收引起,可能與腫瘤負荷有關。本研究中輸注相當血量后各危險度MDS患者血清SFΔ存在差異,原因可能與炎癥因子尤其是TNF-α表達水平不同有關。TNF-α可通過SF轉錄而分泌增加,亦可促進肝細胞分泌SF導致SF增高。有研究表明,低危MDS患者尤其是RA、RCMD型患者,TNF-α表達明顯高于以RAEB-1、RAEB-2型為主要組成的高危MDS患者[10,11]。因此,我們認為低危MDS患者TNF-α高表達是其SFΔ明顯高于中危患者、高危患者的重要原因。
MDS是一種具有高風險向AML轉化的血液系統惡性疾病,其一旦轉為AML,病情往往較原發AML更為兇險,患者預后更差。本研究發現,在大量輸血后高危、極高危MDS患者血清SFΔ明顯低于其他危險度患者,因此我們推測大量輸血后MDS患者的SFΔ與其預后具有一定相關性。基于此結果,我們以血清SFΔ為2 000 ng/mL為分割點,將患者分為SFΔ≥2 000 ng/mL組和SFΔ<2 000 ng/mL組,結果發現SFΔ≥2 000 ng/mL組MDS/AML轉化率和OS均大于SFΔ<2 000 ng/mL組。MDS高危患者細胞內活性氧自由基內源性產物增加,可導致DNA雙鏈斷裂并產生錯誤修復,增加基因的不穩定性,導致遺傳基因改變[12]。此外,不穩定細胞鐵增加可使細胞內鐵代謝異常,可能進一步加劇氧化應激反應,從而加劇前白血病克隆基因的不穩定性,促進MDS向白血病轉化[13]。馮寶章等[14]研究認為,白血病前期或MDS轉白血病均與骨髓TNF-α活性增加有關。TNF-α活性增加可在短期內促使白血病前期骨髓干祖細胞大量增殖,并達到臨床診斷急性白血病的標準。楊永等[15]研究發現,過高的鐵負荷也可導致毒性活性氧增加,活性氧的積累會進一步導致造血干細胞衰老和死亡,促進造血細胞相關基因突變,引起DNA損傷,進而促進MDS發生、發展,增加MDS患者轉為白血病和出現各種并發癥的概率,導致患者預后不良。
綜上所述,初發RARS、REAB-1、RAEB-2型及高危、極高危MDS患者血清SF水平均高于其他分型及危險度者;RAEB-1、RAEB-2型及高危、極高危患者鐵過載程度均高于其他分型及危險度者;血清SF水平變化對MDS患者預后具有一定的預測作用。
[1] 葛丹丹,趙芳,黃蘇,等.血清鐵蛋白水平—骨髓增生異常綜合征預后的風險因素[J].中國實驗血液學雜志,2015,23(5):1370-1374.
[2] Kikuchi S, Kobune M, Iyama S, et al. Improvement of iron-mediated oxidative DNA damage in patients with transfusion-dependent myelodysplastic syndrome by treatment with deferasirox[J]. Free Rad Bio Med, 2012,53(4):643-648.
[3] 楊英,楊波,梁志鵬.鐵代謝指標在骨髓增生異常綜合征無效造血中的臨床研究[J].中國實驗血液學雜志,2013,21(4):948-952.
[4] Tanno T, Bhanu NV, Oneal PA, et al. High levels of GDF15 in thalassemia suppress expression of the iron regulatory protein hepcidin[J]. Nat Med, 2007,13(9):1096-1101.
[5] Tanno T, Porayette P, Sripichai O, et al. Identification of TWSG1 as a second novel erythroid regulator of hepcidin expression in murine and human cells[J]. Blood, 2009,114(1):181-186.
[6] Várkonyi J, Szabó T, Sebestyén P, et al. New aspects of copper and iron metabolism in the myelodysplastic syndromes[J]. Chemotherapy, 2006,52(2):66-68.
[7] Várkonyi J, Tarkovács G, Karádi I, et al. High incidence of hemochromatosis gene mutations in the myelodysplastic syndrome: the Budapest Study on 50 patients[J]. Acta Haematol, 2003,109(2):64-67.
[8] Várkonyi J, Demeter J, Tordai A, et al. The significance of the hemochromatosis genetic variants in multiple myeloma in comparison to that of myelodysplastic syndrome[J]. Ann Hematol, 2006,85(12):869-871.
[9] Santini V, Girelli D, Sanna A, et al. Hepcidin levels and their determinants in different types of myelodysplastic syndromes[J]. PLoS One, 2011,6(8):1725-1726.
[10] 王秀麗,邵宗鴻,姚程,等.骨髓增生異常綜合征患者骨髓T輔助細胞亞群的研究[J].中華血液學雜志,2005,26(12):743-745.
[11] 張越,許洪志,馬春燕,等.AA、MDS和AML患者外周血T淋巴細胞相關細胞因子表達水平的對比研究[J].新醫學,2016,47(6):384-387.
[12] Sallmyr A, Fan J, Rassool FV. Genomic instability in myeloid malignancies: increased reactive oxygen species (ROS), DNA double strand breaks (DSBs) and error-prone repair[J]. Cancer Letters, 2008,270(1):1-9.
[13] Pullarkat V. Objectives of iron chelation therapy in myelodysplastic syndromes: more than meets the eye[J]. Blood, 2009,114(26):5251-5255.
[14] 馮寶章,張益枝.骨髓增生異常綜合征和再生障礙性貧血等骨髓TNF-α活性與白血病的關系[J].白血病·淋巴瘤,2000,9(6):334-337.
[15] 楊永,何廣勝.骨髓增生異常綜合征鐵超負荷研究進展[J].中國實用內科雜志,2012,32(11):885-887.
Changesandsignificanceofserumferritinlevelinpatientswithmyelodysplasticsyndrome
LIUChao1,QINHaoren,JIHongxia,LIUYaoyao,YANGXiangdong
(1TianjinUniversityofTraditionalChineseMedicine,Tianjin300110,China)
ObjectiveTo investigate the changes and clinical significance of serum ferritin (SF) level in patients with primary myelodysplastic syndrome (MDS).MethodsFifty cases of newly diagnosed MDS patients were selected, including different sub-types (6 cases of RA type, 4 RARS, 20 RCMD, 13 RAEB-1, and 7 RAEB-2) and different IPSS-R classifications (3 cases of very low risk, 8 cases of low risk, 20 cases of intermediate risk, 15 cases of high risk, and 4 cases of very high risk). First of all, the blood samples were taken before and after transfusion of red blood cells at 10, 20 and 30 U, respectively, then we measured SF level in each sample by radioimmunoassay and calculates the difference of SF(SFΔ). At last, we analyzed the relationship of SFΔ level with different blood transfusion volume, different sub-type and IPSS-R classification. When the infusion of red blood cells were up to 30 U, we divided the patients into the SFΔ≥2 000 ng/mL group and SFΔ<2 000 ng/mL group, and we compared the prognosis of patients between these two groups.ResultsThe levels of SF in patients with RARS, RAEB-1, and RAEB-2 types were higher than those of patients with RA and RCMD types (allP<0.05); the levels of SF in the high-risk and very-high-risk patients were apparently higher than those in the very-low-risk, low-risk and intermediate-risk patients (allP<0.5). Serum SFΔ levels were lower in patients with RAEB-1 and RAEB-2 types than those in the other types at the blood transfusion of 20 and 30 U (allP<0.05). Serum SFΔ levels in the high-risk and very-high-risk patients with erythrocytes up to 30 U were lower than those in the other risk patients (allP<0.05). All patients were followed up to June 2016. When the infusion of red blood cells were up to 30 U, the transformation rate of MDS/AML in the SFΔ≥2 000 ng/ml group was lower than that in the SFΔ<2 000 ng/ml group, and the whole median survival time in the SFΔ≥2 000 ng/ml group was longer (P<0.01).ConclusionsThe serum SF levels in newly diagnosed MDS patients with RARS, RAEB-1, RAEB-2 types, and in high-risk and very-high-risk patients are higher than those of other sub-types and risk classifications. With the increase of blood transfusion, the level of iron overload in patients with RAEB-1 and RAEB-2 types and in high-risk and very-high-risk patients are higher than those of the other sub-types and risk classifications. The change of serum SF may predict the prognosis of patients with MDS.
myelodysplastic syndrome; ferritin; blood transfusion; acute myelogenous leukemia
國家自然科學基金資助項目(81774048)
劉超(1989-),男,碩士研究生在讀,研究方向為血液病的診斷及治療。E-mail: lkcwtf@163.com
楊向東(1977-),男,副主任醫師,研究方向為老年血液病的診斷及治療。E-mail: yxdtcm@126.com
10.3969/j.issn.1002-266X.2017.48.006
R551.3
A
1002-266X(2017)48-0019-04
2017-08-04)

