青龍衣化學成分及生物活性研究進展
宮俊杰 ,宮學斌 *,張敏 ,趙煜煒 ,姜建波
(1.煙臺龍大核中寶食品有限公司,山東煙臺 265229;2.龍大食品集團有限公司,山東煙臺 265231)
青龍衣化學成分及生物活性研究進展
宮俊杰1,宮學斌1*,張敏2,趙煜煒2,姜建波2
(1.煙臺龍大核中寶食品有限公司,山東煙臺 265229;2.龍大食品集團有限公司,山東煙臺 265231)
青龍衣是胡桃科胡桃屬植物胡桃和胡桃楸未成熟果實的干燥果皮,是核桃加工產業的副產物。青龍衣含有醌類、黃酮類、二芳基庚烷類、萜類、苯丙素類、有機酸及其酯類等營養成分,具有抗腫瘤、抑菌、抗氧化等多種生物活性。本文就青龍衣的化學成分和生物活性作用進行整理總結,并對青龍衣的開發利用進行展望,為青龍衣的進一步開發和利用提供依據。
青龍衣;化學成分;生物活性;研究進展
青龍衣是胡桃科胡桃屬植物胡桃(Juglands mandshuricaMaxim.)和胡桃楸(Juglands ragiaL.)未成熟果實的干燥果皮,是核桃加工產業的副產物。始載于《開寶本草》,命名為“胡桃青龍”,《救急方》中稱之“青胡桃皮”,后于《山東中草藥手冊》中稱為“青龍衣”,現多沿用此名,主要用于治療脘腹疼痛,水痢不止,癰腫瘡毒,白癜風、牛皮癬等[1]。本文就青龍衣的化學成分及生物活性的研究進行整理總結,以期為農產品副產物的進一步開發和利用提供依據。
1 化學成分
青龍衣的化學成分豐富,目前從青龍衣中分離得到的化合物主要有醌類、黃酮類、苯丙素類、有機酸及其酯類和酚類化合物等。
1.1 醌類化合物
醌類化合物是一類分子內具有不飽和環二酮類的化合物,主要由苯醌、蒽醌、萘醌、菲醌四類組成。目前,青龍衣中發現的醌類化合物有70余種,主要為萘醌、蒽醌以及蒽醌的還原產物萘酚及萘酮等(見表1)。其中胡桃醌具有明確的細胞毒作用,是中藥抗腫瘤的研究熱點。

表1 青龍衣中的醌類化合物
1.2 黃酮類化合物
黃酮類化合物是天然產物中普遍存在的一種以2-苯基色原酮為母核的化學成分。青龍衣中含多種黃酮類化合物,這些物質主要為黃酮醇、二氫黃酮醇、雙氫山奈酚、漢黃芩素以及其苷類,也是青龍衣的重要的活性物質,見表2。

續表2
1.3 二芳基庚烷類化合物
二芳基庚烷類化合物是指兩個芳環的1,7位被一條7碳原子脂肪鏈連接而成的一類化合物的總稱,因其具有獨特的化學結構與立體構型,生物活性廣泛,主要體現在抗癌、抗衰老、鎮痛抗炎、提高免疫力等方面。青龍衣中二芳基庚烷類化合物種類也很多,具體見表3。
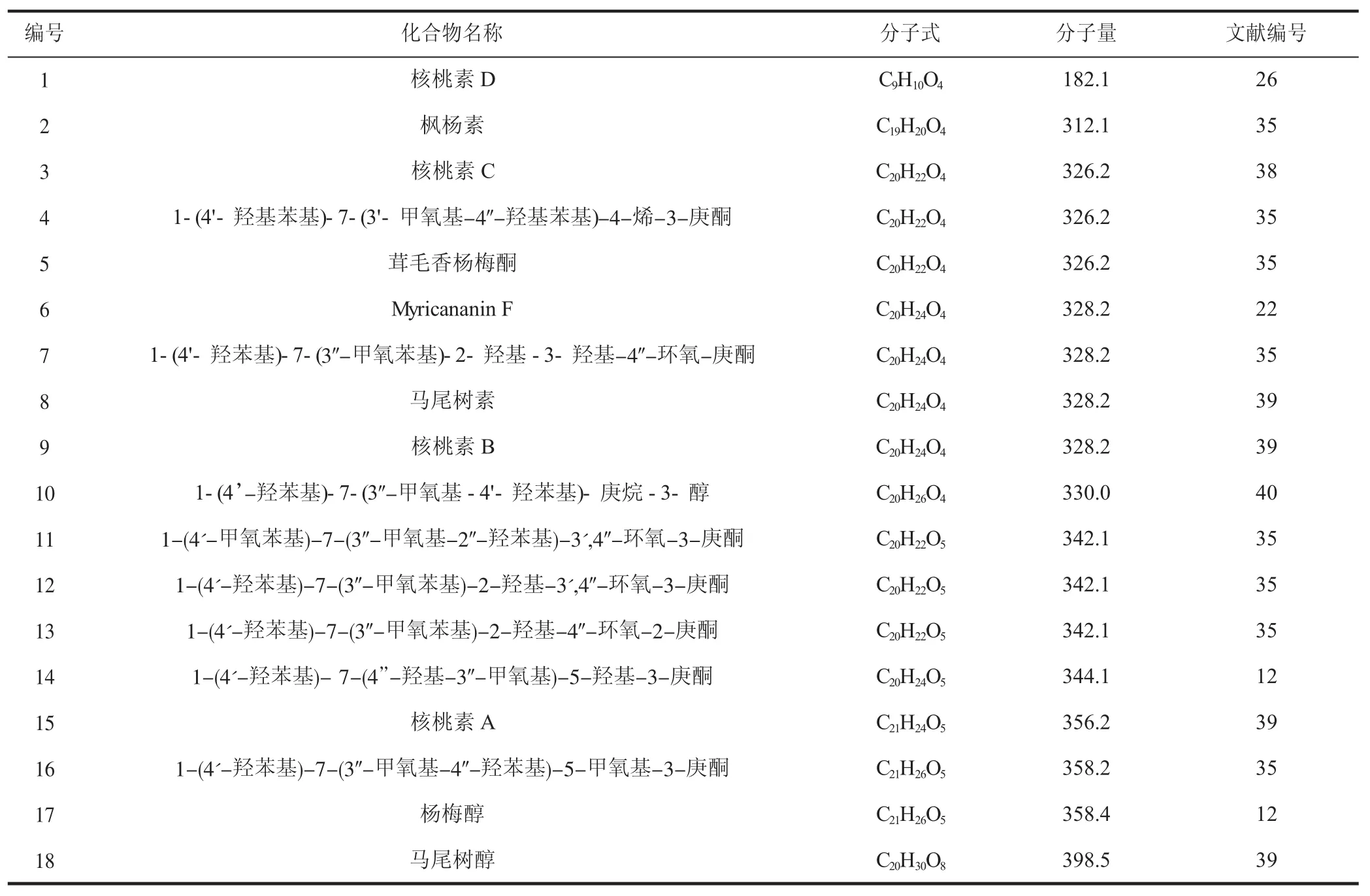
表3 青龍衣中的二芳基庚烷類化合物
1.4 萜類及甾體類化合物
萜類化合物以異戊二烯為單位聚合而成,甾體類化合物的骨架則為環戊烷駢多氫菲,這兩類化合物也是青龍衣中發現較多的天然成分,是揮發油中沸點較低部分的主要組成部分。青龍衣中的萜類及甾體類化合物見表4。
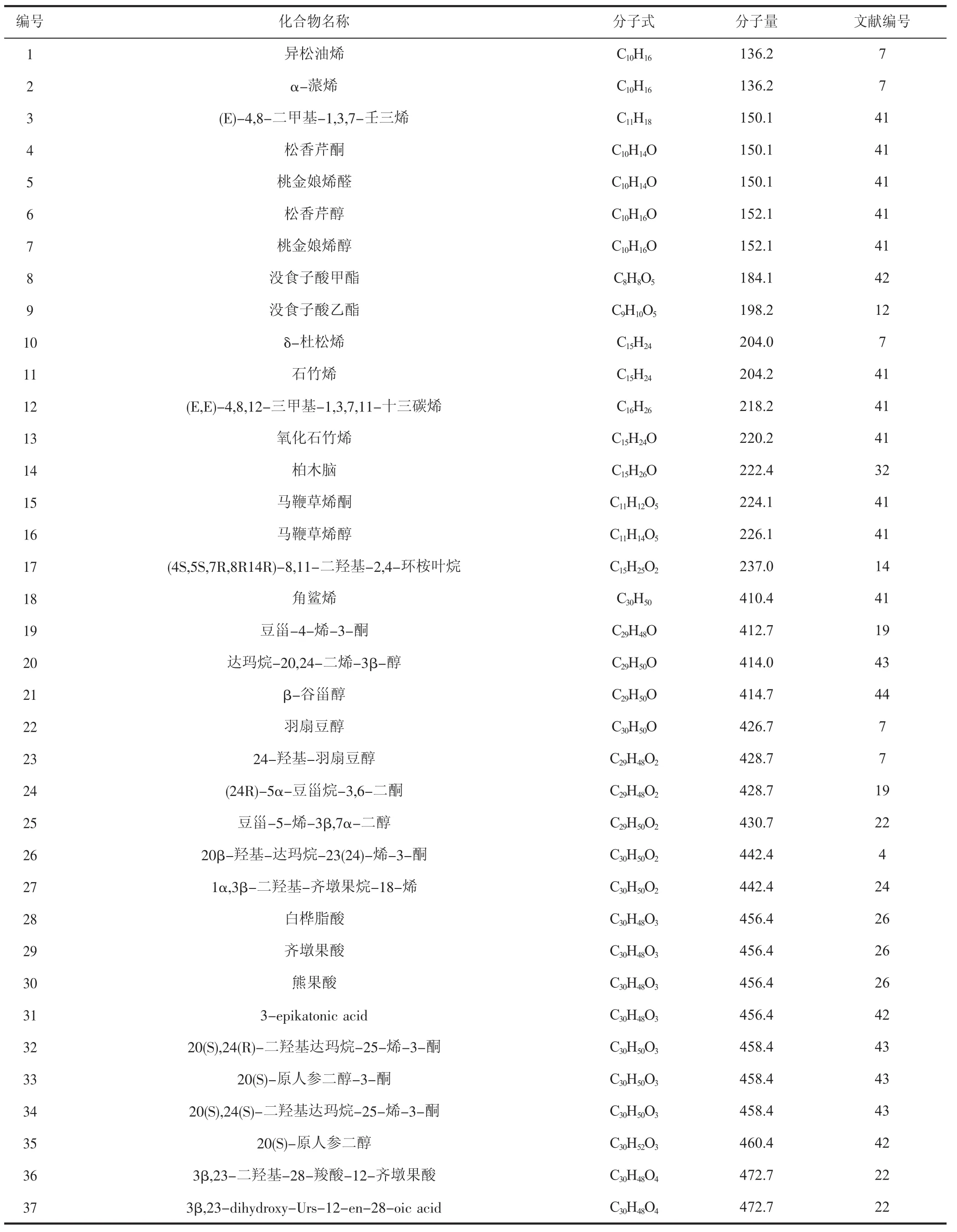
表4 青龍衣中的萜類及甾體類化合物
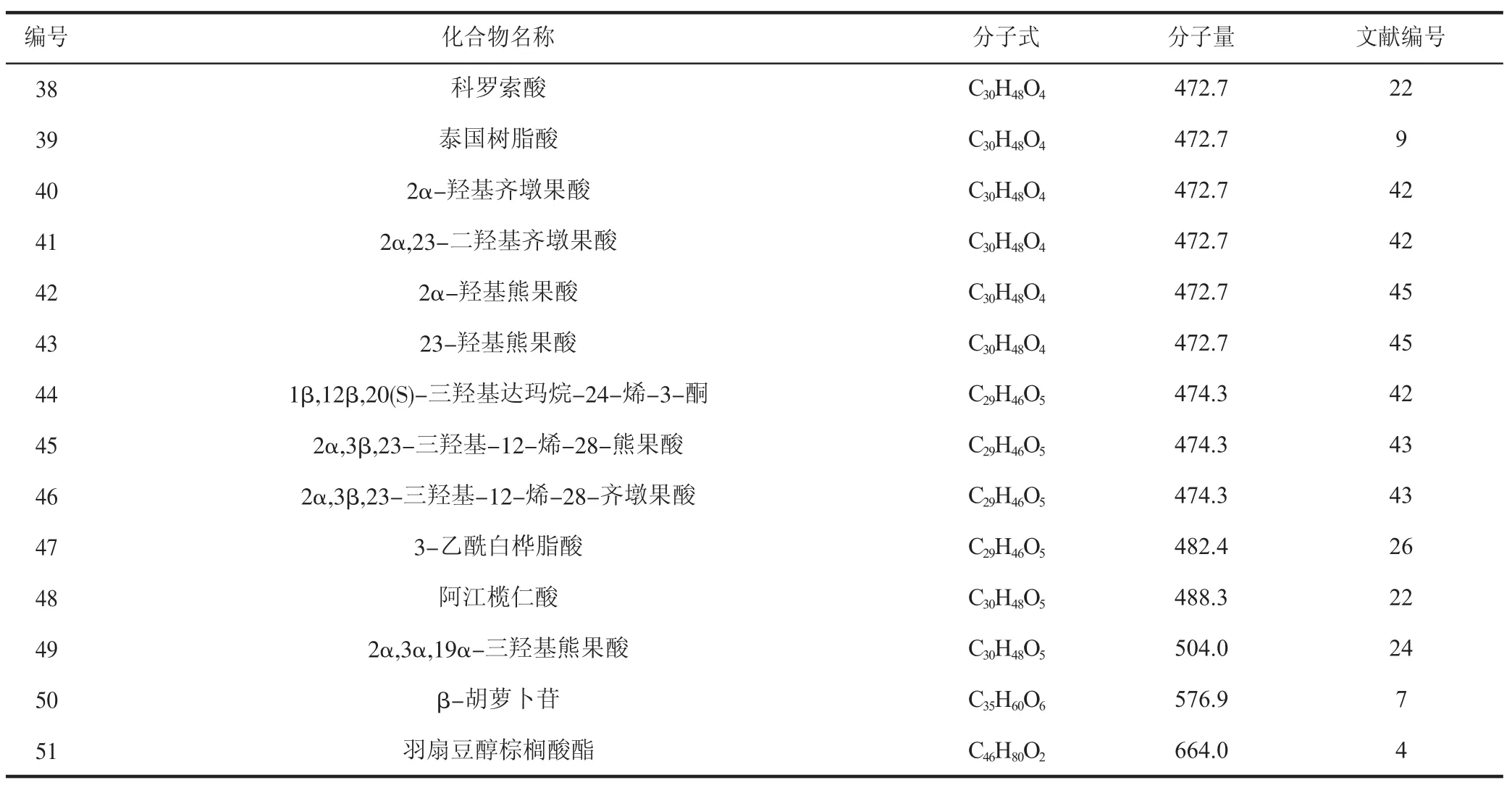
續表4
1.5 苯丙素類化合物
苯丙素類化合物是苯環的C3-C6位與三個碳原子組成的直鏈連接而成的一類化合物。青龍衣中的該類化合物大多為綠原酸及其異構體等,具有較強的抗氧化活性(見表5)。
1.6 有機酸及其酯類
目前,在青龍衣中分離得到的有機酸及其酯類化合物約為17種,其中沒食子酸具有明確的抗氧化活性,具體見表6。
1.7 酚類化合物
酚類化合物是指芳香烴環上的氫被羥基取代的一種芳香族化合物,青龍衣中的酚類化合物主要為酚及酚苷類見表7。
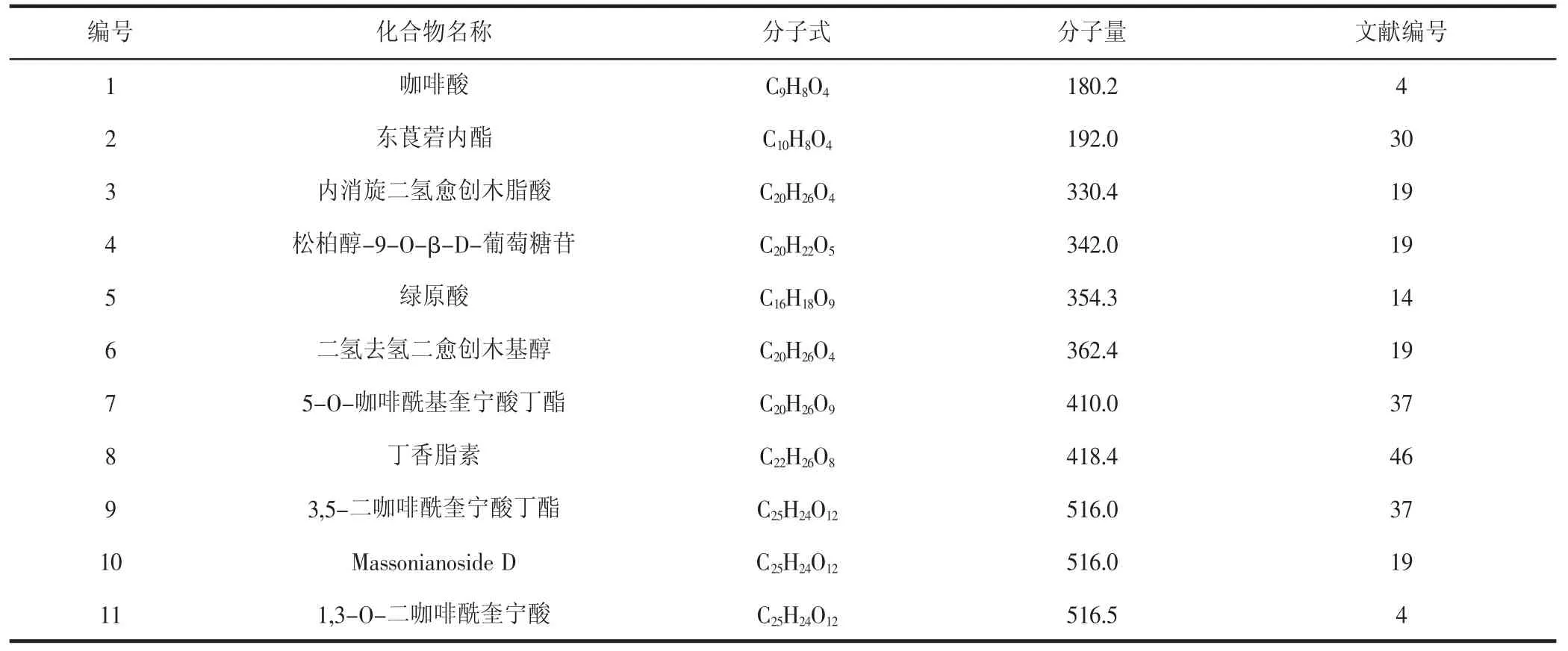
表5 青龍衣中的苯丙素類化合物

表6 青龍衣中的有機酸及其酯類物質
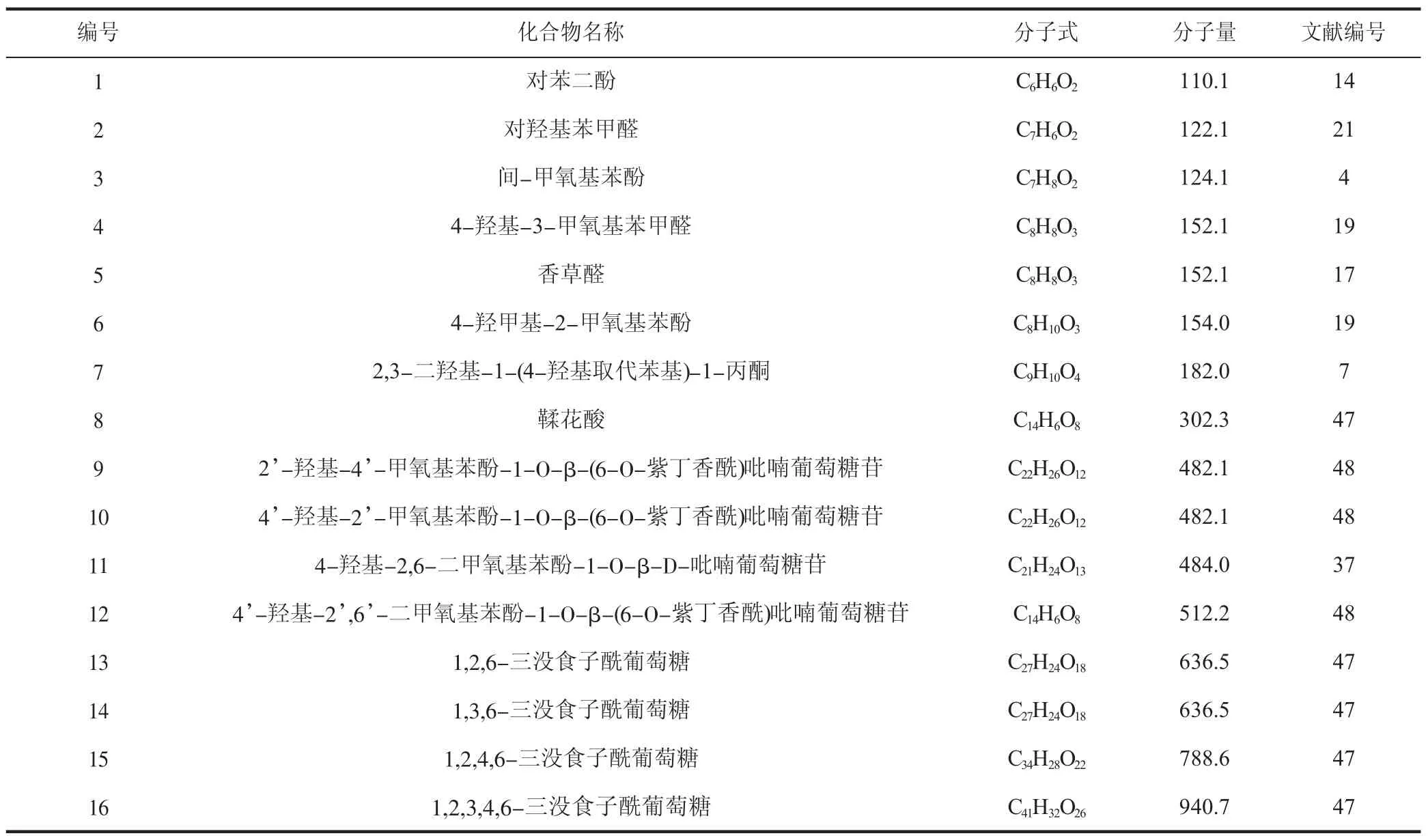
表7 青龍衣中的酚類化合物
2 生物活性
2.1 抗腫瘤活性
青龍衣在臨床中用于治療多種癌癥,特別對消化道腫瘤治療效果顯著[49]。曲中原等[50]利用四甲基偶氮唑藍(MTT)比色法,對青龍衣的醇提物以及不同溶劑萃取部位進行了體外抗腫瘤實驗,結果表明青龍衣的醇提物以及其石油醚、氯仿、乙酸乙酯萃取部位對四種腫瘤細胞株(SGC-7901、HepG-2、HCT-8、Capan-2) 均有細胞毒作用,是青龍衣抗腫瘤的主要活性部位。青龍衣石油醚部位還對人肝癌細胞Huh7.5.1和人宮頸癌細胞Hela抑制作用顯著,且高于氯仿及乙酸乙酯部位,其IC50分別為124.99μg/mL和45.33μg/mL,并可誘導人肝癌細胞Huh7.5.1凋亡[51]。青龍衣氯仿和乙酸乙酯部位對白血病細胞HL60和人胃癌細胞BGC823的抑制率均大于50%,其IC50<100μg/mL[52]。另外,李福榮[53]對青龍衣進行抗白血病細胞K562活性部位篩選,發現青龍衣乙酸乙酯部位對白血病細胞K562抑制作用顯著。張麗杰等[54]利用大孔樹脂對青龍衣乙醇提取物進行初步分離,通過MTT法進行人胃癌細胞BGC803的體外抑制活性實驗,實驗表明青龍衣30%乙醇洗脫組分的細胞毒作用最為顯著。隨后劉麗娟等[55,56]對青龍衣30%乙醇洗脫組分進行分離,得到4個萘酚苷類化合物,提示萘酚苷類化合物可能為青龍衣抗腫瘤的活性單體,進一步研究發現萘酚的單糖苷對人肝癌細胞SMMC 7721和人乳腺癌細胞MCF-7的抑制活性大于雙糖苷,其IC50<100μg/mL,同時沒食子酰基可能在抑瘤活性中發揮了重要作用。
青龍衣中的胡桃醌也是重要的具有明確抗腫瘤活性的有效成分,姬艷菊[57]研究了胡桃醌、亞砷酸注射液、奧沙利鉑及氟尿嘧啶對人肝癌細胞SMMC 7721的抑制效果,得出其抑制強度大小分別為奧沙利鉑>胡桃醌≈氟尿嘧啶>亞砷酸注射液,同時胡桃醌對人乳腺癌細胞和人宮頸癌細胞也有不同程度的抑制作用[58,59]。季雨彬等[60]以S180肉瘤小鼠為模型,考察胡桃醌的抗腫瘤效果及機制,研究表明胡桃醌對S180肉瘤小鼠的抑瘤作用顯著,其作用途徑是胡桃醌可以阻滯細胞生長的G2/M期。Kamei等[61]研究發現胡桃醌還可以通過抑制腫瘤細胞生長的S期,發揮抗腫瘤作用,其細胞毒強度與酚羥基個數呈正相關。Varga等[62]發現胡桃醌可以堵塞Ca2+通道,抑制細胞生長和T細胞增殖,從而誘導腫瘤細胞的凋亡。另外,胡桃醌還可以通過誘導腫瘤細胞DNA損傷以及抑制mRNA合成起到抗腫瘤作用[63,64]。
另外,青龍衣中多糖類成分也具有抗腫瘤作用,汲晨鋒等[65-68]作了一系列研究后提出,青龍衣多糖可以增強紅細胞功能,提高免疫能力,發揮抗腫瘤作用。
2.2 抑菌活性
青龍衣提取物對植物病原菌、細菌、真菌均有顯著的抑制作用。翟梅枝等[69]考察了青龍衣乙醇提取物及不同溶劑萃取物對34種常見植物病原菌的抑制活性,結果表明青龍衣乙醇提取物對34種供試菌均表現出不同程度的抑制作用,其中乙酸乙酯部位抑菌效果最好,對番茄灰霉、棉花立枯和小麥紋枯的抑制率可達到100%。任先偉等[70]采用管碟法和最低抑菌濃度(MIC)實驗研究了青龍衣不同極性提取物對7種細菌的抑菌活性,抑菌效果強弱分別為乙酸乙酯部位>氯仿部位>正丁醇部位>石油醚部位,其中乙酸乙酯相具有廣譜抑菌作用,對金黃色葡萄球菌的抑制效果最好,MIC為0.781mg/mL,抑菌機制主要是通過破壞菌體的細胞壁和細胞膜結構,影響細菌的生長繁殖。另有研究表明,胡桃醌是青龍衣發揮抑菌作用的有效成分,它可以抑制幽門螺桿菌中的酶HpCGS、HpFabD及HpFabZ達到抗幽門螺桿菌的作用[71]。同時,高濃度的胡桃醌可以抑制黃曲霉素的生長,而低濃度的胡桃醌則會對黃曲霉素的生長起到促進作用[72]。另外,胡桃醌還能夠通過抑制DNA聚合酶的活性,從而阻斷HIV病毒的復制[74]。
2.3 抗氧化活性
植物多酚因其羥基中的鄰位酚羥基極易被氧化,具有很強的清除自由基能力,是天然的抗氧化劑,植物多酚主要包括酚酸類、苯丙素類、黃酮類、木質素、大分子色素及鞣質等[74]。劉艷等[75]研究了青龍衣乙醇提取物和乙酸乙酯提取物對菜籽油的抗氧化作用,結果表明乙醇提取物的抗氧化活性高于乙酸乙酯提取物,且呈與濃度呈正相關。李利華[76]以清除·OH、O2-·以及NO2-的能力為指標,考察了青龍衣70%乙醇提取物、水提物、正丁醇提取物和乙酸乙酯提取物的抗氧化能力,研究顯示70%乙醇提取物清除自由基能力最強,且多酚含量高于其他提取物。萬政敏[77]對核桃不同部位的抗氧化成分進行分離,從青龍衣中檢測到9種多酚類物質,分別為沒食子酸、綠原酸、咖啡酸、對羥基苯甲酸、香豆酸、阿魏酸、蘆丁、桑色素、槲皮素。田平平等[78]以DPPH自由基清除能力為指標,利用UPLC-MS法從青龍衣中檢測到7中抗氧化活性成分,分別為綠原酸、短葉蘇木酚羧酸、花靛-葡萄糖/半乳糖、鞣花、槲皮素-阿拉伯糖、表兒茶素或兒茶素、槲皮素-3-O-葡萄糖苷等。
2.4 其他
青龍衣中的無機成分鉀鹽具有鎮痛活性[79],青龍衣與其它中藥配伍還可用于治療Ⅱ型糖尿病[80]。
3 研究展望
青龍衣作為我國傳統中藥,近年來國內外學者對其進行了廣泛而深入的研究,分離得到豐富的化學成分,在抗腫瘤活性的研究上也取得了較大進展;也應用到食品等其他領域。但青龍衣的資源問題一直不被重視,常被視為廢棄物得不到相應保護,目前急需更好的開發利用其生物活性的途徑和方法,充分利用這一寶貴的自然資源,減少浪費。
[1]南京中醫藥大學.中藥大辭典(下冊)[M].上海:上海科學技術出版社,2005.
[2]王艷秋.北青龍衣抗氧化活性譜效關系的研究 [D].哈爾濱:黑龍江大學,2013.
[3]王宏歌.核桃楸外果皮活性成分的研究 [D].哈爾濱:東北林業大學,2013.
[4]周媛媛,劉兆熙,孟穎,等.青龍衣乙酸乙酯部位的化學成分研究[J].中醫藥信息,2015,32(3):20-22.
[5]Min B S,Norio N R,Hirotsugu M,et al.Inhibition of Human ImmunodeficiencyVirusType 1 ReverseTranscriptase and Ribonuclease H Activities byConstituents ofJuglans Mandshurica[J].ChemPharmBull,2000,48(2):194-200.
[6]李海洋.核桃青皮有效化學成分及抑菌性研究 [D].咸陽:西北農林科技大學,2012.
[7]董梅,袁日,齊鳳琴,等.青龍衣中細胞毒活性成分的研究[J].天然產物研究與開發,2011,23(5):805-808.
[8]黃柳舒.山核桃果皮活性成分的研究 [D].杭州:浙江工商大學,2011.
[9]張建斌.甘肅青龍衣(核桃青皮)化學成分的研究[D].蘭州:西北師范大學,2009.
[10]Binder R G,Benson M E,Flath R A.Eight 1,4-naphth-Oquinones from Juglans[J].Phyto Chem,1989,28(10):2799-2801.
[11]王海香,中照靜,杜艷麗,等.胡桃屬植物青皮的化學成分及作用機理研究進展[J].生物質化學工程,2008,42(1):47-52.
[12]周媛媛,劉雨新,蔣艷秋,等.青龍衣抗腫瘤有效部位的化學成分研究[J].中草藥,2016,47(17):2979-2983.
[13]Machida K,Matsuoka E,Kasahara T,et al.Studies on the constituents of Juglans species.I.Structural determination of(4S)-and (4R)-4-hydroxy-alpha-tetralone derivatives from the fruit of JuglansmandshuricaMAXIM.var.sieboldianaMAKINO[J].Chemical&Pharmaceutical Bulletin,2005,53(8):934-937.
[14]周媛媛,劉兆熙,孟穎.青龍衣有效部位化學成分研究[J].中草藥,2014,45(16):2303-2306.
[15]王紅萍,尹江艷.核桃青皮的有效成分及綜合利用 [J].安徽農業科學,2013,(24):10129-10131.
[16]曲中原.青龍衣抗腫瘤活性成分及其作用機制研究 [D].北京:北京中醫藥大學,2010.
[17]周媛媛,蔣艷秋,孟穎,等.青龍衣活性部位的化學成分研究[J].中成藥,2015,37(2):332-335.
[18]劉元慧.山核桃外果皮的化學成分及生物活性研究 [D].杭州:浙江林學院,2009.
[19]周媛媛,劉雨新,蔣艷秋,等.青龍衣的化學成分[J].中成藥,2015,37(12):2669-2673.
[20]王艷梅.核桃楸青果皮生物活性及活性成分研究 [D].哈爾濱:東北林業大學,2008.
[21]管小玉,曲中原,鄒翔,等.胡桃楸的化學成分研究進展[J].中草藥,2009,(s1):35-38.
[22]皮新梅.青龍衣化學成分及殺蟲活性的研究[D].北京:北京化工大學,2014.
[23]周媛媛,劉雨新,孟穎,等.青龍衣中的醌類成分研究 [J].中醫藥學報,2015,(3):8-10.
[24]周媛媛,孟穎,蔣艷秋,等.青龍衣化學成分研究[J].中藥材,2014,37(11):1998-2001.
[25]戚雅君,翁琳,王增.山核桃的化學成分及藥理活性研究進展[J].中國醫院藥學雜志,2010,30(19):1682-1685.
[26]張建斌,柳軍璽,查飛,等.青龍衣的化學成分研究 [J].中草藥,2009,40(6):847-849.
[27]許紹惠,唐婉屏,韓忠環.核桃楸毒性成分研究[J].沈陽農業大學學報,1986(2):38-43.
[28]Min B S,Lee S Y,Kim J H,et al.Anti-complement activity of constituents from the stem-bark ofJuglans mandshurica.[J].Biological&Pharmaceutical Bulletin,2003,26(7):1042.
[29]Liu L,Li W,Koike K,et al.New alpha-tetralonyl glucosides from the fruit ofJuglans mandshurica[J].Chemical&Pharmaceutical Bulletin,2004,52(5):566.
[30]周媛媛,王棟.青龍衣化學成分的研究 [J].中醫藥信息,2010,27(2):18-20.
[31]李靜,徐康平,鄒輝,等.胡桃楸青果皮化學成分研究 [J].中南藥學,2013,11(1):1-3.
[32]周曄,王偉,王成章,等.核桃屬(Juglans)植物多酚類物質研究進展 [J].南京林業大學學報(自然科學版),2013,37(5):146-152.
[33]吳曉駿,吳威,趙余慶.山核桃化學成分和生物活性研究進展[J].食品研究與開發,2013,(12):127-130.
[34]高樹贏.北青龍衣的化學成分及質量標準的研究 [D].哈爾濱:黑龍江大學,2009.
[35]周媛媛,王棟.青龍衣中二芳基庚烷類成分研究 [J].中國實驗方劑學雜志,2011,17(22):92-93.
[36]張麗杰.北青龍衣細胞毒活性部位譜效關系的研究 [D].哈爾濱:黑龍江大學,2011.
[37]楊炳友,蔣艷秋,孟穎,等.青龍衣正丁醇部位化學成分研究[J].中草藥,2015,46(4):481-485.
[38]柳軍璽,邸多隆.核桃青皮中的二芳基庚烷類化合物[C]//中國化學會學術年會有機化學分會場.2008.
[39]Liu J X,Di D L,Huang X Y,et al.Two new diarylheptanoids fromthe pericarps ofJuglans regiaL[J].中國化學快報(英文版),2007,39(8):943-946.
[40]黃成鋼,閻新佳,鄒曉祺,等.青龍衣的化學成分和抗腫瘤活性研究 [J].哈爾濱商業大學學報(自然科學版),2014,(5):517-521.
[41]Buttery R G,Light D M,Nam Y,et al.Volatile components of green walnut husks.[J].Journal of Agricultural&Food Chemistry,2000,48(7):2858-61.
[42]李鑫,霍金海,郭麗娜,等.青龍衣的化學成分及其抗癌作用的研究進展[J].黑龍江中醫藥,2016,45(5):59-60.
[43]周媛媛,王棟,牛峰.抗腫瘤中藥青龍衣化學成分的研究[J].中草藥,2010,41(1):11-14.
[44]劉全宇.青龍衣化學成分的研究[D].哈爾濱:黑龍江中醫藥大學,2007.
[45]楊炳友,孟穎,劉兆熙,等.青龍衣中三萜類化合物的分析[J].中國實驗方劑學雜志,2015,21(2):49-52.
[46]周媛媛,付蕾,金陽,等.青龍衣抗腫瘤成分的研究 [J].中醫藥學報,2013,41(4):70-71.
[47]司傳領,劉忠,惠嵐峰,等.核桃楸樹皮提取物的化學成分及其抗氧化活性研究(英文)[J].林產化學與工業,2008,28(1):29-32.
[48]Machida K,Yogiashi Y,Matsuda S,et al.A new phenolic glycoside syringate from the bark ofJuglans mandshuricaMAXIM.var.sieboldiana MAKINO[J].Journal of Natural Medicines,2009,63(2):220-222.
[49]張洪娟,桑樹榮.高奎濱用青龍衣制劑治療腫瘤用藥經驗[J].黑龍江中醫藥,2000,(2):62.
[50]曲中原,鄒翔,崔蘭,等.青龍衣不同萃取部位抗腫瘤活性研究[J].上海中醫藥雜志,2009,(1):87-90.
[51]段燕玲,魏曉璐,任先偉,等.青龍衣提取物的抗真菌和抗腫瘤活性研究[J].食品工業科技,2016,37(13):77-82.
[52]劉薇,林文翰,季宇彬.青龍衣毒性作用及體外抗腫瘤作用的實驗研究[J].哈爾濱商業大學學報(自然科學版),2004,29(1):4-10.
[53]李福榮,王慶國,韓紀舉,等.青龍衣有效成分的初步提取分離及體外抗腫瘤活性研究 [J].時珍國醫國藥,2011,22(3):608-609.
[54]張麗杰,關健,劉麗娟.北青龍衣抗腫瘤譜效關系研究初探[J].現代生物醫學進展,2010,10(4):751-752.
[55]劉麗娟,王常禹,麻風華.北青龍衣細胞毒活性部位中的萘酚苷[J].中國現代應用藥學,2010,27(8):704-708.
[56]劉麗娟,齊鳳琴,龔顯峰.北青龍衣中萘醌類衍生物的細胞毒活性研究[J].中國現代應用藥學,2010,(7):574-577.
[57]姬艷菊,徐巍.青龍衣提取物對人肝癌細胞株抑制作用的實驗研究[J].中醫藥學報,2014,(5):30-34.
[58]許紹惠,許弘.胡桃屬植物毒性成分及其應用 [J].沈陽農業大學學報,1990,(2):167-170.
[59]RyoA,Liou Y C,Lu K P,et al.Prolyl isomerase Pin1:a catalyst for oncogenesis and a potential therapeutic target in cancer[J].Journal ofCell Science,2003,116(5):773-783.
[60]季宇彬,曲中原,鄒翔,等.青龍衣中胡桃醌對S180肉瘤小鼠的抑瘤作用研究[J].中國藥學雜志,2009,44(3):195-199.
[61]Kamei H,Koide T,Kojima T,et al.Inhibition of cell growth in culture byquinones[J].Cancer Biotherapy&Radiopharmaceuticals,1998,13(3):185.
[62]Varga Z,Bene L,Pieri C,et al.The effect of juglone on the membrane potentialand whole-cellK+currentsofhuman lymphocytes [J]. Biochemical & Biophysical Research Communications,1996,218(3):828.
[63]Paulsen M T,Ljungman M.The natural toxin juglone causes degradation of p53 and induces rapid H2AX phosphorylation and cell death in human fibroblasts [J].Toxicology& Applied Pharmacology,2005,209(1):1.
[64]Munday R,Munday C M.Induction of quinone reductase and glutathione transferase in rat tissues by juglone and plumbagin[J].Planta Medica,2000,66(05):399-402.
[65]王曉晶,季宇彬.青龍衣多糖對荷瘤小鼠紅細胞膜流動性及封閉度的影響[J].藥品評價,2005,2(4):76-79.
[66]季宇彬,陳海繼,汲晨鋒.青龍衣多糖對H22型腫瘤細胞ATP酶活性的影響[C]//全國化學生物學學術會議,2007:12.
[67]汲晨鋒,肖鳳,季宇彬.青龍衣多糖對S180小鼠紅細胞Ca2+,Mg2+-ATP酶活性及[Ca2+]i的影響[J].中草藥,2008,39(12):1842-1844.
[68]俞文婕,王添敏,翟延君.胡桃楸抗腫瘤作用及其機制研究概況[J].中國實驗方劑學雜志,2012,18(20):329-332.
[69]翟梅枝,王磊,何文君,等.核桃青皮乙醇提取物抑菌活性研究[J].西北植物學報,2009,29(12):2542-2547.
[70]任先偉,魏曉璐,黃鑫,等.核桃青皮提取物抑菌活性及抑菌機理研究[J].食品工業科技,2015,36(18):93-98.
[71]Kong Y H,Zhang L,Yang Z Y,et al.Natural product juglone targets three key enzymes from Helicobacter pylori:inhibition assay with crystal structure characterization[J].Acta Pharmacologica Sinica,2008,29(7):870-876.
[72]Mahoney N,Molyneux R J,Campbell B C.Regulation of aflatoxin production by naphthoquinones of walnut(Juglans regia)[J].Journal ofAgricultural&Food Chemistry,2000,48(9):4418-4421.
[73]Min B,Miyashiro H,Hattori M.Inhibitory effects of quinones on RNase H activity associated with HIV-1 reverse transcriptase[J].PhytotherapyResearch Ptr,2002,16(S1):57.
[74]劉暢,周家春.植物多酚抗氧化性研究 [J].糧食與油脂,2011,(2):43-46.
[75]劉艷,方晨,曹凱,等.新疆核桃青皮提取物抗氧化作用研究[J].食品工業,2012,(9):114-116.
[76]李利華.不同溶劑核桃青皮提取物抗氧化性能研究[J].食品工業,2017,(5):126-128.
[77]萬政敏.核桃青皮中多酚類物質及其抗氧化性的分析[D].呼和浩特:內蒙古農業大學,2007.
[78]田平平,李仁宙,簡永健,等.核桃青皮的強抗氧化活性成分及其抗氧化穩定性[J].中國農業科學,2016,49(3):543-553.
[79]杜旭,王明晶,姜力偉,等.中藥青龍衣鎮痛作用機理的研究[J].中國中醫藥科技,1997,(3):155-156.
[80]吳學勤.青龍衣治療Ⅱ型糖尿病臨床觀察 [C]//全國中藥研究與開發學術研討會論文摘要集[A],2001.
Research Progress of Chemical Constituents and Biological Actions of Pericarps ofJuglans mandshurica
GONG Jun-jie1,GONG Xue-bin1*,ZHANG Min2,ZHAO Yu-wei2,JIANG Jian-bo2
(1.Yantai Longda Hezhongbao Food Co.,Ltd,Yantai 265229,China;2.Longda Foodstuff Group Co.,Ltd,Yantai 265231,China)
Qinglongyi is dry peelJuglandaceaewalnut plant walnuts and walnut immature fruit,is a by-product of walnut processing industry.Several different classes of compounds have been separated from Pericarps ofJuglans mandshurica,including quinones,flavonoids,diarylheptanoids,terpenoids,phenylpropanoids and organic acids and their esters,ect.The modern biological studies show that Pericarps ofJuglans mandshuricahas various biological actions,such as anti-tumor,antimicrobial,antioxidant and other activities,which is widely used in clinical.This article aimed at reviewing the recent literatures on chemical constituents and biological actions while analyzing and expecting the research status of Pericarps of Juglans mandshurica,in order to provide reference for its further development and utilization.
Pericarps ofJuglans mandshurica;chemical constituents;biological actions;research progress
Q946.91
A
1008-1038(2017)12-0021-11
10.19590/j.cnki.1008-1038.2017.12.007
2017-09-19
宮俊杰(1973—),男,工程師,研究方向為農產品加工與安全控制
*通訊作者:宮學斌(1937—),男,高級工程師,研究方向為農產品加工與安全
1 5,7-二羥基色原酮 C9H6O4 178.2 7 2 5-羥基-7-甲氧基黃酮 C16H12O4 268.1 30 3山姜素 C16H14O4 270.1 31 4喬松酮 C16H14O4 270.3 8 5(2S)-5,7,4′-三羥基二氫黃酮 C15H12O5 272.1 3 6柚皮素 C16H12O5 272.1 26 7雙氫山奈酚 C15H12O5 272.1 18 8漢黃芩素 C16H12O5 284.1 31 9山奈酚 C15H10O6 286.0 18 10 櫻花亭 C16H14O5 286.3 13 11 3,5,7-三羥基-4'-甲氧基黃酮 C16H12O6 300.1 30 12 (2S)-5-羥基-6,7-二甲氧基二氫黃酮 C17H16O5 300.1 31 13 5-羥基-7,8-二甲氧基二氫黃酮 C17H16O5 300.1 31 14 5-羥基-7,4′-二甲氧基黃烷酮 C17H16O5 300.1 13 15 槲皮素 C15H10O7 302.0 32 16 桑色素 C15H10O7 302.0 32 17 黃杉素 C15H12O7 304.3 5 18 黃卡瓦胡椒素 C18H18O5 314.1 33 19 楊梅素 C15H10O8 318.0 5 20 5-羥基 -3,7,3″,4″-四甲氧基黃酮 C19H18O7 358.1 3 21 5-羥基-3,7,3′,4′-四甲氧基黃酮 C20H20O7 372.1 3 22 胡桃苷 C20H18O10 418.4 13 23 柚皮素-7-O-β-D-吡喃葡萄糖苷 C22H24O9 432.1 26 24 山奈酚-3-O-α-L-鼠李糖苷 C21H20O10 432.4 12 25 阿福豆苷 C21H20O10 432.4 34 26 扁蓄苷 C20H18O11 434.4 13 27 槲皮素-3-木糖苷 C20H18O11 434.4 13 28 6,5’-二異戊烯基槲皮素 C25H26O7 438.0 12 29 山奈酚-3-O-β-D-葡萄糖苷 C23H24O9 444.1 35 30 山奈酚-3-O-α-L-鼠李糖 C22H23O10 447.1 36 31 山奈酚-3-O-β-D-吡喃葡萄糖苷 C21H20O11 448.4 37 32 槲皮苷 C21H20O11 448.4 34 33 槲皮素-3-阿拉伯吡喃糖苷 C21H21O11 449.1 32 34 槲皮素-3-O-α-L-鼠李糖苷 C22H23O11 463.1 32

