PP2A調控p38信號通路對星形膠質細胞遷移能力的影響研究
張黎軍 趙盼盼 隨瑞斌 徐志秀 李 青 王超偉 趙建華 袁 彬 吉四輩
新鄉醫學院第一附屬醫院神經內科,河南 衛輝 453100
·論著科研之窗·
PP2A調控p38信號通路對星形膠質細胞遷移能力的影響研究
張黎軍 趙盼盼 隨瑞斌 徐志秀 李 青 王超偉 趙建華 袁 彬 吉四輩△
新鄉醫學院第一附屬醫院神經內科,河南 衛輝 453100
目的探討蛋白磷酸酯酶- 2A(PP2A)對星形膠質細胞遷移能力影響及機制研究。方法體外分離培養乳鼠原代星形膠質細胞,分別用PP2A激活劑DES(激活組)和抑制劑OA(抑制組)作用于星形膠質細胞,同時設置對照組,對照組細胞中加入等量DMSO。PP2A活性檢測試劑盒檢測細胞中PP2A活性,Transwell小室檢測細胞遷移能力,Western blot檢測細胞中p38、p- p38、MMP- 2、MMP- 9蛋白水平。用p38信號通路抑制劑SB202190和PP2A激活劑DES共同作用于星形膠質細胞,檢測細胞的遷移能力及細胞中p38、p- p38、MMP- 2、MMP- 9蛋白水平。結果抑制組細胞中PP2A活性明顯低于對照組,而激活組細胞中PP2A活性明顯高于對照組,差異均有統計學意義(P<0.01)。抑制組細胞遷移能力和細胞中MMP- 2、MMP- 9水平明顯低于對照組(P<0.01)。激活組細胞遷移能力和細胞中MMP- 2、MMP- 9水平明顯高于對照組(P<0.01)。抑制組細胞中p- p38水平與對照組相比明顯升高,而激活組細胞中p- p38水平與對照組相比明顯降低,差異均有統計學意義(P<0.01)。p38信號通路抑制劑SB202190和PP2A激活劑DES共同作用后的細胞遷移能力及MMP- 2、MMP- 9蛋白水平較SB202190單獨作用后均明顯升高(P<0.01)。結論PP2A負調控p38信號通路促進星形膠質細胞遷移。
星形膠質細胞;PP2A;遷移;p38信號通路
星形膠質細胞是一種廣泛存在于哺乳動物腦內的膠質細胞[1]。星形膠質細胞能夠促進神經的修復和再生,在維持血腦屏障、神經系統內環境穩定和神經系統損傷中均有重要作用[2- 4]。有研究表明,星形膠質細胞的遷移在神經性退變疾病中發揮關鍵作用[5]。研究星形膠質細胞的遷移對中樞神經系統疾病的治療具有重大意義。PP2A是一種絲氨酸/蘇氨酸蛋白磷酸酶,共有75種異源三聚體,參與多種細胞的生物學功能[6]。有研究表明,上調星形膠質細胞中PP2A的水平能夠改善APP/PS1雙轉基因小鼠的神經損傷[7]。本研究體外分離培養了星形膠質細胞,探討PP2A對星形膠質細胞遷移的作用,以期為治療中樞神經系統疾病提供理論基礎。
1 材料與方法
1.1材料
1.1.1 實驗動物:出生48 h內的SD乳鼠購自于新鄉醫學院動物實驗中心。
1.1.2 主要儀器及試劑:p38單克隆抗體、p- p38單克隆抗體、MMP- 2單克隆抗體、MMP- 9單克隆抗體、β- actin單克隆抗體均購自于美國Cell Signaling;倒置顯微鏡購自于日本Olympus;CO2培養箱購自于美國Thermo;Transwell 小室購自于美國康寧;PP2A活性檢測試劑盒購自于美國Promega;BCA蛋白濃度檢測試劑盒購自于碧云天生物技術研究所。
1.2方法
1.2.1 星形膠質細胞分離培養:取出生48 h內的SD乳鼠,用75%酒精消毒后,斷頸處死。取出乳鼠大腦組織放在平皿中,加入PBS洗滌3次,觀察洗滌液透亮時,取出腦皮層組織,用眼科剪剪碎后,加入0.125%的胰蛋白酶,放在37 ℃中消化15 min,期間每隔3 min搖晃一次。視組織塊大小消化時間不同,觀察組織完全消化后,加入含有10% FBS、100 U/mL雙抗的DMEM/F12細胞培養液終止消化,過篩(200目),1 000 rpm離心10 mn。棄上清液,加入適量的細胞培養液懸浮細胞,接種到細胞培養瓶中,放在37 ℃,5% CO2培養箱中培養。每3 d更換一次培養液,9 d后,密封細胞培養瓶,放在37 ℃的搖床上,100 rpm培養過夜。分離培養的細胞表達GFAP,鑒定為星形膠質細胞。更換新鮮培養液,培養至第2代時可進行細胞實驗。
1.2.2 實驗分組:細胞實驗分為3組,依次為對照組,抑制組,激活組。對照細胞中加入等量的DMSO;抑制組中加入15 nM的PP2A抑制劑OA;激活組加入15 nM的PP2A激活劑DES。
1.2.3 PP2A酶活性檢測:取1.2.2各組細胞,培養48 h后,加入細胞裂解液,放置于冰上裂解20 min,轉移裂解液至EP管中,4 ℃,12 000 rpm離心10 min,吸取蛋白上清至EP管中,按照BCA蛋白濃度檢測試劑盒檢測提取的蛋白濃度。取50 μg蛋白樣品按照PP2A活性檢測試劑盒說明書檢測樣品中PP2A的活性。依據磷酸鹽標準曲線計算樣品中PP2A的活性。
1.2.4 Transwell小室檢測細胞遷移:取第2代星形膠質細胞,經胰蛋白酶消化后,根據1.2.2分組中加入對應的含有1% FBS的細胞培養液懸液細胞,調整細胞濃度為1×105個/mL。取500 μL細胞懸液加入到經PDL事先包被好的Transwell小室的上室,在小室的下室加入700 μL的含有10% FBS的細胞培養液。將小室放在12孔板上,在37 ℃,5% CO2培養箱中培養8 h后,把上層多余的細胞擦掉。觀察8 h后細胞的遷移的數目。總細胞數目是膜上層的細胞和膜下層的細胞之和。細胞遷移率=膜上層的細胞/總細胞數目。
1.2.5 Western blot檢測細胞中p38、p- p38、MMP- 2、MMP- 9蛋白水平:取1.2.2中各組細胞,培養48 h后,棄細胞培養液,加入裂解液,放在冰上裂解20 min,移液槍反復吹打細胞,轉移裂解液至EP管中,15 000 rpm,4 ℃離心10 min。吸取蛋白上清液至EP管中。根據BCA蛋白濃度檢測試劑盒對蛋白樣品進行定量。取蛋白樣品與Loading buffer 混合后,放置于沸水中5 min。將蛋白樣品加入到PAGE凝膠上樣孔中,每孔中加入60 μL的變性蛋白樣品。觀察溴酚藍移動到分離膠和濃縮膠的交界處,100 V電壓電泳90 min。取出蛋白凝膠,將蛋白轉印至NC膜上,轉膜電流為275 mA,轉膜時間為60 min。用4%脫脂奶粉封閉轉印后的NC膜。與一抗(800倍稀釋)在4 ℃孵育過夜,二抗(1 000倍稀釋)37 ℃孵育120 min后,滴加顯色液,分析蛋白相對表達水平。
1.2.6 抑制p38信號通路對星形膠質細胞遷移的影響:取第2代的星形膠質細胞,分為3組,依次為SB202190組、DES+SB202190組和未處理組。SB202190組細胞用含有p38信號通路抑制劑SB202190終濃度為30 μmol/L的細胞培養液培養細胞,DES+SB202190組用p38信號通路抑制劑SB202190終濃度為30 μmol/L和15 nM的PP2A激活劑DES共同作用,未處理組細胞用正常細胞培養液培養細胞。參照1.2.4 Transwell小室檢測8 h細胞遷移情況,參照1.2.5 Western blot檢測細胞中p38、p- p38、MMP- 2、MMP- 9蛋白水平。
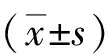
2 結果
2.1細胞中PP2A活性檢測結果分別用15 nM的PP2A抑制劑OA和15 nM的PP2A激活劑DES作用于星形膠質細胞,檢測細胞中PP2A活性。結果顯示,抑制劑OA作用后的細胞中PP2A活性明顯低于對照組,差異具有統計學意義(P<0.01)。激活劑DES作用后的細胞中PP2A活性明顯高于對照組,差異具有統計學意義(P<0.01)。見圖1。

1:對照組;2:抑制組;3:激活組;##P<0.01 vs 對照組;**P<0.01 vs 對照組圖1 細胞中PP2A活性檢測結果
2.2 PP2A對細胞遷移影響結果星形膠質細胞經15 nM的PP2A抑制劑OA和15 nM的PP2A激活劑DES作用后,Transwell小室檢測細胞的遷移能力,Western blot檢測細胞中MMP- 2、MMP- 9蛋白水平。結果顯示,抑制劑OA作用后的細胞遷移能力和細胞中MMP- 2、MMP- 9蛋白水平均明顯低于對照組,差異具有統計學意義(P<0.01)。激活劑DES作用后的細胞遷移能力和細胞中MMP- 2、MMP- 9蛋白水平明顯高于對照組,差異具有統計學意義(P<0.01)。見圖2。

1:對照組;2:抑制組;3:激活組;A:細胞遷移率;B:Western blot結果圖;C:以β- actin為內參,目的蛋白相對表達水平;##P<0.01 vs 對照組;**P<0.01 vs 對照組圖2 PP2A對細胞遷移影響結果
2.3 PP2A對p- p38蛋白表達影響檢測結果星形膠質細胞經15 nM的PP2A抑制劑OA和15 nM的PP2A激活劑DES作用后,Western blot檢測細胞中p- p38水平。結果顯示,抑制劑OA作用后的細胞中p- p38蛋白水平明顯高于對照組,差異具有統計學意義(P<0.01)。激活劑DES作用后的細胞中p- p38蛋白水平明顯低于對照組,差異具有統計學意義(P<0.01)。見圖3。

1:對照組;2:抑制組;3:激活組;A:Western blot結果圖;B:以p38為內參,p- p38蛋白相對表達水平;##P<0.01 vs 對照組;**P<0.01 vs 對照組圖3 PP2A對p- p38蛋白表達影響檢測結果
2.4 p38信號通路抑制劑對p- p38蛋白表達影響檢測結果星形膠質細胞經30 μmol/L p38信號通路抑制劑SB202190作用后,Western blot檢測細胞中p- p38水平。結果顯示,p38信號通路抑制劑作用后的細胞中p- p38蛋白水平明顯低于未處理組,差異具有統計學意義(P<0.01)。見圖4。

1:未處理組;2:信號通路抑制劑組;A:Western blot結果圖;B:以p38為內參,p- p38蛋白相對表達水平;**P<0.01 vs 未處理組圖4 p38信號通路抑制劑對p- p38蛋白表達影響檢測結果
2.5抑制p38信號通路對細胞遷移影響結果星形膠質細胞經 p38信號通路抑制劑SB202190和PP2A激活劑DES共同作用后,Western blot檢測細胞中MMP- 2、MMP- 9水平,Transwell小室檢測細胞遷移能力。結果顯示,p38信號通路抑制劑作用后的細胞遷移能力和細胞中MMP- 2、MMP- 9蛋白水平明顯高于未處理組,差異具有統計學意義(P<0.01)。p38信號通路抑制劑SB202190和PP2A激活劑DES共同作用后的細胞遷移能力和細胞中MMP- 2、MMP- 9蛋白水平明顯高于SB202190組,差異具有統計學意義(P<0.01)。見圖5。
3 討論
星形膠質細胞是一類與中樞神經系統密切相關的細胞。最初認為星形膠質細胞對神經元具有營養作用,隨著研究的深入發現,星形膠質細胞在神經系統中具有廣泛的生物學功能[8]。在中樞神經系統中,星形膠質細胞具有傳遞神經遞質、維持突觸生物學功能等多種作用[9- 11]。另外,星形膠質細胞在中樞神經系統疾病中同樣發揮重要作用。在AD病人腦內的老年斑周圍有大量的星形膠質細胞的聚集[12]。研究星形膠質細胞的遷移對AD發病機制具有重要意義。
PP2A具有A、B、C三個亞基,含有數量龐大的三聚體,而這些三聚體能夠以多種方式影響細胞內的多種蛋白,從而參與細胞的多種生物學功能的發揮過程[13]。最近的研究表明,PP2A在中樞神經系統中發揮重要作用,PP2A活性降低能夠破壞神經元軸突功能的發揮[14- 15]。PP2A在AD病人的腦內活性下降,而PP2A是否能夠影響星形膠質細胞的遷移。本研究通過體外分離培養星形膠質細胞,用 PP2A激活劑和抑制劑分別作用于星形膠質細胞,結果發現,PP2A激活劑和抑制劑能夠有效促進PP2A活性和抑制PP2A活性。進一步檢測了細胞的遷移情況,結果發現,PP2A具有促進星形膠質細胞遷移的能力。

1:未處理組;2:SB202190組;3:DES+SB202190組;A:細胞遷移率;B:Western blot結果圖;C:以β- actin為內參,目的蛋白相對表達水平;**P<0.01 vs 未處理組;##P<0.01 vs SB202190組圖5 抑制p38信號通路對細胞遷移影響結果
細胞遷移是一種細胞運動現象,在血管生成、免疫反應、胚胎發育、癌癥發生、傷口愈合、神經退行性疾病等過程中發揮重要作用[16- 17]。細胞遷移是一個復雜的過程,受多種基因的共同嚴格調控。基質金屬蛋白酶家族(MMPs)是目前為止研究較多的與細胞遷移有關的蛋白家族。其中MMP- 2、MMP- 9在細胞遷移過程中發揮關鍵作用[18]。本研究中進一步檢測了細胞中的MMP- 2、MMP- 9蛋白水平,結果發現,PP2A激活劑能夠促進星形膠質細胞中MMP- 2、MMP- 9蛋白的表達,而PP2A抑制劑能夠抑制星形膠質細胞中MMP- 2、MMP- 9蛋白的表達,這與細胞遷移檢測結果相符。
p38是絲裂原活化蛋白激酶(MAPKs)家族的成員之一,在細胞信號轉導過程中發揮作用[19]。有研究表明,p38參與炎癥反應、生理應激、細胞遷移、神經系統疾病發生等過程[20- 21]。本研究中,檢測了PP2A激活劑和抑制劑作用后的細胞中p38的磷酸化水平。結果發現,PP2A激活劑能夠減弱p38的磷酸化水平,而PP2A抑制劑則增強了p38的磷酸化水平。為了探討p38信號通路對星形膠質細胞的影響,用p38信號通路特異性抑制劑作用于星形膠質細胞,結果發現,p38信號通路特異性抑制劑同樣能夠增強星形膠質細胞的遷移能力,并且能夠增強PP2A激活劑促遷移能力。這提示,PP2A可能通過負調控p38信號通路促進星形膠質細胞的遷移。
PP2A能夠促進星形膠質細胞的遷移,作用機制可能與p38信號通路有關。這為進一步研究PP2A對星形膠質細胞生物學活性的作用奠定了基礎,為治療神經退行性疾病提供了理論基礎。
[1] Furihata T,Ito R,Kamiichi A,et al.Establishment and characterization of a new conditionally immortalized human astrocyte cell line[J].Journal of Neurochemistry,2016,136(1):92- 105.
[2] Maresca B,Spagnuolo MS,Cigliano L.Haptoglobin modulates beta- amyloid uptake by U- 87 MG astrocyte cell line[J].Journal of Molecular Neuroscience,2015,56(1):35- 47.
[3] Rajalakshmy AR,Malathi J,Madhavan HN.Serum- derived hepatitis C virus 1a infection of human astrocyte cell line SVG[J].Journal of viral hepatitis,2016,23(3):211- 216.
[4] Ono K,Suzuki H,Higa M,et al.Glutamate release from astrocyte cell- line GL261 via alterations in the intracellular ion environment[J].Journal of Neural Transmission,2014,121(3):245- 257.
[5] Seyedzadeh MH,Safari Z,Zare A,et al.Study of curcu- min immunomodulatory effects on reactive astrocyte cell function[J].International immunopharmacology,2014,22(1):230- 235.
[6] Gürsel DB,Banu MA,Berry N,et al.Tight regulation between cell survival and programmed cell death in GBM stem- like cells by EGFR/GSK3b/PP2A signaling[J].Journal of neuro- oncology,2015,121(1):19- 29.
[7] Juraszek B,Na?cz KA.Protein phosphatase PP2A- a novel interacting partner of carnitine transporter OCTN2 (SLC22A5) in rat astrocytes[J].Journal of Neurochemistry,2016,139(4):537- 551.
[8] 高志影,榮華,劉得水,等.β- 細辛醚對皮質酮誘導原代培養星形膠質細胞凋亡的干預作用[J].中國老年學雜志,2016,36(3):566- 568.
[9] Quincozes- Santos A,Bobermin LD,Latini A,et al.Resveratrol protects C6 astrocyte cell line against hydrogen peroxide- induced oxidative stress through heme oxyge- nase 1[J].PLoS One,2013,8(5):e64372.
[10] 余萍萍,王莉,唐凡人,等.白藜蘆醇對大鼠腦缺血/再灌注損傷后星形膠質細胞活化的影響[J].中國藥理學通報,2015,31(9):1 228- 1 233.
[11] Degos V,Chhor V,Brissaud O,et al.Neuroprotective effects of dexmedetomidine against glutamate agonist- induced neuronal cell death are related to increased astrocyte brain- derived neurotrophic factor expression[J].The Journal of the American Society of Anesthesiologists,2013,118(5):1 123- 1 132.
[12] Medeiros R,Castello NA,Cheng D,et al.α 7 Nicotinic receptor agonist enhances cognition in aged 3xTg- AD mice with robust plaques and tangles[J].The American journal of pathology,2014,184(2):520- 529.
[13] Petty EL,Lafon A,Tomlinson SL,et al.Promotion of Cell Viability and Histone Gene Expression by the Acetyltransferase Gcn5 and the Protein Phosphatase PP2A in Saccharomyces cerevisiae[J].Genetics,2016,203(4):1 693- 1 707.
[14] Chica N,Rozalén AE,Pérez- Hidalgo L,et al.Nutri- tional control of cell size by the greatwall- endosulfine- PP2A·B55 pathway[J].Current Biology,2016,26(3):319- 330.
[15] Merrill RA,Slupe AM,Strack S.N- terminal phosphorylation of PP2A/Bβ2 regulates translocation to mitochondria,Drp1 dephosphorylation,and neuronal survival[J].The FEBS journal,2013,280(2):662.
[16] Berns EJ,Sur S,Pan L,et al.Aligned neurite outg- rowth and directed cell migration inself- assembled monodomain gels[J].Biomaterials,2014,35(1):185- 195.
[17] Yang K,Cao F,Sheikh AM,et al.Up- regulation of Ras/Raf/ERK1/2 signaling impairs cultured neuronal cell migration,neurogenesis,synapse formation,and dendritic spine development[J].Brain Structure and Function,2013,218(3):669- 682.
[18] Dayer C,Stamenkovic I.Recruitment of matrix metalloproteinase- 9 (MMP- 9) to the fibroblast cell surface by lysyl hydroxylase 3 (LH3) triggers transforming growth factor- β (TGF- β) activation and fibroblast differentiation[J].Journal of Biological Chemistry,2015,290(22):13 763- 13 778.
[19] Ghosh S,Kumar A,Tripathi RP,et al.Connexin- 43 regulates p38- mediated cell migration and invasion induced selectively in tumour cells by low doses of γ- radiation in an ERK- 1/2- independent manner[J].Carcinogenesis,2014,35(2):383- 395.
[20] Koci J,Santibaez J F,Krsti A,et al.Interleukin- 17 modulates myoblast cell migration by inhibiting urokinase type plasminogen activator expression through p38 mitogen- activated protein kinase[J].The international journal of biochemistry & cell biology,2013,45(2):464- 475.
[21] Bernet JD,Doles JD,Hall JK,et al.p38 MAPK signa- ling underlies a cell- autonomous loss of stem cell self- renewal in skeletal muscle of aged mice[J].Nature medicine,2014,20(3):265- 271.
EffectofPP2Aregulatesp38signalingpathwayonthemigrationofastrocytes
ZHANGLijun,ZHAOPanpan,SUIRuibin,XUZhixiu,LIQing,WANGChaowei,ZHAOJianhua,YUANBin,JISibei
DepartmentofNeurology,theFirstAffiliatedHospitalofXinxiangMedicalUniversity,Weihui453100,China
ObjectiveTo investigate the effect and mechanism of PP2A on the migration of astrocytes.MethodsRat primary astrocytes were isolated and cultured in vitro,and treated with PP2A activator DES (active group) and inhibitor OA (inhibition group),respectively.The control group was treated with same amount of DMSO.We detected the PP2A activity with PP2A activity assay kit,cell migration ability with transwell assay,and the levels of p38,p- p38,MMP- 2,MMP- 9 by Western blot.We also treated the astrocytes with P38 signaling pathway inhibitor SB202190 and activator DES,and then detected the migration ability of the cells and the levels of p38,p- p38,MMP- 2 and MMP- 9 protein.ResultsPP2A activity in the inhibition group was significantly lower than that in the control group,while the PP2A activity in active group was significantly higher than that in the control group,the differences were statistically significant (P<0.01).The cell migration ability and the level of MMP- 2 and MMP- 9 in the inhibition group were significantly lower than those in the control group (P<0.01).The cell migration ability and the levels of MMP- 2 and MMP- 9 in the activated group were significantly higher than those in the control group (P<0.01).Compared with control group,the levels of p- p38 in the control group were significantly higher than that in the control group,while the p- p38 level in the activated group was significantly lower than that in the control group,and the differences were statistically significant (P<0.01).Cells treated with SB202190 and DES showed higher migration ability and MMP- 2,MMP- 9 protein levels than that treated with SB202190 only (P<0.01).ConclusionPP2A negatively regulates the p38 signaling pathway to promote the migration of astrocytes.
Astrocyte;PP2A;Migration;P38 signaling pathway
10.3969/j.issn.1673- 5110.2017.20.005
河南省科技廳科技攻關項目(編號172102310685)
△通信作者:吉四輩(1966—),碩士研究生,主任醫師。研究方向:腦血管病基礎與臨床方向。
R730.264
A
1673- 5110(2017)20- 0020- 06
(收稿2017- 05- 13)
王喜梅

