Bcl-2蛋白抑制鈣信號的建模與全局動力學分析?
牛帥帥建偉祁宏
1)(山西大學復雜系統研究所,太原 030006)
2)(山西大學數學科學學院,太原 030006)
3)(廈門大學物理系,廈門 361005)
Bcl-2蛋白抑制鈣信號的建模與全局動力學分析?
牛帥1)2)帥建偉3)?祁宏1)?
1)(山西大學復雜系統研究所,太原 030006)
2)(山西大學數學科學學院,太原 030006)
3)(廈門大學物理系,廈門 361005)
Bcl-2蛋白,鈣信號,分岔分析
1 引 言
鈣離子(Ca2+)作為細胞內重要的信使分子,參與并控制著幾乎一切重要的細胞活動過程[1],被認為是生物體的一種“生存因子”[2].在靜息狀態下,細胞內的大部分Ca2+儲藏于內質網中,細胞質內的Ca2+濃度([Ca2+]Cyt)處在一個較低的水平.當細胞受到生理刺激時,Ca2+從位于內質網上的IP3R通道釋放到細胞質中,同時可經心肌肌漿網鈣泵(SERCA)返回到內質網中,因此[Ca2+]Cyt會以振蕩的形式變化.Ca2+正是通過鈣振蕩的振幅、周期以及持續時間來控制各種生理活動[3].但鈣信號是把雙刃劍,當IP3R通道過量釋放Ca2+時,細胞質中Ca2+會呈現高幅振蕩[4?6]或持續提升[6?8],引發一系列災難性事件,從而導致細胞死亡[9,10],因此Ca2+也被認為是細胞的“無情殺手”[2].
正因為Ca2+是一種生死攸關的信號分子,所以負責釋放它的IP3R通道就成為細胞內的“信號中心”[11].實驗表明細胞內存在多種直接或間接調控IP3R通道活性的蛋白[11,12],它們對鈣信號的振幅和頻率等發揮著復雜的調控作用,從而使得Ca2+振蕩對不同刺激信號有豐富的編碼行為,抗凋亡蛋白Bcl-2就是其中重要的一員[13].實驗研究結果表明,Bcl-2抑制IP3R通道活性從而降低[Ca2+]Cyt的機制主要有兩種:一種是2009年文獻[14]中提出的Bcl-2可以直接結合在IP3R通道上,促使其構象發生改變,從而減少Ca2+的釋放,稱為直接機制;另一種是2014年文獻[15]中提出的Bcl-2可為多巴胺-cAMP調節的磷蛋白(DARPP-32)與鈣調神經磷酸酶(CaN)提供結合平臺,它們的結合可以促使pDARPP-32去磷酸化,從而減緩它對蛋白磷酸酶1(PP1)的抑制作用,導致IP3R通道去磷酸化,最終削弱它釋放Ca2+的能力.簡言之,第二種機制是Bcl-2及其相關蛋白構成一個負反饋環改變IP3R通道的磷酸化狀態,間接減少它所釋放的Ca2+,稱為間接機制.
可以看出,相比于直接機制,間接機制非常復雜,僅依靠實驗現象很難全面理解各種信號之間復雜的相互作用關系,所以該間接機制如何具體調控鈣信號,依然是一個有待探討的重要問題.如果利用數學建模的方法,特別是分岔理論[16],定量研究它們之間的相互作用過程,就可以更系統且深入地理解該機制[17].因此,基于間接機制,建立了Bcl-2調節鈣信號的數學模型,利用數值模擬方法定量研究Bcl-2對鈣信號的抑制作用,通過分岔理論對模型進行系統地分析,以期能夠全面理解Bcl-2間接抑制鈣信號相關的信號通路,并預測一些實驗結果,為治療鈣信號失調引起的相關疾病提供一些潛在的思路.
2 模型和方法
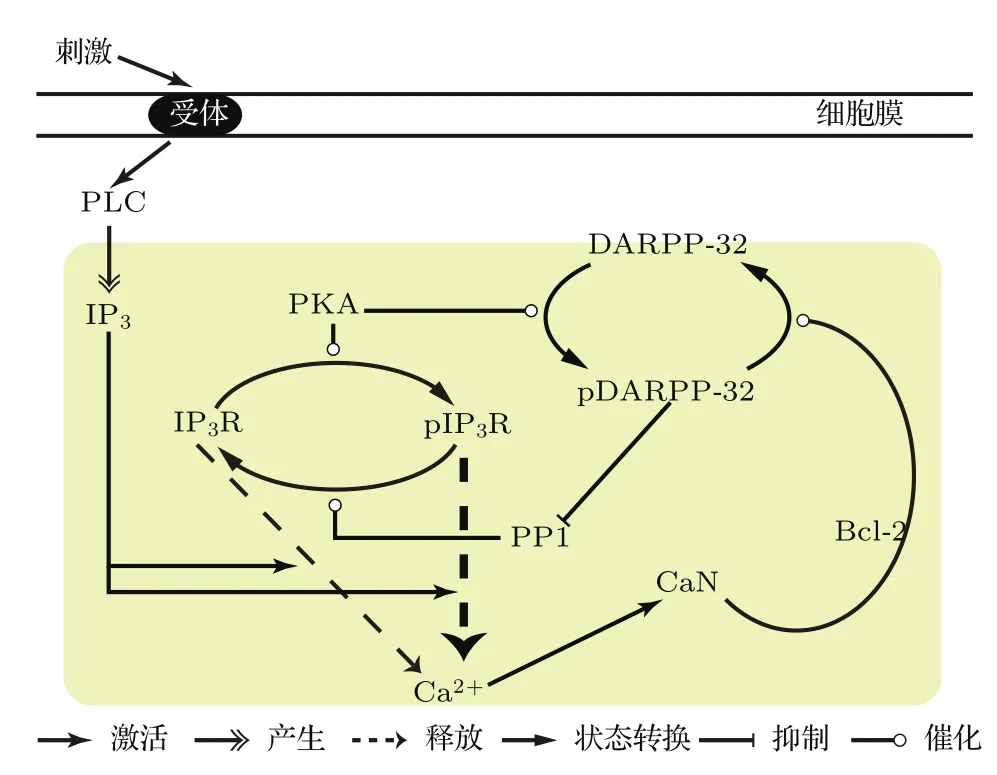
圖1 (網刊彩色)Bcl-2及其相關蛋白調節Ca2+釋放機制圖外界刺激使細胞膜上的受體激活磷脂酶C(PLC)并產生IP3,IP3結合到IP3R通道使Ca2+釋放.虛線粗箭頭表示pIP3R比IP3R釋放Ca2+能力更強Fig.1.(color online)Mechanism of Bcl-2 and its related proteins on Ca2+release.An extracellular signal molecule binds to its receptor and activates phospholipase C(PLC).The latter stimulates the formation of IP3,which binds to IP3R channel and modulates Ca2+release.The bold dashed arrow depicts that the release of Ca2+from pIP3R is stronger than IP3R.
基于文獻[15]總結的機制構建模型,但只考慮圖1中黃色部分,用IP3的濃度([IP3])來反映刺激的大小,其取值范圍為0—1μM.該模型包含3個模塊:[Ca2+]Cyt變化、IP3R通道的磷酸化與去磷酸化、Bcl-2及其相關蛋白構成的負反饋環.
2.1 Ca2+模塊
采用Li-Rinzel模型刻畫[Ca2+]Cyt的變化[18].在一個封閉的細胞中,[Ca2+]Cyt的變化主要由三個因素決定:1)Ca2+通過IP3R通道從內質網釋放到細胞質中,記為Jchan;2)Ca2+從內質網滲漏到細胞質中,記為Jleak;3)位于內質網上的SERCA鈣泵將細胞質中的Ca2+泵回到內質網中,記為Jpump.Li-Rinzel模型的另一個動力學變量h是與Jchan相關的IP3R通道開通的比例,因此該模型表示為
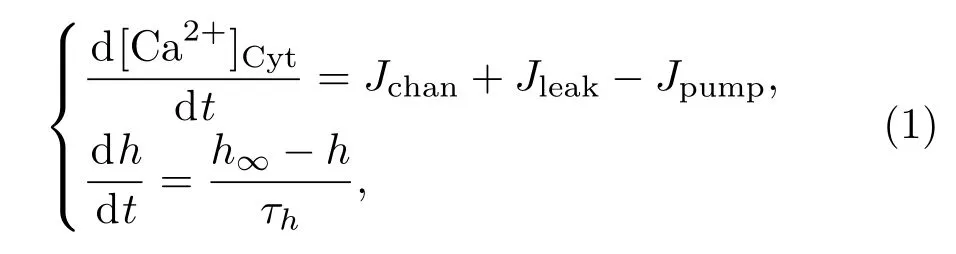
其中,

2.2 IP3R通道磷酸化與去磷酸化模塊
IP3R通道(本文指IP3R-1蛋白,其第1755位氨基酸為絲氨酸)有磷酸化(pIP3R)和非磷酸化(IP3R)兩種狀態,且前者釋放Ca2+的能力更強[15].若把每摩爾IP3R通道釋放Ca2+的最大速率記為k,pIP3R與IP3R釋放Ca2+的速率比記為α(1<α≤9),那么Li-Rinzel模型中IP3R通道釋放Ca2+的最大速率u1可以表示為
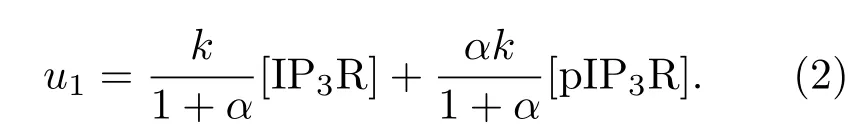
此外,IP3R兩種狀態之間的轉換是由兩種酶催化的:蛋白激酶A(PKA)可使其磷酸化成為pIP3R,而PP1則可使pIP3R去磷酸化成為IP3R.磷酸化與去磷酸化的過程可用米曼方程描述[19],pIP3R的濃度變化可表示為
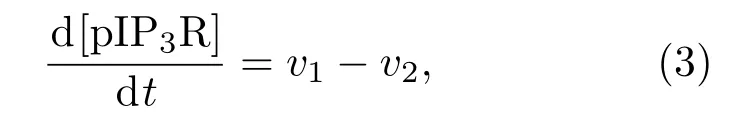
其中,
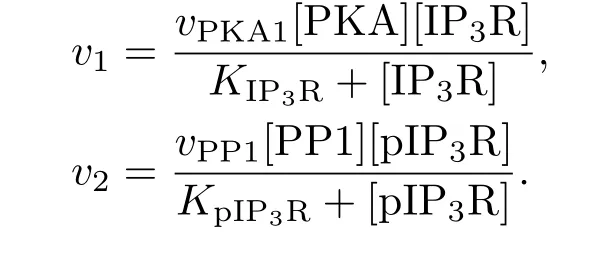
2.3 Bcl-2及其相關蛋白構成負反饋環模塊
細胞質中的Ca2+可以激活CaN,它有4個Ca2+結合位點,兩個對Ca2+親和系數高,另外兩個對Ca2+親和系數低[20],兩者相差上百倍,所以可以只考慮CaN與前兩個Ca2+結合的情況.該過程可用質量作用定律來描述[21],活化的CaN(CaN?)的濃度變化可以用以下方程來描述:
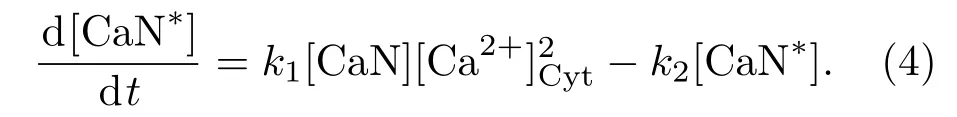
此外,CaN與CaN?滿足質量守恒
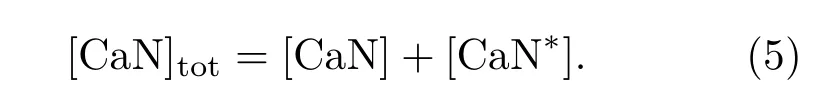
由于Ca2+與CaN的結合與解離過程要比[CaN?]的變化快很多,因此可以用準穩態假設[21]得到

CaN?可以通過Bcl-2使pDARPP-32去磷酸化成為DARPP-32,其反應速率為
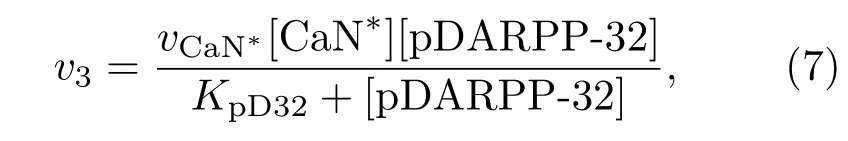
其中vCaN?表示該過程的最大反應速率,可用希爾方程[22]描述Bcl-2對它的調節
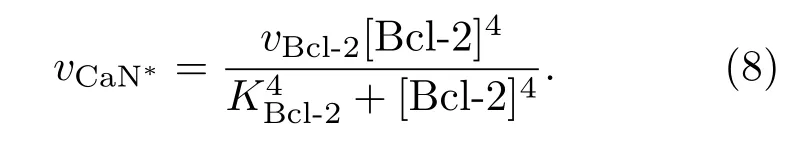
PKA還可使DARPP-32磷酸化,其反應速率為
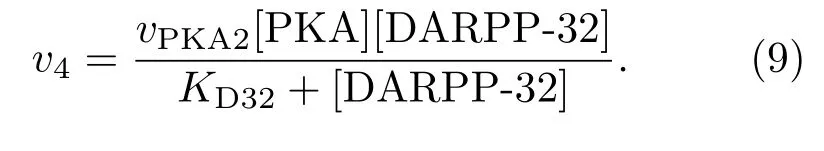
pDARPP-32對PP1有抑制作用,該作用可以體現在PP1使pIP3R去磷酸化的最大速率,則有
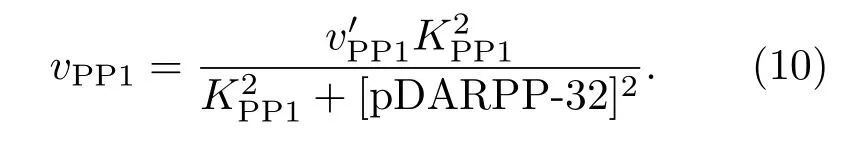
綜上所述,Bcl-2蛋白調節Ca2+的動力學模型為

3 結果與分析
3.1 參數擬合確定
Li-Rinzel模型中各參數的具體意義見文獻[18],由該模型默認參數得到的Ca2+振蕩的最大振幅約為0.5μM(1 M=1 mol/L),周期為10—14 s,由于要擬合文獻[15]實驗中Ca2+振蕩的振幅與周期,對Li-Rinzel模型中相關參數取值進行了幅度和周期的標量變換(見表1).對于其他兩個模塊中的各參數值,α和[IP3]是可調的,各蛋白質濃度的值均來源于文獻[23—26],反應速率參數較難從文獻中獲取,僅查得k1和k2的值[25],其余參數值由對文獻[15]中實驗結果的擬合得到(見表2).
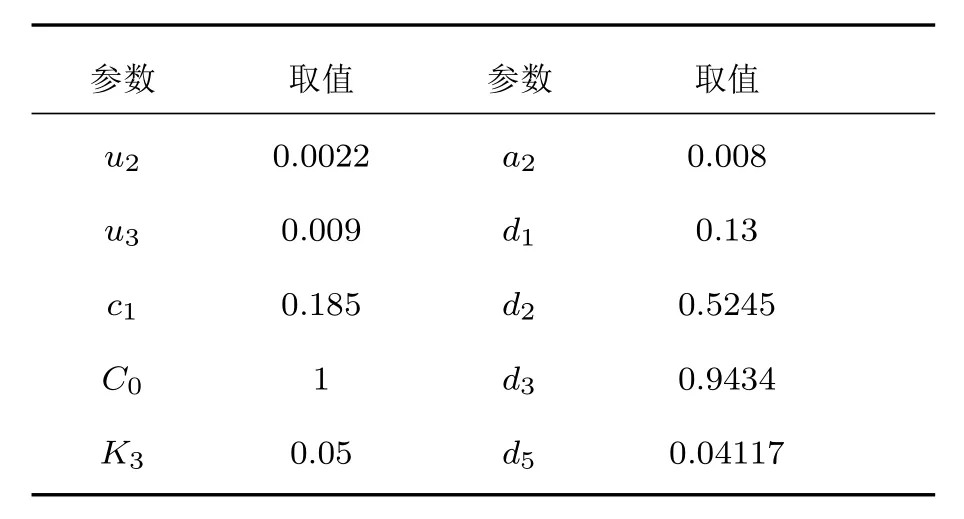
表1 Li-Rinzel模型中的參數Table 1.Parameters in Li-Rinzel model.
表2 模型中的參數值Table 2.Parameters in the model.
3.2 [Ca2+]Cyt時間序列
圖2所示為標準參數下Bcl-2取不同濃度(其值在生理學范圍[27])時[Ca2+]Cyt隨時間變化的曲線.當Bcl-2濃度低(0.1μM,圖2(a))時,[Ca2+]Cyt的振幅和峰值均高;而當Bcl-2濃度高(0.3μM,圖2(b))時,[Ca2+]Cyt的振幅和峰值均低.無論是[Ca2+]Cyt的振幅還是周期,數值模擬結果都與實驗結果(文獻[15]Fig.1B)高度符合.當Bcl-2濃度繼續升高(0.5μM,圖2(c))時,[Ca2+]Cyt呈現衰減振蕩.這意味著[Bcl-2]取不同的值,[Ca2+]Cyt既可能呈現周期性的變化,即極限環振蕩,也有可能呈現衰減振蕩至穩態.
3.3 [IP3]和[Bcl-2]單參數分岔分析
從以上時間序列僅能得到某一特定[IP3]下,即某一特定刺激強度時,細胞質鈣信號的信息,而分岔分析可以更全面地了解系統的行為.因為IP3對鈣振蕩起著決定性的作用[28],所以很多鈣信號模型以[IP3]作為分岔參數[29?32]研究系統的動力學行為.為探討Bcl-2對細胞質鈣信號的調節作用,分別選取[IP3]和[Bcl-2]為分岔參數,進行分岔分析(圖3).圖中,黑色實線是穩定的平衡點(表示Ca2+不振蕩,其值為[Ca2+]Cyt的穩態值),紅色虛線是不穩定的平衡點,它們的交點為霍普夫分岔點(Hopf bifurcation,HB,表示系統在穩定態與振蕩態之間的轉換);綠色和橙色實心點分別表示穩定極限環的最大值和最小值(分別對應Ca2+振蕩的峰值和谷值),綠色和橙色空心圈分別表示不穩定極限環的最大值和最小值.
圖3(a)—(c)為Bcl-2取不同濃度(0,0.25,0.4μM)時,以[IP3]為分岔參數得到的結果.可以看出,當[Bcl-2]=0μM時,回歸到原始的Li-Rinzel鈣信號振蕩模型,這時,鈣信號在振蕩區域的振幅隨[IP3]的增加而變大;但我們的模型表明,當[Bcl-2]=0.25μM時,鈣信號的振幅隨[IP3]的增加基本不變,當[Bcl-2]=0.4μM時,鈣信號的振幅隨[IP3]的增加主要呈現減小的行為.比較不同濃度的Bcl-2的結果時發現,高濃度的Bcl-2會抑制鈣信號的振幅.
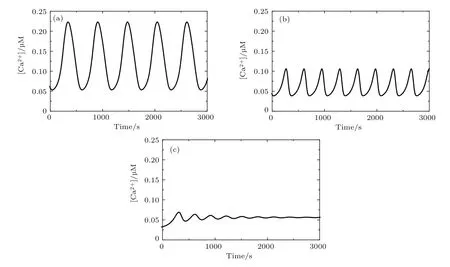
圖2 不同[Bcl-2]對應的[Ca2+]Cyt時間序列圖 (a)[Bcl-2]=0.1μM;(b)[Bcl-2]=0.3μM;(c)[Bcl-2]=0.5μMFig.2.Time series of[Ca2+]Cytfor different[Bcl-2]as(a)[Bcl-2]=0.1 μM,(b)[Bcl-2]=0.3 μM,(c)[Bcl-2]=0.5 μM.
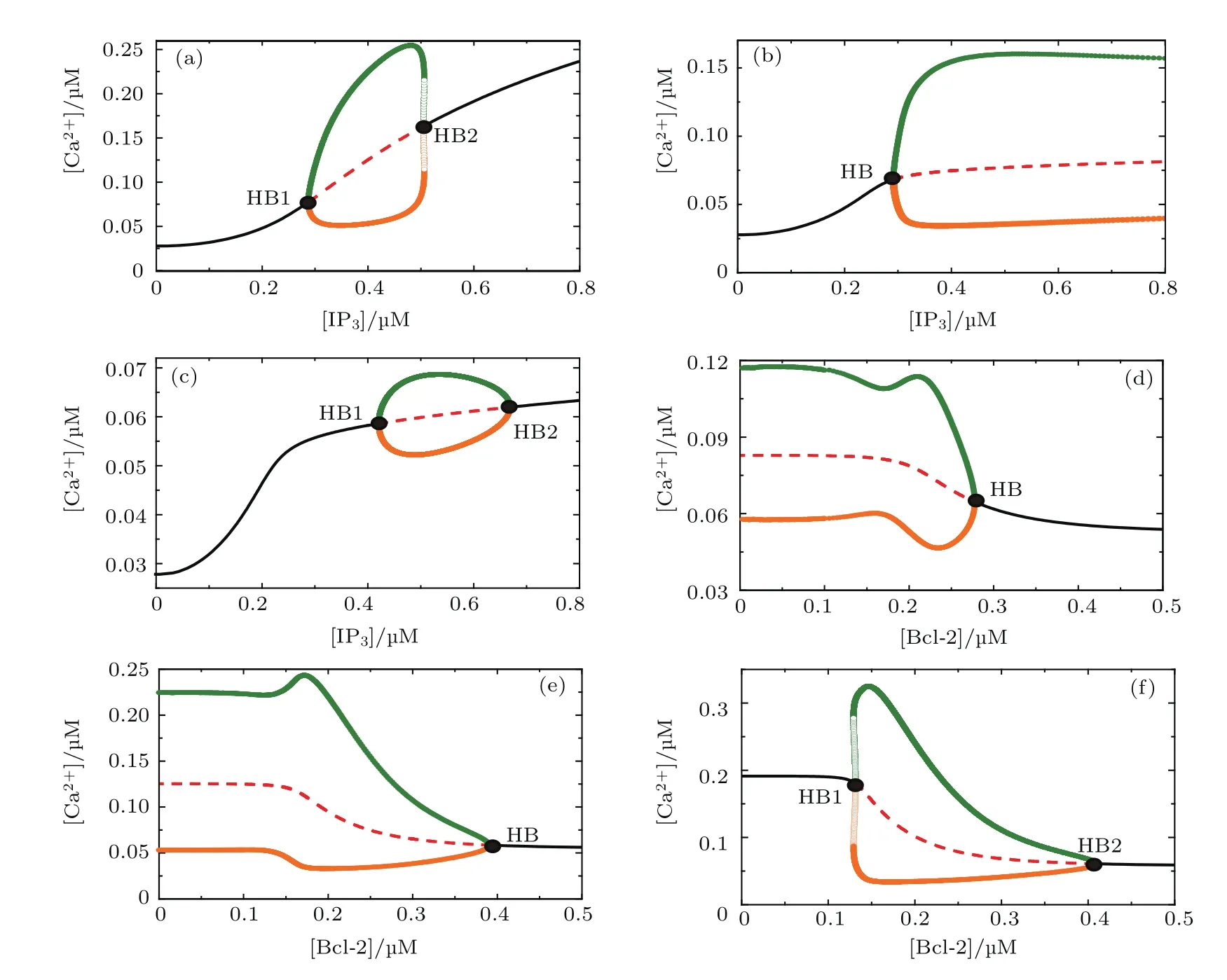
圖3 (網刊彩色)[IP3]對[Ca2+]Cyt的分岔圖 (a)[Bcl-2]=0μM,(b)[Bcl-2]=0.25μM,(c)[Bcl-2]=0.4μM;[Bcl-2]對[Ca2+]Cyt的分岔圖 (d)[IP3]=0.3μM,(e)[IP3]=0.4μM,(f)[IP3]=0.6μMFig.3.(color online)The one-parameter bifurcation diagram for[IP3]:(a)[Bcl-2]=0μM,(b)[Bcl-2]=0.25μM,(c)[Bcl-2]=0.4μM;the one-parameter bifurcation diagram for[Bcl-2]:(d)[IP3]=0.3μM,(e)[IP3]=0.4 μM,(f)[IP3]=0.6μM.
圖3(d)—(f)為IP3取 不 同 濃 度(0.3, 0.4,0.6μM)時,以[Bcl-2]為分岔參數得到的結果.可以看出,當[IP3]=0.3μM時,隨著[Bcl-2]的增加,鈣信號的振幅在接近穩定點前,主要呈現基本不變的行為;當[IP3]=0.4μM時,隨著[Bcl-2]的增加,鈣信號的振幅先呈現基本不變趨勢,然后線性減小,最后變成穩定點;當[IP3]=0.6μM時,鈣信號的振幅隨[Bcl-2]的增加主要呈現減小趨勢.所以,正如實驗所觀察到的[15],Bcl-2對細胞質鈣信號確實有抑制作用,但我們的模型同時表明,當[IP3]低時鈣信號的振幅呈現出對Bcl-2的魯棒行為.
3.4 α單參數分岔分析
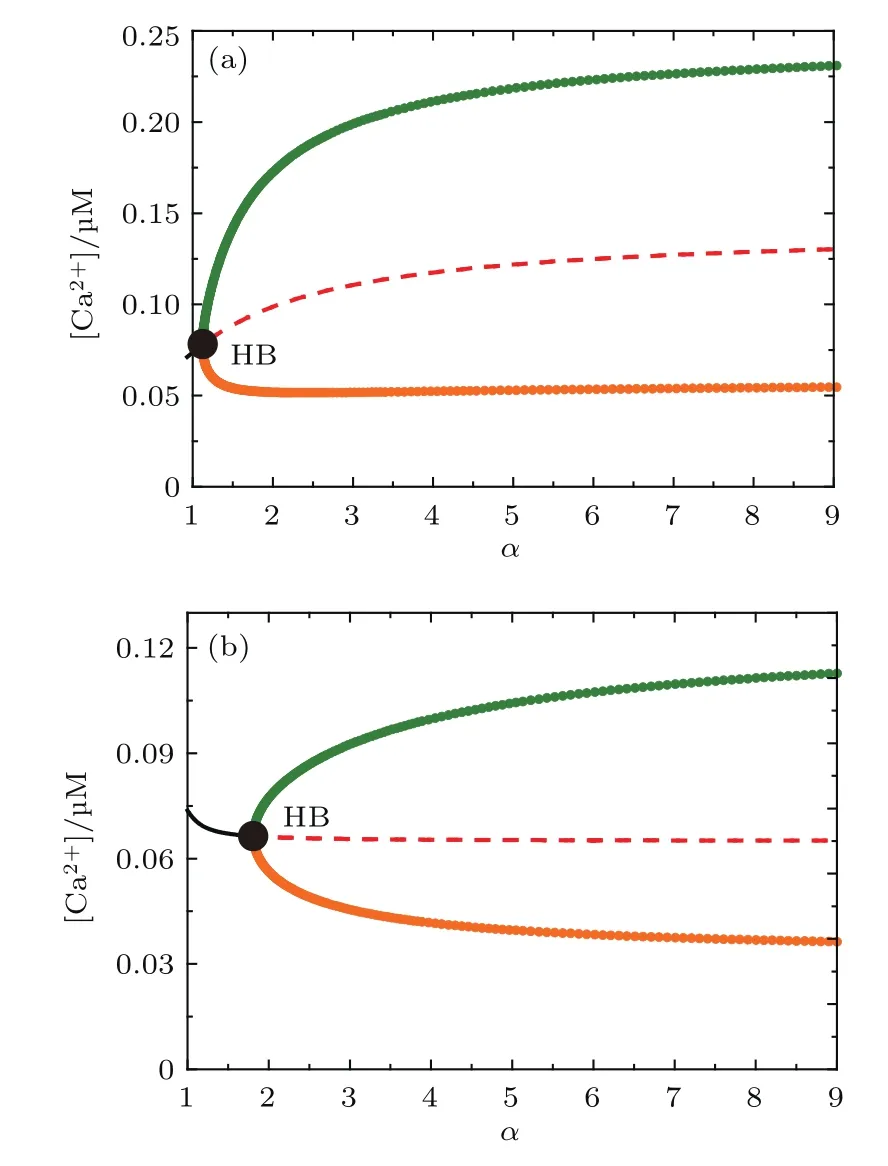
圖4 (網刊彩色)α對[Ca2+]Cyt的分岔圖 (a)[Bcl-2]=0.1 μM;(b)[Bcl-2]=0.3μMFig.4.(color online)The one-parameter bifurcation diagram for α:(a)[Bcl-2]=0.1 μM;(b)[Bcl-2]=0.3 μM.
本模型的參數中,α為最重要的一個,它表示pIP3R與IP3R釋放Ca2+的速率比.文獻[15]中僅提到前者釋放Ca2+的能力更強,但強多少并未定量檢測.在標準參數(表1)中將其假設為6,因此有必要通過參數敏感性分析來檢驗該參數是否可靠.圖4(a)和圖4(b)分別為Bcl-2取0.1和0.3μM時,以α為分岔參數得到的結果.結果顯示α的改變并不會顯著地影響細胞質鈣信號的振蕩,證明該參數有很強的魯棒性,其取值是合理的.
從以上模擬結果可以看出,本文的理論模型可以很好地重復和驗證實驗結果,且具有很好的魯棒性.所以,接下來利用該模型進行了一系列預測.
3.5 [IP3]和[Bcl-2]雙參數分岔分析
從以上單參數分岔分析我們發現,Bcl-2不僅可以調節Ca2+振蕩的幅度,而且影響極限環產生的條件(即能產生振蕩的[IP3]的區域).通過對[IP3]和[Bcl-2]的雙參數分岔分析,得到了系統產生極限環振蕩的參數區域(圖5陰影部分),圖中灰色線為左Hopf分岔點,黑色線為右Hopf分岔點.在非振蕩區域系統穩定,其穩定吸引子為相應參數組合下系統的穩定平衡點.結果表明,當[Bcl-2]較小時,系統有兩個Hopf分岔點,且Bcl-2對系統的影響較小;當[Bcl-2]較大時,系統在[IP3]的取值范圍內,只有一個Hopf分岔點;當[Bcl-2]很大時,極限環振蕩消失.這表明Bcl-2對細胞質鈣信號有很重要的調節作用,在生物學相關實驗中需要注意它的使用量.
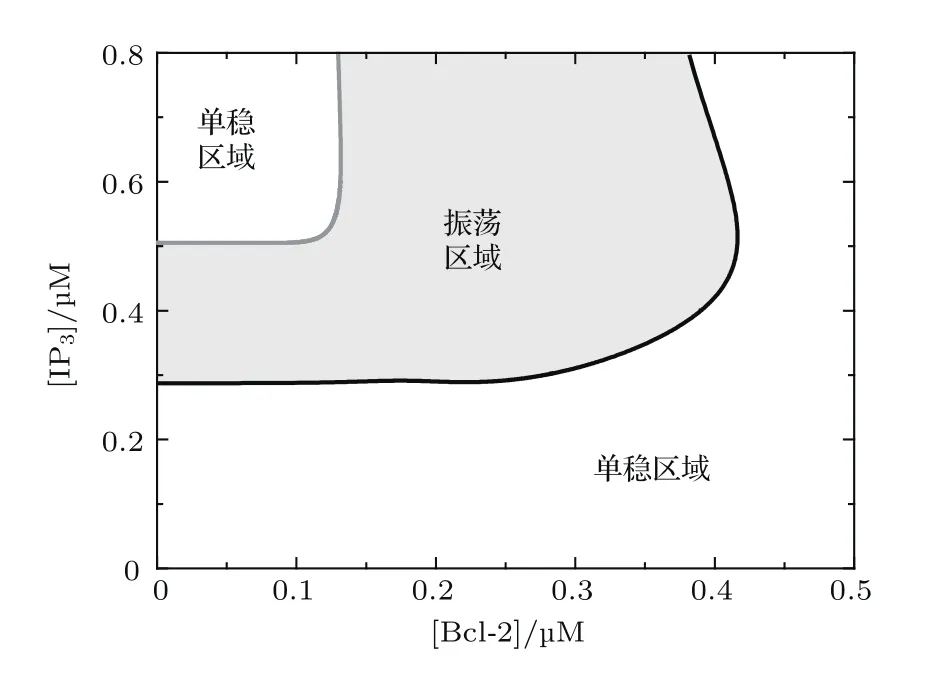
圖5 [IP3]和[Bcl-2]雙參數分岔圖 圖中灰色部分表示Ca2+持續振蕩區域,白色部分表示Ca2+穩定區域Fig.5.Two-parameter bifurcation diagram for[IP3]and[Bcl-2].In the grey region,sustained oscillations of Ca2+occur,while in the white region,the level of Ca2+is stable.
3.6 [PP1]單參數分岔分析
Bcl-2間接抑制鈣信號最終是通過PP1使pIP3R去磷酸化實現的,因此PP1起著關鍵且更直接的作用,但是文獻[15]并未對PP1調節鈣信號進行分析,可以借助模型定量預測PP1對鈣信號的影響.圖6(a)和圖6(b)分別為Bcl-2取0.1和0.3μM時,以[PP1]為分岔參數得到的結果.該結果表明,PP1可以顯著地抑制細胞質鈣信號,而且其調節鈣信號的方式與Bcl-2極其相似(圖3(e)和圖3(f)).這對生物學家有兩方面的啟示:一是重視PP1在抑制細胞質鈣信號方面的作用,二是在檢測Bcl-2間接抑制鈣信號的實驗中可以建立PP1與Bcl-2的定量關系,用PP1代替Bcl-2,這樣可以節約實驗成本,簡化實驗設計,加快實驗進程.
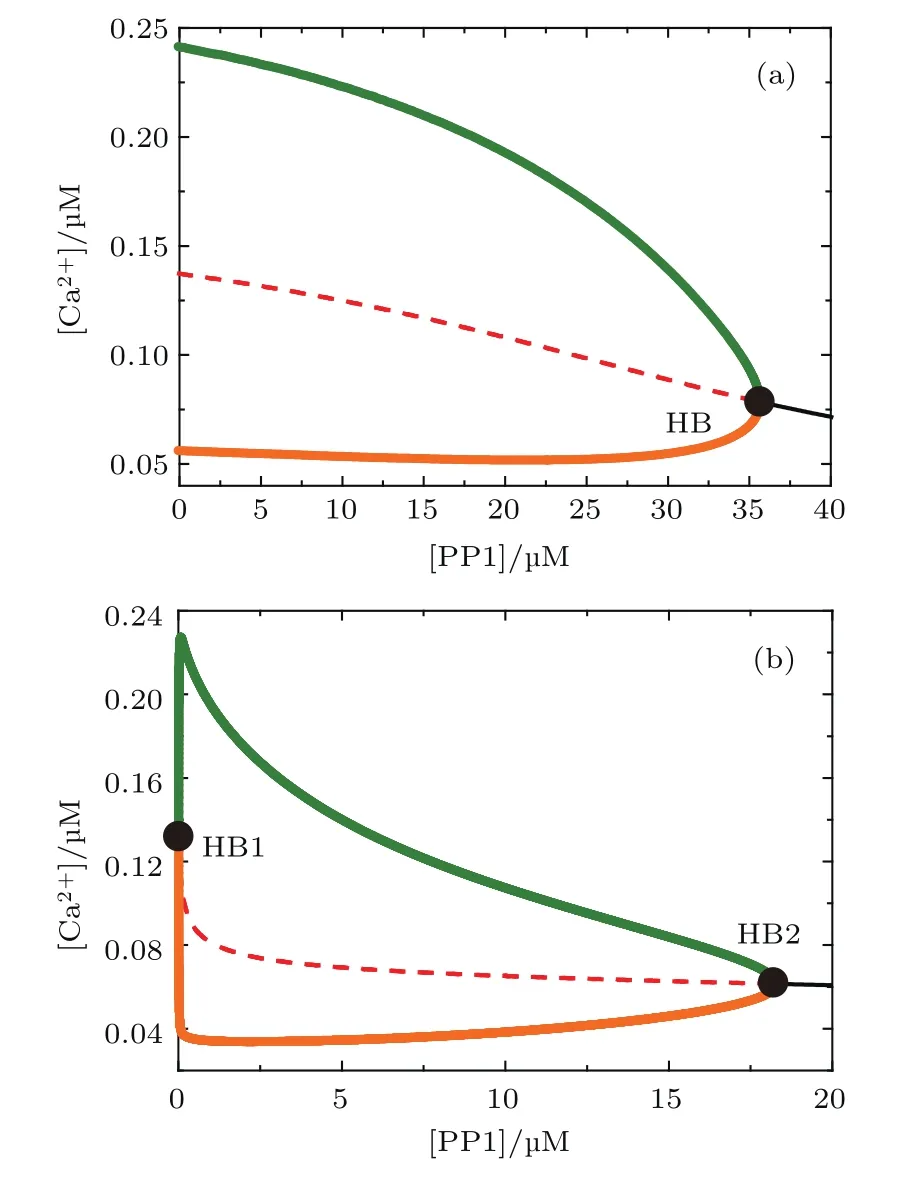
圖6 (網刊彩色)[PP1]對[Ca2+]Cyt的分岔圖 (a)[Bcl-2]=0.1μM;(b)[Bcl-2]=0.3μMFig.6.(color online)The one-parameter bifurcation diagram for[PP1]:(a)[Bcl-2]=0.1μM;(b)[Bcl-2]=0.3μM.
3.7 [PKA]單參數分岔分析
從模型機制圖中可以發現,除了文獻[15]中提出的Ca2+通過Bcl-2作用于DARPP-32進而降低IP3R通道釋放Ca2+構成的負反饋環之外,還存在一個由PKA引發的一致前饋環(coherent feedforward loop)[33]:PKA一方面直接促進IP3R磷酸化,另一方面通過增加pDARPP-32對PP1的抑制作用從而減弱PP1對pIP3R的去磷酸化.選取不同的IP3和Bcl-2的濃度組合,以[PKA]為分岔參數得到了3種具有代表性的分岔圖(圖7).圖3(d)—(f)和圖7結果對比顯示,PKA與Bcl-2的分岔圖形狀正好相反,說明了PKA和Bcl-2在Ca2+的釋放中起著相反的作用.當[IP3]和[Bcl-2]均較高時(圖7(c)),PKA對鈣信號的振幅有促進作用,這與已發表的實驗結果相一致[34,35].但是隨著[IP3]和[Bcl-2]的減小,鈣信號振幅對PKA呈現越來越強的魯棒性(圖7(a)和圖7(b)),這種情況還未見實驗報道.
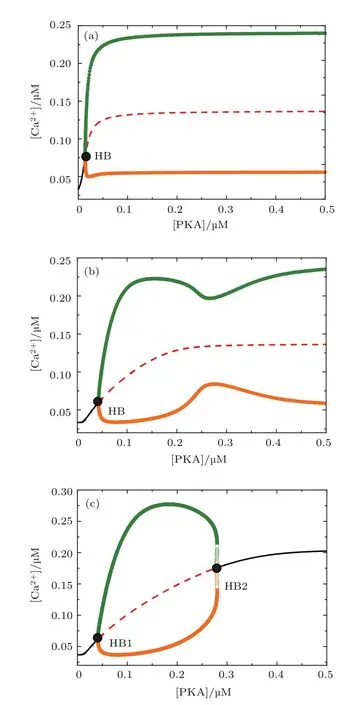
圖7 (網刊彩色)[PKA]對[Ca2+]Cyt的分岔圖(a)[IP3]=0.4μM且[Bcl-2]=0.1μM;(b)[IP3]=0.4μM 且[Bcl-2]=0.3μM;(c)[IP3]=0.6μM且[Bcl-2]=0.3μMFig.7.(color online)The one-parameter bifurcation diagram for[PKA]:(a)[IP3]=0.4μM and[Bcl-2]=0.1μM;(b)[IP3]=0.4μM and[Bcl-2]=0.3μM;(c)[IP3]=0.6μM and[Bcl-2]=0.3μM.
4 結 論
Ca2+在細胞命運抉擇中起著關鍵作用,而Bcl-2蛋白是鈣信號的主要抑制因子之一[13?15],所以對其進行定量研究有重要的意義.本文針對最新的生物學重要實驗成果,建立了Bcl-2調控鈣信號的數學模型,模型結果與實驗結果符合得很好.但是對于這一復雜的調控機制,實驗僅能給出部分定性信息.進一步采用單參數分岔分析的方法全面系統地從理論角度證明了Bcl-2對細胞質鈣信號確實具有抑制作用.
在對模型進行魯棒性檢驗之后,預測了一些有生物學意義的結果.雙參數分岔分析表明Bcl-2對IP3能產生振蕩的區域有很大影響,預示著它可以改變細胞對刺激強度的響應;且當[Bcl-2]很大時,極限環振蕩消失.因此Bcl-2不僅會影響細胞的鈣信號動力學,而且會改變細胞命運.
此外,人體內約1/3的蛋白質可被蛋白激酶磷酸化,而磷酸酶可將其去磷酸化,而且大部分癌基因所編碼的蛋白質為蛋白激酶,所以蛋白激酶和磷酸酶的平衡在很大程度上決定著細胞的命運[36,37].PKA和PP1就是一對調控IP3R通道磷酸化和去磷酸化的蛋白激酶和磷酸酶[38].本文利用單參數分岔分析分別預測了PKA和PP1對細胞質鈣信號的影響,發現PKA對鈣信號的促進作用有一定的局限性,特別是隨著[IP3]和[Bcl-2]的減小,PKA對鈣信號的影響越來越弱.而PP1可以有效地抑制鈣信號,而且預測其調節鈣信號的方式與Bcl-2極其相似.這些結果表明,在對該信號通路進行干預時需要注意PKA和PP1的用法和用量.
本文的模型表明,IP3對鈣信號振幅有促進作用,Bcl-2對鈣信號振幅的影響整體呈現抑制作用,PKA和Bcl-2對鈣信號有相反的作用.當不同濃度的IP3,Bcl-2和PKA相互組合時,它們對鈣信號振幅有復雜的調控作用:有時呈現魯棒性,有時呈現促進作用,有時呈現抑制作用.這些復雜而豐富的調控作用使得Ca2+振蕩對不同刺激信號有豐富的編碼行為,恰好說明了Ca2+能成為細胞內重要的信使分子,參與并控制許多細胞活動過程的原因.
根據模型的動力學討論,Bcl-2蛋白通過鈣信號調控細胞命運的機制如下:高濃度的Bcl-2會加快pDARPP-32的去磷酸化,減小后者對PP1的抑制作用,使更多的PP1促進pIP3R的去磷酸化,降低pIP3R的濃度,從而減少內質網Ca2+的釋放,有利于細胞存活.相反,低濃度的Bcl-2使pDARPP-32去磷酸化的過程減慢,后者可以充分發揮對PP1的抑制作用,使得PP1不能很好地將pIP3R去磷酸化,從而增加內質網Ca2+的釋放,引起細胞凋亡.
本研究的局限之處在于:一方面,Bcl-2通過抑制IP3R通道活性降低[Ca2+]Cyt的機制有兩種,為了研究清楚間接機制而未考慮直接機制,事實上兩者之間存在一定程度的耦合,這是以后將要研究的問題;另一方面,Bcl-2蛋白作為細胞中一個關鍵的抗凋亡蛋白,也可與其他促凋亡蛋白,如PUMA,Bax等結合[39],從而影響它與IP3R的結合效率;此外,Ca2+信號動力學也受其他多種信號分子,如p53蛋白的調控[40].總之,細胞生理活動是一個極其復雜的過程,本文的研究僅是為了深刻揭示Bcl-2間接抑制[Ca2+]Cyt的機制,并不能完全反映實際的情況.
雖然本文的研究有一定的局限性,但是它不僅能夠使人們更系統、深入地了解Bcl-2蛋白抑制鈣信號的機制,而且可以揭示該信號通路中相關的蛋白如何通過調節鈣信號決定細胞的命運,因此可為因鈣信號失調而導致的多種疾病,如癌癥[41,42]、阿爾茲海默癥等[10]提供有用信息.
[1]Berridge M J,Bootman M D,Roderick H L 2003Nat.Rev.Mol.Cell Biol.4 517
[2]Orrenius S,Zhivotovsky B,Nicotera P 2003Nat.Rev.Mol.Cell Biol.4 552
[3]Parekh A B 2011Trends Biochem.Sci.36 78
[4]Gerasimenko J V,Gerasimenko O V,Palejwala A,Tepikin A V,Petersen O H,Watson A J 2002J.Cell Sci.115 485
[5]Scorrano L,Oakes S A,Opferman J T,Cheng E H,Sorcinelli M D,Pozzan T,Korsmeyer S J 2003Science300 135
[6]Florea A M,Splettstoesser F,Dopp E,Rettenmeier A W,Büsselberg D 2005Toxicology216 1
[7]Boehning D,Patterson R L,Sedaghat L,Glebova N O,Kurosaki T,Snyder S H 2003Nat.Cell Biol.5 1051
[8]Piacentini R,Gangitano C,Ceccariglia S,Fà A D,Azzena G B,Michetti F,Grassi C 2008J.Neurochem.105 2109
[9]Kim I,Xu W,Reed J C 2008Nat.Rev.Drug Discov.7 1013
[10]Qi H,Shuai J W 2016Med.Hypotheses89 28
[11]Prole D L,Taylor C W 2016J.Physiol.594 2849
[12]Foskett J K,White C,Cheung K H,Mak D O D 2007Physiol.Rev.87 593
[13]Vervliet T,Parys J,Bultynck G 2016Oncogene35 5079
[14]Rong Y P,Bultynck G,Aromolaran A S,Zhong F,Parys J B,de Smedt H,Mignery G A,Roderick H L,Bootman M D,Distelhorst C W 2009Proc.Natl.Acad.Sci.USA106 14397
[15]Chang M J,Zhong F,Lavik A R,Parys J B,Berridge M J,Distelhorst C W 2014Proc.Natl.Acad.Sci.USA111 1186
[16]Lu B Y,Yue H 2010Acta Biophys.Sin.26 406(in Chinese)[魯保云,岳紅 2010生物物理學報 26 406]
[17]Li X,Liu F,Shuai J W 2016Acta Phys.Sin.65 178704(in Chinese)[李翔,劉鋒,帥建偉 2016物理學報 65 178704]
[18]Li Y X,Rinzel J 1994J.Theor.Biol.166 461
[19]Ferrell J E,Ha S H 2014Trends Biochem.Sci.39 496
[20]Li H,Rao A,Hogan P G 2011Trends Cell Biol.21 91
[21]Yi M,Zhao Q,Tang J,Wang C 2011Biophys.Chem.157 33
[22]Goldbeter A 1991Proc.Natl.Acad.Sci.USA88 9107
[23]Parys J,Bezprozvanny I 1995Cell Calcium18 353
[24]Svenningsson P,Nishi A,Fisone G,Girault J A,Nairn A C,Greengard P 2004Annu.Rev.Pharmacol.Toxicol.44 269
[25]Shin S Y,Choo S M,Kim D,Baek S J,Wolkenhauer O,Cho K H 2006FEBS Lett.580 5965
[26]Neves S R,Tsokas P,Sarkar A,Grace E A,Rangamani P,Taubenfeld S M,Alberini C M,SchaffJ C,Blitzer R D,Moraru I I 2008Cell133 666
[27]Lindner A U,Prehn J H,Huber H J 2013Mol.Biosyst.9 2359
[28]Alzayady K J,Wang L,Chandrasekhar R,Wagner L E 2016Sci.Signal.9 ra35
[29]De Young G W,Keizer J 1992Proc.Natl.Acad.Sci.USA89 9895
[30]Shuai J W,Jung P 2003Proc.Natl.Acad.Sci.USA100 506
[31]Qi H,Li L X,Shuai J W 2015Sci.Rep.5 7984
[32]Sneyd J,Han J M,Wang L,Chen J,Yang X,Tanimura A,Sanderson M J,Kirk V,Yule D I 2017Proc.Natl.Acad.Sci.USA114 1456
[33]Alon U 2007Nat.Rev.Genet.8 450
[34]Dyachok O,Gylfe E 2004J.Biol.Chem.279 45455
[35]Chaloux B,Caron A Z,Guillemette G 2007Biol.Cell99 379
[36]Ceulemans H,Bollen M 2004Physiol.Rev.84 1
[37]Bononi A,Agnoletto C,de Marchi E,Marchi S,Patergnani S,Bonora M,Giorgi C,Missiroli S,Poletti F,Rimessi A,Pinton P 2011Enzym.Res.2011 329098
[38]Tang T S,Tu H P,Wang Z N,Bezprozvanny I 2003J.Neurosci.23 403
[39]Luna-Vargas M P,Chipuk J E 2016Trends Cell Biol.26 906
[40]Giorgi C,Bonora M,Sorrentino G,Missiroli S,Poletti F,Suski J M,Ramirez F G,Rizzuto R,Di Virgilio F,Zito E 2015Proc.Natl.Acad.Sci.USA112 1779
[41]Roderick H L,Cook S J 2008Nat.Rev.Cancer8 361
[42]Monteith G R,Prevarskaya N,Roberts-Thomson S J 2017Nat.Rev.Cancer.17 367
Modeling of Bcl-2 protein suppressed calcium signaling and its global dynamics analysis?
Niu Shuai1)2)Shuai Jian-Wei3)?Qi Hong1)?
1)(Complex Systems Research Center,Shanxi University,Taiyuan 030006,China)
2)(School of Mathematical Sciences,Shanxi University,Taiyuan 030006,China)
3)(Department of Physics,Xiamen University,Xiamen 361005,China)
9 June 2017;revised manuscript
18 July 2017)
Calcium ion(Ca2+)is a signal for both life and death in cells.Either directly or indirectly,Bcl-2 protein can regulate Ca2+release from IP3R channel,thereby determining the cell fate.In this work,based on recent experimental results,a mathematical model is constructed to describe the signaling pathway of Ca2+release regulated by Bcl-2 indirectly.The model output fits nicely to the experimental data.The model demonstrates that Bcl-2 can suppress Ca2+signaling.After the robustness test of the model,the roles of some key components in the signaling pathway are predicted.Twoparameter bifurcation analyses of[IP3]and[Bcl-2]are conducted to show that Bcl-2 has a crucial role in the oscillatory region of Ca2+signaling.Single-parameter bifurcation analyses of[PP1]and[PKA]reveal that the PP1 can inhibit Ca2+from signaling potently,while PKA only promotes Ca2+signaling to some extent.Our model also indicates that the different combinations of concentrations of IP3,Bcl-2 and PKA generate complex regulations on Ca2+signaling.This work not only plays a guiding role in relevant biological experiments,but also provides some insights into the treatment of diseases caused by disruption of Ca2+homeostasis.
Bcl-2 protein,calcium signaling,bifurcation analysis
PACS:87.18.Vf,87.10.Ed,82.40.BjDOI:10.7498/aps.66.238701
*Project supported by the National Natural Science Foundation of China(Grant Nos.11504214,31370830,11675134).
?Corresponding author.E-mail:jianweishuai@xmu.edu.cn
?Corresponding author.E-mail:hongqi@sxu.edu.cn
(2017年6月9日收到;2017年7月18日收到修改稿)
鈣離子(Ca2+)是生物體內一種“生死攸關”的信號分子,Bcl-2蛋白可以直接或間接調節IP3R通道釋放Ca2+的能力,借此決定細胞命運.本文基于新近的實驗成果,針對Bcl-2蛋白間接調控Ca2+的信號通路建立數學模型,得到了與實驗數據相符合的結果,從理論上證明了Bcl-2蛋白對鈣信號有抑制作用.在對模型進行魯棒性檢驗之后,本文對該信號通路中一些關鍵組分的作用進行了預測.以[IP3]和[Bcl-2]為雙分岔參數分析的結果表明Bcl-2對刺激強度能產生Ca2+振蕩的區域有重要影響.以蛋白磷酸酶1[PP1]和蛋白激酶A[PKA]為單分岔參數分析的結果揭示:PP1可以有效地抑制鈣信號,而PKA對鈣信號的促進作用有一定的局限性.模型結果表明,不同濃度組合的IP3,Bcl-2和PKA會對鈣信號發揮復雜的調控作用.本文不僅對相關生物學實驗有一定的指導作用,而且可為治療因鈣信號失調而導致的疾病提供思路.
10.7498/aps.66.238701
?國家自然科學基金(批準號:11504214,31370830,11675134)資助的課題.
?通信作者.E-mail:jianweishuai@xmu.edu.cn
?通信作者.E-mail:hongqi@sxu.edu.cn

