巨桉EgrZFP6基因在非生物逆境脅迫響應中的功能*
王曉榮 程龍軍 徐鳳華 倪曉祥 陸 軍(浙江農林大學 亞熱帶森林培育國家重點實驗室 杭州 311300)
巨桉EgrZFP6基因在非生物逆境脅迫響應中的功能*
王曉榮 程龍軍 徐鳳華 倪曉祥 陸 軍
(浙江農林大學 亞熱帶森林培育國家重點實驗室 杭州 311300)
【目的】 通過對巨桉非生物逆境響應相關基因EgrZFP6(Eucgr.A01232)蛋白結構和基因功能的初步研究,探討該基因在巨桉非生物逆境響應中所發揮的作用,為桉樹抗逆育種提供理論基礎。【方法】 首先利用CDD在線軟件分析EgrZFP6編碼蛋白序列的結構域,并利用NCBI中的Blast軟件搜索與EgrZFP6蛋白序列相似程度較高的其他物種中ZFP蛋白,用Clustalx進行多序列比對,聯合分析、比較它們的結構域。然后,構建EgrZFP6∷sGFP融合載體,采用基因槍轟擊洋蔥表皮方法對EgrZFP6蛋白表達進行亞細胞定位; 同時,構建35S∷EgrZFP6超表達載體,采用花序侵染法進行擬南芥遺傳轉化; 對獲得的超表達擬南芥轉基因純合株系,分析其正常條件、低溫、干旱和高鹽等非生物逆境處理下的表型變化; 利用酵母雙雜交法篩選到與EgrZFP6互作蛋白EgrERF4(Eucgr.F01164),并對低溫、干旱和高鹽等非生物脅迫下巨桉植株中EgrERF4的表達情況用實時熒光定量RT-PCR方法進行分析。【結果】 巨桉EgrZFP6編碼蛋白為1個典型C2H2型鋅指結構蛋白,有2個包含QALGGH序列的植物特有鋅指結構域,1個乙烯響應元件結合因子相關雙性抑制子EAR基序和1個L-box基序; 亞細胞定位結果表明EgrZFP6表達蛋白定位在細胞核中; 與野生型對照相比,EgrZFP6超表達的擬南芥轉化植株中,主根伸長生長受到一定抑制,對低溫敏感性增強, PEG(1 g·L-1以上)處理能促進側根增加和伸長,植株根伸長對高鹽抑制作用的耐受性有一定程度提高。乙烯響應相關轉錄因子基因EgrERF4編碼蛋白能夠與EgrZFP6編碼蛋白互作; 正常巨桉植株不同低溫(-8,-4,0,4 ℃)2 h處理下,除-8 ℃外,EgrERF4表達均呈現被誘導趨勢; 4 ℃低溫不同時間(0.5,2,6,12,24,48 h)處理下,基因也被誘導表達; 干旱條件下,隨處理時間延長,基因表達被嚴重抑制,而高鹽(200 mmol·L-1)脅迫則能促進EgrERF4表達。【結論】 EgrZFP6轉錄因子可能通過與EgrERF4互作參與巨桉低溫、高鹽和干旱脅迫響應。在低溫脅迫下發揮負調控作用; 而在干旱和高鹽逆境條件下能通過改變植株根構型,一定程度上提高對逆境的適應能力。
巨桉;EgrZFP6; 非生物逆境; 基因功能
低溫、干旱等非生物脅迫會制約植物生長和發育,對農林業生產有嚴重影響。研究植物抗逆生理和分子機制對提高植物非生物逆境脅迫抗性具有重要意義(Dos Reisetal., 2012; Roychoudhuryetal., 2015)。為了應對逆境脅迫,植物在長期進化過程中形成了一定的響應機制,植物感受到逆境信號后,通過相應基因調控,改變一系列代謝過程,產生應對脅迫的響應,如提高可溶性糖含量,增加抗滲透脅迫物質如脯氨酸、甜菜堿等,進而提高植物抗逆性(Takabe, 2012)。在植物抗逆分子響應機制中,作為基因開關的轉錄因子(transcription factor, TF)發揮重要作用。植物中轉錄因子數量龐大,相當一部分成員與逆境調控相關,如bZIP、WRKY、AP2/EREBP、MYB和NAC等,近年來鋅指類轉錄因子(Zinc Finger Protein: ZFP)也被證明在植物逆境脅迫響應中發揮重要作用(Gujjaretal., 2014; Reddyetal., 2013)。
根據ZFP轉錄因子具有的半胱氨酸(C)和組氨酸(H)殘基數量和位置,可將鋅指蛋白轉錄因子分為C2H2,C2H,C2C2,C2HCC2C2,C2C2C2等類型。其中C2H2型鋅指蛋白是植物中研究較多、功能較為明確的一類鋅指蛋白。其鋅指結構域由約30個氨基酸組成,包含2個半胱氨酸和2個組氨酸,以及一段植物所特有的高度保守序列(QALGGH)(Kuboetal., 1998; 黃驥等, 2014)。
C2H2型鋅指蛋白在植物中成員眾多,擬南芥(Arabidopsisthaliana)中發現176個成員(Englbrechtetal., 2004),水稻(Oryzasativa)基因組數據顯示水稻上有182個(Agarwaletal., 2007)。C2H2型鋅指蛋白廣泛參與植物生長、發育和代謝,以及植物對低溫、高鹽和干旱等非生物逆境響應(Kiebowicz-Matuketal., 2012)。水稻OsZFP1作為負調控因子,能抑制鹽脅迫相關基因表達,轉基因植株對鹽脅迫抗性降低; 同時,OsZFP1的逆境響應還受脫落酸(ABA)影響,暗示其可能參與ABA依賴的逆境響應過程(Kongetal., 2004)。水稻另外1個C2H2型鋅指蛋白轉錄因子基因OsZFP245的超表達則能夠提高植株對低溫、干旱和氧化逆境的抗性(Huangetal., 2009)。矮牽牛(Petuniahybrida)基因ZPT2-3也可被低溫、干旱和重金屬等非生物脅迫誘導表達,其轉基因植株干旱耐受力有效提高(Suganoetal., 2003)。這些表明C2H2型鋅指蛋白轉錄因子能夠在植物非生物逆境脅迫響應中發揮作用。
目前植物C2H2型鋅指蛋白在林木中研究較少。巨桉(Eucalyptusgrandis)作為世界三大用材樹種之一,在我國南方各省栽培廣泛,為我國林業產業發展做出重要貢獻。但其對低溫敏感,不耐干旱、鹽漬,這嚴重限制其栽培范圍的擴大; 低溫、干旱等不良天氣條件還經常對桉樹生產造成損失。因此,研究巨桉非生物逆境脅迫響應分子機制對桉樹抗逆分子育種具有重要意義。作者所在實驗室前期研究中發現,EgrZFP6表達受低溫、鹽脅迫誘導,極有可能參與巨桉非生物脅迫響應過程(Wangetal., 2014),本研究利用遺傳轉化和酵母(Saccharomycescerevisiae)雙雜交等手段,對該基因在低溫、干旱和高鹽等非生物逆境脅迫下的功能進行了初步研究。
1 材料與方法
1.1 材料
巨桉幼苗生長在浙江農林大學苗圃地。所選試驗材料為長勢一致的6個月苗齡組培無性系幼苗。擬南芥野生型為COL。試驗處理均在Snijders微氣候控制生長箱(MC1000,荷蘭)中進行。擬南芥培養條件: 白天24 ℃ 15 h,夜間22 ℃ 9 h; 巨桉培養條件: 白天25 ℃ 12 h,夜間22 ℃ 12 h。光照強度150 μmol·m-2s-1,相對濕度(RH)70%。
1.2 EgrZFP6蛋白序列分析
在巨桉數據庫phytozome(http://www.phytozome.net/search.php)下載EgrZFP6全長序列,設計引物,進行全長序列測序驗證后,將其編碼蛋白序列在https://blast.ncbi.nlm.nih.gov/Blast.cgi進行Blast比對,選擇5個與該蛋白序列相似程度比較高的不同物種蛋白序列,利用Clastalx1.83進行多重比對。同時,用CDD在線軟件(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析蛋白序列保守域。
1.3 EgrZFP6亞細胞定位
設計引物(表1),PCR擴增去掉終止密碼子的EgrZFP6開放閱讀框序列,以pCAMBIA1300為載體骨架,利用多克隆位點處的KpnI和XbaI酶切位點,構建EgrZFP6-GFP融合蛋白表達載體。提取質粒,金粉包埋后轟擊洋蔥(Alliumcepa)表皮細胞。激光共聚焦顯微鏡掃描成像。
1.4 EgrZFP6超表達載體構建、異源轉化擬南芥及超表達擬南芥低溫、鹽和PEG處理
超表達載體骨架為含35S啟動子的pCAMBIA1301,EgrZFP6全長序列擴增引物見表1,利用多克隆位點處的KpnI和XbaI酶切位點,雙酶切法構建35S∷EgrZFP6超表達載體。提取質粒,選取健壯盛花期擬南芥采用農桿菌(Agrobacterium)蘸花法轉化擬南芥(許紅梅等, 2010)。收獲侵染植株種子,于含20 mg·L-1潮霉素(hygromycin)的1/4MS培養基上進行篩選,陽性植株繼續繁殖,收獲,篩選,PCR檢測,直到獲得T3代轉基因純合株系。提取10天苗齡的野生型和2個超表達EgrZFP6擬南芥純合株系RNA,逆轉錄后,設計引物(表1)以AtActin為內參基因進行半定量RT-PCR,鑒定EgrZFP6在轉基因株系中的表達情況。
野生型和超表達EgrZFP6擬南芥種子均勻播種在1/2MS培養基上,4 ℃暗處理24 h后置于生長箱中生長。1周后,比較和分析野生型和超表達株系表型變化; 參考Zhao等(2016)方法,將10天苗齡幼苗于-8 ℃低溫處理3天,然后正常培養條件下緩苗3天,拍照觀察表型,統計植株死亡率; 鹽(NaCl)處理梯度為0,50,100 mmol·L-1,使用PEG6000模擬干旱處理,處理梯度為1,5,9 g·L-1,種子發芽后,于生長箱中生長1周,觀察表型并拍照(Nikon, D7000)。
1.5 巨桉低溫、干旱和鹽脅迫處理
選取6個月苗齡生長一致的巨桉幼苗,在植物低溫生長箱(MC1000,Snijders,荷蘭)中進行不同低溫(-8,-4,0,4 ℃,2 h)處理以及4 ℃低溫不同時間(0.5,2,6,12,24,48 h)處理,低溫處理均以正常生長溫度(25 ℃)為對照(CK)。將處理苗的栽培盆置于200 mmol·L-1NaCl水溶液中,保持液面位于栽培盆高度的1/3處,以清水為對照(CK)進行高鹽處理。干旱處理則以5,3,2,1天不澆水的苗作為處理組,正常澆水的(每天每盆苗澆水200 mL)為對照(CK)。每個處理3株苗,進行3次重復。試驗處理結束后同時收獲葉片,提取RNA置于-70 ℃冰箱(SANYO,日本)備用。
1.6 EgrZFP6互作蛋白篩選
利用Clontech公司酵母雙雜交試劑盒(Cat.630489),構建巨桉酵母雜交文庫。同時,構建pGADT7-EgrZFP6和pGBKT7-EgrZFP6共轉化Y2H gold酵母菌株進行自激活檢測,然后抽提文庫質粒與誘餌載體pGBKT7-EgrZFP6共轉化Y2H gold進行文庫篩選。具體操作步驟按照試劑盒說明進行。最后,對篩選到的與EgrZFP6互作的蛋白EgrERF4進行酵母雙雜交一對一驗證。
EgrZFP6和EgrERF4基因全長序列擴增引物見表1。利用多克隆位點EcoR I和BamH I酶切位點,雙酶切法構建pGBKT7-EgrZFP6和pGADT7-EgrERF4,pGBKT7-Lam為陰性對照,pGBKT7-53為陽性對照。
1.7 RNA提取、cDNA合成及基因定量表達分析
巨桉RNA提取參考CTAB+Trizol法(王亞紅等, 2010),擬南芥RNA提取參照Trizol法(金美芳, 2007)。cDNA反轉錄試劑盒由康為世紀公司提供,定量熒光染料SYBR由TAKARA公司(大連,中國)提供。設計引物(表1)用BIO-Rad CFX96實時熒光定量RT-PCR系統(BioRad, 美國)以及系統自帶的Bio-Rad CFX Manager(Ver 1.5.5.34)軟件進行試驗和結果分析。

表1 所用引物序列Tab.1 List of primer sequences used in the study
2 結果與分析
2.1 EgrZFP6編碼蛋白結構分析
EgrZFP6編碼蛋白含有2個鋅指結構域,對該基因蛋白序列進行保守結構域搜索,并將其與其他不同植物中的同源蛋白比對分析,結果表明該基因編碼蛋白含有2個高度保守的鋅指蛋白結構域,且2個鋅指結構域核心序列均為QALGGH,該序列是植物鋅指蛋白所特有的(Takatsuji, 1999)。另外,EgrZFP6蛋白序列還分別含有1個乙烯響應元件結合因子相關雙性抑制子(ERF associated amphiphilic repression: EAR)基序: DLNLTP和1個L-box基序(圖1)。
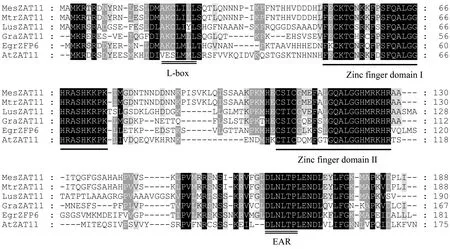
圖1 巨桉EgrZFP6蛋白序列與其他植物同源蛋白序列比對Fig.1 Multiple alignments of homologus proteins with high similarity sequences to EgrZFP6 in Eucalyptus grandisMesZAT11:木薯Manihot esculenta(OAY41302.1); MtrZAT11:蒺藜苜蓿Medicago truncatula(XP_013468307.1); LusZAT11:亞麻Linum usitatissimum(XP_002533000); GraZAT11:雷蒙德氏棉Gossypium raimondii(XP_012483278.1); AtZAT11: 擬南芥Arabidopsis thaliana (AEC09397.1).鋅指結構域用加粗黑線標示,L-box和EAR基序用雙實線表示。 The zinc finger domain is marked with thicken black line, L-box and EAR motif are showed with double lines.
2.2 EgrZFP6亞細胞定位結果分析
構建EgrZFP6-GFP表達載體,利用基因槍轟擊洋蔥表皮的方法對EgrZFP6蛋白進行亞細胞定位分析,結果表明該蛋白定位于細胞核中(圖2)。其可能是作為轉錄因子在細胞核內發揮基因表達調控作用。
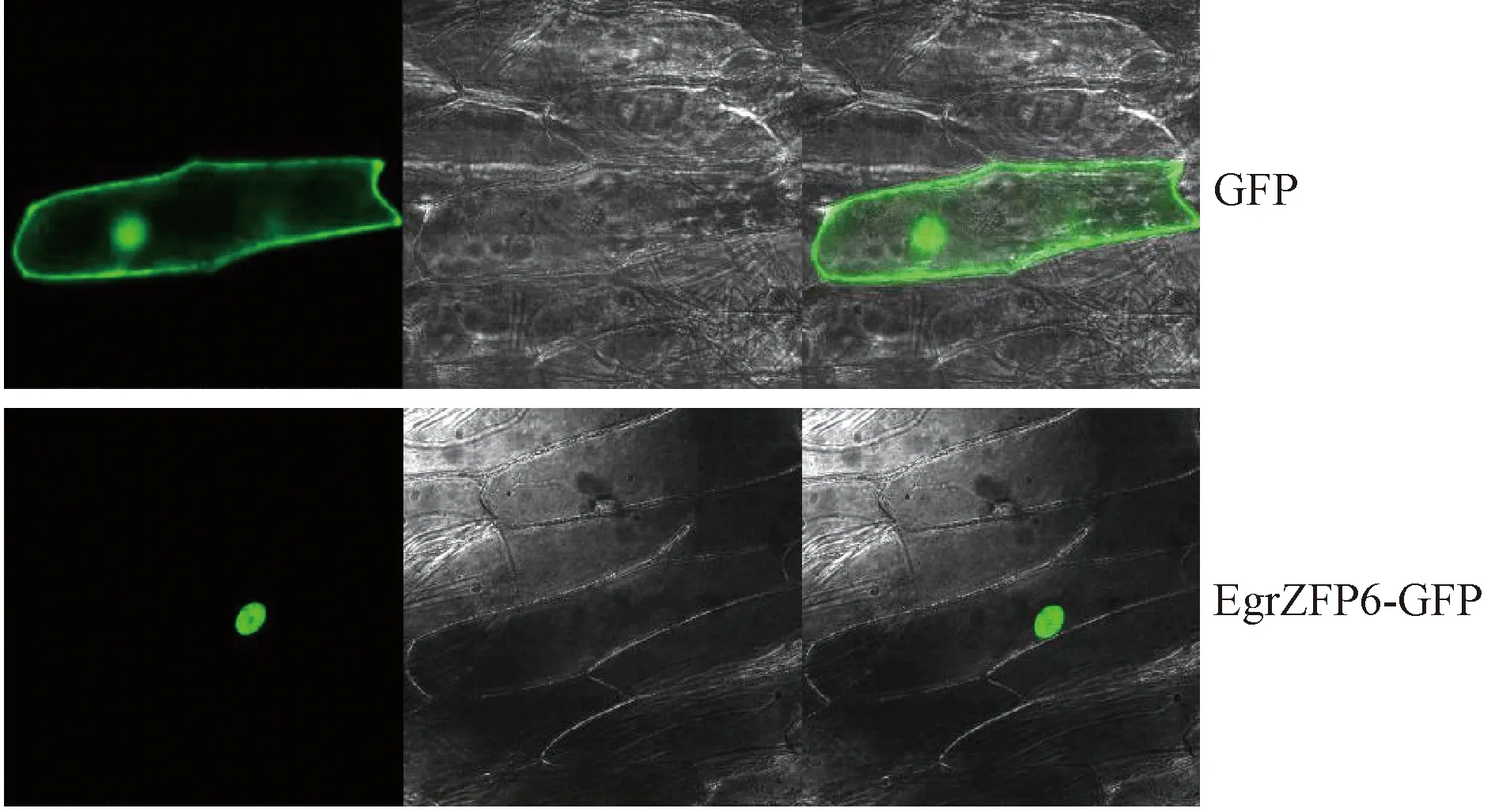
圖2 EgrZFP6的亞細胞定位Fig.2 Subcellular localization of EgrZFP6
2.3 超表達EgrZFP6轉基因擬南芥株系鑒定
半定量RT-PCR分析結果(圖3)表明,野生型COL中沒有檢測到EgrZFP6表達,在2個轉基因純合株系EgrZFP6-OX1和EgrZFP6-OX2中EgrZFP6具有明顯表達(圖3)。
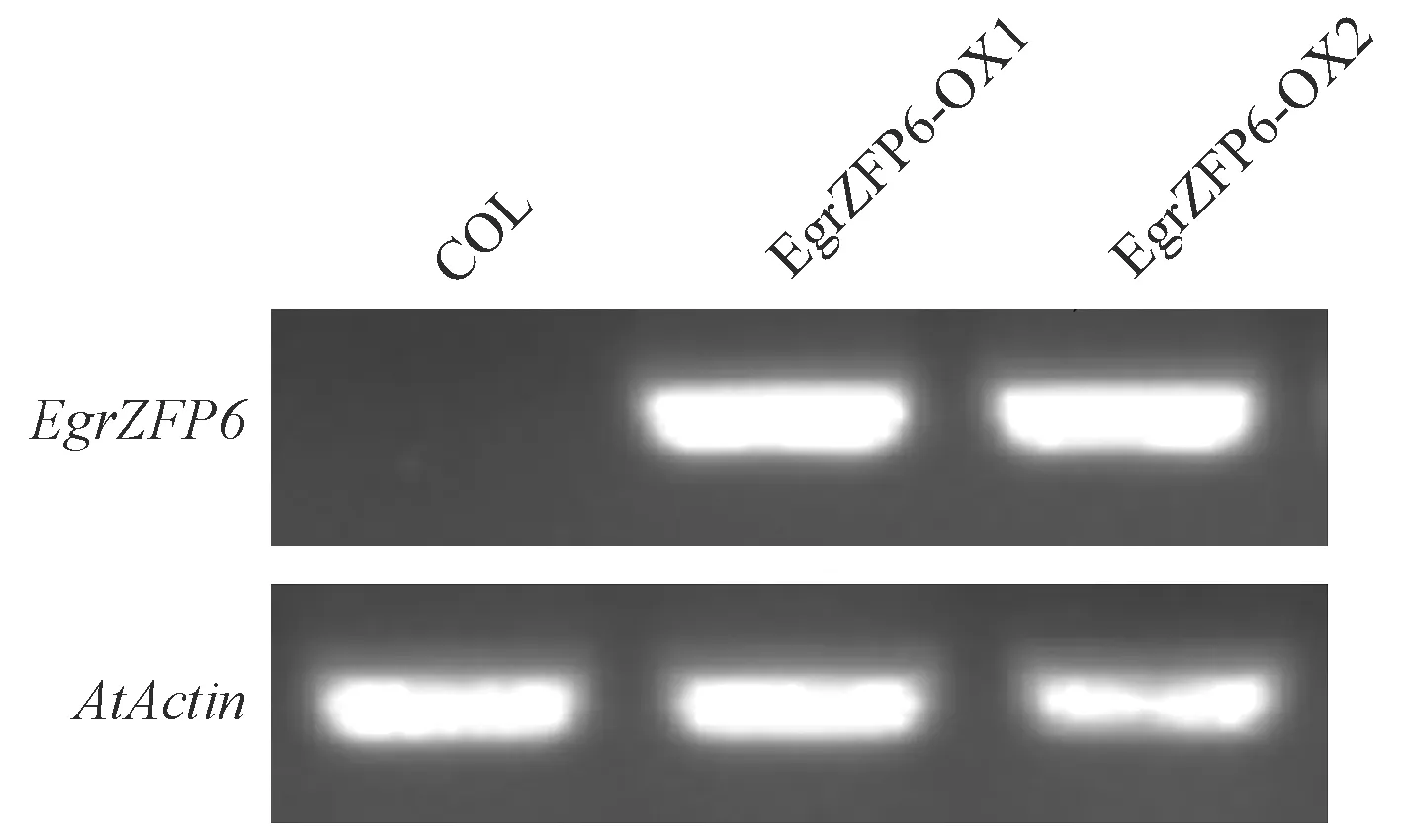
圖3 野生型和超表達EgrZFP6擬南芥轉基因株系鑒定Fig.3 Identification of EgrZFP6 expression in wild type and two EgrZFP6 over-expression lines in Arabidopsis thalianaCOL: 野生型; EgrZFP6-OX1, EgrZFP6-OX2: 超表達株系。下同。COL: Wild type; EgrZFP6-OX1, EgrZFP6-OX2: Over-expression lines. The same below.
2.4 超表達EgrZFP6基因擬南芥株系正常條件及低溫、高鹽和PEG處理下表型分析
超表達EgrZFP6擬南芥2個純合株系EgrZFP6-OX1和EgrZFP6-OX2,播種7天后與對照(COL)相比,根長生長明顯受到抑制(圖4A),2個轉基因株系的根長分別為野生型的 89.4%和 87.0%(圖4B)。
鹽處理下,EgrZFP6超表達擬南芥株系與野生型擬南芥隨鹽濃度提高,主根、側根生長都表現為受鹽抑制,但受抑制程度EgrZFP6超表達株系相對于野生型有所減弱,暗示超表達EgrZFP6在一定程度上能夠提高植株對鹽脅迫的耐受性(圖5)。
在PEG處理中,1 g·L-1以上的濃度即能誘導EgrZFP6超表達擬南芥株系側根大量發生,同時側根伸長作用也明顯被促進。但主根伸長與對照相比,在PEG處理下受抑制作用減弱,表示超表達EgrZFP6株系主根伸長生長對滲透脅迫的抑制作用敏感性下降(圖6)。
超表達EgrZFP6轉基因株系,-8 ℃低溫處理3天,然后于正常溫度下(24 ℃)恢復生長3天,轉基因株系生長恢復速度很慢; 同時,野生型死亡率為16%,而轉基因株系的植株死亡率分別達到了40%和48%。表明EgrZFP6超表達提高了轉基因株系對低溫的敏感性(圖7)。
2.5 酵母雙雜交結果分析
酵母雙雜交文庫中篩選到1個與EgrZFP6互作的蛋白EgrERF4,對該基因編碼蛋白與EgrZFP6的互作情況進行了一對一驗證。pGADT7/pGBKT7-EgrZFP6轉化后融合菌株在雙缺平板DDO(SD/-Trp/-Leu)和四缺平板QDO(SD/-Trp/-Leu/-His/-Ade)沒有菌斑生長,陰性對照(pGADT7-T/pGBKT7-Lam)也沒有菌斑生長,陽性對照(pGADT7-T/pGBKT7-53)菌斑生長正常并且顯藍色(圖8 A),表明其沒有自激活活性。而pGBKT7-EgrZFP6與pGADT7-EgrERF4轉化后的融合菌株雙雜交在雙缺平板DDO(SD/-Trp/-Leu)上可正常生長,在四缺平板QDO(SD/-Trp/-Leu/-His/-Ade)上正常生長且菌斑為藍色(圖8B),這些結果表明EgrZFP6和EgrERF4兩個蛋白存在互作現象。
2.6 EgrERF4定量表達結果分析
對正常巨桉幼苗低溫、干旱和鹽脅迫條件下,葉片中EgrERF4表達進行分析,結果表明,不同低溫(-8,-4,0,4 ℃)2 h處理下,除了-8 ℃處理下EgrERF4表達受到抑制外,其他低溫條件都對基因表達呈誘導趨勢,其中4 ℃處理對基因的誘導作用最強,表達量為對照(25 ℃)的8.6倍(圖9A)。-8 ℃時的抑制作用可能是由于過低溫度造成凍害,引起細胞調控紊亂所致。4 ℃不同時間(0.5,2,6,12,24,48 h)處理定量結果表明,處理0.5 h后,表達量即明顯上調,達到對照的1.5倍,處理6 h時基因相對表達量已是對照的7.6倍,12 h后誘導作用達到最大,上調至對照的9.6倍,之后表達量有所下降,但仍處于高度誘導水平(圖9B)。
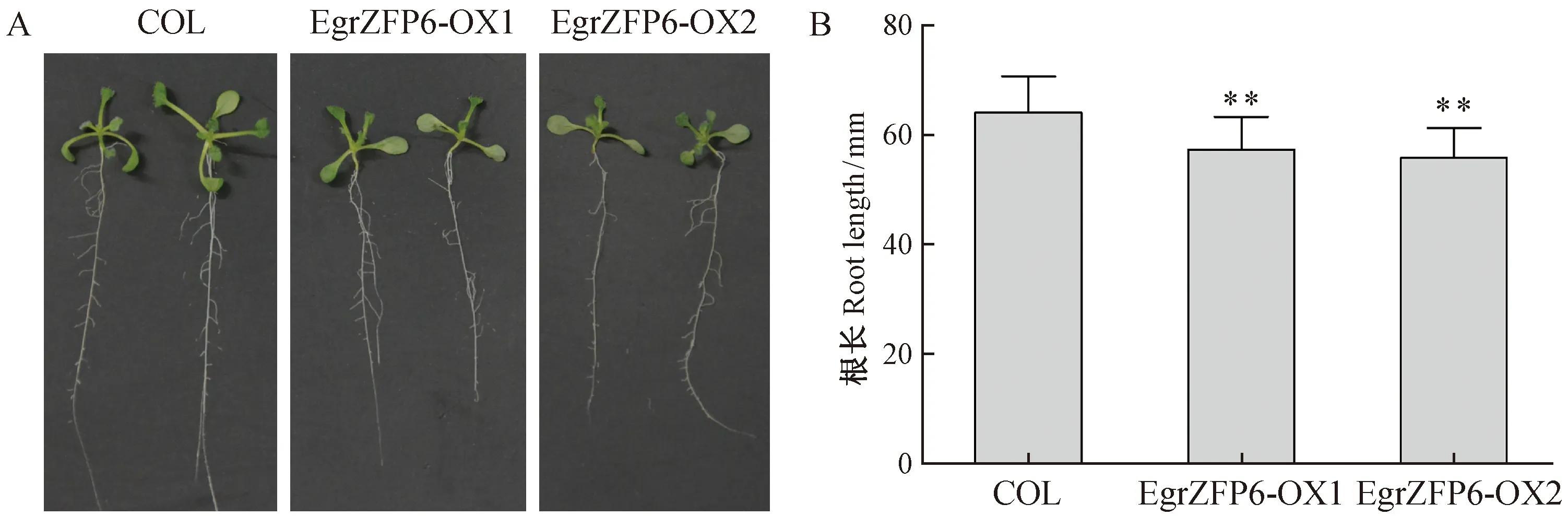
圖4 野生型和超表達EgrZFP6擬南芥轉基因株系生長7天后表型(A)和根長差異(B)Fig.4 Phenotype(A) of wild type and EgrZFP6 over-expression lines after 7 days growth and difference of the primary root length(B)t檢驗 t test: **,Plt;0.01.

圖5 鹽脅迫下野生型和超表達EgrZFP6擬南芥的表型Fig.5 Phenotype of wild type and EgrZFP6 over-expression Arabidopsis thaliana lines under salt treatments

圖6 模擬干旱脅迫下野生型和超表達EgrZFP6擬南芥的表型Fig.6 Phenotype of wild type and EgrZFP6 over-expression Arabidopsis thaliana lines under PEG treatments
巨桉植株在200 mmol·L-1NaCl處理12 h后,EgrERF4表達量即開始受到明顯誘導,至48 h時表達量達到對照組的12.6倍(圖9C),表明EgrERF4表達受到高鹽脅迫誘導。而干旱脅迫下,處理1天后EgrERF4表達即受到抑制,第2天恢復對照水平,隨后又表現出強烈的抑制效應,干旱處理5天時,表達量僅為對照的0.17倍(圖9D)。

圖7 -8 ℃處理后野生型和超表達EgrZFP6擬南芥的表型Fig.7 Phenotype of wild type and EgrZFP6 over-expression Arabidopsis thaliana lines after treatment at -8 ℃
3 討論
作為典型C2H2型鋅指結構蛋白,EgrZFP6不僅有2個極為保守的鋅指結構域,同時還含有1個EAR基序,該基序是1個轉錄抑制基序,含有它的轉錄因子往往作為負調控因子起作用。擬南芥中同樣含有EAR基序的鋅指結構轉錄因子基因AtERF7超表達能夠通過降低保衛細胞對ABA的敏感性,導致由于水分過度蒸發而負調控植株對干旱逆境的響應(Songetal., 2005); 擬南芥AtZAT11基因超表達能夠下調液泡鎳轉運蛋白表達,進一步降低植株中鎳含量,致使超表達AtZAT11植株對鎳的耐受性降低(Liuetal., 2014)。小麥(Triticumaestivum)基因TaZFP34可以被低溫、高鹽和干旱等非生物逆境因子誘導表達,且干旱誘導時產生對根發育相關的B類響應調節因子基因SHY2表達的抑制作用,提高植株根冠比(Changetal., 2016)。本研究中超表達EgrZFP6基因的2個擬南芥株系中,植株表現出根長生長受抑制現象,這極有可能是因為EgrZFP6作為負調控因子,下調了根伸長相關分子途徑中重要基因表達而導致的。另外,轉基因株系對低溫敏感性的提高也可能與EgrZFP6對基因表達的負調控特性有關,其可能抑制了植株中一些響應低溫脅迫基因的表達,提高了植株對低溫的敏感性。
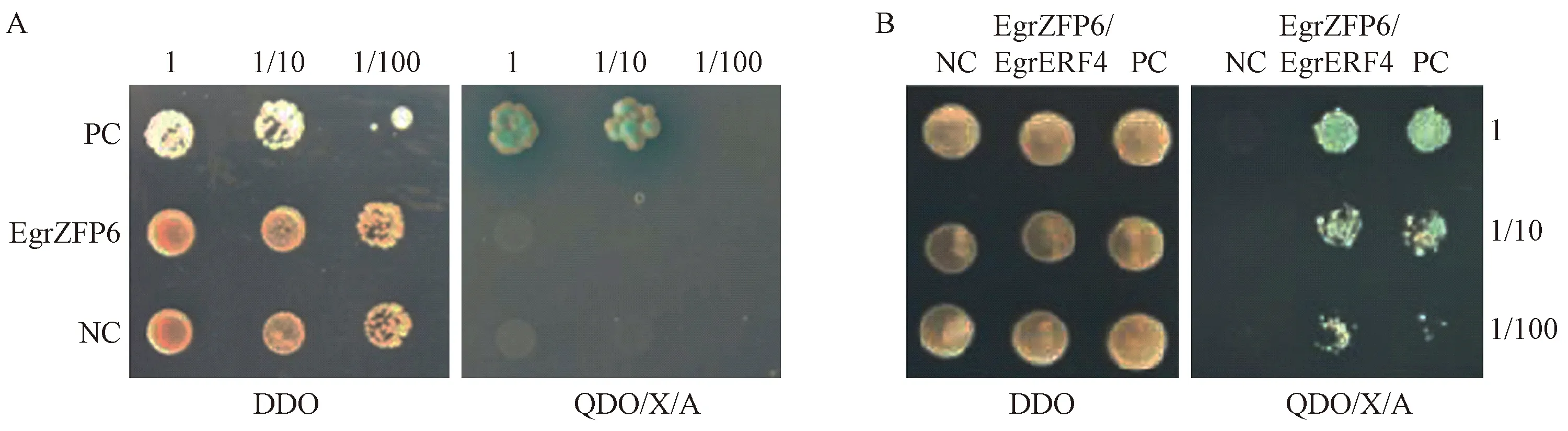
圖8 EgrZFP6自激活檢測(A)及EgrZFP6與EgrERF4酵母雙雜結果(B)Fig.8 The self-activation detection of EgrZFP6(A)and the result of yeast two-hybrid of EgrERF4 and EgrZFP6(B)DDO: 雙缺平板(SD/-Trp/-Leu); QDO: 四缺平板(SD/-Trp/-Leu/-His/-Ade); X: 酵母半乳糖苷酶; A: 金擔子素A; NC: 陰性對照; PC: 陽性對照; 1, 1/10, 1/100: 稀釋倍數。DDO: SD/-Trp/-Leu; QDO: SD/-Trp/-Leu/-His/-Ade; X: X-α-Gal; A: Aureobasidin A; NC: Negative control; PC: Positive control; 1, 1/10, 1/100: Dilution multiple.
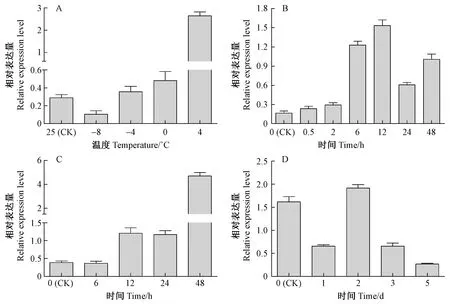
圖9 EgrERF4在不同低溫(A)、4 ℃不同時間(B)、鹽脅迫(C)和干旱脅迫(D)處理下相對表達量Fig.9 Relative expression of EgrERF4 under different temperature treatment(A)、different time treatment at 4 ℃(B)、salt treatment(C) and drought stress(D)
另外,也有研究表明,C2H2型鋅指結構蛋白即使含有轉錄抑制基序EAR,其仍可以作為激活因子發揮正調控作用,在非生物逆境脅迫中發揮重要作用(Ohtaetal., 2001)。番茄(Lycopersiconesculentum)中含有EAR基序的C2H2型鋅指結構蛋白基因SIZF2在擬南芥中超表達參與ABA信號傳導,下調激素特別是ABA相關基因的表達,增強其對鹽脅迫的耐受性(Hichrietal., 2014)。擬南芥基因ZFP3超表達可增強植株對鹽和滲透脅迫的耐受能力(Zhangetal., 2016a); 玉米(Zeamays)ZmZF1和野大豆(Glycinesoja)GsZFP1超表達擬南芥抗旱性都得到明顯增強(Huaietal., 2009; Luoetal., 2011); 水稻基因ZFP252和OsMSR15則能夠在水稻干旱脅迫調控中發揮重要作用,其超表達植株干旱耐受性提高(Xuetal., 2008; Zhangetal., 2016b)。本研究在模擬干旱PEG處理下,EgrZFP6擬南芥轉基因株系相對于對照根伸長不受影響,而側根數量和長度都明顯增加,這是干旱適應性的表現,暗示EgrZFP6的超表達能夠形成一定的抗旱性植株表型特征。高鹽脅迫下,EgrZFP6轉基因植株對鹽脅迫耐受性有一定程度提高。這應該都與EgrZFP6對相應逆境響應相關基因的正向調控作用密不可分。EgrZFP6在低溫和干旱、高鹽不同逆境下所發揮的截然不同調控機制,表明了該基因在植物逆境調控中的復雜性。
EgrZFP6蛋白序列中還含有1個L-box基序,該基序參與蛋白與蛋白之間的互作效應(Kagaleetal., 2011)。酵母雙雜交篩選結果表明,EgrZFP6能夠與EgrERF4互作,EgrERF4是乙烯應答因子ERF轉錄因子基因家族中的1個成員,該家族成員編碼蛋白序列以含有1個AP2/ERF結構域為重要特征,在低溫、干旱和高鹽等非生物逆境脅迫響應過程中發揮重要調控作用(Xuetal., 2011; Mizoietal., 2012)。非生物逆境響應中,該家族轉錄因子和C2H2型鋅指結構蛋白因子類似,發揮的作用也有兩面性,既可以是負調控因子,也可以是正調控因子。水稻OsERF109的超表達使轉基因植株的干旱耐受能力降低(Yuetal., 2016),超表達OsAP23則會提高轉基因植株對鹽的敏感性(Zhuangetal., 2013),這些ERF類轉錄因子都是作為負調控因子而存在的。而另外一些ERF基因家族成員則可以促進非生物逆境抗性的提高。大豆(Glycinemax)中GmERF3和水稻中JERF3、JERF1和TERF1的超表達都能使轉基因植株有效增強對干旱和高鹽的抗性(Zhangetal., 2009; 2010a; 2010b; Gaoetal., 2008)。酵母雙雜交結果表明EgrZFP6蛋白能夠與EgrERF4蛋白互作。表達層面上,巨桉EgrERF4基因表達在低溫和鹽脅迫下都被不同程度誘導,但受干旱逆境條件抑制。這與EgrZFP6的表達結果相似(Wangetal., 2014),二者表達具有一定協同性。這暗示它們在功能發揮方面可能也存在較大相似性,EgrZFP6與EgrERF4的互作效應在非生物逆境脅迫響應中的具體作用,尚需進一步的研究進行揭示。
4 結論
巨桉C2H2型鋅指結構蛋白轉錄因子EgrZFP6,參與低溫逆境脅迫響應的負調控作用,提高植物對低溫的敏感性。但在干旱和高鹽等滲透脅迫下,其過表達能夠改變植株根構型,使其向適應脅迫的方向發展。同時EgrZFP6可與乙烯響應因子蛋白EgrERF4互作,二者可能通過這種互作效應協同參與巨桉低溫、干旱和高鹽等逆境脅迫響應過程。
黃 驥, 王建飛, 張紅生. 2004.植物C2H2型鋅指蛋白的結構與功能. 遺傳, 26(3): 414-418.
(Huang J, Wang J F, Zhang H S. 2004.Structure and function of plant C2H2 zinc finger protein. Hereditas, 26(3): 414-418.[in Chinese])
金美芳. 2007. 擬南芥總RNA的簡便提取與效果分析. 福建師范大學福清分校學報,79(2): 16-18.
(Jin M F. 2007. A simple method forArabidopsisthalianatotal RNA isolation and its advantage. Journal of Fuqing Branch of Fujian Normal University, 79(2): 16-18. [in Chinese])
許紅梅,張立軍,劉 淳. 2010.農桿菌蘸花法侵染擬南芥的研究. 北方園藝,(14):143-146.
(Xu H M, Zhang L J, Liu C. 2010. Study of infection ofArabidopsisthalianabyAgrobacteriumdipping flower method. Northern Horticulture,(14):143-146.[in Chinese])
王亞紅,劉 縉,王玉國. 2010.高質量提取銀杏種仁總RNA的改良方法. 中國農學通報, 26(15): 48-52.
(Wang Y H, Liu J, Wang Y G. 2010. An improved method for RNA isolation from seeds ofGinkgobilobaL. Chinese Agricultural Science Bulletin, 26(15):48-52.[in Chinese])
Agarwal P, Arora R, Ray S,etal. 2007. Genome-wide identification of C2H2 zinc-finger gene family in rice and their phylogeny and expression analysis. Plant Molecular Biology, 65(4): 467-485.
Chang H, Chen D, Kam J,etal. 2016. Abiotic stress upregulated TaZFP34 represses the expression of type-B response regulator and SHY2 genes and enhances root to shoot ratio in wheat. Plant Science, 252: 88-102.
Dos Reis S P, Lima A M, de Souza C R. 2012. Recent molecular advances on downstream plant responses to abiotic stress. International Journal of Molecular Sciences, 13(7): 8628-8647.
Englbrecht C C, Heiko S, Siegfried B. 2004. Conservation, diversification and expansion of C2H2 zinc finger proteins in theArabidopsisthalianagenome. BMC Genomics, 5(1): 39.
Gao S M, Zhang H W, Tian Y,etal. 2008. Expression ofTERF1 in rice regulates expression of stress-responsive genes and enhances tolerance to drought and high-salinity. Plant Cell Reports, 27(11): 1787-1795.
Gujjar R S, Akhtar M, Singh M. 2014. Transcription factors in abiotic stress tolerance. Indian Journal of Plant Physiology, 19(4): 306-316.
Hichri I, Muhovski Y, ?i?ková E,etal. 2014. TheSolanumlycopersicumZinc Finger2 cysteine-2/histidine-2 repressor-like transcription factor regulates development and tolerance to salinity in tomato andArabidopsis. Plant Physiology, 164(4): 1967-1990.
Huai J L, Zheng J, Wang G Y. 2009. Overexpression of a new Cys2/His2 zinc finger protein ZmZF1 from maize confers salt and drought tolerance in transgenicArabidopsis. Plant Cell, Tissue and Organ Culture, 99(2): 117-124.
Huang J, Sun S J, Xu D Q,etal. 2009. Increased tolerance of rice to cold, drought and oxidative stresses mediated by the overexpression of a gene that encodes the zinc finger protein ZFP245. Biochemical and Biophysical Research Communications, 389(3): 556-561.
Kagale S, Rozwadowski K. 2011. EAR motif-mediated transcriptional repression in plants: an underlying mechanism for epigenetic regulation of gene expression. Epigenetics, 6(2):141-146.
Kong J, Cao W H, Zhang J S,etal. 2004. Transgenic analysis of a salt-inhibitedOsZFP1 gene from rice. Acta Botanica Sinica, 46(5): 573-577.
Kubo K I, Sakamoto A, Kobayashi A,etal. 1998. Cys2/His2 zinc-finger protein family of petunia: evolution and general mechanism of target-sequence recognition. Nucleic Acids Research, 26(2): 608-615.
Liu X M, An J, Han H J,etal. 2014. ZAT11, a zinc finger transcription factor, is a negative regulator of nickel ion tolerance inArabidopsis. Plant Cell Reports, 33(12): 2015-2021.
Luo X, Bai X, Zhu D,etal. 2011. GsZFP1, a new Cys2/His2-type zinc-finger protein, is a positive regulator of plant tolerance to cold and drought stress. Planta, 235(6): 1141-1155.
Mizoi J, Shinozaki K, Yamaguchi-Shinozaki K. 2012. AP2/ERF family transcription factors in plant abiotic stress responses. Biochimica et Biophysica Acta (BBA)-Gene Regulatory Mechanisms, 1819(2): 86-96.
Ohta M, Matsui K, Hiratsu K,etal. 2001. Repression domains of class II ERF transcriptional repressors share an essential motif for active repression. Plant Cell, 13(8): 1959-1968.
Reddy D S, Mathur P B, Sharma K K. 2013. Regulatory role of transcription factors in abiotic stress responses in plants//Climate change and plant abiotic stress tolerance. Wiley-VCH Verlag GmbH amp; Co. KGaA, 555-588.
Roychoudhury A, Banerjee A, Lahiri V. 2015. Metabolic and molecular-genetic regulation of proline signaling and its cross-talk with major effectors mediates abiotic stress tolerance in plants. Turkish Journal of Botany, 39(6): 887-910.
Song C P, Agarwal M, Ohta M,etal. 2005. Role of anArabidopsisAP2/EREBP-type transcriptional repressor in abscisic acid and drought stress responses. Plant Cell, 17(8): 2384-2396.
Sugano S, Kaminaka H, Rybka Z,etal. 2003. Stress-responsive zinc finger geneZPT2-3 plays a role in drought tolerance in petunia. The Plant Journal, 36(6): 830-841.
Takabe T. 2012. Engineering of betaine biosynthesis and transport for abiotic stress tolerance in plants. Journal of Plant Biochemistry and Biotechnology, 21(1): 58-62.
Takatsuji H. 1999. Zinc-finger proteins: the classical zinc finger emerges in contemporary plant science. Plant Molecular Biology, 39(6): 1073-1078.
Wang S, Wei X L, Cheng L J,etal. 2014. Identification of a C2H2-type zinc finger gene family fromEucalyptusgrandisand its response to various abiotic stresses. Biologia Plantarum, 58(2): 385-390.
Xu Z S, Chen M, Li L C,etal. 2011. Functions and application of the AP2/ERF transcription factor family in crop improvement. Journal of Integrative Plant Biology, 53(7): 570-585.
Xu D Q, Huang J, Guo S Q,etal. 2008. Overexpression of a TFIIIA-type zinc finger protein geneZFP252 enhances drought and salt tolerance in rice (OryzasativaL.). FEBS Letters, 582(7): 1037-1043.
Yu Y, Yang D, Zhou S,etal. 2016. The ethylene response factor OsERF109 negatively affects ethylene biosynthesis and drought tolerance in rice. Protoplasma, 254: 401-408.
Zhang G, Chen M, Li L,etal. 2009. Overexpression of the soybeanGmERF3 gene, an AP2/ERF type transcription factor for increased tolerances to salt, drought, and diseases in transgenic tobacco. Journal of Experimental Botany, 60(13): 3781-3796.
Zhang H, Wu L, Wan L,etal. 2010a. Functional analyses of ethylene response factor JERF3 with the aim of improving tolerance to drought and osmotic stress in transgenic rice. Transgenic Research, 19(5): 809-818.
Zhang Z, Li F, Li D,etal. 2010b. Expression of ethylene response factor JERF1 in rice improves tolerance to drought. Planta, 232(3): 765-774.
Zhang A, Liu D, Hua C,etal. 2016a. TheArabidopsisgene zinc finger protein 3(ZFP3) is involved in salt stress and osmotic stress response. PLoS One,11(12): e0168367.
Zhang X, Zhang B, Li M J,etal. 2016b.OsMSR15 encoding a rice C2H2-type zinc finger protein confers enhanced drought tolerance in transgenicArabidopsis. Journal of Plant Biology, 59(3): 271-281.
Zhao C, Zhang Z, Xie S,etal. 2016. Mutational evidence for the critical role of CBF transcription factors in cold acclimation inArabidopsis. Plant Physiology,171(4): 2744-2759.
Zhuang J, Jiang H H, Wang F,etal. 2013. A rice OsAP23, functioning as an AP2/ERF transcription factor, reduces salt tolerance in transgenicArabidopsis. Plant Molecular Biology Reporter, 31(6): 1336-1345.
(責任編輯 徐 紅)
FunctionofZFP6GenefromEucalyptusgrandisinResponsetoAbioticStresses
Wang Xiaorong Cheng Longjun Xu Fenghua Ni Xiaoxiang Lu Jun
(StateKeyLaboratoryofSubtropicalSilvicultureZhejiangAamp;FUniversityHangzhou311300)
【Objective】EgrZFP6(Eucgr.A01232)is a gene which is involved in abiotic stresses response inEucalyptusgrandis. With the study of protein structure and function of EgrZFP6, the roles it possibly played in abiotic stress response inE.grandiswere discussed in order to provide a basis for stress resistance breeding ofEucalyptus.【Method】 The EgrZFP6 protein structure was analyzed with CDD online software. And, sequences of ZFP protein in other plant species that have high similarity with EgrZFP6 were downloaded from NCBI after Blast software was used. Multiple alignments for these sequences were finished with Clustalx and their motifs were analyzed. EgrZFP6∷sGFP fused expression vector was also constructed and transformed into onion epidermal cells via gene gun bombardment to identify subcellular localization of EgrZFP6. Transformation of 35S∷EgrZFP6 intoArabidopsisthalianawas via floral-dip method. Two homozygous lines ofEgrZFP6 over-expression inA.thalianawere obtained, their phenotype under normal condition, low temperature, drought and high salinity treatments were evaluated compared to wild type (COL). Based on Yeast 2 Hybridization, EgrERF4 (Eucgr.F01164), a protein can interact with EgrZFP6, was screened from the Yeast 2 Hybridization library. The expression ofEgrERF4 under low temperature, drought and salinity inE.grandisseedlings was also analyzed. Protein that can interact with EgrZFP6 were screened and verified by Yeast 2 Hybridization. Gene expression ofEgrERF4 under abiotic stresses was analyzed by real time fluorescence quantitative RT-PCR method .【Result】 The EgrZFP6 is a classic C2H2 type zinc finger protein. There are 2 zinc finger domains with QALGGH sequence which is specific for plants in it. An ERF (ethylene responsive element binding factor) associated amphiphilic repression (EAR) motif and a L-box motif were also found in the protein sequence.Result of subcellular localization revealed the protein EgrZFP6 encoded was localized in the nuclear. Under normal condition, the twoEgrZFP6 over-expressionA.thalianalines showed primary root growth inhibition compared to wide type. However, its sensitivity to the low temperature was increased. PEG treatments can promote lateral root growth and increase the number of them and the transgenic lines showed tolerance to salinity treatment to some extent. EgrERF4, an ethylene responsive factor, can interact with EgrZFP6. For the low temperature treatments to theE.grandisseedlings,EgrERF4 expression can be induced under time course treatments (0.5,2,6,12,24,48 h) at 4 ℃ and different low temperature (-8,-4,0,4 ℃,2 h) except for -8 ℃.EgrERF4 expression induction was also found under high salinity (200 mmol·L-1), but drought inhibited theEgrERF4 expression.【Conclusion】 EgrZFP6 transcriptional factor was possibly involved in the low temperature, high salinity and drought stresses through interacting with EgrERF4 inEucalyptusgrandis. In plants, EgrZFP6 may negatively regulate the sensitivity to cold stress. But for drought and salinity stress responses, it possibly played a positive role via changing the root pattern.
Eucalyptusgrandis;EgrZFP6; abiotic stress; gene function
10.11707/j.1001-7488.20171107
2017-03-22;
2017-04-20。
國家自然科學基金項目“巨桉鋅指結構蛋白基因EgrZPCT在抗冷脅迫中功能和調控機制研究”(31270657); 浙江省科技廳林木新品種選育重大科技專項“沿海防護林重點樹種高抗品種選育”(2016C02056-9)。
*程龍軍為通訊作者。
S718.46
A
1001-7488(2017)11-0060-09

