電解質溶液中的核心觀念分析
江蘇 陳 穎 李萬春
電解質溶液中的核心觀念分析

電解質溶液理論是學習的難點和考試的熱點。分析歷年來的高考化學試題,可以發現高考對這部分內容的考查主要集中在四種化學觀念上。以此四種觀念作為復習的抓手,可以突破難點,提高復習效率。
1.平衡觀
電解質溶液中存在三個平衡體系,平衡移動原理是分析平衡體系的根本原理,可用平衡移動原理作為知識主線統帥復習,對三大平衡列表進行比較:
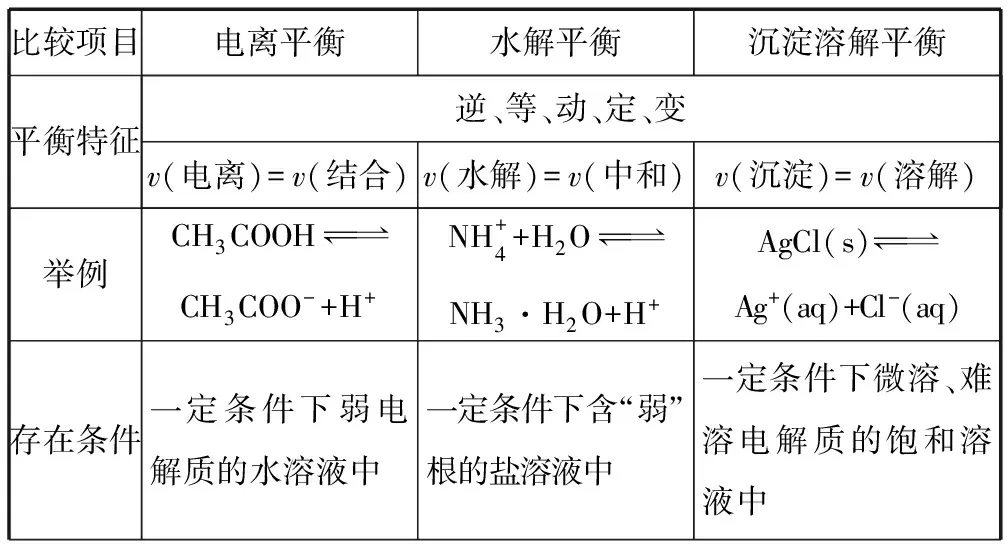
比較項目電離平衡水解平衡沉淀溶解平衡平衡特征逆、等、動、定、變v(電離)=v(結合)v(水解)=v(中和)v(沉淀)=v(溶解)舉例CH3COOH CH3COO-+H+NH+4+H2O NH3·H2O+H+AgCl(s) Ag+(aq)+Cl-(aq)存在條件一定條件下弱電解質的水溶液中一定條件下含“弱”根的鹽溶液中一定條件下微溶、難溶電解質的飽和溶液中
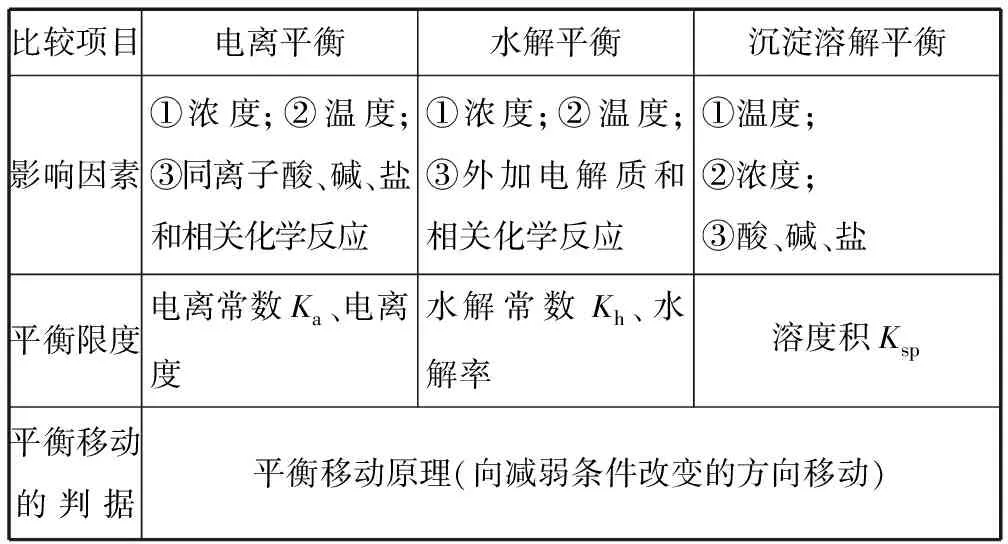
續表
例1下列圖示與對應的敘述相符的是
( )
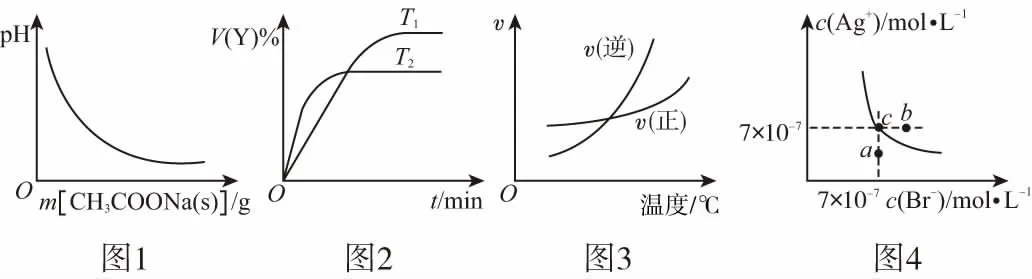
A.圖1表示CH3COOH溶液中逐步加CH3COONa固體后,溶液pH的變化
C.圖3表示某可逆反應正、逆反應速率隨溫度變化,則該反應的正反應是吸熱反應
D.圖4表示AgBr的沉淀溶解平衡,在AgBr飽和溶液中加入NaBr固體,可使溶液由c點到b點
解析:在CH3COOH溶液中加CH3COONa固體后,CH3COOH的電離平衡逆向移動,溶液pH增大,A錯誤;對于放熱反應,溫度降低時,平衡正向移動,生成物的體積分數增大,且溫度低時反應后達到平衡所需的時間長,B正確;圖3說明反應達到平衡后,升高溫度,逆反應速率大于正反應速率,平衡逆向移動,該反應是放熱反應,C錯誤;在AgBr飽和溶液中加入NaBr固體后,c(Br-)增大,溶解平衡逆向移動,c(Ag+)減小,但平衡點仍在曲線上,D錯誤。
答案:B
2.主次觀
在分析電解質溶液中的微粒濃度關系時,我們只有抓住其中主要矛盾和次要矛盾的關系,才能把握問題的本質,不會偏離方向,順利解決問題。
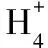
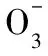
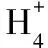
例2下列有關電解質溶液中微粒的物質的量濃度關系正確的是
( )
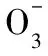

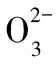
D.常溫下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
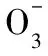
答案:D
3.守恒觀
守恒觀在化學中無處不在,守恒法是解化學題的核心方法之一,掌握了守恒法就等于掌握了化學解題的金鑰匙。電解質溶液中存在如下三個守恒:

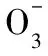

電解質溶液中的等式通常有兩個,即電荷守恒式和物料守恒式,一些復雜的等式往往是對這兩個守恒關系式經過變形得到的,或代入某些所給已知條件得到的。
例3下列溶液中微粒的物質的量濃度關系正確的是
( )
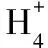
B.0.1 mol/L Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.25℃時,pH=2的HCOOH與pH=12的NaOH等體積混合:c(HCOO-)+c(H+) 答案:D 電解質溶液部分的實驗內容是很豐富的,既有定性實驗,也有定量實驗。例如,溶液pH的測定、強電解質和弱電解質的實驗判定、沉淀的生成與轉化、中和滴定等。以實驗為主線進行復習,在解決實驗問題的過程中能加深對知識的理解,實現問題解決的自動化、條理化和準確化。在歷年來的高考中,對這部分的化學實驗的考查主要集中在酸堿中和滴定這個定量實驗上,考查實驗的基本知識及滴定原理的遷移運用。 例4滴定實驗是化學學科中重要的定量實驗。請回答下列問題: (1)酸堿中和滴定——用標準鹽酸滴定未知濃度的NaOH溶液,下列操作造成測定結果偏高的是________(填選項字母)。 A.滴定終點讀數時,俯視滴定管刻度 B.盛裝未知液的錐形瓶用蒸餾水洗過,未用未知液潤洗 C.酸式滴定管用蒸餾水洗凈后,未用標準鹽酸潤洗 D.滴定前,滴定管尖嘴有氣泡,滴定后氣泡消失 滴定次數待測液體積(mL)標準KMnO4溶液體積(mL)滴定前讀數滴定后讀數第一次25.000.5020.40第二次25.003.0023.00第三次25.004.0024.10 ①滴定時,KMnO4溶液應裝在________(填“酸”或“堿”)式滴定管中,滴定終點時滴定現象是________________________。 ②該草酸溶液的物質的量濃度為________。 (3)沉淀滴定——滴定劑和被滴定物反應的生成物比滴定劑與指示劑反應的生成物更難溶。參考下表中的數據,若用AgNO3滴定NaSCN溶液,可選用的指示劑是________(填字母)。 難溶物AgClAgBrAgCNAg2CrO4AgSCN顏色白淺黃白磚紅白Ksp1.77×10-105.35×10-131.21×10-161.12×10-121.0×10-12 A.NaCl B.NaBr C.NaCN D.Na2CrO4 解析:(1)A項,使所測標準液體積偏小,測定結果偏小;B項,對實驗結果無影響;C項,標準液被稀釋,使耗用標準液體積偏大,測定結果偏高;D項,氣泡體積計入標準液中了,使所測標準液體積偏大,測定結果偏高。 (3)用AgNO3滴定NaSCN溶液時,生成白色的AgSCN沉淀。指示劑與滴定劑反應應生成與此不同顏色的沉淀,據此可排除A、C選項;滴定劑和被滴定物反應的生成物比滴定劑與指示劑反應的生成物更難溶,據此可排除B項。選Na2CrO4為指示劑,滴定終點時生成磚紅色沉淀。 江蘇省常州市橫山橋高級中學)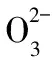
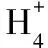
4.實驗觀