蘋果酵素天然發(fā)酵過程中代謝產(chǎn)物的變化規(guī)律
楊小幸,周家春,陳啟明,秦 臻,馬明月,趙黎明,*
蘋果酵素天然發(fā)酵過程中代謝產(chǎn)物的變化規(guī)律
楊小幸1,周家春1,陳啟明1,秦 臻1,馬明月2,趙黎明1,*
(1.華東理工大學(xué)生物工程學(xué)院,華東理工大學(xué)發(fā)酵工業(yè)分離提取技術(shù)研發(fā)中心,生物反應(yīng)器工程國家重點(diǎn)實(shí)驗(yàn)室,上海 200237;2.重慶郵電大學(xué)生物信息學(xué)院,重慶 400065)
為研究蘋果酵素天然發(fā)酵過程中物質(zhì)代謝變化,對天然發(fā)酵過程中pH值、總酸、有機(jī)酸(乳酸、醋酸、蘋果酸)、糖類(蔗糖、葡萄糖、果糖)、乙醇、總酚含量、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除率的變化進(jìn)行分析。結(jié)果表明,發(fā)酵過程中pH值從5.05降至3.88,總酸、乳酸含量呈不斷上升趨勢,乙酸質(zhì)量分?jǐn)?shù)由0.018%升至0.23%,蘋果酸質(zhì)量濃度在發(fā)酵前14 d由初值0.67 g/L上升至2.45 g/L后略微下降;葡萄糖、果糖質(zhì)量濃度呈先升后降趨勢,且二者均在發(fā)酵第21天達(dá)到最大值130.6、177.2 g/L,蔗糖質(zhì)量濃度不斷下降趨于0 g/L;乙醇在發(fā)酵14~21 d過程中產(chǎn)生,發(fā)酵4周后乙醇體積分?jǐn)?shù)可達(dá)6.6%;總酚質(zhì)量濃度與DPPH自由基清除率呈先升后降趨勢,均在發(fā)酵第21天達(dá)到最大值為259.4 mg/L、90.9%。
蘋果酵素;天然發(fā)酵;代謝物質(zhì);DPPH自由基清除率
近年來,隨著人們保健意識的加強(qiáng),酵素發(fā)酵飲料越來越受消費(fèi)者歡迎。酵素是以植物、動物、菌類等為原料,經(jīng)多種微生物發(fā)酵而產(chǎn)生的、富含多種生物活性成分的微生物發(fā)酵產(chǎn)品[1]。已有研究表明酵素具有解酒護(hù)肝、促進(jìn)淋巴細(xì)胞增殖等作用[2-3]。酵素產(chǎn)品按生產(chǎn)工藝可分為群種發(fā)酵酵素和純種發(fā)酵酵素[4]。群種發(fā)酵作為一種傳統(tǒng)的發(fā)酵方式是將原料置于自然條件下利用原料自身所攜帶的微生物進(jìn)行發(fā)酵,因此又稱為天然發(fā)酵。與純種發(fā)酵方式相比,天然發(fā)酵操作工藝簡單,可較大程度地保留原料中的營養(yǎng)成分,在家庭酵素制作中得到廣泛應(yīng)用,多數(shù)酵素企業(yè)采用天然發(fā)酵方式制作酵素產(chǎn)品或?qū)⑵渥鳛榻退禺a(chǎn)品制作工藝的重要環(huán)節(jié)之一。天然酵素中的微生物主要有酵母菌、曲霉及乳酸菌[1],因此發(fā)酵周期的控制需要結(jié)合發(fā)酵過程中多種微生物的基質(zhì)代謝與產(chǎn)物生成情況綜合考慮。目前對酵素天然發(fā)酵過程的研究多集中在抗氧化性能變化[5-8]以及多糖的分離鑒定[9-11],對發(fā)酵過程中代謝產(chǎn)物變化的研究則相對較少。而原料自身利用程度、生成代謝物的種類產(chǎn)量是酵素產(chǎn)品質(zhì)量指標(biāo)的關(guān)鍵所在,也是判定發(fā)酵終點(diǎn)的主要依據(jù)。因此研究發(fā)酵過程中代謝物質(zhì)的變化規(guī)律很有必要。
蘋果含有糖類、蛋白質(zhì)、有機(jī)酸、維生素及蘋果多酚等營養(yǎng)成分,是日常生活中最常見、消費(fèi)量最大的水果之一,也是日常飲食中外源性抗氧化物質(zhì)的主要來源[12],Kris-Etherton等[13]研究表明富含抗氧化成分的食品在防治自由基引起的疾病方面具有重要的作用。因此選擇蘋果為原料,探究蘋果酵素天然發(fā)酵過程中pH值、總酸、有機(jī)酸、糖類、總酚含量、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-trinitrophenylhydrazine,DPPH)自由基清除率的變化,以期為天然酵素產(chǎn)品發(fā)酵工藝的優(yōu)化及其綜合性開發(fā)提供一定的理論依據(jù)。
1 材料與方法
1.1 材料與試劑
富士蘋果、白砂糖(一級品) 市售;DPPH、福林-酚(均為分析純)、沒食子酸 阿拉丁化學(xué)試劑有限公司;標(biāo)準(zhǔn)品(蔗糖、葡萄糖、果糖、蘋果酸、乳酸、乙酸) 美國Sigma公司;乙腈(色譜純) 上海泰坦科技有限公司。
1.2 儀器與設(shè)備
CP214C電子天平 美國Ohaus公司;5810R大容量高速離心機(jī) 德國Eppendorf公司;UV-2000紫外分光光度計(jì) 尤尼克(上海)儀器有限公司;FE20精密pH計(jì) 瑞士Mettler-Toledo公司;高效液相色譜(high performance liquid chromatography,HPLC)系統(tǒng)(配有LC-10ADvp梯度泵、SPD-10Avp檢測器、RID-10A檢測器) 日本Shimadzu公司。
1.3 方法
1.3.1 蘋果酵素的制備
先用自來水沖洗蘋果表面數(shù)次,直至去除黏附在蘋果表面的雜物,后用純凈水沖洗蘋果表面并晾干。白砂糖用紫外燈輻照處理45 min,按蘋果與白砂糖質(zhì)量比2∶1將蘋果和白砂糖加入到已滅菌的玻璃瓶中,封口,放在暗處,室溫(10~20 ℃)發(fā)酵28 d。發(fā)酵過程中,分別在第2、5、8、11、14、21、28天取樣。取樣時先把玻璃瓶中的物料搖勻,后打開玻璃瓶下方閥門,使酵素液體流出,取得樣品。將所取蘋果酵素樣品離心(4 000 r/min,10 min),待測。
1.3.2 pH值的測定
取離心后的不同發(fā)酵天數(shù)的蘋果酵素樣品5 mL于10 mL離心管中,使用精密pH計(jì)測定各個樣品的pH值。
1.3.3 總酸含量的測定
參照GB/T 12456—2008《食品中總酸的測定》的方法測定,測定結(jié)果以蘋果酸質(zhì)量濃度(g/100 mL)計(jì)。
1.3.4 有機(jī)酸含量的測定
有機(jī)酸測定參考Molina等[14]方法進(jìn)行:將發(fā)酵不同時間的蘋果酵素離心,經(jīng)0.45 μm微孔濾膜過濾,采用HPLC法對蘋果酵素中的乳酸、乙酸、蘋果酸進(jìn)行定量測定,檢測條件:色譜柱ODS-C18柱(25 mm×4.6 mm,5 μm),流動相為體積分?jǐn)?shù)0.1%磷酸溶液,等度洗脫30 min,樣品進(jìn)樣量20 μL,流速1.0 mL/min,柱溫25 ℃;檢測波長215 nm。
1.3.5 糖含量的測定
蘋果酵素中的糖類測定參考Ghosh等[15]方法,將發(fā)酵不同時間的蘋果酵素離心稀釋后經(jīng)0.45 μm微孔濾膜過濾,采用HPLC測定。HPLC檢測條件為:NH2P-50 ShodexC-NH2色譜柱,流動相為V(乙腈)∶V(超純水)=70∶30,等度洗脫60 min,進(jìn)樣量20 μL,流速1.0 mL/min,柱溫35 ℃;示差折光檢測器。
1.3.6 乙醇含量的測定
參照GB/T 5009.225—2016《酒中乙醇濃度的測定》方法測定。
1.3.7 總酚含量的測定
采用福林-酚法[16]測定蘋果酵素中總酚含量。取0.1 mL 樣品用去離子水1∶1稀釋,與1 mL體積分?jǐn)?shù)50%的福林-酚溶液混合均勻并保持5 min,加入2 mL 7.5 g/100 mL Na2CO3溶液,避光條件下反應(yīng)30 min,于760 nm波長處測吸光度。蘋果酵素中總酚的含量以1 L酵素液中含有的沒食子酸(gallic acid equivalent,GAE)的質(zhì)量(mg)計(jì)。按照標(biāo)準(zhǔn)曲線線性方程y=5.547x+0.002 2(R2=0.999 6)計(jì)算總酚含量。每個樣品平行測定3 次。
1.3.8 蘋果酵素發(fā)酵過程中DPPH自由基清除率的測定
蘋果酵素天然發(fā)酵過程中DPPH自由基清除率變化測定參考Brand-Williams等[17]方法。取0.3 mL樣品中加入3.7 mL 10-4mol/L DPPH溶液,常溫下避光反應(yīng)30 min,于515 nm波長處測定吸光度。0.3 mL無水乙醇和3.7 mL DPPH溶液混合作為空白對照。每個樣品平行測定3 次。DPPH自由基清除率由下列公式計(jì)算而得:
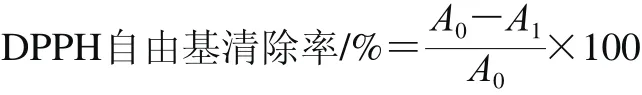
式中:A0為對照樣品吸光度;A1為待測樣品吸光度。
1.4 數(shù)據(jù)統(tǒng)計(jì)與分析
使用Sigma Plot 10.0與SPSS 19.0數(shù)據(jù)處理軟件繪制圖表及數(shù)據(jù)處理。實(shí)驗(yàn)數(shù)據(jù)以 ±s表示。使用單因素方差分析、LSD法和Duncan法等多重方法對數(shù)據(jù)進(jìn)行比較。
2 結(jié)果與分析
2.1 蘋果酵素天然發(fā)酵過程中pH值、總酸含量變化
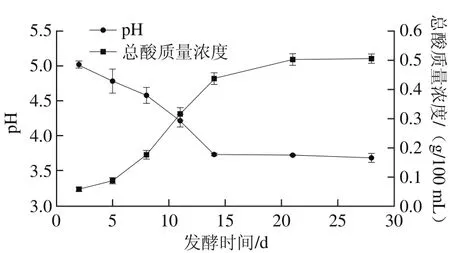
圖1 天然發(fā)酵過程中pH值、總酸變化Fig. 1 Changes in pH value and total titratable acidity during natural fermentation
pH值的變化可以反映發(fā)酵過程是否正常,而酸度是衡量酵素成熟度的主要指標(biāo),同時也是反映植物酵素質(zhì)量品質(zhì)的重要理化指標(biāo),蘋果酵素發(fā)酵過程中pH值、總酸隨發(fā)酵時間的變化結(jié)果如圖1所示。pH值在14 d內(nèi)由初始值5.02±0.05迅速下降至3.69±0.02。總酸含量呈逐漸上升趨勢,且在14 d內(nèi)上升速率較快,后期趨于平緩,質(zhì)量濃度由初值(0.06±0.008)g/100 mL上升至(0.51±0.02)g/100 mL。這是由于發(fā)酵過程中乙酸、乳酸等有機(jī)酸含量增加所致[18]。由此說明蘋果酵素在14 d內(nèi)發(fā)酵迅速。蔣增良等[5-6]探究發(fā)現(xiàn)葡萄酵素與藍(lán)莓酵素天然發(fā)酵過程中的pH值均在前8 d內(nèi)快速下降,之后隨著發(fā)酵時間的延長,pH值變化不明顯,發(fā)酵8 周后,葡萄酵素pH值為4.70,藍(lán)莓酵素pH值為4.48,說明葡萄酵素與藍(lán)莓酵素在前8 d內(nèi)發(fā)酵迅速。由此可見,酵素產(chǎn)品在天然發(fā)酵過程中的發(fā)酵速度與發(fā)酵用原料的種類有關(guān)。可能是由于不同原料所攜帶的微生物種類和數(shù)量不同,所形成的自然環(huán)境會有所差別,而影響發(fā)酵速度。
2.2 蘋果酵素天然發(fā)酵過程中乳酸、乙酸、蘋果酸含量變化
有機(jī)酸是蘋果中的天然產(chǎn)物,其種類和含量嚴(yán)重影響產(chǎn)品的風(fēng)味,而在天然發(fā)酵過程中有機(jī)酸的種類和數(shù)量會發(fā)生變化,因此有機(jī)酸是發(fā)酵制品的重要指標(biāo)之一[19]。天然蘋果酵素發(fā)酵過程中乙酸、乳酸及蘋果酸變化如圖2所示。隨著發(fā)酵時間的延長,乳酸質(zhì)量分?jǐn)?shù)由最初值0.004%上升至0.023%,乙酸含量則呈顯著上升趨勢,質(zhì)量分?jǐn)?shù)由初值0.018%上升至0.23%,而且從發(fā)酵14 d后上升速度較快。這是由于發(fā)酵前14 d酵素體系內(nèi)的醋酸菌只能利用葡萄糖、果糖代謝生成乙酸,而14 d后,由于酵母菌的代謝產(chǎn)生的乙醇含量越來越多,醋酸菌在有葡萄糖、果糖和乙醇的條件下開始大量生成乙酸等代謝產(chǎn)物[20]。蘋果酸在發(fā)酵14 d上升至(2.45±0.18)g/L后略有下降。蘋果酸是蘋果中所含的主要有機(jī)酸之一,發(fā)酵前期會在高滲透壓下從蘋果中溶至酵素液中,從而使蘋果酸含量上升;隨著發(fā)酵時間延長,蘋果酸會被體系中少量的乳酸菌通過蘋果酸發(fā)酵途徑代謝生成乳酸,使蘋果酸含量下降[19]。
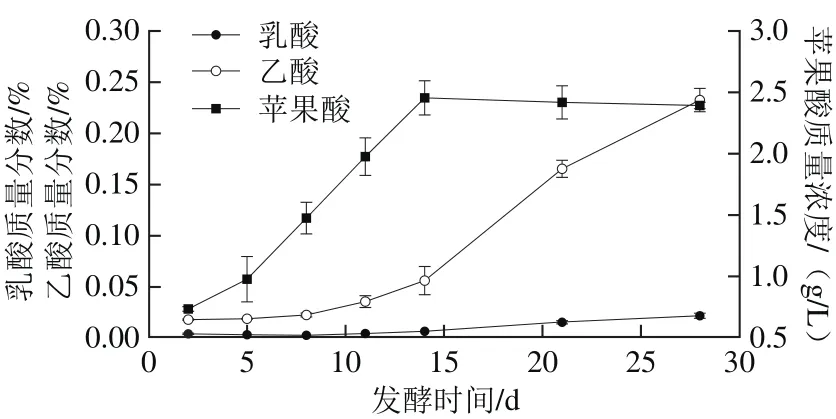
圖2 天然發(fā)酵過程中蘋果酸、乳酸、乙酸含量變化Fig. 2 Changes in malic acid, lactic acid, acetic acid production during natural fermentation
2.3 天然蘋果酵素發(fā)酵過程中糖類含量變化
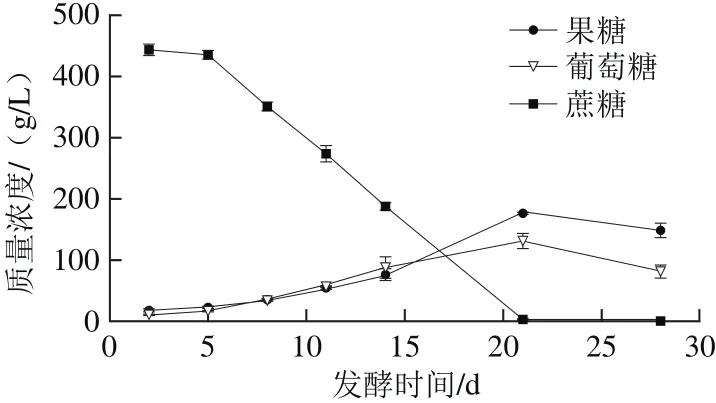
圖3 天然發(fā)酵過程中蔗糖、葡萄糖、果糖含量變化Fig. 3 Changes in sucrose, glucose and fructose production during natural fermentation
糖類作為天然發(fā)酵過程主要碳源,其含量是研究蘋果酵素過程微生物代謝變化的核心指標(biāo)之一。蘋果酵素發(fā)酵過程中,果糖、葡萄糖、蔗糖隨發(fā)酵時間變化結(jié)果如圖3所示。在發(fā)酵21 d內(nèi),隨著發(fā)酵時間的延長,發(fā)酵液中果糖與葡萄糖含量逐漸增高,而后逐漸下降,且質(zhì)量濃度在發(fā)酵第21天達(dá)到最高值(177.2±0.6)、(130.6±12.9)g/L;蔗糖質(zhì)量濃度隨著發(fā)酵時間的延長不斷下降,且在發(fā)酵第28天從初始值(443.2±9.1)g/L降低趨于0g/L。這一過程中的變化趨勢可能是發(fā)酵過程中蔗糖會被微生物直接代謝利用或被水解酶水解生成果糖和葡萄糖,導(dǎo)致蔗糖含量不斷下降[20]。發(fā)酵21 d內(nèi)果糖、葡萄糖含量上升是因?yàn)檎崽撬獾纳伤俾蚀笥诙叩南乃俾剩话l(fā)酵21 d后,可能是因?yàn)殡S著發(fā)酵時間的延長,蘋果酵素中的菌種結(jié)構(gòu)發(fā)生變化,酵母菌等優(yōu)勢菌種會優(yōu)先利用蘋果酵素中的果糖、葡萄糖代謝成乙醇,而使二者含量降低。
2.4 蘋果酵素天然發(fā)酵過程中乙醇含量變化
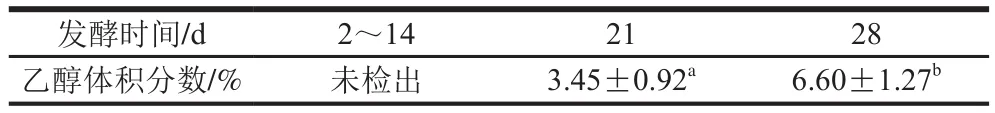
表1 天然發(fā)酵過程中乙醇含量變化Table 1 Change in alcohol production during natural fermentation
由于蘋果表面會附帶有酵母菌等真菌[21],在對蘋果原料預(yù)清洗過程中,由于未對蘋果進(jìn)行滅菌操作,因此蘋果表明會殘留部分酵母菌,天然發(fā)酵過程中酵母菌會利用糖代謝生成乙醇等代謝產(chǎn)物。而乙醇含量高低會直接影響液體產(chǎn)品風(fēng)味口感及質(zhì)量,因此乙醇是發(fā)酵飲料中一個重要指標(biāo)之一。蘋果酵素天然發(fā)酵過程中乙醇含量變化如表1所示,發(fā)酵前14 d,發(fā)酵液中并未檢測出乙醇,隨著發(fā)酵時間延長,乙醇體積分?jǐn)?shù)呈上升趨勢,且在第28天達(dá)到(6.60±1.27)%。Goh等[22]研究表明,當(dāng)糖質(zhì)量濃度高于110 g/L,微生物的生長受到抑制。由于發(fā)酵初期,蔗糖質(zhì)量濃度遠(yuǎn)高于110 g/L,而高質(zhì)量濃度蔗糖會抑制酵母菌等微生物的生長代謝。隨發(fā)酵時間延長,當(dāng)蔗糖質(zhì)量濃度低于110 g/L時,酵母菌等微生物利用果糖、葡萄糖生成乙醇[23]。由圖3可知,發(fā)酵第14天、21天,蔗糖質(zhì)量濃度分別為197、3.7 g/L,因此可以推測在發(fā)酵14~21 d過程中,當(dāng)蔗糖質(zhì)量濃度降低至110 g/L以下時,酵母菌等微生物代謝糖生成乙醇。Ghosh等[15]報(bào)道印度大米飲料天然發(fā)酵過程中酵母菌、霉菌等需氧微生物的數(shù)量呈先升后降趨勢,雙歧桿菌、乳桿菌等厭氧微生物的數(shù)量呈不斷上升趨勢。葡萄糖、果糖等游離糖的存在有利于乳酸菌等厭氧微生物的生長。因此通過天然發(fā)酵過程中糖類、有機(jī)酸及乙醇含量的變化,可推測蘋果酵素天然發(fā)酵過程中微生物群落結(jié)構(gòu)也會發(fā)生改變,但天然發(fā)酵過程中具體微生物種類和數(shù)量的變化需進(jìn)一步研究。
2.5 蘋果酵素天然發(fā)酵過程中總酚含量變化
蘋果中酚類物質(zhì)種類豐富,是蘋果中主要抗氧化物質(zhì)。蘋果酵素天然發(fā)酵過程中總酚含量變化如圖4所示。隨著發(fā)酵時間的延長,總酚含量呈先上升后下降趨勢,發(fā)酵第21天達(dá)到最大值(259.4±3.6)mg/L,且具有顯著性差異(P<0.05)。因此,發(fā)酵過程可以顯著提高蘋果酵素中的總酚含量。除蘋果酵素外,已有報(bào)道表明在藍(lán)莓酵素、葡萄酵素天然發(fā)酵過程中總酚含量呈逐漸上升趨勢,發(fā)酵結(jié)束后二者的總酚質(zhì)量濃度分別為1.74、2.31 mg/mL[5-6]。葉盼等[24]研究也表明蘋果汁乳酸菌發(fā)酵過程中總酚含量呈先降低再升高后緩慢降低的趨勢且在發(fā)酵第9天其質(zhì)量濃度達(dá)到最高值103.1 mg/L。由此說明,原料種類與發(fā)酵體系中的微生物種類均影響發(fā)酵過程中酚類物質(zhì)的積累。總酚含量增加的原因可能是由于體系內(nèi)高糖濃度所形成的高滲透壓體系,使蘋果中的酚類物質(zhì)溶出。此外,Chu Shengche等[25]研究表明發(fā)酵過程中微生物會把復(fù)雜的大分子酚類物質(zhì)轉(zhuǎn)換成小分子物質(zhì),使酚類含量增加。Ghosh等[26]研究表明乳酸菌產(chǎn)生的酶類及有機(jī)酸使大米中酚類物質(zhì)溶出并呈游離態(tài),導(dǎo)致發(fā)酵過程中總酚含量上升。Di Cagno等[27]指出一定濃度的酚類物質(zhì)會產(chǎn)生抑菌作用,而體系中的優(yōu)勢菌種為維持自身生長會產(chǎn)生降解酚類的物質(zhì),使總酚含量降低。因此,發(fā)酵過程總酚含量的變化,不僅與發(fā)酵原料及發(fā)酵條件有關(guān),也與微生物的作用相關(guān)。
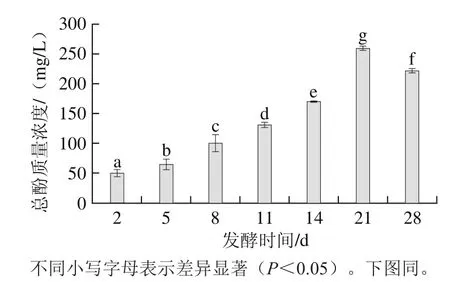
圖4 天然發(fā)酵過程中總酚含量變化Fig. 4 Changes in total phenolic compounds during natural fermentation
2.6 蘋果酵素天然發(fā)酵過程中DPPH自由基清除率變化
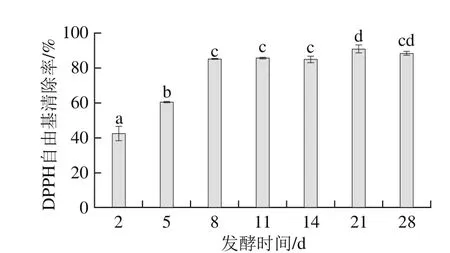
圖5 天然發(fā)酵過程中DPPH自由基清除率變化Fig. 5 Changes in DPPH radical scavenging ability during natural fermentation
由圖5可知,蘋果酵素DPPH自由基清除率在前8 d從(42.7±3.9)%上升到(85.3±0.3)%,之后略有上升,且在發(fā)酵第21天達(dá)到最高,清除率為(90.9±2.2)%,且具有顯著性差異(P<0.05)。因此,發(fā)酵過程可提高蘋果酵素的DPPH自由基清除能力。相關(guān)研究表明不同的發(fā)酵過程可以不同程度地提高發(fā)酵產(chǎn)品的DPPH自由基清除能力。葉盼等[24]研究蘋果汁發(fā)酵過程中DPPH自由基清除率呈先上升后下降趨勢,在發(fā)酵第9天達(dá)到最高值,比未發(fā)酵蘋果汁高出35.3%。葡萄酵素與藍(lán)莓酵素在天然發(fā)酵過程中DPPH自由基清除能力分別提高了12.5%、3.6%[5-6]。發(fā)酵過程中導(dǎo)致蘋果酵素DPPH自由基清除能力增加的原因較復(fù)雜。Karaman等[28]曾報(bào)道酚類物質(zhì)能很容易地給出1 個氫離子,并通過共振雜化而穩(wěn)定,這是具有高自由基清除能力的主要原因,且酚類物質(zhì)的增加很可能是DPPH自由基清除能力提高的重要原因。
3 結(jié) 論
本研究表明蘋果酵素天然發(fā)酵過程中乳酸、乙酸含量逐漸增加,蘋果酸、葡萄糖、果糖、總酚含量、DPPH自由基清除率呈先上升后下降趨勢,且均在發(fā)酵第21天達(dá)到最大值。發(fā)酵14~21 d過程中乙醇生成且呈上升趨勢,發(fā)酵第28天乙醇體積分?jǐn)?shù)可達(dá)(6.6±1.9)%。以上代謝產(chǎn)物不僅豐富了蘋果酵素中的營養(yǎng)物質(zhì)的種類及含量,而且它們在發(fā)酵過程中所呈現(xiàn)出的變化規(guī)律可清晰地反映出天然發(fā)酵過程中營養(yǎng)物質(zhì)的利用程度及生物活性物質(zhì)的積累水平。因此可根據(jù)發(fā)酵過程中有機(jī)酸、糖類、總酚等生物活性物質(zhì)的積累量以及乙醇等風(fēng)味物質(zhì)的含量變化來確定天然發(fā)酵過程的發(fā)酵周期,為天然發(fā)酵酵素產(chǎn)品的生產(chǎn)和開發(fā)提供一定的技術(shù)支撐和理論指導(dǎo)。
[1] 毛建衛(wèi), 吳元峰, 方晟. 微生物酵素研究進(jìn)展[J]. 發(fā)酵科技通訊,2010, 39(3): 42-44. DOI:10.3969/j.issn.1674-2214.2010.03.018.
[2] 趙金鳳, 宿秀莘, 曲佳樂, 等. 敖東酵素對脾淋巴細(xì)胞增殖作用的影響[J]. 食品與發(fā)酵科技, 2014, 50(3): 50-53. DOI:10.3969/j.issn.1674-506X.2014.03-013.
[3] 曲佳樂, 趙金鳳, 皮子鳳, 等. 植物酵素解酒護(hù)肝保健功能研究[J].食品科技, 2013, 38(9): 51-54. DOI:10.13684/j.cnki.spkj.2013.09.043.
[4] 中國生物發(fā)酵產(chǎn)業(yè)協(xié)會. 酵素產(chǎn)品分類導(dǎo)則: T/CBFIA 08001—2016[S]. 北京: 中國標(biāo)準(zhǔn)出版社, 2016: 1-5.
[5] 蔣增良, 毛建衛(wèi), 黃俊, 等. 藍(lán)莓酵素在天然發(fā)酵過程中抗氧化性能的變化[J]. 食品工業(yè)科技, 2013, 34(2): 194-197. DOI:10.13386/j.issn1002-0306.2013.02.059.
[6] 蔣增良, 毛健衛(wèi), 黃俊, 等. 葡萄酵素在天然發(fā)酵過程中體外抗氧化性能的變化[J]. 中國食品學(xué)報(bào), 2014, 14(10): 29-33. DOI:10.16429/j.1009-7848.2014.10.015.
[7] 賈麗麗, 冀利, 孫曙光, 等. 冬棗酵素發(fā)酵過程中生物學(xué)特性和抗氧化活性研究[J]. 食品與發(fā)酵科技, 2014, 50(4): 30-33. DOI:10.3969/i.issn.1674-506X.2014.04-008.
[8] 郭爽, 石永偉, 曲佳樂, 等. 敖東酵素對小鼠抗氧化功能的影響[J].食品與發(fā)酵科技, 2014, 50(5): 16-19.
[9] KAWAZOE N, OKADA H, FUKUSHI E, et al. Two novel oligosaccharides isolated from a beverage produced by fermentation of a plant extract[J]. Carbohydrate Research, 2008, 343(3): 549-554.DOI:10.1016/j.carres.2007.11.029.
[10] OKADA H, FUKUSHI E, YAMAMORI A, et al. Novel fructopyranose oligosaccharides isolated from fermented beverage of plant extract[J].Carbohydrate Research, 2010, 345(3): 414-418. DOI:10.1016/j.carres.2009.12.003.
[11] OKADA H, FUKUSHI E, YAMAMORI A, et al. Isolation and structural confirmation of the oligosaccharides containing alpha-D-fructofuranoside linkages isolated from fermented beverage of plant extracts[J]. Carbohydrate Research, 2011, 346(16): 2633-2637.DOI:10.1016/j.carres.2011.09.002.
[12] KALINOWSKA M, BIELAWSKA A, LEWANDOWSKASIWKIEWICZ H, et al. Apples: content of phenolic compounds vs. variety, part of apple and cultivation model, extraction of phenolic compounds, biological properties[J]. Plant Physiology and Biochemistry, 2014, 84: 169-188. DOI:10.1016/j.plaphy.2014.09.006.
[13] KRIS-ETHERTON P M, HECKER K D, BONANOME A, et al. Bioactive compounds in foods: their role in the prevention of cardiovascular disease and cancer[J]. American Journal of Medicine,2002, 113(9): 71-88. DOI:10.1016/S0002-9343(01)00995-0.
[14] MOLINA A M, GUADALUPE V, VARELA C, et al. Differential synthesis of fermentative aroma compounds of two related commercial wine yeast strains[J]. Food Chemistry, 2009, 117(2): 189-195.DOI:10.1016/j.foodchem.2009.03.116.
[15] GHOSH K, RAY M, ADAK A, et al. Microbial, saccharifying and antioxidant properties of an Indian rice based fermented beverage[J]. Food Chemistry, 2015, 168: 196-202. DOI:10.1016/j.foodchem.2014.07.042.
[16] SINGLETON V L, ORTHOFER R, LAMUELA-RAVENTOS R M.Methods in enzymology[M]. United States, Elsevier Academic Press Inc, 1999: 152-178.
[17] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free radical method to evaluate antioxidant activity[J]. LWT-Food Science and Technology, 1995, 28(1): 25-30. DOI:10.1016/S0023-6438(95)80008-5.
[18] JAYABALAN R, SUBATHRADEVI P, MARIMUTHU S, et al.Changes in free-radical scavenging ability of kombucha tea during fermentation[J]. Food Chemistry, 2008, 109(1): 227-234.DOI:10.1016/j.foodchem.2007.12.037.
[19] XIONG T, PENG F, LIU Y Y, et al. Fermentation of Chinese sauerkraut in pure culture and binary co-culture with Leuconostoc mesenteroides and Lactobacillus plantarum[J]. LWT-Food Science and Technology, 2014, 59(2): 713-717. DOI:10.1016/j.lwt.2014.05.059.
[20] LIU C H, HSU W H, LEE F L, et al. The isolation and identification of microbes from a fermented tea beverage, Haipao, and their interations during Haipao fermentation[J]. Food Microbiology, 1996, 13(6)∶ 407-415. DOI∶10.1006/fmic.1996.0047.
[21] 田衛(wèi), 李軍, 李新華. 二氧化氯對榨汁蘋果表面腐生酵母菌殺菌規(guī)律的研究[J]. 食品科學(xué), 2005, 26(7): 74-77. DOI:10.3321/j.issn:1002-6630.2005.07.014.
[22] GOH W N, ROSMA A, KAUR B, et al. Fermentation of black tea broth (Kombucha)∶ I. effects of sucrose concentration and fermentation time on the yield of microbial cellulose[J]. International Food Research Journal, 2012, 19(1)∶ 109-117.
[23] KANG M, KIM J, PARK H J, et al. Application of metabolomics in the analysis of manufacturing type of Pu-erh tea and composition changes with different postfermentation year[J]. Journal of Agricultural and Food Chemistry, 2010, 58(1)∶ 345-352. DOI∶10.1021/jf902818c.
[24] 葉盼, 趙黎明, 蔣麗華, 等. 發(fā)酵蘋果汁的抗氧化性能變化[J]. 食品與發(fā)酵工業(yè), 2016, 42(4): 114-118. DOI:10.13995/j.cnki.11-1802/ts.201604021.
[25] CHU S C, CHEN C. Effects of origins and fermentation time on the antioxidant activities of kombucha[J]. Food Chemistry, 2006, 98(3)∶502-507. DOI∶10.1016/j.foodchem.2005.05.080.
[26] GHOSH K, RAY M, ADAK A, et al. Role of probiotic Lactobacillus fermentum KKL1 in the preparation of a rice based fermented beverage[J]. Bioresource Technology, 2015, 188∶ 161-168.DOI∶10.1016/j.biortech.2015.01.130.
[27] DI CAGNO R, CODA R, DE ANGELIS M, et al. Exploitation of vegetables and fruits through lactic acid fermentation[J]. Food Microbiology, 2013, 33(1)∶ 1-10. DOI∶10.1016/j.fm.2012.09.003.
[28] KARAMAN ?, TüTEM E, BA?KAN K S, et al. Comparison of total antioxidant capacity and phenolic composition of some apple juices with combined HPLC-CUPRAC assay[J]. Food Chemistry, 2010,120(4)∶ 1201-1209. DOI∶10.1016/j.foodchem.2009.11.065.
Changes in Metabolites during Natural Fermentation of Apple into Enzyme Drink
YANG Xiaoxing1, ZHOU Jiachun1, CHEN Qiming1, QIN Zhen1, MA Mingyue2, ZHAO Liming1,*
(1. State Key Laboratory of Bioreactor Engineering, R&D Center of Separation and Extraction Technology in Fermentation Industry,School of Biotechnology, East China University of Science and Technology, Shanghai 200237, China;2. School of Bioinformatics, Chongqing University of Posts and Telecommunications, Chongqing 400065, China)
The objective of this work was to analyze the changes in metabolites during the natural fermentation of apple into an enzyme drink. The pH value, total titrable acid, organic acids (lactic acid, acetic acid, and malic acid), sugars (sucrose,glucose, and fructose), alcohol, total phenolic content and 1,1-diphenyl-2-picryl-hydrazyl (DPPH) radical scavenging ability were investigated. Results showed that pH value decreased from 5.05 to 3.88 while total titratable acidity and lactic acid increased gradually during the fermentation process. Acetic acid was accumulated from 0.018% to 0.23% during the process;malic acid increased from 0.67 g/L to 2.45 g/L during the first 14 days and then decreased slightly. Glucose and fructose increased until reaching their maximum of 130.6 and 177.2 g/L on the 21thday and then decreased, while sucrose kept decreasing to almost 0 g/L during the whole fermentation process. Alcohol was produced from the 14thto 21thday, reaching 6.6% on the 28thday. Both total phenolic content and DPPH radical scavenging ability increased continuously to their maximum values (259.4 mg/L, 90.9 %) on the 21stday followed by a decrease.
fermented apple drink rich in enzyme; natural fermentation process; metabolites; DPPH radical scavenging ability
DOI∶10.7506/spkx1002-6630-201724003
TS201.3
A
1002-6630(2017)24-0015-05
楊小幸, 周家春, 陳啟明, 等. 蘋果酵素天然發(fā)酵過程中代謝產(chǎn)物的變化規(guī)律[J]. 食品科學(xué), 2017, 38(24): 15-19.
10.7506/spkx1002-6630-201724003. http://www.spkx.net.cn
YANG Xiaoxing, ZHOU Jiachun, CHEN Qiming, et al. Changes in metabolites during natural fermentation of apple into enzyme drink[J]. Food Science, 2017, 38(24)∶ 15-19. (in Chinese with English abstract) DOI∶10.7506/spkx1002-6630-201724003. http∶//www.spkx.net.cn
2017-03-07
國家自然科學(xué)基金面上項(xiàng)目(31371725);重慶郵電大學(xué)科研啟動基金項(xiàng)目(A2016-87);
中央高校基本科研業(yè)務(wù)費(fèi)專項(xiàng)(222201717026)
楊小幸(1991—),女,碩士研究生,研究方向?yàn)槭称芳庸ぜ夹g(shù)。E-mail:1391750551@qq.com
*通信作者:趙黎明(1977—),男,教授,博士,研究方向?yàn)槭称芳庸ぜ夹g(shù)。E-mail:zhaoliming@ecust.edu.cn

