酶催化合成L-茶氨酸的研究進展
李 元,劉 珊,祝 俊
(中國科學院天津工業(yè)生物技術(shù)研究所,天津 300308)
酶催化合成L-茶氨酸的研究進展
李 元,劉 珊,祝 俊*
(中國科學院天津工業(yè)生物技術(shù)研究所,天津 300308)
L-茶氨酸是茶葉中的特征氨基酸,具有改善食品風味、放松減壓、增強抗腫瘤藥物療效等多種功能。本文介紹了L-茶氨酸的生理功能及其在食品、保健品和醫(yī)藥領(lǐng)域中的應(yīng)用,并重點對L-茶氨酸的酶法合成進行了綜述,在此基礎(chǔ)上探討了工業(yè)化生產(chǎn)L-茶氨酸的未來可能的研究方向,以期為利用酶法實現(xiàn)L-茶氨酸的工業(yè)化生產(chǎn)提供參考依據(jù)。
茶葉;L-茶氨酸;生物合成;酶
L-茶氨酸(L-theanine)屬于酰胺類化合物,分子式為C7H14N2O3,是茶葉中含量最豐富的游離氨基酸,占總游離氨基酸含量的50%以上。它是茶葉香味和口感的主要成分,因此它的含量多少對茶葉的風味和品質(zhì)起到關(guān)鍵性的作用。大量研究結(jié)果表明L-茶氨酸具有多種重要的生理功能[1],因而被廣泛應(yīng)用于食品、保健品及醫(yī)藥行業(yè)中。
L-茶氨酸可從茶葉中提取分離[2-3],但其僅占茶葉干質(zhì)量的1%~2%[4];另外,由于缺乏簡便、特異和高效的分離方法,高純度L-茶氨酸的提取分離通常涉及耗時、高成本和復(fù)雜的操作過程,不利于工業(yè)化生產(chǎn)。與此相反,化學法[5-6]合成L-茶氨酸具有方法簡單、成本低、產(chǎn)率高等優(yōu)點,但是合成的茶氨酸為L-和D-形式的外消旋混合物,通常被認為是“非天然”產(chǎn)物,其安全性評價亟待研究。
近年來,隨著生物工程技術(shù)的發(fā)展,L-茶氨酸的生物合成[7-11]備受關(guān)注。目前應(yīng)用于L-茶氨酸合成的生物酶主要有L-谷氨酰胺酶、γ-谷氨酰轉(zhuǎn)肽酶(γ-glutamyltranspeptidase,GGT)、L-谷氨酰胺合成酶(L-glutamine synthetase,GS)、γ-谷氨酰甲胺合成酶(γ-glutamylmethylamide synthetase,GMAS)和γ-谷氨酰半胱氨酸合成酶(γ-glutamylcysteine synthetase,γ-GCS)。本文結(jié)合本課題組的前期工作,參考近年來國內(nèi)外有關(guān)文獻對L-茶氨酸的生理功能及應(yīng)用現(xiàn)狀進行了概述,并著重綜述了L-茶氨酸酶催化合成方法的研究進展,探討了未來可能的研究方向和方法,以期為L-茶氨酸的研究開發(fā)和綜合利用提供理論依據(jù),并為其生物合成的工業(yè)化生產(chǎn)提供參考依據(jù)。
1 L-茶氨酸的生理功能及應(yīng)用現(xiàn)狀
L-茶氨酸具有多種重要的生理功能,如:通過調(diào)節(jié)腦中神經(jīng)傳達物質(zhì)的濃度降低血壓[12];與抗腫瘤藥物并用時,增強抗腫瘤藥物的抗癌效果,并減少抗腫瘤藥物的副作用[13];抑制短暫腦缺血引起的神經(jīng)細胞死亡,對神經(jīng)細胞有保護作用[14-15];影響腦中多巴胺等神經(jīng)傳達物質(zhì)的代謝和釋放,從而改善認知能力和提高學習能力[16]、放松減壓并緩解焦慮[17];提高免疫力[18];減肥作用[19]等。
L-茶氨酸作為一種安全、集多種生理功能于一體的功能性活性因子,被廣泛應(yīng)用于食品、保健品和醫(yī)藥行業(yè)。在食品行業(yè),由于具有優(yōu)良的加工特性和穩(wěn)定性,L-茶氨酸主要用作茶飲料、食品的風味改良劑和功能性食品的添加劑[20],如美國達拉斯VIB Holdings LLC公司生產(chǎn)的以L-茶氨酸為添加劑的安神飲料Vacation in a Bottle。在保健品行業(yè),L-茶氨酸作為天然鎮(zhèn)靜劑、抗抑郁劑在國外市場上大受歡迎,日本、美國市場上已有多種不同品牌的茶氨酸保健產(chǎn)品[21],如美國保健品牌Doctor’s Best的L-茶氨酸膠囊;然而,在國內(nèi)L-茶氨酸主要是銷往國外,國內(nèi)基本沒有茶氨酸類的保健品上市。在醫(yī)藥行業(yè),L-茶氨酸可開發(fā)為治療腫瘤的輔助藥物、降壓藥物或可用于安神鎮(zhèn)靜藥物中等,目前日本已經(jīng)把L-茶氨酸作為有效成分用于鎮(zhèn)靜劑中。近年來,L-茶氨酸生理功能和藥理藥效實驗的研究表明其在保健品和醫(yī)藥領(lǐng)域中具有巨大的應(yīng)用價值和廣闊的開發(fā)前景。
2 生物體內(nèi)L-茶氨酸的合成
在茶樹中,L-茶氨酸合成酶(theanine synthetase,TS)在ATP供能的條件下,催化L-谷氨酸和乙胺合成L-茶氨酸[22],如圖1所示。Sasaoka等[23]對TS的性質(zhì)進行了研究,結(jié)果表明該酶為茶樹特有的合成酶,對乙胺具有高親合力,然而其非常不穩(wěn)定并且難以分離,不適宜體外合成L-茶氨酸,因此限制了其在L-茶氨酸體外合成中的應(yīng)用。
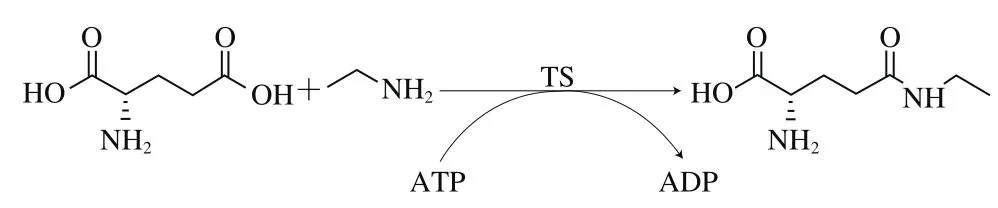
圖1 茶樹中L-茶氨酸的生物合成[24]Fig. 1 Biosynthesis of L-theanine in the tea plant[24]
3 酶催化體外合成L-茶氨酸
隨著基因工程技術(shù)的深入開展,研究人員對酶促體外合成L-茶氨酸進行了不斷地探索和技術(shù)創(chuàng)新。目前,用于L-茶氨酸體外合成的酶如圖2所示,主要包括:1)以L-谷氨酰胺為底物、基于γ-谷氨酰轉(zhuǎn)移反應(yīng)的酶:L-谷氨酰胺酶和GGT;2)以L-谷氨酸為底物、需ATP供能的合成酶:GS、GMAS和γ-谷氨酰半胱氨酸合成酶γ-GCS。L-谷氨酰胺酶和GGT催化L-谷氨酰胺和乙胺合成L-茶氨酸;GS、GMAS和γ-GCS在ATP存在條件下催化L-谷氨酸和乙胺合成L-茶氨酸。
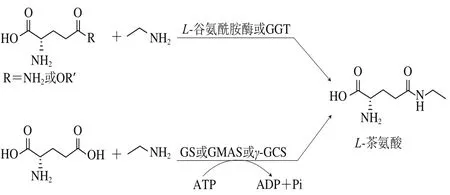
圖2 酶催化合成L-茶氨酸Fig. 2 Biosynthesis of L-theanine by various enzymes
3.1 L-谷氨酰胺酶催化L-茶氨酸合成
L-谷氨酰胺酶是一種酰胺基水解酶[25],催化L-谷氨酰胺的γ-酰胺鍵水解為L-谷氨酸和游離氨(圖3A),在原核和真核生物中廣泛分布。此外,一些L-谷氨酰胺酶還可催化L-谷氨酰胺的γ-谷氨酰基的轉(zhuǎn)移反應(yīng),例如來自硝基還原假單胞菌Pseudomonas nitroreducens的L-谷氨酰胺酶[26],其可催化羥胺、甲胺和乙胺作為受體分子的轉(zhuǎn)移反應(yīng),如圖3B所示,其中當乙胺作為受體分子時形成L-茶氨酸。Tachiki[27]和Pu Hefang[28]等分別對天然形式的來自菌株P(guān). nitroreducensIFO 12694的L-谷氨酰胺酶和重組形式的來自菌株P(guān). nitroreducensDSM14399的L-谷氨酰胺酶進行了深入研究,其催化合成L-茶氨酸的反應(yīng)條件如表1所示。
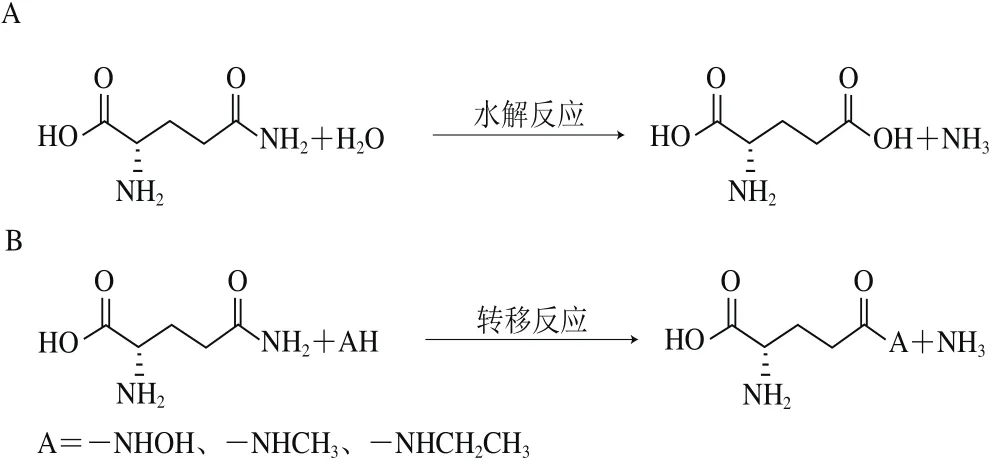
圖3 L-谷氨酰胺酶催化的反應(yīng)[25]Fig. 3 Reactions catalyzed by L-glutaminase[25]
為了增強L-谷氨酰胺酶的穩(wěn)定性和可復(fù)用性,Yokoyama等[29]使用介孔二氧化硅(mesoporous silica,MPS)作為固定化載體對菌株IFO 12694的L-谷氨酰胺酶進行了固定化,并通過用氧化鋯表面修飾提高MPS在高pH值下的穩(wěn)定性,從而改善固定化酶對于L-茶氨酸生產(chǎn)的可復(fù)用性。Itoh等[30]使用碳包覆MPS的孔表面也獲得了類似的效果。此外,Matsuura等[31]開發(fā)了包含L-谷氨酰胺酶-MPS組合物的流動型微反應(yīng)器,可用于連續(xù)合成L-茶氨酸。
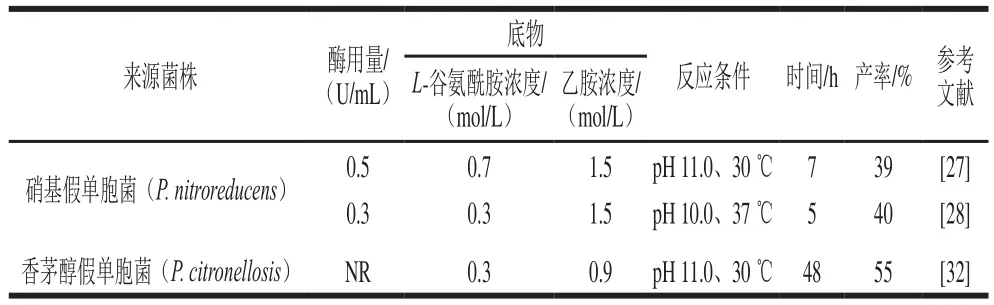
表1 各種來源L-谷氨酰胺酶催化合成L-茶氨酸方法的比較Table 1 Comparative analysis of the methods available for enzymatic synthesis of L-theanine using L-glutaminase from various sources
除了P. nitroreducens外,來自香茅醇假單胞菌P. citronellosis GEA FERM BP-8353所衍生的L-谷氨酰胺酶也可合成L-茶氨酸[32]。該菌株為日本太陽化學株式會社研究人員從土壤中分離出的一種新細菌。使用P. citronellosis GEA的無細胞提取物合成L-茶氨酸時,在0.3 mol/L L-谷氨酰胺和0.9 mol/L乙胺時反應(yīng)最佳,30 ℃、pH 11.0孵育48 h后,轉(zhuǎn)化率達到約55%。
3.2 GGT催化L-茶氨酸合成

圖 4 GGT催化的反應(yīng)[33]Fig. 4 Reactions catalyzed by GGT[33]
GGT催化γ-谷氨酰化合物的γ-谷氨酰基部分轉(zhuǎn)移到其他氨基酸和短肽上[33](圖4A),當水作為γ-谷氨酰基受體時,其催化γ-谷氨酰化合物的水解(圖4B)。
GGT廣泛存在于從細菌到哺乳動物的一系列生物體中。相比哺乳動物,細菌GGT具有更廣泛的底物特異性,目前用于L-茶氨酸合成的GGT均來自于細菌。2002年,Suzuki等[34]首次發(fā)現(xiàn)來自大腸桿菌Escherichia coli K-12的GGT可催化γ-谷氨酰胺和乙胺生成L-茶氨酸,轉(zhuǎn)化率為60%。隨后研究者們對使用來自E. coli[35-39]、枯草芽孢桿菌Bacillus subtilis[40-43]和地衣芽孢桿菌B. licheniformis[44]的GGT催化合成L-茶氨酸進行了深入研究,如表2所示。
理論上,GGT催化合成L-茶氨酸可使用各種γ-谷氨酰基供體,其轉(zhuǎn)肽活性隨γ-谷氨酰基供體而變化。例如,來自B. licheniformis的GGT以L-谷氨酰胺作為γ-谷氨酰基供體時,相對活力是以GAME作為供體的4.4 倍[45];相反地,當使用GMAE代替L-谷氨酰胺作為供體時,來自E. coli K-12的GGT的相對活力增加1.2 倍[36]。當以GAME為γ-谷氨酰基供體時,使用含有GGT的E. coli全細胞催化L-茶氨酸合成轉(zhuǎn)化率可達95%[36];使用固定化的含有GGT的E. coli全細胞催化L-茶氨酸合成,在使用6 次后,平均轉(zhuǎn)化率可達87.2%[37]。2013年,Zhang Hongjuan等[39]報道了利用各種取代的γ-谷氨酰基苯胺為γ-谷氨酰基供體,使用來自E. coli的GGT催化合成L-茶氨酸。
與L-谷氨酰胺酶相似,通過GGT催化合成L-茶氨酸時,無需ATP參與;然而通常需要使用較高濃度的乙胺和優(yōu)化反應(yīng)pH值以抑制底物L-谷氨酰胺的水解和因自轉(zhuǎn)肽作用形成γ-谷氨酰-谷氨酰胺副產(chǎn)物。為了減少通過GGT生物合成L-茶氨酸期間的底物水解和自轉(zhuǎn)肽副反應(yīng),Wang Haoqi等[41]使用其中游離α-氨基和羧基被Zn封閉的L-谷氨酰胺-Zn(Ⅱ)絡(luò)合物代替L-谷氨酰胺作為底物,其L-茶氨酸產(chǎn)率增加了16.9%。
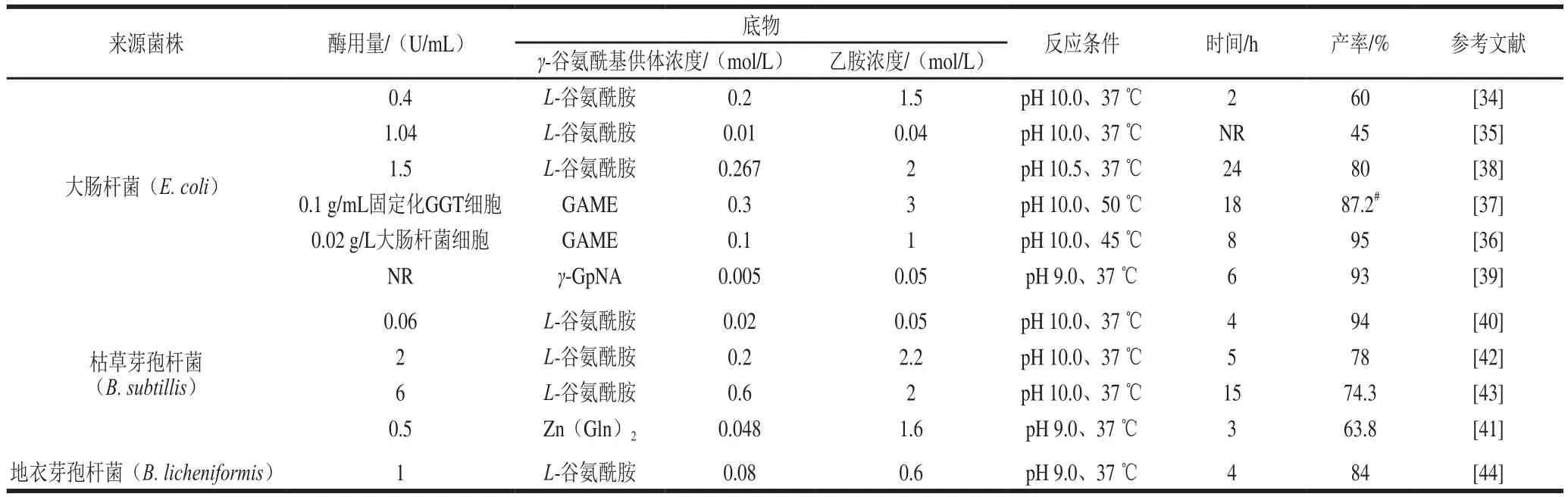
表2 各種來源GGT催化合成L-茶氨酸方法的比較Table 2 Comparative analysis of the methods available for enzymatic synthesis of L-theanine using GGT from various sources
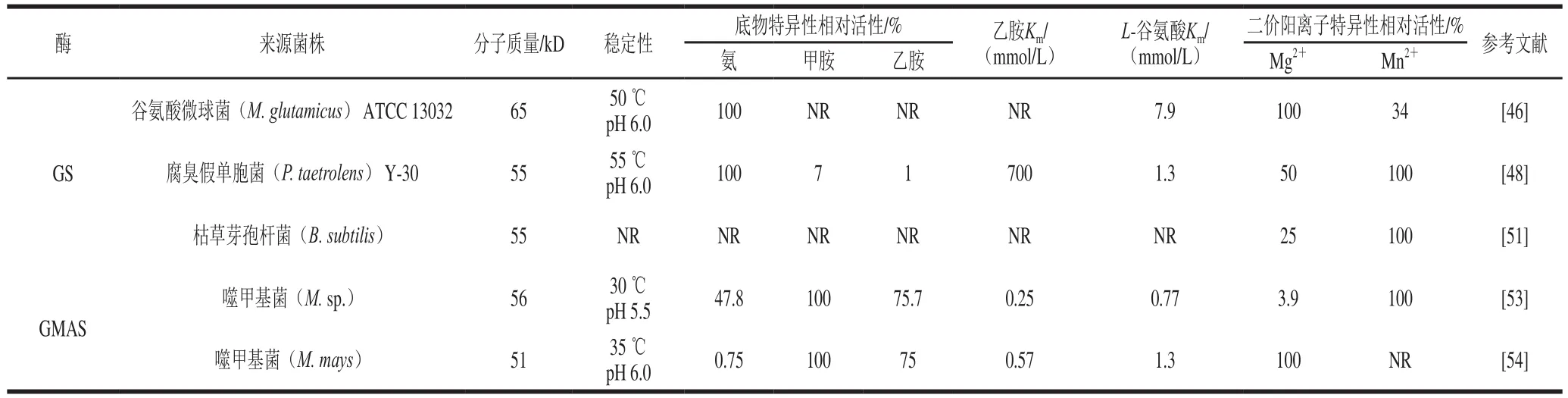
表3 各種來源GS和GMAS酶學性質(zhì)的比較Table 3 Comparative enzymatic characterization of GS and GMAS from various sources
3.3 GS催化L-茶氨酸合成
GS在ATP存在條件下,催化L-谷氨酸鹽和游離氨轉(zhuǎn)化為L-谷氨酰胺。Tachiki等[46-47]首次對來自谷氨酸微球菌Micrococcus glutamicus ATCC 13032的GS催化L-谷氨酸和乙胺合成L-茶氨酸進行了報道。隨后,Yamamoto等[48]對來自腐臭假單胞菌Pseudomonas taetrolens Y-30菌株的GS進行了純化及酶學性質(zhì)研究,經(jīng)表征其具有生產(chǎn)L-茶氨酸的能力;該來源編碼GS的基因已在E. coli中成功表達,重組的GS顯示與天然GS具有相同的性質(zhì),且該酶在表達系統(tǒng)中的生產(chǎn)能力比在原始細菌P. taetrolens Y-30中高約30 倍[49]。在GS催化L-茶氨酸合成時,需要ATP參與,因此該課題組將“偶聯(lián)發(fā)酵與能量轉(zhuǎn)移”的酵母糖酵解ATP再生系統(tǒng)應(yīng)用于GS生物合成L-茶氨酸中,反應(yīng)體系經(jīng)過優(yōu)化后,200 mmol/L L-谷氨酸可產(chǎn)生170 mmol/L L-茶氨酸[50]。此外,Zhou Xin等[51]研究表明來自B. subtilis的GS能在E. coli BL21(DE3)/pET28a-glnA細胞中作為可溶性蛋白高效表達(約占總蛋白的86%);在pH 7.5和Mn2+濃度為10 mmol/L條件下,重組GS具有最大的L-茶氨酸合成活力(6.4 U/mg)。
3.4 GMAS催化L-茶氨酸合成
GMAS在ATP供能的條件下催化L-谷氨酸和甲胺合成γ-谷氨酰甲胺(γ-glutamylmethylamide,γ-GMA);對于依賴甲胺作為單獨的碳源和氮源的細菌,GMAS在甲胺代謝中間體γ-GMA的生物合成中發(fā)揮著重要作用[52]。相比GS,其對乙胺顯示出更高的活性,各種來源的GMAS和GS酶學性質(zhì)的比較如表3所示。
1 9 9 2年,K i m u r a等[53]首次從噬甲基菌株Methylophaga sp. AA-30中純化出GMAS,該酶在pH 7.5 和40 ℃條件下有最大活性,表現(xiàn)出較寬的底物特異性范圍,并能以乙胺和L-谷氨酸為底物催化合成L-茶氨酸,但未進行深入研究。2007年,Yamamoto等[54]從200多種甲胺和/或甲醇同化細菌中篩選出M. mays No. 9作為L-茶氨酸生產(chǎn)菌,并從中分離出GMAS,該酶在中性pH值范圍對乙胺具有較高的活性;同時在較低底物濃度條件下,該酶催化的L-茶氨酸產(chǎn)量高于P. taetrolens Y-30 GS大約20 倍。隨后該課題組將M. mays No. 9中編碼GMAS的基因在E. coli中進行了重組表達,結(jié)果表明重組菌的產(chǎn)酶能力可比原始M. mays No. 9高23 倍,而重組GMAS的酶學性質(zhì)與天然GMAS無明顯不同[55],這使得大量生產(chǎn)GMAS用于工業(yè)L-茶氨酸生產(chǎn)成為可能;以重組GMAS作為催化劑,研究了偶聯(lián)酵母糖酵解ATP再生的L-茶氨酸生物合成,結(jié)果表明含600 mmol/L L-谷氨酸鈉、600 mmol/L鹽酸乙胺、300 mmol/L葡萄糖、200 mmol/L磷酸鉀緩沖液(pH 7.0)、30 mmol/L MgCl2、5 mmol/L MnCl2、5 mmol/L單磷酸腺苷(adenosine monophosphate,AMP)、30 U/mL GMAS 和40 g/L 酵母細胞的1 mL混合體系中,在48 h內(nèi)可催化合成約110 g/L L-茶氨酸[56]。另外,該課題組將GMAS和酵母干細胞封閉于透析膜管中,該膜封閉酶制備法可實現(xiàn)600 mmol/L L-谷氨酸和乙胺100%轉(zhuǎn)化為L-茶氨酸,且在含NAD+混合反應(yīng)液中經(jīng)6 次連續(xù)反應(yīng)仍能保持較高的L-茶氨酸生產(chǎn)能力[57]。
與L-谷氨酰胺酶和GGT相比,GMAS在催化L-茶氨酸合成時,以廉價的L-谷氨酸鹽為原料,只需要添加等當量的乙胺,而無需考慮L-谷氨酰胺為底物時由于其水解及自轉(zhuǎn)肽反應(yīng)帶來的副產(chǎn)物問題。然而,與GS相似,GMAS在催化L-茶氨酸的合成中是需要ATP參與的,ATP再生是關(guān)系到GMAS用于工業(yè)化生產(chǎn)L-茶氨酸的關(guān)鍵。鑒于重組GMAS在L-茶氨酸合成中所表現(xiàn)出的優(yōu)勢,本課題組開發(fā)了偶聯(lián)基于磷酸激酶(polyphosphate kinase,PPK)的ATP再生系統(tǒng)的酶法L-茶氨酸合成路線[58],如圖5所示,通過PPK催化,以廉價易得的多聚磷酸鹽(polyphosphate,polyP)為底物實現(xiàn)ATP再生,在200 mL反應(yīng)體系中,添加催化量的ATP,以400 mmol/L L-谷氨酸和乙胺為底物,實現(xiàn)了L-茶氨酸84%的產(chǎn)率。該反應(yīng)體系基于酶法ATP再生,相比酵母糖酵解ATP再生,體系簡單易控,有利于工業(yè)化生產(chǎn)L-茶氨酸,相關(guān)反應(yīng)體系比較如表4所示。
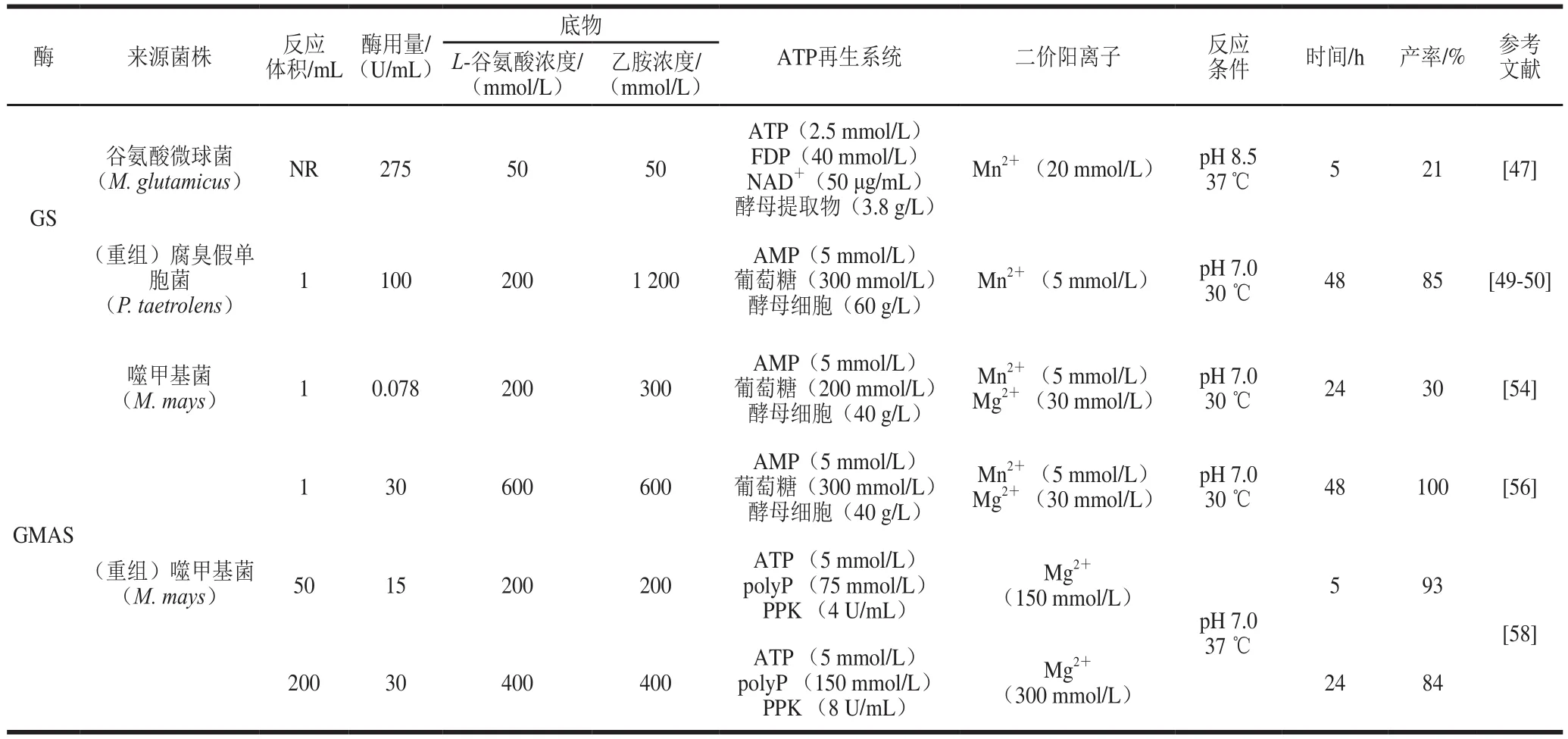
表4 各種來源GS和GMAS催化合成L-茶氨酸方法的比較Table 4 Comparative analysis of the methods available for enzymatic synthesis of L-theanine using GS and GMAS from various sources
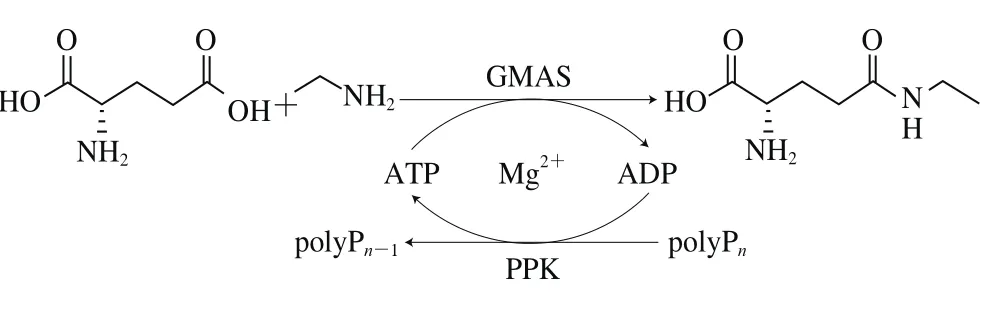
圖5 偶聯(lián)基于PPK ATP再生酶法合成L-茶氨酸[58]Fig. 5 Enzymatic synthesis of L-theanine by GMAS coupled with an ATP regeneration system based on PPK[58]
3.5 GCS合成酶催化L-茶氨酸合成
γ-GCS在ATP供能條件下,以L-谷氨酸和L-半胱氨酸為底物催化合成γ-谷氨酰半胱氨酸,是生物體內(nèi)合成谷胱甘肽的重要用酶[59]。Miyake等[60]報道了來自E. coli的γ-GCS具有催化L-谷氨酸和脂肪胺類生成γ-谷氨酰胺類化合物的能力,且反應(yīng)速度與亞甲基長度有關(guān)(正丙胺>丁胺>乙胺>>甲胺);利用重組E. coli DH5α/pGSK1表達的γ-GCS催化,并偶聯(lián)E. coli自身ATP再生系統(tǒng),18 h后能以429 mmol/L乙胺合成12.1 mmol/L L-茶氨酸。然而,該酶對乙胺的底物特異性較差,需要對其進行進一步改造,以提高其底物特異性。
4 結(jié) 語
L-茶氨酸因其獨特的生物學功能,在食品、保健品、醫(yī)藥等領(lǐng)域必將有著巨大的應(yīng)用價值和廣闊的開發(fā)前景,所以實現(xiàn)L-茶氨酸的工業(yè)化生產(chǎn)尤為重要。由于高效、節(jié)能、環(huán)境友好等優(yōu)點,酶催化合成L-茶氨酸日益受到青睞。目前L-茶氨酸的酶法合成已經(jīng)取得一定進展,但仍存在一些問題:1)使用L-谷氨酰胺酶和GGT催化L-谷氨酰胺及衍生物與乙胺合成L-茶氨酸,反應(yīng)過程中不需要ATP參與,然而需要使用過量乙胺并在堿性條件下反應(yīng),以抑制底物L-谷氨酰胺水解及自轉(zhuǎn)肽作用;另外,還存在底物濃度偏低和轉(zhuǎn)化效率不高的問題。2)使用GS、GMAS及γ-GCS催化L-谷氨酸與乙胺合成L-茶氨酸,不存在底物水解及自轉(zhuǎn)肽等副反應(yīng),然而反應(yīng)過程需要ATP參與,使得ATP再生成為此類酶,特別是GMAS,應(yīng)用于L-茶氨酸工業(yè)生產(chǎn)的關(guān)鍵問題。因此,可從以下幾個方面進行深入研究:1)進一步表征這些酶的晶體結(jié)構(gòu),從而更完善地闡明乙胺結(jié)合以及通過γ-谷氨酰基的轉(zhuǎn)移或L-谷氨酸的連接生物合成L-茶氨酸的分子機制,以更好地利用定向進化技術(shù)提高酶對乙胺的底物特異性、催化活性和穩(wěn)定性,進一步提高合成L-茶氨酸的效率。2)利用生物信息學中的基因挖掘技術(shù)從自然界中篩查和表征更多具有催化L-茶氨酸合成功能的酶,并比較其酶性質(zhì)和合成L-茶氨酸的能力,以開發(fā)更有效的酶用于L-茶氨酸的工業(yè)生產(chǎn)。3)開發(fā)更高效的ATP再生系統(tǒng),以解決GMAS等酶在工業(yè)化生產(chǎn)應(yīng)用中的瓶頸問題。
[1] LIANG Y R, LIU C, XIANG L P, et al. Health benef i ts of theanine in green tea: a review[J]. Tropical Journal of Pharmaceutical Research,2015, 14(10): 1943-1949. DOI:10.4314/tjpr.v14i10.29.
[2] VUONG Q V, STATHOPOULOS C E, GOLDING J B, et al.Optimum conditions for the water extraction of L-theanine from green tea[J]. Journal of Separation Science, 2011, 34(18): 2468-2474.DOI:10.1002/jssc.201100401.
[3] YE J H, JIN J, LUO Y W, et al. Isolation of L-theanine from tea solution by cation exchange resin in batch and fi xed bed column[J].Biotechnology and Bioprocess Engineering, 2011, 16(2): 256-263.DOI:10.1007/s12257-010-0223-8.
[4] CARTWRIGHT R A, ROBERTS E A H, WOOD D J. Theanine, an amino-acid N-ethyl amide present in tea[J]. Journal of the Science of Food and Agriculture, 1954, 5(12): 597-599. DOI:10.1002/jsfa.2740051208.
[5] GU H N, JIANG Y X, WANG J. A practical synthesis of ethyl L-glutamine (L-theanine)[J]. Organic Preparations and Procedures International, 2004, 36(2): 182-185.DOI:10.1080/00304940409355394.
[6] ZHANG Z Z, YAN S H, LI D X, et al. Chemical synthesis and the stability of theanine[J]. Advanced Materials Research, 2012,396/397/398: 1273-1277. DOI:10.4028/www.scientif i c.net/AMR.396-398.1273.
[7] VUONG Q V, BOWYER M C, ROACH P D. L-Theanine: properties,synthesis and isolation from tea[J]. Journal of the Science of Food and Agriculture, 2011, 91(11): 1931-1939. DOI:10.1002/Jsfa.4373.
[8] MU W M, ZHANG T, JIANG B. An overview of biological production of L-theanine[J]. Biotechnology Advances, 2015, 33(3/4):335-342. DOI:10.1016/j.biotechadv.2015.04.004.
[9] 陳林, 張正竹, 陳鍵, 等. 茶氨酸酶促生物合成研究進展[J]. 茶葉科學, 2011, 31(1): 1-10.
[10] 羅晶晶, 張靈枝, 王登良. 生物技術(shù)在茶氨酸合成上的應(yīng)用進展[J]. 廣東茶業(yè), 2013(增刊1): 13-15. DOI:10.3969/j.issn.1672-7398.2013.01.005.
[11] 賁培玲, 朱巖巖, 殷志敏. L-茶氨酸生物制備技術(shù)和生物功能研究進展[J]. 中國茶葉加工, 2015(4): 19-25.
[12] YOTO A, MOTOKI M, MURAO S, et al. Effects of L-theanine or caffeine intake on changes in blood pressure under physical and psychological stresses[J]. Journal of Physiological Anthropology,2012, 31: 1-9. DOI:10.1186/1880-6805-31-28.
[13] LI L, WANG X R, XIONG Y, et al. L-Theanine: a promising substance in tumor research[J]. Journal of Food Agriculture and Environment, 2013, 11(1): 25-27.
[14] THANGARAJAN S, DEIVASIGAMANI A, NATARAJAN S S, et al.Neuroprotective activity of L-theanine on 3-nitropropionic acid-induced neurotoxicity in rat striatum[J]. International Journal of Neuroscience,2014, 124(9): 673-684. DOI:10.3109/00207454.2013.872642.
[15] ZHAO Y, ZHAO B L. The neuroprotective effect of L-theanine and its inhibition on nicotine dependence[J]. Chinese Science Bulletin, 2014,59(31): 4014-4019. DOI:10.1007/s11434-014-0529-6.
[16] TAMANO H, FUKURA K, SUZUKI M, et al. Advantageous effect of theanine intake on cognition[J]. Nutritional Neuroscience, 2014, 17(6):279-283. DOI:10.1179/1476830513Y.0000000094.
[17] UNNO K, TANIDA N, ISHII N, et al. Anti-stress effect of theanine on students during pharmacy practice: positive correlation among salivary alpha-amylase activity, trait anxiety and subjective stress[J].Pharmacology Biochemistry and Behavior, 2013, 111: 128-135.DOI:10.1016/j.pbb.2013.09.004.
[18] LI C J, TONG H O, YAN Q X, et al. L-Theanine improves immunity by altering TH2/TH1 cytokine balance, brain neurotransmitters,and expression of phospholipase C in rat hearts[J]. Medical Science Monitor, 2016, 22: 662-669. DOI:10.12659/MSM.897077.
[19] ZHENG G D, SAYAMA K, OKUBO T, et al. Anti-obesity effects of three major components of green tea, catechins, caffeine and theanine,in mice[J]. In Vivo, 2004, 18(1): 55-62.
[20] 朱松, 王洪新. 茶氨酸的生理功能及在食品中的應(yīng)用[J]. 食品研究與開發(fā), 2005, 26(3): 18-20. DOI:10.3969/j.issn.1005-6521.2005.03.006.
[21] 帥玉英, 沈宇峰, 黃海娟, 等. 功能性配料L-茶氨酸的生產(chǎn)應(yīng)用與法規(guī)情況簡介[J]. 中國食品添加劑, 2013, 117(2): 181-185.DOI:10.3969/j.issn.1006-2513.2013.02.021.
[22] ASHIHARA H. Occurrence, biosynthesis and metabolism of theanine(gamma-glutamyl-L-ethylamide) in plants: a comprehensive review[J].Natural Product Communications, 2015, 10(5): 803-810.
[23] SASAOKA K, KITO M, ONISHI Y. Some properties of theanine synthesizing enzyme in tea seedlings[J]. Agricultural and Biological Chemistry, 1965, 29(11): 984-988. DOI:10.1080/00021369.1965.10858501.
[24] DENG W W, OGITA S, ASHIHARA H. Biosynthesis of theanine(gamma-ethylamino-L-glutamic acid) in seedlings of Camellia sinensis[J]. Phytochemistry Letters, 2008, 1(2): 115-119.DOI:10.1016/j.phytol.2008.06.002.
[25] NANDAKUMARA R, YOSHIMUNE K, WAKAYAMAC M, et al.Microbial glutaminase: biochemistry, molecular approaches and applications in the food industry[J]. Journal of Molecular Catalysis B: Enzymatic, 2003, 23(2/3/4/5/6): 87-100. DOI:10.1016/S1381-1177(03)00075-4.
[26] TACHIKI T, YAMADA T, UEDA M, et al. Purification and some properties of glutaminase from Pseudomonas nitroreducens IFO 12694[J]. Bioscience Biotechnology and Biochemistry, 1996, 60(7):1160-1164. DOI:10.1271/bbb.60.1160.
[27] TACHIKI T, YAMADA T, MIZUNO K, et al. Gamma-glutamyl transfer reactions by glutaminase from Pseudomonas nitroreducens IFO12694 and their application for the syntheses of theanine and gamma-glutamylmethylamide[J]. Bioscience Biotechnology and Biochemistry, 1998, 62(7): 1279-1283. DOI:10.1271/Bbb.62.1279.
[28] PU Hefang, WANG Qi, ZHU Fenfen, et al. Cloning, expression of glutaminase from Pseudomonas nitroreducens and application to theanine synthesis[J]. Biocatalysis and Biotransformation, 2013, 31(1):1-7. DOI:10.3109/10242422.2012.749462.
[29] YOKOYAMA T, ISHII R, ITOH T, et al. Synthesis of L-theanine using enzyme/mesoporous silica conjugates under high pH conditions[J].Materials Letters, 2011, 65(1): 67-69. DOI:10.1016/j.matlet.2010.09.016.
[30] ITOH T, HOSHIKAWA Y, MATSUURA S, et al. Production of L-theanine using glutaminase encapsulated in carbon-coated mesoporous silica with high pH stability[J]. Biochemical Engineering Journal, 2012, 68: 207-214. DOI:10.1016/j.bej.2012.07.012.
[31] MATSUURA S, YOKOYAMA T, ISHII R, et al. An enzymeencapsulated microreactor for efficient theanine synthesis[J].Chemical Communications, 2012, 48(56): 7058-7060. DOI:10.1039/C2cc32271d.
[32] TACHIKI T, OKADA Y, OZEKI M, et al. Process for producing theanine: US7335497[P]. (2008-02-16)[2016-08-20].
[33] CASTELLANO I, MERLINO A. γ-Glutamyltranspeptidases:sequence, structure, biochemical properties, and biotechnological applications[J]. Cellular and Molecular Life Sciences, 2012, 69(20):3381-3394. DOI:10.1007/s00018-012-0988-3.
[34] SUZUKI H, IZUKA S, MIYAKAWA N, et al. Enzymatic production of theanine, an “umami” component of tea, from glutamine and ethylamine with bacterial gamma-glutamyltranspeptidase[J]. Enzyme and Microbial Technology, 2002, 31(6): 884-889. DOI:10.1016/S0141-0229(02)00213-2.
[35] YAO Y F, WENG Y M, HU H Y, et al. Expression optimization and biochemical characterization of a recombinant gammaglutamyltranspeptidase from Escherichia coli Novablue[J]. Protein Journal, 2006, 25(6): 431-441. DOI:10.1007/s10930-006-9037-0.
[36] ZHANG F, ZHENG Q Z, JIAO Q C, et al. Synthesis of theanine from glutamic acid gamma-methyl ester and ethylamine catalyzed by Escherichia coli having gamma-glutamyltranspeptidase activity[J].Biotechnology Letters, 2010, 32(8): 1147-1150. DOI:10.1007/s10529-010-0273-1.
[37] ZHANG F, ZHENG Q Z, JIAO Q C, et al. Enzymatic synthesis of theanine from glutamic acid gamma-methyl ester and ethylamine by immobilized Escherichia coli cells with gamma-glutamyltranspeptidase activity[J]. Amino Acids, 2010, 39(5): 1177-1182. DOI:10.1007/s00726-010-0553-z.
[38] WANG Q, MIN C, ZHU F F, et al. Production of bioactive gammaglutamyl transpeptidase in Escherichia coli using sumo fusion partner and application of the recombinant enzyme to L-theanine synthesis[J].Current Microbiology, 2011, 62(5): 1535-1541. DOI:10.1007/s00284-011-9891-7.
[39] ZHANG Hongjuan, ZHANG Weiguo, WANG Zhiyuan, et al.Enzymatic synthesis of theanine with Escherichia coli gammaglutamyltranspeptidase from a series of gamma-glutamyl anilide substrate analogues[J]. Biotechnology and Bioprocess Engineering,2013, 18(2): 358-364. DOI:10.1007/s12257-012-0644-7.
[40] SHUAI Y Y, ZHANG T, JIANG B, et al. Development of efficient enzymatic production of theanine by gamma-glutamyltranspeptidase from a newly isolated strain of Bacillus subtilis, SK11.004[J]. Journal of the Science of Food and Agriculture, 2010, 90(15): 2563-2567.DOI:10.1002/jsfa.4120.
[41] WANG Haoqi, YAO Zhong, ZHOU Zhi, et al. Enzymatic synthesis of theanine with L-glutamine-Zn(Ⅱ) complexes[J]. Biotechnology and Bioprocess Engineering, 2012, 17(6): 1135-1139. DOI:10.1007/s12257-012-0205-0.
[42] CHEN X Y, SU L Q, WU D, et al. Application of recombinant Bacillus subtilis gamma-glutamyltranspeptidase to the production of L-theanine[J]. Process Biochemistry, 2014, 49(9): 1429-1439.DOI:10.1016/j.procbio.2014.05.019.
[43] 傅嘉懿, 陳晟, 吳敬. γ-谷氨酰轉(zhuǎn)肽酶補料法合成L-茶氨酸工藝研究[J]. 生物技術(shù)通報, 2016, 32(2): 165-171. DOI:10.13560/j.cnki.biotech.bull.1985.2016.02.022.
[44] BINDAL S, GUPTA R. L-Theanine synthesis using gammaglutamyl transpeptidase from Bacillus licheniformis ER-15[J]. Journal of Agricultural and Food Chemistry, 2014, 62(37): 9151-9159.DOI:10.1021/jf5022913.
[45] LIN L L, CHOU P R, HUA Y W, et al. Overexpression, one-step purification, and biochemical characterization of a recombinant gamma-glutamyltranspeptidase from Bacillus licheniformis[J]. Applied Microbiology and Biotechnology, 2006, 73(1): 103-112. DOI:10.1007/s00253-006-0440-4.
[46] TACHIKI T, WAKISAKA S, KUMAGAI H, et al. Glutamine synthetase from Micrococcus glutamicus: effect of nitrogen sources in culture medium on enzyme formation and some properties of crystalline enzyme[J]. Agricultural and Biological Chemistry, 1981,45(6): 1487-1492. DOI:10.1271/bbb1961.45.1487.
[47] TACHIKI T, SUZUKI H, WAKISAKA S, et al. Production of γ-glutamylmethylamide and γ-glutamylethylamide by coupling of baker’s yeast preparations and bacterial glutamine synthetase[J]. The Journal of General and Applied Microbiology, 1986, 32(6): 545-548.DOI:10.2323/jgam.32.545.
[48] YAMAMOTO S, UCHIMURA K, WAKAYAMA M, et al.Purification and characterization of glutamine synthetase of Pseudomonas taetrolens Y-30: an enzyme usable for production of theanine by coupling with the alcoholic fermentation system of baker’s yeast[J]. Bioscience Biotechnology and Biochemistry, 2004, 68(9):1888-1897. DOI:10.1271/Bbb.68.1888.
[49] YAMAMOTO S, WAKAYAMA M, TACHIKI T. Cloning and expression of Pseudomonas taetrolens Y-30 gene encoding glutamine synthetase: an enzyme available for theanine production by coupled fermentation with energy transfer[J]. Bioscience Biotechnology and Biochemistry, 2006, 70(2): 500-507. DOI:10.1271/Bbb.70.500.
[50] YAMAMOTO S, WAKAYAMA M, TACHIKI T. Theanine production by coupled fermentation with energy transfer employing Pseudomonas taetrolens Y-30 glutamine synthetase and baker’s yeast cells[J]. Bioscience Biotechnology and Biochemistry, 2005, 69(4):784-789. DOI:10.1271/Bbb.69.784.
[51] ZHOU Xin, ZHANG Zhengping, JIA Xiaohe, et al. Mn2+enhances theanine-forming activity of recombinant glutamine synthetase from Bacillus subtilis in Escherichia coli[J]. World Journal of Microbiology and Biotechnology, 2008, 24(8): 1267-1272.DOI:10.1007/s11274-007-9599-9.
[52] KIMURA T, SUGAHARA I, HAYASHI K, et al. Primary metabolic pathway of methylamine in Methylophaga sp. AA-30[J]. Agricultural and Biological Chemistry, 1990, 54(11): 2819-2826. DOI:10.1080/000 21369.1990.10870440.
[53] KIMURA T, SUGAHARA I, HANAI K, et al. Purification and characterization of gamma-glutamylmethylamide synthetase from Methylophaga sp. AA-30[J]. Bioscience Biotechnology and Biochemistry, 1992, 56(5): 708-711. DOI:10.1271/bbb.56.708.
[54] YAMAMOTO S, WAKAYAMA M, TACHIKI T. Characterization of theanine-forming enzyme from Methylovorus mays No. 9 in respect to utilization of theanine production[J]. Bioscience Biotechnology and Biochemistry, 2007, 71(2): 545-552. DOI:10.1271/Bbb.60590.
[55] YAMAMOTO S, WAKAYAMA M, TACHIKI T. Cloning and expression of Methylovorus mays No. 9 gene encoding gammaglutamylmethylamide synthetase: an enzyme usable in theanine formation by coupling with the alcoholic fermentation system of baker’s yeast[J]. Bioscience Biotechnology and Biochemistry, 2008,72(1): 101-109. DOI:10.1271/Bbb.70462.
[56] YAMAMOTO S, MORIHARA Y, WAKAYAMA M, et al. Theanine production by coupled fermentation with energy transfer using gammaglutamylmethylamide synthetase of Methylovorus mays No. 9[J].Bioscience Biotechnology and Biochemistry, 2008, 72(5): 1206-1211.DOI:10.1271/Bbb.70663.
[57] YAMAMOTO S, MORIHARA Y, WAKAYAMA M, et al. Repeated batch production of theanine by coupled fermentation with energy transfer using membrane-enclosed gamma-glutamylmethylamide synthetase and dried yeast cells[J]. Bioscience Biotechnology and Biochemistry, 2009, 73(12): 2800-2802. DOI:10.1271/Bbb.90647.
[58] LIU S, LI Y, ZHU J. Enzymatic production of L-theanine by gammaglutamylmethylamide synthetase coupling with an ATP regeneration system based on polyphosphate kinase[J]. Process Biochemistry, 2016,51(10): 1458-1463. DOI:10.1016/j.procbio.2016.06.006.
[59] KELLY B S, ANTHOLINE W E, GRIFFITH O W. Escherichia coli gamma-glutamylcysteine synthetase - two active site metal ions affect substrate and inhibitor binding[J]. Journal of Biological Chemistry,2002, 277(1): 50-58. DOI:10.1074/jbc.M107961200.
[60] MIYAKE K, KAKITA S. A novel catalytic ability of gammaglutamylcysteine synthetase of Escherichia coli and its application in theanine production[J]. Bioscience Biotechnology and Biochemistry,2009, 73(12): 2677-2683. DOI:10.1271/Bbb.90538.
Process in Enzymatic Synthesis of L-Theanine
LI Yuan, LIU Shan, ZHU Jun*(Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China)
L-theanine (γ-glutamylethylamide), a unique non-protein-derived amino acid in tea, has a broad range of bioactivities, such as improving food fl avor, releasing pressure and enhancing the eff i ciency of anticancer agents. Herein,the physiological and pharmacological activities of L-theanine and its applications in food, health and medical industries are summarized with focus on the enzymatic synthesis of L-theanine. Moreover, directions for future research are also discussed in the hope of providing a guideline for the large-scale industrial production of L-theanine.
tea; L-theanine; biosynthesis; enzyme
10.7506/spkx1002-6630-201723047
TS202.3
A
1002-6630(2017)23-0298-07
李元, 劉珊, 祝俊. 酶催化合成L-茶氨酸的研究進展[J]. 食品科學, 2017, 38(23): 298-304.
10.7506/spkx1002-6630-201723047. http://www.spkx.net.cn
LI Yuan, LIU Shan, ZHU Jun. Process in enzymatic synthesis of L-theanine[J]. Food Science, 2017, 38(23): 298-304. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201723047. http://www.spkx.net.cn
2016-09-09
天津市科技計劃項目(14ZCZDSY00064)
李元(1986—),女,助理研究員,碩士,研究方向為生物催化。E-mail:li_yuan@tib.cas.cn
*通信作者:祝俊(1962—),男,研究員,博士,研究方向為酶工程與生物催化。E-mail:zhu_j@tib.cas.cn

