ROS/ALOX5/NLRP3信號通路激活在低氧所致肺動脈內皮增殖中的作用
胡 志,馬 慧,范粉玲,劉文娟,謝 航
(西安交通大學第一附屬醫院結構性心臟病科,陜西 西安 710061)
ROS/ALOX5/NLRP3信號通路激活在低氧所致肺動脈內皮增殖中的作用
胡 志,馬 慧,范粉玲,劉文娟,謝 航
(西安交通大學第一附屬醫院結構性心臟病科,陜西 西安 710061)
目的考察ROS/ALOX5/NLRP3信號通路相關蛋白激活在低氧所致肺動脈內皮細胞增殖中的作用。方法將人肺動脈內皮細胞分別在常氧狀態(21% O2)和低氧狀態(1% O2)下培養24、48、72及96小時,同時低氧狀態下分別設立活性氧(ROS)清除劑Trolox組和ALOX5抑制劑齊留通組。采用CCK-8法檢測細胞增殖率的改變,活性氧探針H2-DCFA檢測低氧狀態下肺動脈內皮細胞內ROS的變化,Western blot法分別檢測低氧狀態及加入Trolox或齊留通干預后ALOX5、NLRP3和Caspase-1蛋白表達的變化。結果肺動脈內皮細胞在低氧作用48、72及96 h后可見增殖顯著,分別達(135.6±29.4)%、(185.3±21.7)%及(212.3±39.0)%。同時,細胞內ROS在24、48及72 h可檢測到顯著增加,96小時后基本恢復正常。ALOX5、NLRP3和Caspase-1蛋白隨低氧時間增加而表達增多。預先加入ROS清除劑Trolox和ALOX5抑制劑齊留通均可抑制NLRP3炎性小體相關蛋白NLRP3和Caspase-1的表達,且細胞增殖率也顯著降低。結論ROS/ALOX5/NLRP3信號通路在低氧所致的肺動脈內皮細胞增殖中顯著激活,抑制這一通路可顯著減少低氧所致的內皮細胞增殖。
肺動脈高壓;低氧;人肺動脈內皮細胞;NLRP3炎性小體;信號通路
肺動脈高壓(pulmonary arterial hypertension,PAH)是一種以肺血管循環阻力增加、肺動脈壓力持續增高,進而誘發右心衰竭的高致死率和致殘率疾病,其病理生理改變以進展性肺動脈壓力升高和血管重建為特征[1]。目前雖然機制未明,但臨床PAH患者檢查發現,低氧所導致的肺泡血管內皮細胞和肺動脈內皮細胞功能不全、異常增殖在PAH的發生發展中起著至關重要的作用[2]。
低氧所誘發的肺動脈內皮細胞增殖機制較為復雜,新近研究資料表明,氧化應激和炎癥應答可導致血管內皮生長因子(vascular endothelial growth factor,VEGF)釋放,同時促進內皮細胞活化后釋放成纖維細胞生長因子(fibroblast growth factors,FGF),進而改變肺部動脈血管微環境,從而促進肺動脈內皮細胞(pulmonary artery endothelial cells,PAEC)無序增殖,使肺動脈血管狹窄而誘發PAH[3]。但低氧是如何誘發肺動脈內皮增生,期間關聯的信號分子及機制還遠未闡明。
花生四烯酸5脂氧酶(arachidonate 5-lipoxygenase,ALOX5),可催化具有促血管增殖作用的白三烯類物質的生成。文獻報道,在PAH動物模型中發現,長期低氧可能伴隨ALOX5表達改變[4]。NLRP3,也被稱做NALP3(NACHT,LRR and PYD domains-containing protein 3)是由位于1號染色體長臂的NLRP3基因所編碼的重要炎癥小體,其在低氧所致的腫瘤細胞增殖中起重要作用[5,6],但其對動脈內皮細胞的促增殖作用還不明確。由于 ROS生成,ALOX5表達及NLRP3激活在低氧導致的肺動脈內皮增殖中的作用尚不清楚,因此本研究試圖考察ROS/ALOX5/NLRP3信號通路相關蛋白在低氧所致肺動脈內皮細胞增殖中的變化規律,同時采用活性氧(ROS)清除劑Trolox組和ALOX5抑制劑齊留通來驗證這一通路抑制對內皮細胞增殖的影響。
1 材料與方法
1.1主要試劑與儀器CCK-8 檢測試劑盒購自美國Dojindo Molecular Technologies 公司;活性氧探針2’,7’-二氯熒光素二乙酸鹽(2’,7’-dihydrodichlorofluorescein diacetate,H2-DCFDA)購自碧云天生物技術研究所;低氧培養容器(Hypoxia Incubator Chamber購自加拿大Stemcell公司;ALOX5,NLRP3,Caspase-1及GAPDH抗體購自美國CST公司;Thermo MK3型酶標儀產地美國;Olympus IX53 倒置熒光顯微鏡產地日本。
1.2方法
1.2.1細胞培養 人肺動脈內皮細胞(Human pulmonary artery endothelial cells,HPAEC)購自美國ScienCell實驗室。常規DMEM培養基含10%胎牛血清進行傳代培養,20代內用于實驗。
1.2.2低氧及藥物處理 HAPEC細胞正常培養條件為37 ℃和5% CO2,95% 空氣;低氧條件下,將HAPEC細胞置于Stemcell公司的低氧培養容器,培養條件為1% O2,5% CO2,94% N2。為考察ROS清除劑Trolox和ALOX5抑制劑齊留通對細胞增殖的影響,在進行低氧處置前,預先加入10 μmol/L 的Trolox和齊留通。
1.2.3細胞增殖率測定 將96孔板低氧及常氧狀態下培養的HAPEC細胞,每孔加入10 μl的CCK-8溶液,37 ℃下室溫孵育2小時后,用酶標儀在450 nm下檢測吸光度值。檢驗結果重復三次取均值(n=3)。
1.2.4細胞內ROS檢測 細胞內總ROS測定采用ROS敏感的熒光探針H2-DCFDA進行反應標記。具體方法如下:HPAEC細胞進行ROS測定前,先用PBS液清洗2次,然后加入10 μg/ml的H2-DCFDA溶液按1∶500濃度稀釋,37 ℃孵育15 min后,PBS液清洗3次,去除殘留的反應液,488 nm下進行熒光激發,熒光分光光度計檢測OD值,檢驗結果重復三次取均值(n=3)。倒置熒光顯微鏡進行拍照記錄。
1.2.5Western Blot分析 將常氧或低氧狀態培養不同時間、不同藥物處理的HPAEC進行收集,加入細胞裂解液后進行蛋白定量。每組取20 μg蛋白進行SDS-聚丙烯酰胺凝膠電泳,然后轉至PVDF膜。室溫下2%BSA封閉1小時,按不同稀釋倍數加入一抗(ALOX5,NLRP3,Caspase-1及GAPDH),4 ℃ 封閉過夜后PBS清洗3次,加入1:1000稀釋的HRP標記二抗室溫孵育1小時,ECL顯色,常規膠片曝光。Image-Pro Plus Version 6.0 圖像分析軟件進行灰度分析。檢驗結果重復三次取均值(n=3)。
1.3統計學方法采用SPSS 16.0 軟件進行統計分析。實驗結果均以均數±標準差表示,單因素方差分析(ANOVA),組間比較采用t檢驗。P< 0.05為差異有統計學意義。
2 結果
2.1低氧對肺動脈內皮細胞增殖率的影響肺動脈內皮細胞在低氧作用48、72和96小時后可見增殖顯著,增殖率分別達(135.6±29.4)%、(185.3±21.7)%和(212.3±39.0)%,與常氧對照組比較,差異有統計學意義。見圖1。
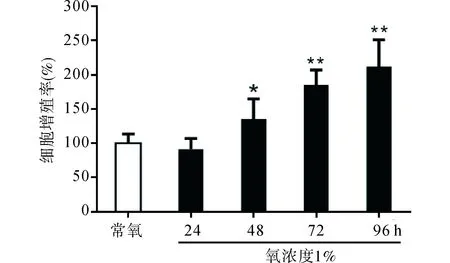
圖1 低氧對肺動脈內皮細胞增殖率的影響(n=3) 與常氧組比較,*P < 0.05,**P < 0.01
2.2低氧對肺動脈內皮細胞ROS生成的影響圖2 A為熒光分光光度法檢測肺動脈內皮細胞內ROS的生成變化(n=3);圖2B為常氧組及低氧24、48、72及96小時ROS探針H2-DCFDA激發后的熒光照片。結果可見,低氧作用24、48及72小時可見細胞內ROS生成顯著增多,分別達(164.38±19.75)%、(196.31±36.02)%及(272.74±31.77)%,與常氧對照組比較差異有統計學意義。見圖2。第96小時細胞內ROS基本恢復正常。
2.3低氧對肺動脈內皮細胞ROS/ALOX5/NLRP3信號通路相關蛋白表達的影響隨著低氧作用時間的延長,ALOX5蛋白在第48、72及96小時出現顯著上調,而炎癥小體相關蛋白NLRP3和Caspase-1的表達上調在早期(第24小時)已開始出現。見圖3。
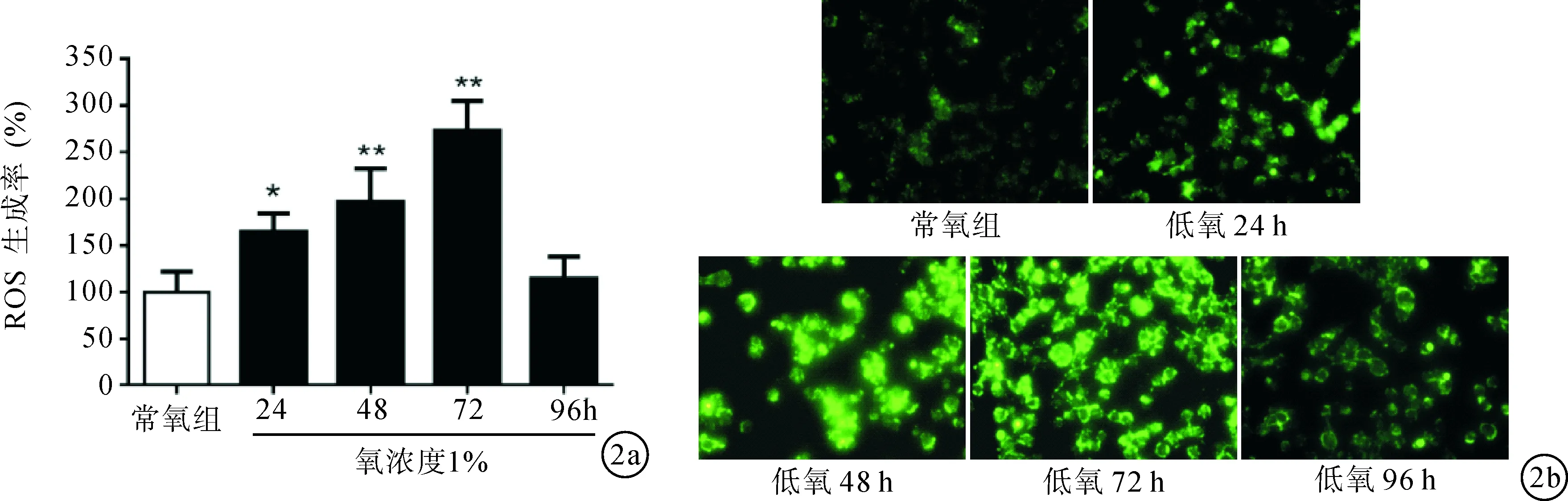
圖2 低氧致肺動脈內皮細胞ROS生成增加 a:熒光分光光度法檢測肺動脈內皮細胞內ROS的生成變化(n=3);b:常氧組及低氧24、48、72及96小時ROS探針H2-DCFDA激發后的熒光照片。與對照組比較,*P < 0.05,**P < 0.01
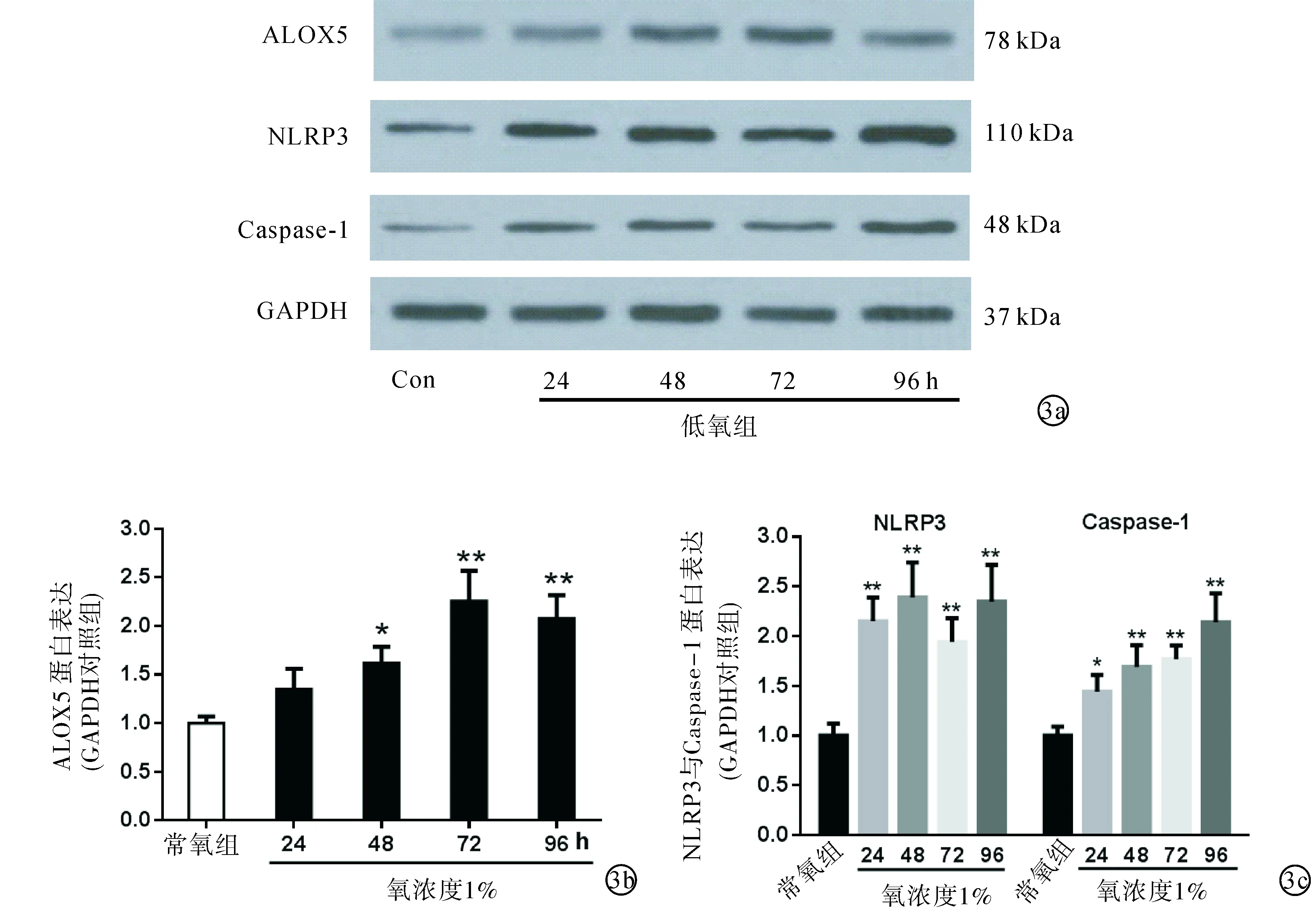
圖3 低氧對肺動脈內皮細胞ROS/ALOX5/NLRP3信號通路相關蛋白表達的影響 a:Western Blot法檢測低氧狀態下24、48、72及96小時后ALOX5、NLRP3和Caspase-1蛋白表達的變化,內參蛋白為GAPDH;b:Image-Pro Plus6.0軟件分析ALOX5蛋白表達量(n=3);c:Image-Pro Plus6.0軟件分析NLRP3和Caspase-1蛋白表達量(n=3)。與對照組比較,*P < 0.05,**P < 0.01
2.4Trolox和齊留通對ROS/ALOX5/NLRP3信號通路蛋白的干預及對HPAEC增殖的影響圖4a為Trolox和齊留通對ROS/ALOX5/NLRP3信號通路蛋白的干預作用;圖4b為Trolox和齊留通對HPAEC增殖的影響。10 μmol/L的 Trolox和齊留通均能顯著下調ALOX5、NLRP3及Caspase-1蛋白的表達,且能抑制低氧所導致的肺動脈內皮細胞增殖。
3 討論
目前,人們對PAH的病理生理機制尚不明確。長期以來,低氧[7]、酸中毒[8]、肺動脈血管內皮增殖[9]及血管重塑所致的肺泡毛細血管循環阻力增加[10]均被認為是導致PAH的重要危險因素。近年來,隨著對PAH發病機制的深層次探索,低氧導致的氧化應激損傷、炎性通路激活[11]及誘發的內皮功能障礙逐漸成為新的研究熱點和潛在藥物作用靶標[12]。
肺血管內皮細胞(PVEC) 在正常生理狀態下,其增殖率和凋亡率之間維持著動態平衡,其數量的相對穩定對維持血管正常結構與功能至關重要。但PAH發病中,低氧作為重要的危險因素可引起PVEC增殖率和凋亡率之間失衡,使PVEC數量增多,其產生的促血管生成物質VEGF、FGF及LTs等大量釋放,改變肺動脈血管微環境進而導致內膜和平滑肌增厚,使肺血管管腔出現明顯狹窄,表現為肺循環阻力持續增大,動脈壓力持續升高而發展為PAH[13]。

圖4 Trolox和齊留通對ROS/ALOX5/NLRP3信號通路蛋白的干預及對HPAEC增殖的影響 A:ROS清除劑Trolox和ALOX5抑制劑齊留通對ROS/ALOX5/NLRP3信號通路蛋白的干預作用;B:Trolox和齊留通對HPAEC增殖的影響(n=3)。與低氧組比較,##P < 0.01;與常氧組比較,**P < 0.01
近年的研究表明,低氧狀態除可促進低氧細胞內ROS生成外,還可能激活下游氧化應激和炎癥反應,其中誘發血管生長因子釋放的ALOX5蛋白及NLRP3炎癥小體的表達規律可能在PVEC增殖中扮演重要作用[14]。為進一步探索低氧誘導動脈內皮增殖的機制,本研究采用人肺動脈內皮細胞作為研究對象,在低氧作用48、72和96 h后可見其增殖顯著。同時,細胞內ROS在24、48、72 h顯著增加,ALOX5、NLRP3和Caspase-1蛋白隨低氧時間增加而表達增多。預先加入ROS清除劑Trolox和ALOX5抑制劑齊留通均可抑制NLRP3炎性小體相關蛋白NLRP3和Caspase-1的表達,且細胞增殖率也顯著降低。
本研究結果首先明確了在體外條件下,低氧可促進肺動脈內皮細胞增殖,伴隨出現細胞內ROS增多,同時細胞膜脂質調節關鍵蛋白ALOX5表達增加,炎癥蛋白NLRP3和Caspase-1激活,以上結果均說明,肺動脈內皮細胞在低氧條件下的增殖與氧化應激、炎癥和脂質代謝紊亂相關。ALOX5的增加可能通過旁分泌方式作用于肺小動脈內膜,引起內膜增厚以及介導新生血管的形成,由此產生明顯的肺血管重構。隨著病情的發展,將進一步誘發血管中膜和內膜增厚及血管彈性下降,引起血管阻力增加,肺細小動脈肌性化;NLRP3其介導的炎癥通路及下游Caspase-1的激活及白介素1β的釋放也與動脈內皮細胞炎癥反應及增殖關系密切。后續實驗中,我們在低氧體系中預先加入ROS清除劑Trolox和ALOX5抑制劑齊留通,恰好抑制了ROS/ALOX5/NLRP3信號通路,同時大大阻斷了內皮細胞增殖。因此,我們大致可以推論,ROS/ALOX5/NLRP3信號通路是調節動脈內皮增殖的重要機制之一。
目前改善內皮細胞功能紊亂的藥物,如內皮素受體拮抗劑、血管緊張素受體阻斷劑、血脂調節藥物等已經證明可一定程度改善PAH患者的病情,但由于這些藥物副作用較大,目前臨床上仍不能作為低氧性PAH的長期治療手段[15]。因此,尋找新的針對低氧性PAH的有效治療靶點和新藥物勢在必行。本研究結果提示,ROS/ALOX5/NLRP3信號通路在低氧所致的肺動脈內皮細胞增殖中顯著激活,抑制這一通路可顯著減少低氧所致的內皮細胞增殖,但這一信號通路的干預實驗尚需在PAH動物模型中驗證,其后續是否可作用藥物調控的靶點從而形成新的治療手段,還有待進一步深入研究。
[1] Humbert M,Morrell NW,Archer SL,et al.Cellular and molecular pathobiology of pulmonary arterial hypertension[J].Journal of the American College of Cardiology,2004,43(12 Supplement):S13-S24.
[2] Xu W,Kaneko FT,Zheng S,et al.Increased arginase II and decreased NO synthesis in endothelial cells of patients with pulmonary arterial hypertension[J].The FASEB journal,2004,18(14):1746-1748.
[3] Morrell NW,Adnot S,Archer SL,et al.Cellular and molecular basis of pulmonary arterial hypertension[J].Journal of the American College of Cardiology,2009,54(1 Supplement):S20-S31.
[4] Thompson AR.,Lawrie A.Targeting vascular remodeling to treat pulmonary arterial hypertension[J].Trends in molecular medicine,2017,23(1):31-45.
[5] Ravichandran P,Liu HZ,Choubey D.Hypoxia primes human normal prostate epithelial cells and cancer cell lines for the NLRP3 and AIM2 inflammasome activation[J].Oncotarget 2016,7(19):28183.
[6] Ghiringhelli F,Apetoh L,Tesniere A,et al.Activation of the NLRP3 inflammasome in dendritic cells induces IL-1β-dependent adaptive immunity against tumors[J].Nature medicine,2009,15(10):1170-1178.
[7] Semenza GL.Oxygen sensing,hypoxia-inducible factors,and disease pathophysiology[J].Annual Review of Pathology[J].Mechanisms of Disease,2014,9:47-71.
[8] Chang G,Zhang K,Xu T,et al.Feeding a high-grain diet reduces the percentage of LPS clearance and enhances immune gene expression in goat liver[J].BMC veterinary research,2015,11(1):67.
[9] Kim J,Kang Y,Kojima Y,et al.An endothelial apelin-FGF link mediated by miR-424 and miR-503 is disrupted in pulmonary arterial hypertension[J].Nature medicine,2013,19(1):74-82.
[10]Perros F,Ranchoux B,Izikki M,et al.Nebivolol for improving endothelial dysfunction,pulmonary vascular remodeling,and right heart function in pulmonary hypertension[J].Journal of the American College of Cardiology 2015,65(7):668-680.
[11]Magne J,Pibarot P,Sengupta PP,et al.Pulmonary hypertension in valvular disease:a comprehensive review on pathophysiology to therapy from the HAVEC Group[J].JACC:Cardiovascular Imaging,2015,8(1):83-99.
[12]Perros F,Ranchoux B,Izikki M,et al.Nebivolol for improving endothelial dysfunction,pulmonary vascular remodeling,and right heart function in pulmonary hypertension[J].Journal of the American College of Cardiology,2015,65(7):668-680.
[13]Yamaji-Kegan K,Takimoto E,Zhang A,et al.Hypoxia-induced mitogenic factor (FIZZ1/RELMα) induces endothelial cell apoptosis and subsequent interleukin-4-dependent pulmonary hypertension[J].American Journal of Physiology-Lung Cellular and Molecular Physiology,2014,306(12):L1090-L1103.
[14]Porter KM,Kang BY,Adesina SE,et al.Chronic hypoxia promotes pulmonary artery endothelial cell proliferation through H2O2-induced 5-lipoxygenase[J].PloS one,2014,9(6):e98532.
[15]Galiè N,Corris PA,Frost A,et al.Updated treatment algorithm of pulmonary arterial hypertension[J].Turk Kardiyoloji Dernegi arsivi:Turk Kardiyoloji Derneginin yayin organidir,2014,42:78-94.
TheeffectofROS/ALOX5/NLRP3signalingpathwayonhypoxia-inducedpulmonaryarteryendothelialcellproliferation
HUZhi,MAHui,FANFen-ling,LIUWen-juan,XIEHang
(DepartmentofStructuralHeartDisease,TheFirstAffiliatedHospital,Xi’anJiaotongUniversity,Xi’an710061,China)
ObjectiveTo investigate the role of activation of ROS/ALOX5/NLRP3 signaling pathway in hypoxia-induced proliferation of pulmonary artery endothelial cells.MethodsThe human pulmonary arterial endothelial cells (HPAEC) were cultured in normoxia (21% O2) and hypoxia (1% O2) for 24,48,72 and 96 hours,respectively.At the same time,subsets of reactive oxygen species (ROS) scavenger,Trolox and ALOX5 inhibitor,Zileuton were set up.The CCK-8 method was used to detect the cell proliferation rate.The change of ROS level in HPAEC under hypoxia was detected by probe H2-DCFA.Western blot was used to detect the expression of ALOX5,NLRP3 and caspase-1 protein after intervention of hypoxia,Trolox and Zileuton,respectively.ResultsHPAEC were significantly proliferated at 48,72 and 96 hours after hypoxia,reaching (135.6±29.4)%,(185.3±21.7)% and (212.3±39.0)%,respectively.At the same time,intracellular ROS at 24-,48-and 72-hour was increased significantly and return to normal at 96 hour.The protein expressions of ALOX5,NLRP3 and caspase-1 were increased with the prolonged hypoxia time.Pretreatment with Trolox and Zileuton inhibited the expressions of NLRP3 and caspase-1 in the inflammasome,and the cell proliferation rate was decreased significantly.ConclusionROS/ALOX5/NLRP3 signaling pathway is significantly activated in hypoxia-induced proliferation of HPAEC,and inhibition of this pathway can significantly reduce hypoxia-induced endothelial cell proliferation.
Pulmonary arterial hypertension;Hypoxia;Human pulmonary artery endothelial cells;NLRP3 inflammasome;Signaling pathway
陜西省自然科學基礎研究基金面上項目(編號:2014JM2-8171)
R563
A
1672-6170(2017)06-0044-05
2017-07-21;
2017-09-22)

