基質輔助激光解吸電離飛行時間質譜在臨床微生物檢驗中的應用與發展
張 嶸
基質輔助激光解吸電離飛行時間質譜在臨床微生物檢驗中的應用與發展
張 嶸
基質輔助激光解吸電離飛行時間質譜; 微生物鑒定; 細菌耐藥性; 分子流行病學
Application and development of MALDI-TOF MS in clinical microbiology laboratory
基質輔助激光解吸電離飛行時間質譜(MALDI-TOF MS)自20世紀90年代開始成功用于細菌的快速鑒定,其原理是根據不同細菌的特征性蛋白指紋圖譜進行細菌鑒定,打破了傳統生化反應方法煩瑣的鑒定流程,大大縮短了檢測時間,降低了檢測成本,且具有準確、高通量等優勢,為臨床微生物檢驗帶來了革命性的發展。MALDI-TOF MS在臨床微生物實驗室的應用主要涵蓋以下方面:①病原微生物的鑒定;②細菌耐藥性的檢測;③某些特定菌株的分子流行病學分析。
1 MALDI-TOF MS在病原菌鑒定中的應用
1.1 培養后病原微生物鑒定
MALDI-TOF MS對培養后臨床病原菌的快速檢測已十分成熟,有文獻評估臨床常用的2臺質譜儀——布魯克公司Biotyper MS和物生梅里埃公司的VITEK MS的鑒定性能,其對臨床常見病原菌的鑒定準確率均達95%以上[1]。此外,MALDI-TOF MS在厭氧菌、真菌、分枝桿菌及其他少見或難培養細菌的鑒定方面與傳統方法相比較具有明顯優勢。
采用傳統方法鑒定厭氧菌周期長,鑒定困難,有些菌種之間很難區分,不能滿足臨床實驗室快速準確的要求。隨著MALDI-TOF MS數據庫不斷完善,MALDI-TOF MS對臨床分離的厭氧菌鑒定準確率已經達到90%以上[2]。與“金標準”16S rRNA相比,197株臨床分離厭氧菌,MALDI-TOF MS鑒定準確率為94.9%[3]。真菌亦是臨床鑒定的難題,質譜對臨床常見白念珠菌、近平滑念珠菌、熱帶念珠菌、新生隱球菌等鑒定總準確率能達96%以上,但是對數據庫中未包含的菌種,例如弗比恩畢赤酵母無法給出鑒定結果,需要自建庫進行補充[4]。由于菌絲和細胞壁破碎困難,絲狀真菌是目前質譜鑒定的瓶頸,有文獻報道經復雜的前處理后,390株臨床分離的絲狀真菌的鑒定準確率僅為85.6%[5]。
質譜的另一個優勢是對細菌復合群的鑒定,常規的生化反應均難將復合群區分到種。Biotyper MS的數據庫對醋酸鈣-鮑曼不動桿菌復合群的區分能力可達到100%[6],VITEK MS對于鏈球菌屬,尤其對肺炎鏈球菌和其他鏈球菌之間的區分準確率可達99.1%(115/116)[7]。結核分枝桿菌復合群菌種同源性高,鑒定困難,Biotyper MS可鑒定至種的水平,結核分枝桿菌和牛分枝桿菌的鑒定準確率在96%左右[8],對非結核分枝桿菌復合群細菌鑒定準確率為98.4%(65/66)[9]。目前國產質譜儀對臨床革蘭陰性桿菌的鑒定準確率可達到98.05%,但是對某些復合群的鑒別仍然有待提高[10]。
質譜用于支原體的鑒定目前還有一定的困難,主要由于數據庫有限,樣本混合其他細菌,或合并多種支原體感染,干擾質譜儀鑒定的準確性。目前質譜可通過自建庫或直接分析某一種如肺炎支原體特征峰進行鑒定[11]。
1.2 臨床樣本直接檢測細菌
質譜針對培養后病原菌的鑒定可縮短鑒定時間,但仍需培養18~24 h,而將質譜運用于臨床樣本的直接檢測,可大大縮短檢測周轉時間(turnaround time,TAT),對于臨床細菌及真菌感染患者的早期診斷和治療有重要意義。
鑒于血流感染的重要性,MALDI-TOF MS用于陽性血培養標本的快速檢測一直是研究的熱點,標本前處理能除去血液中血細胞以及其他非細菌成份的干擾,對直接檢測尤為重要。差速離心的方法在菌量大于107cfu/mL時準確率在87%左右[12];分離膠方法檢出率約59%;Sepsityper商品化試劑盒可檢出88%細菌,陰性菌鑒定準確率更高[13];合適的裂解劑(如SDS和saponin)可提高直接檢測的檢出率。從目前文獻綜合評估,Sepsityper具有標準化、準確率高的優點,但操作稍復雜,且成本較裂解劑及分離膠方法高。
目前MALDI-TOF MS直接檢測血培養還存在一些問題。臨床常用血培養瓶如BacT/ALERT活性炭需氧瓶內活性炭吸附細菌導致細菌濃度降低,前處理后檢測效果不佳,需要鑒定短時間培養后生成菌膜,需要耗時4~8 h[14];革蘭陽性菌的鑒定準確率低于革蘭陰性菌;無法可靠地區分肺炎鏈球菌與草綠色鏈球菌[15];混合感染樣本只能檢測一種細菌或無法給出鑒定結果[16];對厭氧菌的鑒定準確率在75%左右等。國內外對MALDI-TOF MS運用于臨床標本的直接鑒定都持樂觀態度,中國臨床微生物質譜共識專家組以及上海醫學會檢驗醫學專科委員會臨床微生物學組均發表了關于血培養直接質譜檢測共識,將MALDI-TOF MS用于血培養直接檢測作為未來的手段。
除了血培養陽性標本外,MALDI-TOF MS還可用于尿液標本的直接檢測。尿液樣本經離心后洗滌,對菌量>105cfu/mL的尿液樣本檢出率為92.7%,尤其是革蘭陰性桿菌顯示很好的符合性[17]。采用SDS前處理,可大大提高方法準確度。文獻對比發現過濾(78.9%)和固體培養(84.2%)比差速離心(68.4%)有更高的準確率,MALDI-TOF MS在尿液樣本的直接檢測具有巨大潛力[18]。其他無菌體液標本的快速檢測報道不多,主要為腦脊液,已有報道檢出腦膜炎患者腦脊液中肺炎鏈球菌、布魯菌和肺炎克雷伯菌[19-20]。
2 MALDI-TOF MS在細菌耐藥性檢測中的研究與應用
MALDI-TOF MS應用于細菌耐藥性的檢測是質譜在微生物檢驗中的另一個拓展。根據目前已有的報道,大致可分為:①直接尋找耐藥菌中特異峰,采用特定的軟件分析獲得耐藥和敏感細菌的差異性(直接分析法);②根據細菌產生特異性酶水解抗生素,檢測抗生素峰圖的變化,確認是否耐藥(酶水解法);③曲線下面積計算法;④其他方法。
2.1 直接分析法
在2000年,Edwards-Jones等[21]首次提出了采用MALDI-TOF MS快速區分MRSA和MSSA,隨后更多的研究驗證了MALDI-TOF MS對MRSA和MSSA具有區分能力。Biotyper MS采用分析軟件區分MRSA組的準確率為83.3%,MSSA組為90.9%[22],見圖1;VITEK MS通過建立SuperSpectra,選擇3個特征峰區分MRSA和MSSA,準確率達到84%和91%[23],見圖2。同理,MALDI-TOF MS對耐萬古霉素腸球菌也可進行快速區分,采用GA算法其特異度和靈敏度分別為92.40%和99.18%[24]。2014年,Lau等[25]發現質荷比為11109 Da是blaKPC表達pKpQIL肽的特征峰,通過該特征峰可快速區分產KPC型碳青霉烯酶的肺炎克雷伯菌。
2.2 酶水解法
腸桿菌科細菌、銅綠假單胞菌和鮑曼不動桿菌對β內酰胺類和碳青霉烯類抗生素的耐藥機制大多數是由于產生水解抗生素的酶,如CTX-M、KPC、NDM和OXA酶等。2011年首次報道MALDI-TOF MS檢測碳青霉烯酶,整個過程1~2.5 h即可完成[26]。隨后大量文獻報道,針對革蘭陰性桿菌β內酰胺酶以及碳青霉烯酶耐藥菌株的檢測,通過孵育水解抗生素區分耐藥株和敏感株[27-28]。胡燕燕等[29]比較產KPC型碳青霉烯酶腸桿菌科細菌在不同藥物濃度下水解厄他培南的能力,推薦0.1 g/L的厄他培南作為水解底物來檢測產KPC型腸桿菌科細菌。為了加快水解時間,有研究報道,添加NH4HCO3等促進水解酶活性物質從而提高腸桿菌科細菌KPC酶水解美羅培南的能力,將靈敏度從76%提高至98%[30]。
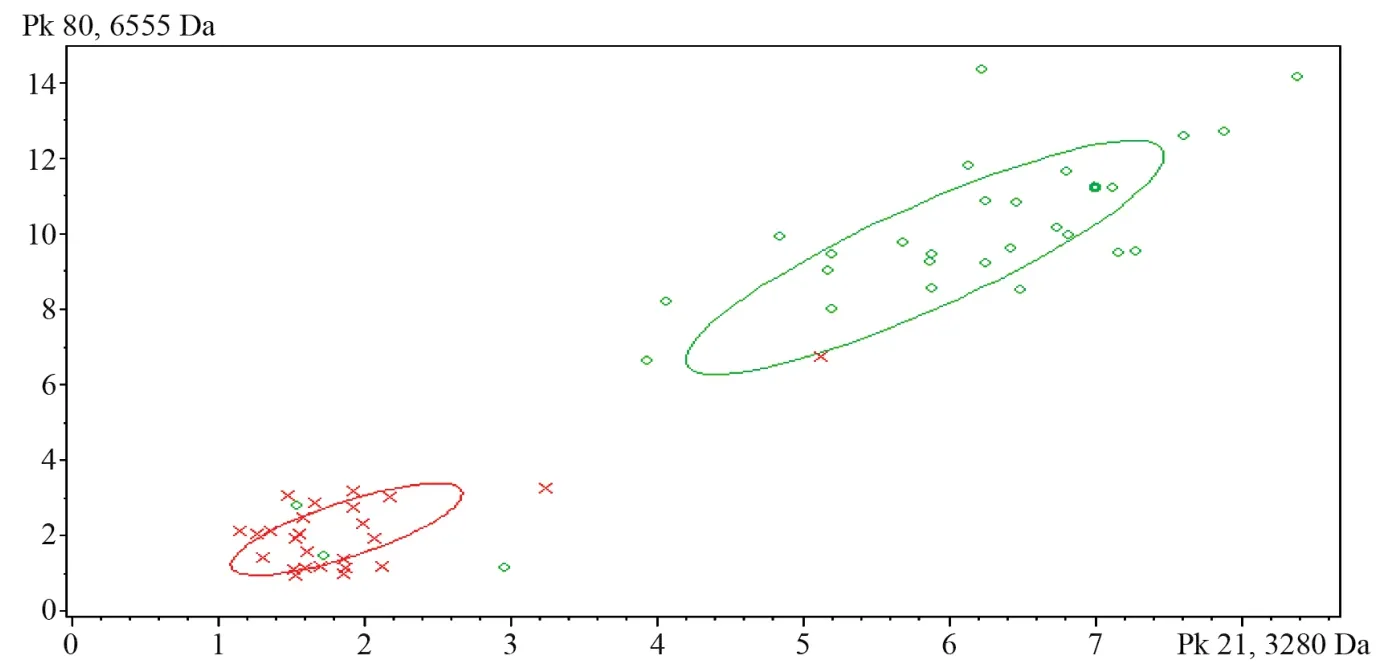
圖1 MRSA(紅色×)和MSSA(綠色○)的二維分析圖Figure 1 Two-dimensional profiling of MRSA (red×) and MSSA (green ○) isolates
圖2 MRSA(紅色峰)和MSSA(藍色峰)的區分Figure 2 The SuperSpectra of MRSA (red peaks) and MSSA (blue peaks)
2.3 曲線下面積法
2009年,Marinach等[31]發現白念珠菌在不同濃度氟康唑的壓力下,其表達的蛋白組分會發生改變,用MALDI-TOF MS能定性地表現出來。基于此原理,近2年興起一種確定細菌耐藥的新方法——曲線下面積法:細菌在含有抗生素的溶液中培養,敏感菌株會被抗生素抑制,細菌濃度大大降低,在質譜峰圖上有直觀的體現。根據孵育前后質譜峰曲線下面積的比值(cutoff值)來判斷細菌對該藥物是否耐藥,可定量得到細菌對該抗生素的MIC值,見圖3。2014年,Lange等[32]檢測108株肺炎克雷伯菌對碳青霉烯類藥物的敏感性,結果與E試驗相比,該方法靈敏度和特異度分別為97.3%和93.5%。2016年,Sparbier等[33]對大量藥物進行半定量的分析,包括青霉素類、頭孢菌素類、碳青霉烯類、氟喹諾酮類以及氨基糖苷類,該方法能夠快速測定抗生素對細菌的MIC值,鑒定與藥敏結果在短時間內完成。
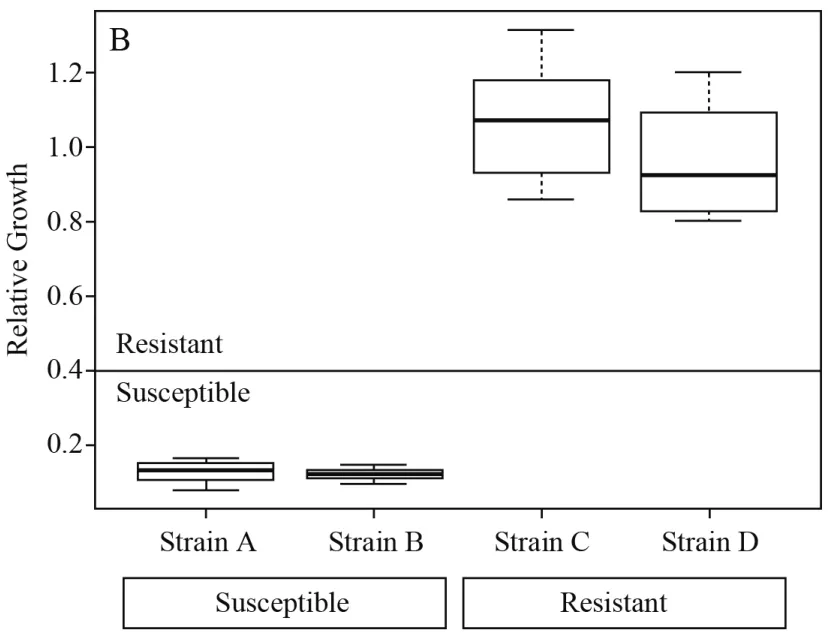
圖3 敏感株(A,B)與耐藥株(C,D)曲線下面積比值與cutoff值的比較Figure 3 Comparison of area ratio and cutoff value between the sensitive strains (A, B) and resistant strains (C, D)
2.4 其他方法
外膜蛋白缺失是導致細菌耐藥的另一重要原因,Cai等[34]首次采用質譜快速檢測外膜蛋白缺失引起碳青霉烯類耐藥的肺炎克雷伯菌,與SDSPAGE比較,MALDI-TOF MS具有快速、準確、直觀等優勢。Hu等[35]對外膜蛋白缺失的大腸埃希菌快速檢測,進一步驗證了質譜檢測外膜蛋白的可靠性。
近年來發展的耐藥快速檢測方法還包括采用核素標記生長培養基中特定氨基酸。細菌生長程度不同,培養基中核素標記的氨基酸消耗程度不同,通過檢測核素反映細菌的耐藥情況。目前研究采用這種方法檢測MRSA,孵育3 h甚至更少時間即可得到結果[36]。
質譜技術在耐藥性檢測中的應用已經顯示出巨大潛力,如能與培養后純菌落鑒定相結合,可將TAT時間縮短24~48 h,如與直接樣本檢測相結合,則可將報告臨床時間提早48~54 h。
3 MALDI-TOF MS在流行病學的應用研究
質譜除了對細菌耐藥的快速檢測外,還可用于聚類分析和主成份分析,為醫院感染和傳染性疾病的監測、防控提供方法。傳統的細菌同源性主要是采用多位點序列分型(MLST)、脈沖場凝膠電泳(PFGE)等分子生物學分析手段對細菌管家基因以及特異的限制性內切酶剪切后的DNA片段進行研究,質譜同源性分析主要是基于檢測細菌的蛋白質,因此在分型方法上與MLST和PFGE存在差異。2011年,首次采用質譜技術對金黃色葡萄球菌進行分型,通過13個特征峰,找到不同的CC群組與組之間的差異[37],見圖4。后續有研究者利用質譜對不同ST型的金黃色葡萄球菌ST17和ST1進行系統發育樹分析,結果顯示同一ST型之間菌株分布集中,不同ST型之間距離明顯[38]。黃永祿等[39]采用Biotyper MS對產ESBL大腸埃希菌最常見ST型ST131和ST405型進行聚類分析,兩組之間存在明顯分簇情況,靈敏度和特異度分別為97.9%和93.3%,VITEK MS通過建立SuperSpectra,對ST131和非ST131型大腸埃希菌采用自建數據庫并進行分析和驗證,得到兩者區分的靈敏度和特異度分別為86.6%和95.1%[40]。在小樣本量的比較中,MALDI-TOF MS分型結果與“金標準”PFGE分型情況完全相同,且具有更快速、成本更低的優勢。雖然質譜用于分型尚處于研究階段,但有希望成為一種新的快速分型方法。

圖4 MALDI分型與CC分型的聚類分析樹狀圖Figure 4 Dendrogram representation of hierarchical cluster analysis of the MALDI types and CC types
4 總結和展望
MADLI-TOF MS經過數十年的發展,為臨床微生物實驗室帶來了革命性的發展。其具有的快速、準確、靈敏、高通量等特點,加上操作簡單和低耗材的優勢在臨床微生物實驗室被推廣。現階段MADLI-TOF MS在微生物檢測中還存在很大的發展和提升空間,隨著技術的不斷發展,相信在不久的將來,一定會成為微生物常規工作的一大支柱。
[1]MARTINY D, BUSSON L, WYBO I, et al. Comparison of the Microflex LT and VITEK MS systems for routine identification of bacteria by matrix-assisted laser desorption ionization-time of flight mass spectrometry[J]. J Clin Microbiol, 2012, 50(4):1313-1325.
[2]LI Y, GU B, LIU G, et al. MALDI-TOF MS versus VITEK 2 ANC card for identification of anaerobic bacteria[J]. J Thorac Dis, 2014, 6(5): 517-523.
[3]HANDAL N, BAKKEN JORGENSEN S, SMITH TUNSJO H,et al. Anaerobic blood culture isolates in a Norwegian university hospital: identification by MALDI-TOF MS vs 16S rRNA sequencing and antimicrobial susceptibility profiles[J]. APMIS,2015, 123(9): 749-758.
[4]BADER O, WEIG M, TAVERNE-GHADWAL L, et al.Improved clinical laboratory identification of human pathogenic yeasts by matrix-assisted laser desorption ionization time-offlight mass spectrometry[J]. Clin Microbiol Infect, 2011, 17(9):1359-1365.
[5]BECKER PT, DE BEL A, MARTINY D, et al. Identification of filamentous fungi isolates by MALDI-TOF mass spectrometry:clinical evaluation of an extended reference spectra library[J].Med Mycol, 2014, 52(8): 826-834.
[6]ESPINAL P, SEIFERT H, DIJKSHOORN L, et al. Rapid and accurate identification of genomic species from theAcinetobacter baumannii(Ab) group by MALDI-TOF MS[J]. Clin Microbiol Infect, 2012, 18(11): 1097-1103.
[7]BRANDA JA, MARKHAM RP, GARNER CD, et al.Performance of the Vitek MS v2. 0 system in distinguishingStreptococcus pneumoniaefrom nonpneumococcal species of theStreptococcus mitisgroup[J]. J Clin Microbiol, 2013, 51(9):3079-3082.
[8]QUINLAN P, PHELAN E, DOYLE M. Matrix-assisted laser desorption/ionisation time-of-flight (MALDI-TOF) mass spectrometry (MS) for the identification of mycobacteria from MBBacT ALERT 3D liquid cultures and Lowenstein-Jensen (LJ)solid cultures[J]. J Clin Pathol, 2015, 68(3): 229-235.
[9]MEDIAVILLA-GRADOLPH MC, DE TORO-PEINADO I,BERMUDEZ-RUIZ MP, et al. Use of MALDI-TOF MS for identification of nontuberculousMycobacteriumspecies isolated from clinical specimens[J]. Biomed Res Int, 2015 : 854078.
[10]范欣,肖盟,徐志鵬,等. 國產基質輔助激光解吸電離飛行時間質譜系統Clin-TOF-Ⅱ MS與Bruker Biotyper質譜系統在革蘭陰性菌的鑒定效能評估[J]. 中華檢驗醫學雜志, 2017,40(1): 41-45.
[11]XIAO D, ZHAO F, ZHANG H, et al. Novel strategy for typingMycoplasma pneumoniaeisolates by use of matrix-assisted laser desorption ionization-time of flight mass spectrometry coupled with ClinProTools[J]. J Clin Microbiol, 2014, 52(8): 3038-3043.
[12]CHRISTNER M, ROHDE H, WOLTERS M, et al. Rapid identification of bacteria from positive blood culture bottles by use of matrix-assisted laser desorption-ionization time of flight mass spectrometry fingerprinting[J]. J Clin Microbiol, 2010, 48(5): 1584-1591.
[13]KLEIN S, ZIMMERMANN S, KOHLER C, et al. Integration of matrix-assisted laser desorption/ionization time-of-flight mass spectrometry in blood culture diagnostics: a fast and effective approach[J]. J Med Microbiol, 2012, 61(Pt 3): 323-331.
[14]KOHLMANN R, HOFFMANN A, GEIS G, et al. MALDITOF mass spectrometry following short incubation on a solid medium is a valuable tool for rapid pathogen identification from positive blood cultures[J]. Int J Med Microbiol, 2015, 305(4-5): 469-479.
[15]PROD'HOM G, BIZZINI A, DURUSSEL C, et al. Matrixassisted laser desorption ionization-time of flight mass spectrometry for direct bacterial identification from positive blood culture pellets[J]. J Clin Microbiol, 2010, 48(4): 1481-1483.
[16]SCHUBERT S, WEINERT K, WAGNER C, et al. Novel,improved sample preparation for rapid, direct identification from positive blood cultures using matrix-assisted laser desorption/ionization time-of-flight (MALDI-TOF) mass spectrometry[J]. J Mol Diagn, 2011, 13(6): 701-706.
[17]FERREIRA L, SANCHEZ-JUANES F, GONZALEZ-AVILA M, et al. Direct identification of urinary tract pathogens from urine samples by matrix-assisted laser desorption ionization-time of flight mass spectrometry[J]. J Clin Microbiol, 2010, 48(6):2110-2115.
[18]VERON L, MAILLER S, GIRARD V, et al. Rapid urine preparation prior to identification of uropathogens by MALDITOF MS[J]. Eur J Clin Microbiol Infect Dis,2015,34(9):1787-1795.
[19]NYVANG HARTMEYER G, KVISTHOLM JENSEN A, BOCHER S, et al. Mass spectrometry : pneumococcal meningitis verified andBrucellaspecies identified in less than half an hour[J]. Scand J Infect Dis, 2010, 42(9): 716-718.
[20]SEGAWA S, SAWAI S, MURATA S, et al. Direct application of MALDI-TOF mass spectrometry to cerebrospinal fluid for rapid pathogen identification in a patient with bacterial meningitis[J].Clin Chim Acta, 2014, 435 : 59-61.
[21]EDWARDS-JONES V, CLAYDON MA, EVASON DJ, et al. Rapid discrimination between methicillin-sensitive and methicillin-resistantStaphylococcus aureusby intact cell mass spectrometry[J]. J Med Microbiol, 2000, 49(3): 295-300.
[22]胡燕燕,蔡加昌,周宏偉,等. 基質輔助激光解吸/電離飛行時間質譜儀快速鑒別甲氧西林耐藥和甲氧西林敏感金黃色葡萄球菌的研究[J]. 中華微生物學和免疫學雜志, 2015, 35(1): 42-45.
[23]SHAN W, LI J, FANG Y, et al. Rapid identification of methicillin-resistantStaphylococcus aureus(MRSA) by the Vitek MS Saramis system[J]. Curr Microbiol, 2016 , 72(1):29-32.
[24]NAKANO S, MATSUMURA Y, KATO K, et al. Differentiation ofvanA-positiveEnterococcus faeciumfromvanA-negativeE.faeciumby matrix-assisted laser desorption/ionisation time-offlight mass spectrometry[J]. Int J Antimicrob Agents, 2014, 44(3): 256-259.
[25]LAU AF, WANG H, WEINGARTEN RA, et al. A rapid matrix-assisted laser desorption ionization-time of flight mass spectrometry-based method for single-plasmid tracking in an outbreak of carbapenem-resistantEnterobacteriaceae[J]. J Clin Microbiol, 2014, 52(8): 2804-2812.
[26]BURCKHARDT I, ZIMMERMANN S. Using matrix-assisted laser desorption ionization-time of flight mass spectrometry to detect carbapenem resistance within 1 to 2. 5 hours[J]. J Clin Microbiol, 2011, 49(9): 3321-3324.
[27]JUNG JS, POPP C, SPARBIER K, et al. Evaluation of matrix-assisted laser desorption ionization-time of flight mass spectrometry for rapid detection of beta-lactam resistance inEnterobacteriaceaederived from blood cultures[J]. J Clin Microbiol, 2014, 52(3): 924-930.
[28]HOYOS-MALLECOT Y, RIAZZO C, MIRANDA-CASAS C, et al. Rapid detection and identification of strains carrying carbapenemases directly from positive blood cultures using MALDI-TOF MS[J]. J MicrobiolMethods, 2014, 105 : 98-101.
[29]胡燕燕, 孫謙, 蔡加昌, 等. 基質輔助激光解析/電離飛行時間質譜儀檢測KPC型碳青霉烯酶的研究[J]. 中華微生物學和免疫學雜志, 2012, 32(6): 561-565.
[30]PAPAGIANNITSIS CC, STUDENTOVA V, IZDEBSKI R, et al. Matrix-assisted laser desorption ionization-time of flight mass spectrometry meropenem hydrolysis assay with NH4HCO3, a reliable tool for direct detection of carbapenemase activity[J]. J Clin Microbiol, 2015, 53(5): 1731-1735.
[31]MARINACH C, ALANIO A, PALOUS M, et al. MALDI-TOF MS-based drug susceptibility testing of pathogens: the example ofCandida albicansand fluconazole[J]. Proteomics, 2009, 9(20): 4627-4631.
[32]LANGE C, SCHUBERT S, JUNG J, et al. Quantitative matrix-assisted laser desorption ionization-time of flight mass spectrometry for rapid resistance detection[J]. J Clin Microbiol,2014, 52(12): 4155-4162.
[33]SPARBIER K, SCHUBERT S, KOSTRZEWA M. MBTASTRA: A suitable tool for fast antibiotic susceptibility testing?[J].Methods, 2016, 104 : 48-54.
[34]CAI JC, HU YY, ZHANG R, et al. Detection of OmpK36 porin loss inKlebsiellaspp. by matrix-assisted laser desorption ionization-time of flight mass spectrometry[J]. J Clin Microbiol,2012, 50(6): 2179-2182.
[35]HU YY, CAI JC, ZHOU HW, et al. Rapid detection of porins by matrix-assisted laser desorption/ionization-time of flight mass spectrometry[J]. Front Microbiol, 2015, 6 : 784.
[36]SPARBIER K, LANGE C, JUNG J, et al. MALDI biotyperbased rapid resistance detection by stable-isotope labeling[J]. J Clin Microbiol, 2013, 51(11): 3741-3748.
[37]WOLTERS M, ROHDE H, MAIER T, et al. MALDI-TOF MS fingerprinting allows for discrimination of major methicillinresistantStaphylococcus aureuslineages[J]. Int J Med Microbiol,2011, 301(1): 64-68.
[38]LARTIGUE MF, KOSTRZEWA M, SALLOUM M, et al.Rapid detection of "highly virulent" Group BStreptococcusST-17 and emerging ST-1 clones by MALDI-TOF mass spectrometry[J]. J MicrobiolMethods, 2011, 86(2): 262-265.
[39]黃永祿, 李佳萍, 顧丹霞, 等. 采用基質輔助激光解析電離飛行時間質譜快速檢測產KPC大腸埃希菌ST131和ST405分型的研究[J]. 中國感染與化療雜志, 2016, 16(4): 460-464.
[40]MATSUMURA Y, YAMAMOTO M, NAGAO M, et al.Detection ofEscherichia colisequence type 131 clonal group among extended-spectrum beta-lactamase-producingE. coliusing VITEK MS Plus matrix-assisted laser desorption ionizationtime of flight mass spectrometry[J]. J MicrobiolMethods, 2015,119: 7-9.
R378
A
1009-7708 ( 2017 ) 06-0703-06
10.16718/j.1009-7708.2017.06.018
浙江大學附屬第二醫院檢驗科, 杭州 310009。
張嶸(1972—),女,博士,主任技師,主要從事微生物方面研究。
張嶸,E-mail:brigitte_zx@163.com。
2017-02-27 修回日期:2017-06-20

