胰島素抵抗對小鼠哮喘模型氣道高反應性及肺部炎癥的影響
周寧娟,張 娟,馬婧一,郭 穎,湯麗萍,蘇 慧,孫 新*
(1第四軍醫大學西京醫院兒科,西安 710032;2西京醫院老年病科;*通訊作者,E-mail:sunxin6@fmmu.edu.cn)
胰島素抵抗對小鼠哮喘模型氣道高反應性及肺部炎癥的影響
周寧娟1,張 娟1,馬婧一1,郭 穎1,湯麗萍1,蘇 慧2,孫 新1*
(1第四軍醫大學西京醫院兒科,西安 710032;2西京醫院老年病科;*通訊作者,E-mail:sunxin6@fmmu.edu.cn)
目的 探討胰島素抵抗對小鼠哮喘模型氣道高反應性(AHR)及肺部炎癥的影響。 方法 3周齡C57BL/6J雄性小鼠60只隨機分為4組:正常對照組(HC)、哮喘組(NIRA)、胰島素抵抗組(IRNA)、胰島素抵抗+哮喘組(IRA),每組15只。HC組、NIRA組均給予普通飼料喂養;IRNA組、IRA組均給予高脂飼料喂養,共喂養9周后,計算各組小鼠穩態模型胰島素抵抗評價指數(HOMA-IR),評估胰島素抵抗程度;在小鼠胰島素抵抗模型建立成功后,NIRA組和IRA組小鼠給予卵清蛋白(OVA)致敏、激發,分別建立哮喘模型;HC組和IRNA組小鼠給予生理鹽水作為對照。末次激發24 h內,依次霧化吸入濃度為0,3,6,12,25,50,100 mg/ml Mch,測定氣道高反應性,制作肺病理切片,計數肺泡灌洗液中白細胞總數及分類,檢測血清和肺泡灌洗液(BALF)中相關炎性因子的含量,對各組小鼠氣道高反應性及炎性因子水平的變化情況進行統計學分析。 結果 與NIRA組相比,在吸入乙酰甲膽堿(Mch)濃度為12,25,50,100 mg/ml時,IRA組小鼠氣道阻力明顯升高(P<0.05);肺組織病理切片中,HC組、IRNA組小鼠肺組織無炎癥改變,NIRA組、IRA組炎細胞浸潤明顯,尤以IRA組更甚。與HC組比較,NIRA組、IRA組BALF中白細胞總數、嗜酸性粒細胞比例明顯增高(均P<0.01);血清中抗OVA特異性IgE和IgG1水平顯著升高(P<0.01或P<0.05);BALF中IL-4、IL-17的水平明顯升高(P<0.01或P<0.05),且IRA組明顯高于NIRA組(P<0.05);IFN-γ的水平明顯降低(P<0.05),且IRA組明顯低于NIRA組(P<0.05)。 結論 胰島素抵抗促進哮喘小鼠炎癥因子的釋放,加重肺部炎癥,增加氣道高反應性,加重哮喘的發生和發展。
胰島素抵抗; 哮喘; 氣道高反應性; 炎性因子
支氣管哮喘(bronchial asthma,BA)是一種以慢性氣道炎癥和氣道高反應性為特征的異質性疾病[1]。氣道高反應(airway hyperresponsiveness,AHR)又稱為支氣管高反應性,是指哮喘患者對多種刺激物的反應性異常增高,吸入刺激性物質后,更易出現支氣管平滑肌的收縮、黏液分泌增多及免疫炎性介質的釋放,氣道阻力急速短暫或較長時間的上升、肺通氣功能下降[2]。世界范圍內支氣管哮喘的發病呈逐年增高的趨勢,尤其是兒童[3],大量流行病學資料表明,兒童期肥胖是哮喘發病的一個重要危險因素,慢性炎癥導致機體代謝紊亂可能是導致其發生的原因,但具體作用機制尚不明確[4-6]。然而,近期有研究顯示肥胖不一定都能加重哮喘,只有在胰島素抵抗和(或)糖耐量調節異常的狀態下,才可能加重哮喘的發生,胰島素抵抗或代謝綜合征是發生肥胖哮喘的重要危險因素[7,8]。胰島素抵抗(insulin resistance,IR)是指機體胰島素作用的靶器官對胰島素作用的敏感性下降,即正常劑量的胰島素產生低于其正常生物學效應的一種狀態,可誘發心肺血管疾病、糖尿病、肥胖、血糖異常、血脂紊亂等疾病或生理紊亂狀態[9]。近年來研究發現胰島素抵抗、高胰島素血癥與支氣管哮喘的慢性炎癥狀態發生發展密切相關。相關的臨床研究表明,肺功能受損與糖尿病和血糖水平升高密切相關[10,11]。此外,流行病學調查表明:胰島素抵抗和高胰島素血癥與肺功能的下降密切相關[12,13]。IR在哮喘發生、發展中的作用越來越被重視,但是目前有關IR對肺功能以及肺部炎癥的動物實驗研究較少且差異很大。因此,本研究通過建立穩定的胰島素抵抗哮喘小鼠模型,探討胰島素抵抗對氣道高反應性及肺部炎癥的影響。
1 材料與方法
1.1 主要試劑與儀器
卵清蛋白(ovalbumin,OVA)(美國Sigma公司),高脂飼料:D12492(開源動物飼料有限公司),乙酰甲膽堿(acetyl-β-methylcholinechloride,Mch)(美國Sigma公司),氫氧化鋁(天津市天力化學試劑公司),IgE、IgG1、IL-4、IL-10、IL-17、INF-γ、小鼠胰島素酶聯免疫試劑盒(美國R&D Systems公司),小鼠肺功能儀(加拿大SCIREQ公司),空氣壓霧縮化器(歐姆龍大連有限公司),酶標分析儀(無錫華衛德郎儀器有限公司),超凈工作臺(蘇州凈化設備廠)。
1.2 實驗動物及飼料
3周齡SPF級雄性C57BL/6J小鼠60只[SCXK(軍)2012-0007],體質量(10.93±0.64)g,購自第四軍醫大學實驗動物中心,飼養于西京醫院實驗動物中心,恒定室溫(21-25 ℃),濕度50%-65%,光照10-12 h/d。飼料共兩種:為普通飼料和純化高脂飼料(D12492)。普通飼料熱量構成比為:脂肪10%,蛋白質24%,碳水化合物66%,總熱量為348 kcal/100 g,由第四軍醫大學實驗動物中心提供;高脂飼料熱量構成比為:脂肪60%,碳水化合物20%,蛋白質20%,總熱量為524 kcal/100 g,由開源動物飼料有限公司提供。飼養過程遵循西京醫院實驗動物中心動物保護和使用指南。
1.3 胰島素抵抗小鼠模型的建立

1.4 哮喘模型的建立
致敏:在確定胰島素抵抗模型成功后的第0,7,14天,NIRA組、IRA組采用含OVA[100 μg OVA+1.5 mg Al(OH)3]的生理鹽水配成的200 μl致敏液腹腔注射致敏。HC組、IRNA組采用僅含有Al(OH)3,不含OVA的生理鹽水200 μl腹腔注射,注射方法,部位相同。
激發:NIRA組、IRA組于第21-28天放在霧化箱中,用1%OVA霧化液連續霧化吸入激發8 d,每天1次,每次30 min,HC組、IRNA組用生理鹽水在相同條件下霧化激發,激發次數、持續時間相同。
1.5 肺氣道高反應性的測定
4組小鼠在末次霧化吸入激發24 h內,每組隨機取5只小鼠,在麻醉狀態下進行氣管插管,啟動小鼠肺功能儀FlexiVent軟件系統并進行校正,將插管成功的小鼠鏈接于Y型管,依次霧化吸入濃度為0,3,6,12,25,50,100 mg/ml Mch,每次間隔2 min,測定小鼠氣道總阻力(Rrs),記錄小鼠氣道阻力值。
1.6 血清的收集及BALF中白細胞計數及分類

1.7 肺組織病理學檢查
肺泡灌洗完畢后,暴露小鼠肺部,取小鼠左肺組織,將其固定在4 ml 4%多聚甲醛溶液中至少24 h,常規石蠟包埋、切片后進行HE染色,光鏡下觀察病理改變。
1.8 細胞因子的檢測
用酶聯免疫吸附試驗法(ELISA)檢測血清中抗OVA特異性IgE及IgG1水平;用ELISA法檢測肺泡灌洗液中IL-4、IL-10、IL-17、INF-γ的水平。
1.9 統計學分析

2 結果
2.1 小鼠體質量的比較
隨著飼養時間的延長,各組小鼠體質量逐漸增加,從第2周開始,與HC組相比,IRNA組、IRA組鼠體質量明顯增加(均P<0.01,見圖1)。第5周末,IRNA組、IRA組小鼠肥胖度均超過20%,可認為肥胖。

第2-14周IRNA組和IRA組與HC組比較均P<0.01圖1 各組小鼠體質量的變化 (n=15)Figure 1 Changes of the body weight in different groups (n=15)
2.2 小鼠空腹血糖、空腹胰島素、胰島素抵抗指數的比較
造模第9周末,分別測定4組小鼠FPG、FINS,采用穩態模式評估法計算HOMA-IR。IRNA組(2.82±0.30)和IRA組(2.89±0.37)HOMA-IR均>2.5(見表1),可確定胰島素抵抗模型建立成功。
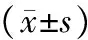


組別nFPG(mmol/L)FINS(mIU/L)HOMA?IR(mmol·mIU/L2)HC組15509±052325±044074±013NIRA組15499±043?327±046?073±012?IRNA組15785±056?808±075?282±030?IRA組15803±063?810±084?289±037?
與HC組比較,*P<0.05
2.3 哮喘急性發作癥狀
NIRA組、IRA組小鼠在霧化過程中均出現不同程度的煩躁或安靜少動、全身瘙癢、抓臉、呼吸加快、點頭呼吸、弓背直立、前肢縮抬、腹肌抽搐等哮喘速發相表現,HC組、IRNA組小鼠霧化過程中活動自如,無上述表現。
2.4 小鼠氣道高反應性
隨著吸入Mch濃度的增加,NIRA組、IRA組小鼠氣道阻力逐漸增高,HC組和IRNA組小鼠氣道阻力沒有明顯變化。與HC組相比,1.5,3,6,12,25,50,100 mg/ml Mch時NIRA組和IRA組小鼠氣道阻力明顯升高(P<0.05);與NIRA組相比,12,25,50,100 mg/ml Mch時IRA組小鼠氣道阻力明顯升高(P<0.05,見圖2)。
2.5 肺組織病理損害
HC組、IRNA組小鼠肺組織整體結構基本正常,肺泡無明顯萎縮或擴張,肺泡隔正常,組織無明顯炎癥細胞浸潤。NIRA組、IRA組可見細小支氣管及伴行血管周圍有較多的炎性細胞浸潤,IRA組炎癥細胞浸潤更明顯(如黑色箭頭所示,見圖3)。
2.6 支氣管肺泡灌洗液中白細胞總數及炎性細胞分類
與HC、IRNA組小鼠相比,NIRA、IRA組小鼠白細胞總數均明顯增多(P<0.01),主要表現為嗜酸粒細胞、中性粒細胞的增多;與NIRA組相比,IRA組小鼠白細胞總數增多更為明顯(P<0.01),其中嗜酸性粒細胞的增高更明顯(P<0.05,見圖4,5)。

與HC組比較,#P<0.05;與NIRA組相比,*P<0.05圖2 各組小鼠氣道阻力的變化Figure 2 The changes of Rrs in four groups

A.HC組 B.NIRA組 C.IRNA組 D.IRA組圖3 各組小鼠肺組織病理變化 (HE染色,×200)Figure 3 Pathological changes of lung tissues in each group (HE staining,×200)

與HC組比較,#P<0.01;與NIRA組相比,*P<0.01圖4 四組BALF中白細胞計數比較 (n=9)Figure 4 The total white blood cell count in the BALF in four groups (n=9)

與HC組比較,#P<0.01;與NIRA組相比,*P<0.05圖5 各組小鼠BALF中白細胞分類計數結果 (n=9)Figure 5 The defferential leukocyte counts in the BALF in four groups (n=9)
2.7 血清中抗OVA特異性IgE及IgG1水平
與HC組和IRNA組相比,NIRA組和IRA組小鼠血清中IgE(P<0.01)及IgG1(P<0.05)水平顯著升高,表明小鼠哮喘模型復制成功。與NIRA組相比,IRA組小鼠血清中IgE(P<0.01)及IgG1(P<0.05)水平升高更顯著,差異具有統計學意義(見圖6)。
2.8 小鼠肺泡灌洗液中IL-4、IL-17、INF-γ的濃度
與HC組和IRNA組相比,NIRA組和IRA組小鼠BALF中IL-4(P<0.01)、IL-17(P<0.05)的濃度明顯升高,而INF-γ的濃度明顯降低(P<0.05);與NIRA組相比,IRA組小鼠BALF中IL-4(P<0.01)、IL-17(P<0.05)的升高更明顯,INF-γ的降低更明顯(P<0.05,見圖7)。

與HC組比較,*P<0.05,**P<0.01圖6 小鼠血清抗OVA特異性IgE和IgG1水平 (n=9)Figure 6 The levels of serum OVA specific IgE and IgG1 in four groups (n=9)

與HC組比較,*P<0.05,**P<0.01;與IRNA組相比,#P<0.05,##P<0.01圖7 四組小鼠肺泡灌洗液中IL-4、IL-17、INF-γ的濃度 (n=9)Figure 7 The concentrations of IL-4,IL-17 and INF-γ in the BALF in four groups (n=9)
3 討論
哮喘是全球最常見的慢性疾病之一,據估計,全球大約3億人患有哮喘,每年約有25萬人死于哮喘[2]。哮喘是一種慢性氣道炎癥性疾病,氣道高反應性是支氣管哮喘肺功能最典型的病理生理特征之一。AHR的改善程度是評估哮喘治療效果的重要指標[17]。近年來,大量流行病學調查和研究顯示:存在胰島素抵抗、高胰島素血癥的患者,肺功能均受到不同程度的損傷[12,13]。胰島素抵抗已成為肥胖兒童哮喘發病增加的重要危險因素,但它們之間的作用機制尚不清楚。我們課題組研究的結果進一步證實了它們之間的相互作用,為進一步機制研究奠定基礎。在本次實驗中,隨著飼養時間的延長,各組小鼠體質量逐漸增加,第5周末,IRNA組、IRA組小鼠肥胖度均超過20%,然而,在第9周末時高脂飲食組(IRNA和IRA組)小鼠才出現胰島素抵抗,IRNA組(2.82±0.30)、IRA組(2.89±0.37)HOMA-IR值>2.5。結果表明:肥胖不一定伴有胰島素抵抗,這可能與肥胖持續的時間和程度有關。
眾多研究表明,體內Th1/Th2比例失調是導致哮喘發病的重要因素,在哮喘發病過程中Th1細胞功能降低,Th2細胞功能亢進[18]。Th1細胞主要分泌INF-γ等細胞因子,Th2細胞主要產生IL-4、IL-5及IL-13等細胞因子。其中,IFN-γ、IL-4分別是Th1和Th2細胞的特征性細胞因子,嗜酸性粒細胞是哮喘發病的關鍵效應細胞[19]。在本實驗中,經OVA致敏、激發,NIRA組和IRA組小鼠BALF中IL-4(P<0.01)、IL-17(P<0.05)的水平較HC組明顯升高,且IRA組明顯高于NIRA組(P<0.01);IFN-γ的水平明顯降低(P<0.05),且IRA組明顯低于NIRA組(P<0.05)。NIRA組和IRA組小鼠均出現不同程度的煩躁或安靜少動、全身瘙癢、抓臉、呼吸加快、點頭呼吸、弓背直立、前肢縮抬、腹肌抽搐等哮喘速發相表現,HC組和IRNA組小鼠活動自如,無上述表現。與HC組相比,NIRA組和IRA組小鼠血清中IgE(P<0.01)及IgG1(P<0.05)水平顯著升高;肺組織病理切片中炎癥細胞浸潤明顯,BALF中白細胞總數、嗜酸性粒細胞百分比明顯高于其他各組(P<0.01),且與NIRA組相比,IRA組上述表現更加顯著。這些實驗室結果表明與單純哮喘(NIRA)小鼠相比,胰島素抵抗哮喘(IRA)小鼠哮喘癥狀、體內炎性因子的改變更為顯著,證實了胰島素抵抗可能通過改變相關炎性因子的水平而加重氣道炎癥的產生,使氣管平滑肌收縮力增加,加重哮喘。
在測定小鼠氣道高反應性時,隨著吸入Mch濃度的增加,NIRA組、IRA組小鼠氣道阻力逐漸增高,而HC組、IRNA組小鼠氣道阻力沒有明顯變化。與HC組相比,在吸入Mch濃度為1.5,3,6、12,25,50,100 mg/ml時,NIRA組和IRA組小鼠氣道阻力明顯升高(均P<0.05),說明哮喘小鼠和胰島素抵抗哮喘小鼠的氣道高反應性明顯增高;與NIRA組相比,在吸入Mch濃度為12,25,50,100 mg/ml時,IRA組小鼠氣道阻力明顯升高(P<0.05),結果表明在吸入相同濃度的Mch時,胰島素抵抗哮喘小鼠的氣道高反應性增高更為顯著,進而說明存在胰島素抵抗可能會增加氣道高反應性,加重哮喘。
綜上所述,本實驗證實了肥胖不一定存在胰島素抵抗,這與肥胖持續的時間和程度有關;胰島素抵抗可以增加哮喘小鼠氣道高反應性;同時促進OVA誘導的小鼠哮喘模型中炎性因子IL-4、IL-17的釋放,降低IFN-γ的水平,加重氣道炎癥反應,進而加重哮喘。此次實驗為下一步研究胰島素抵抗和哮喘之間的發病機制奠定基礎。
[1] Horak F, Doberer D, Eber E,etal. Diagnosis and management of asthma-Statement on the 2015 GINA Guidelines[J]. Wien Klin Wochenschr, 2016, 128(15-16):541-554.
[2] Bateman ED, Hurd SS, Barnes PJ,etal. Global strategy for asthma management and prevention: GINA executive summary[J]. Eur Respir J, 2008, 31(1):143-178.
[3] Global Initiative for Asthma.Global strategy for asthma management and prevention[EB/OL]. http://ginasthma.org/2017-gina-report/wmsGINA-2017-main-report-final-V2.
[4] Beuther DA, Sutherland ER. Overweight, obesity, and incident asthma: a meta-analysis of prospective epidemiologic studies[J]. Am J Respir Crit Care Med, 2007, 175(7):661-666.
[5] Lang JE, Feng H, Lima JJ. Body mass index-percentile and diagnostic accuracy of childhood asthma[J]. J Asthma, 2009, 46(3):291-299.
[6] Ross KR, Hart MA, Storfer-Isser A,etal. Obesity and obesity related co-morbidities in a referral population of children with asthma[J]. Pediatr Pulmonol, 2009, 44(9):877-884.
[7] Zhang Y, Zhang J, Tian C,etal. The-308 G/A polymorphism in TNF-alpha gene is associated with asthma risk: an update by meta-analysis[J]. J Clin Immunol, 2011, 31(2):174-185.
[8] Karampatakis N, Karampatakis T, Galli-Tsinopoulou A,etal. Impaired glucose metabolism and bronchial hyperresponsiveness in obese prepubertal asthmatic children[J]. Pediatr Pulmonol, 2017, 52(2):160-166.
[9] Gast KB, Tjeerdema N, Stijnen T,etal. Insulin resistance and risk of incident cardiovascular events in adults without diabetes: meta-analysis[J]. PLoS One, 2012, 7(12):e52036.
[10] Walter RE, Beiser A, Givelber RJ,etal. Association between glycemic state and lung function: the Framingham Heart Study[J]. Am J Respir Crit Care Med, 2003, 167(6):911-916.
[11] Davis WA, Knuiman M, Kendall P,etal. Glycemic exposure is associated with reduced pulmonary function in type 2 diabetes: the Fremantle Diabetes Study[J]. Diabetes Care, 2004, 27(3):752-757.
[12] Lawlor DA, Ebrahim S, Smith GD. Associations of measures of lung function with insulin resistance and Type 2 diabetes: findings from the British Women's Heart and Health Study[J]. Diabetologia, 2004, 47(2):195-203.
[13] Engstrom G, Hedblad B, Nilsson P,etal. Lung function, insulin resistance and incidence of cardiovascular disease: a longitudinal cohort study[J]. J Intern Med, 2003, 253(5):574-581.
[14] Matthews D, Hosker J, Rudenski A,etal. Homeostasis model assessment:insulin resistance and B-cell function from fasting plasma glucose and insulin concentrations in man[J].Diabetologia,1985,2(8):412-419.
[15] Yeni-Komshian H, Carantoni M, Abbasi F,etal. Relationship between several surrogate estimates of insulin resistance and quantification of insulin-mediated glucose disposal in 490 healthy nondiabetic volunteers[J].Diabetes Care,2000,2(3):171-175.
[16] Jean PB, Veronique J, Pierre-Henri D. Modified quantitative insulin sensitivity check index is better correlated to hyperinsulinemic glucose clamp than other fasting-based index of insulin sensitivity in different insulin-resistant states[J].J Clin Endocrinol Metab,2003,88(10):4917-4923.
[17] Hospers JJ, Postma DS, Rijcken B,etal. Histamine airway hyper-responsiveness and mortality from chronic obstructive pulmonary disease: a cohort study[J]. Lancet, 2000, 356(9238):1313-1317.
[18] Wegmann M. Th2 cells as targets for therapeutic intervention in allergic bronchial asthma[J]. Expert Rev Mol Diagn, 2009, 9(1):85-100.
[19] Antoniu SA. Cytokine antagonists for the treatment of asthma: progress to date[J]. BioDrugs, 2009, 23(4):241-251.
Effectofinsulinresistanceonairwayhyperresponsivenessandpulmonaryinflammationinthemodelofinsulinresistanceasthma
ZHOU Ningjuan1,ZHANG Juan1,MA Jingyi1,GUO Ying1,TANG Liping1,SU Hui2,SUN Xin1*
(1DepartmentofPediatrics,XijingHospital,FourthMilitaryMedicalUniversity,Xi’an710032,China;2DepartmentofGeriatrics,XijingHospital;*Correspondingauthor,E-mail:sunxin6@fmmu.edu.cn)
ObjectiveTo explore the effects of insulin resistance on airway hyperresponsiveness(AHR) and pulmonary inflammation in the asthma mice.MethodsSixty 3-week-old specific pathogen free level male C57BL/6J mice were randomly divided into four groups: healthy control group(HC), non-insulin resistance asthmatic group(NIRA), insulin resistance non-asthmatic group(IRNA) and insulin resistance asthmatic group(IRA). The mice
a standard chow diet in HC group and NIRA group, and a high-fat diet(D12492) in IRNA group and IRA group. After feeding for 9 weeks, insulin resistance was assessed by homoeostasis model assessment-estimated insulin resistance(HOMA-IR). After insulin resistance mouse model was successfully established, the mice in NIRA group and IRA group were intraperitoneally sensitized and orally challenged with ovalbumin(OVA)respectively to induce allergic asthma, while the mice in HC group and IRNA group were treated with equal normal saline(NS)as control. In 24 h after the last challenge, the mice were successively given inhalation of 0, 3, 6, 12, 25, 50, 100 mg/ml Mch to detect the bronchial hyperreactivity and prepare lung tissue section for morphometrical lung analysis. Leukocyte and its subgroup populations in the bronchoalveolar lavage fluid(BALF) were counted, and the levels of inflammatory factors were detected.Changes of airway hyperresponsiveness and the levels of inflammatory cytokines were compared.ResultsCompared to NIRA group, AHR significantly increased at 12, 25, 50, 100 mg/ml in IRA group(P<0.05). There was no appreciable inflammatory cell infiltration in lungs in HC group and IRNA group. However, the inflammatory infiltration was obviously observed in both NIRA group and IRA group, especially IRA group. Compared to HC group, the number of total inflammatory cells and eosinophils increased in NIRA group and IRA group(P<0.01), OVA-specific IgE and IgG1 were also significantly elevated in NIRA group and IRA group(P<0.01 orP<0.05),Th2 cytokines(IL-4, IL-17) in the BALF were significantly increased in NIRA group and IRA group(P<0.01 orP<0.05), especially in IRA group,while the level of IFN-γ decreased in NIRA group and IRA group(P<0.05).ConclusionInsulin resistance can aggravate the occurrence and development of asthmais by promoting the release of inflammatory cytokines,increasing AHR, and promoting the airway remodeling.
insulin resistance; asthma; bronchial hyperreactivity; inflammatory cytokines
國家自然科學基金資助項目(81670449,31371151,31271219)
周寧娟,女,1985-02生,碩士,主治醫師,E-mail:zhounjqm@163.com
2017-07-18
R562.25
A
1007-6611(2017)11-1129-06
10.13753/j.issn.1007-6611.2017.11.009

