葡萄CIPK基因家族的鑒定表達分析
路志浩,霍建強,馬 鈺,胡 煒,毛 娟
(甘肅農業大學 園藝學院,蘭州 730070)
葡萄CIPK基因家族的鑒定表達分析
路志浩,霍建強,馬 鈺,胡 煒,毛 娟
(甘肅農業大學 園藝學院,蘭州 730070)
以水稻、玉米、擬南芥中已知CIPK基因注冊序列為基礎,從葡萄基因組數據庫中電子克隆出16條CIPK基因。對其理化性質分析表明,除 VvCIPK10編碼的251個氨基酸數目外,其余氨基酸數目基本穩定為300~470。整個CIPK家族的理論等電點為6~9。基因結構分析表明, VvCIPK01、 VvCIPK03、 VvCIPK04、 VvCIPK08、 VvCIPK09、 VvCIPK13包含外顯子數都大于10; VvCIPK02、 VvCIPK05、 VvCIPK06、 VvCIPK07、 VvCIPK10、 VvCIPK11、 VvCIPK12、 VvCIPK14、 VvCIPK15、 VvCIPK16包含外顯子數都小于7。聚類分析表明,CIPK基因被分為4個亞族,且在每一個亞族中都包含葡萄和擬南芥的CIPK基因家族成員,說明它們具有很高的同源性。對CIPK蛋白質的二級結構分析表明,葡萄CIPK基因家族所編碼的蛋白質均以α-螺旋和不規則卷曲為主,而β-轉角最少。亞細胞定位后發現, VvCIPK基因在細胞質中表達最多。對葡萄CIPK基因家族上游2 kb區域順式作用元件分析表明, VvCIPK13對于ABA和脫水脅迫的響應最為明顯,葡萄CIPK基因家族對于MYB轉錄因子和WRKY轉錄因子均有響應。 熒光定量分析表明, VvCIPK15在根中表達量最多,在莖中表達量最少;在不同處理下該基因表達差異性顯著。其中,受PEG、ABA、NaCl誘導后呈明顯上調表達,其表達量依次為PEGgt;NaClgt;ABA。同時該基因在受到高、低溫脅迫時表達量也有明顯上調,9個處理中只有在山梨糖中呈下調表達。推測該基因能夠參與調控干旱、鹽堿、低溫等逆境過程。
葡萄;CIPK家族;基因克隆;生物信息學分析;實時定量PCR
葡萄適應性很強,葡萄果實中含有白藜蘆醇和多酚等重要營養或藥用成分[1]。甘肅土壤的鹽漬化與干旱以及冬季的絕對低溫是制約葡萄面積擴展的主要因素之一。因此,有關葡萄抗逆性的研究對于擴大葡萄栽培面積以及提高葡萄品質具有重要的意義。
鈣調磷酸酶B類似蛋白的互作蛋白激酶CIPK(CBL-interacting protein kinase)是作為下游蛋白與活化的鈣調磷酸酶B類似蛋白CBL(Calcineurin B-like proteins)相互作用的一類蛋白[2]。二者的相互作用能將植物Ca2+信號傳遞下去,而Ca2+作為細胞內重要的第二信使,在植物對抗各種非生物脅迫的防御機制中起著重要的作用[3-4]。研究表明,CIPK基因家族編碼蛋白廣泛參與植物的逆境脅迫應答和生長發育調控。非生物脅迫因子,如干旱、高鹽和低鉀等都能引起植物CIPK基因的上調表達。目前,對CIPK基因功能的研究主要集中在擬南芥[5]、水稻[6]和玉米[7]中。研究表明,擬南芥CIPK23編碼蛋白在鉀離子代謝中有重要作用。當植物受到低鉀脅迫時,CBL和 CIPK23相偶聯,共同調控鉀離子的運輸。這個途徑已經在擬南芥、水稻、白楊和葡萄中被確定[8-12]。另外,近幾年中對于CBL-CIPK信號轉導系統的研究也越發深入[13]。研究表明通過 AtCBL1、AtCBL9和 AtCIPK23共同作用后,鉀離子運輸通道將被激活,以此來調節植物對鉀的吸收[9,14]。同時,也有研究提出,CBL可以和PP2C蛋白直接結合,從而去除CIPK的抑制[15]。最近幾年,隨著大規模植物基因組測序的完成,在楊樹、豌豆和苜蓿等植物中對CIPK基因的研究也越來越深入。目前,葡萄基因組測序已完成(http://www.genoscope.cns.fr/externe/Genome Browser/Vitis/),但對葡萄中CIPK基因家族的研究還未見報道。
因此,本研究利用生物信息學技術,從葡萄基因組庫中進行CIPK基因家族的電子克隆,將得到的 VvCIPK基因進行染色體定位、理化性質分析、二級結構預測、亞細胞定位、順式作用元件分析、motif序列分析、同源序列分析以及聚類分析等,同時通過qRT-PCR實時熒光定量技術對逆境脅迫下該基因家族的功能進行鑒定,明確該基因家族在葡萄抗逆中的作用。
1 材料與方法
1.1 材 料
提取RNA所用材料為甘肅農業大學保存的葡萄試管苗‘寶石無核(Gem Seedless)’。
1.2 方 法
1.2.1 葡萄CIPK基因家族成員鑒定 從已知的文獻中可以得到25個擬南芥(Arabidopsisthaliala)的CIPK基因ID;30個水稻(Oryzasativa)的CIPK基因ID;43個玉米(Zeamays)的CIPK基因ID。在NCBI中分別輸入所有的基因號獲得每一條基因對應的CDS與Full-length的序列(http://www.ncbi.nlm.nih.gov)。將獲得的CDS輸入到葡萄(Vitisvinifera)基因庫中,將長度大于1 000 bp的序列保留下來。為了避免重復需要對獲得的所有序列進行篩選(使用的工具:DNAMAN)。在葡萄基因庫獲取已知序列的基因號、CDS長度、氨基酸數目、等電點、分子量大小等理化性質數據(http://www.genoscope.cns.fr/cgi-bin/blast_server/projet_ML/blast.pl)。采用WoLF PSORT進行亞細胞定位(http://www.genscript.com/wolf-psort.html)。
1.2.2 葡萄CIPK基因家族進化及結構分析 利用MEGA 5.0軟件和clustalx.exe分析蛋白系統進化關系,采用GSDS進行基因結構分析(http://gsds.cbi.pku.edu.cn/)[16],用http://meme-suite.org/tools/meme進行motif序列分析[17],并在http://meme-suite.org/tools/meme中進行蛋白質二級結構的預測。
1.2.3 葡萄CIPK基因家族表達及其啟動子上游2 kb順式元件分析 根據所得的基因序列提交至PLACE統計分析轉錄因子及逆境相關順式作用元件數量(http://www.dna.affrc.go.jp/PLACE/signalscan.html),主要記錄的對象有MYB轉錄因子、WRKY轉錄因子、ABA響應元件、脫水響應元件以及低溫響應元件。
1.2.4 材料處理 將‘寶石無核’葡萄芽的莖段接于MS培養基上,分別置于LED白光(WLED424.724 nm,459 nm)下培養35 d后,選取長勢一致的試管苗用于處理,脅迫處理組為:-4 ℃、4 ℃、25 ℃、40 ℃、400 mmol/L NaCl質量分數為10% PEG、400 mmol/L 甘露醇、400 mmol/L山梨糖、50 μmol/L ABA,每個處理設置3組重復,處理時長24 h;以25 ℃處理作為對照。同時以莖為對照,檢測根、莖、葉中的表達情況。以上所有植物材料均被立即投入-80 ℃液氮中保存至RNA提取。
1.2.5 實時熒光定量PCR 參照申鵬等[18]方法提取試管苗莖葉混合RNA、試管苗根部RNA、試管苗莖部RNA、試管苗葉片RNA。由 VvCIPK基因家族的CDS序列在Primer Premier 5中設計引物(表1)。引物由上海生工生物工程技術服務有限公司合成。cDNA合成用Prime Script RT reagent Kit(Perfect Real Time) 試劑盒(TaKaRa)。反轉錄產物在-20 ℃下保存,備用。
實時熒光定量PCR(real-time fluorescent quantitative polymerase chain reaction,qRT-PCR),應用Bio-Rad iCycler iQ實時定量PCR儀,用設計的引物進行PCR 擴增,以葡萄UBQ 基因為內參[19],對 VvCIPK基因家族進行特異性表達分析。擴增體系含1 μL cDNA,上下游引物各 0.8 μL,10.4 μL 反應 MIX,7 μL ddH2O,總體系 20 μL。反應程序為 :95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s,共40個循環;反應結束后分析熒光值變化曲線。試驗重復3 次,數據采用Excel 軟件分析。
2 結果與分析
2.1 葡萄CIPK基因家族編碼蛋白理化性質分析
在NCBI中分別輸入水稻、玉米、擬南芥的基因號,獲得每一條基因對應的CDS序列(http://www.ncbi.nlm.nih.gov)。將獲得的水稻、玉米、擬南芥的CDS序列輸入到葡萄基因庫中,將長度大于1 000 bp的序列保留下來。為了避免重復,使用DNAMAN對獲得的所有序列進行篩選,共得到16條 VvCIPK基因。與水稻、玉米、擬南芥相比,葡萄CIPK基因在數量上均少于上述3種模式作物。對電子克隆出的葡萄CIPK基因家族的16條基因分別命名為 VvCIPK01、 VvCIPK02、 VvCIPK03、 VvCIPK04、 VvCIPK05、 VvCIPK06、 VvCIPK07、 VvCIPK08、 VvCIPK09、 VvCIPK10、 VvCIPK11、 VvCIPK12、 VvCIPK13、 VvCIPK14、 VvCIPK15、 VvCIPK16。玉米中有43個CIPK基因,但只有26個含有FL-cDNA,而在 VvCIPK基因家族中均有FL-cDNA。 VvCIPK01與 VvCIPK07分布于5號染色體上, VvCIPK02與 VvCIPK03分布于6號染色體上, VvCIPK14與 VvCIPK15分布于8號染色體上, VvCIPK11與 VvCIPK16分布于9號染色體上, VvCIPK05與 VvCIPK12分布于10號染色體上, VvCIPK04、 VvCIPK06與 VvCIPK13分布于11號染色體上, VvCIPK08分布于18號染色體上, VvCIPK09分布于15號染色體上, VvCIPK10分布于13號染色體上(圖1)。對蛋白質理化性質分析表明, VvCIPK10編碼的氨基酸數目為251個,其余 VvCIPK基因家族成員編碼的氨基酸數目為300~470,整體小于玉米中CIPK所編碼的氨基酸數目。 VvCIPK家族的理論等電點均分布在6~9,酸性氨基酸有5個,分別是: VvCIPK01、 VvCIPK03、 VvCIPK08、 VvCIPK12、 VvCIPK13。 VvCIPK基因家族成員的序列長度各不相同, VvCIPK04序列最長且包含14個外顯子, VvCIPK06的序列最短且僅包含3個外顯子。 VvCIPK02、 VvCIPK06、 VvCIPK10和 VvCIPK16外顯子數目最少,均含有3個; VvCIPK05、 VvCIPK07、 VvCIPK11、 VvCIPK14和 VvCIPK15均含有4個外顯子,除 VvCIPK12有 7個外顯子外,其余 VvCIPK基因上的外顯子個數均大于10(表2)。

表1 VvCIPK基因家族表達分析的實時熒光定量引物Table 1 qRT-PCR primers for expression on analysis of VvCIPKs
2.2葡萄CIPK基因家族多序列比對及其進化分析
對 VvCIPK基因家族進行多序列比對分析發現: VvCIPK基因家族在C端和N端的均不保守。 VvCIPK10編碼的氨基酸序列長度最小(圖2)。為進一步了解葡萄CIPK蛋白的系譜發生及功能特征,本研究對葡萄CIPK基因家族編碼的氨基酸序列與已經鑒定出的擬南芥、水稻、玉米的CIPK基因家族編碼氨基酸序列進行了聚類分析。結果表明,所有的氨基酸序列被分成4個亞族。第一亞族(GroupⅠ)包含27個基因序列,其中6個基因來自葡萄,9個基因來自擬南芥,其余12個基因來自水稻和玉米,其中 VvCIPK03的親緣關系和水稻CIPK基因親緣關系相近,其余5個 VvCIPK基因均與擬南芥CIPK基因關系相近;第2亞族(GroupⅡ)包含19個基因序列,其中3個基因來自葡萄,8個基因來自擬南芥,其余8個基因來自水稻和玉米,其中 VvCIPK01與水稻CIPK親緣關系相近,其余2個 VvCIPK基因與擬南芥CIPK關系相近;第3亞族(GroupⅢ)包含20個基因序列, 其中6個基因來自葡萄,6個基因來自擬南芥,其余8個基因來自水稻和玉米,該亞族中包含的所有 VvCIPK基因都和擬南芥CIPK基因親緣關系相近;第4亞族(GroupⅣ)包含9個基因,1個基因來自葡萄,2個基因來自擬南芥,其余6個基因來自水稻和玉米,該亞族中的 VvCIPK基因和水稻CIPK親緣關系相近(圖3)。所以整體上 VvCIPK基因與AtCIPK基因同源性高,說明該基因在進化上比較保守。

圖1 葡萄 CIPK基因在染色體上的分布Fig.1 The distribution of CIPK genes in grape chromosome
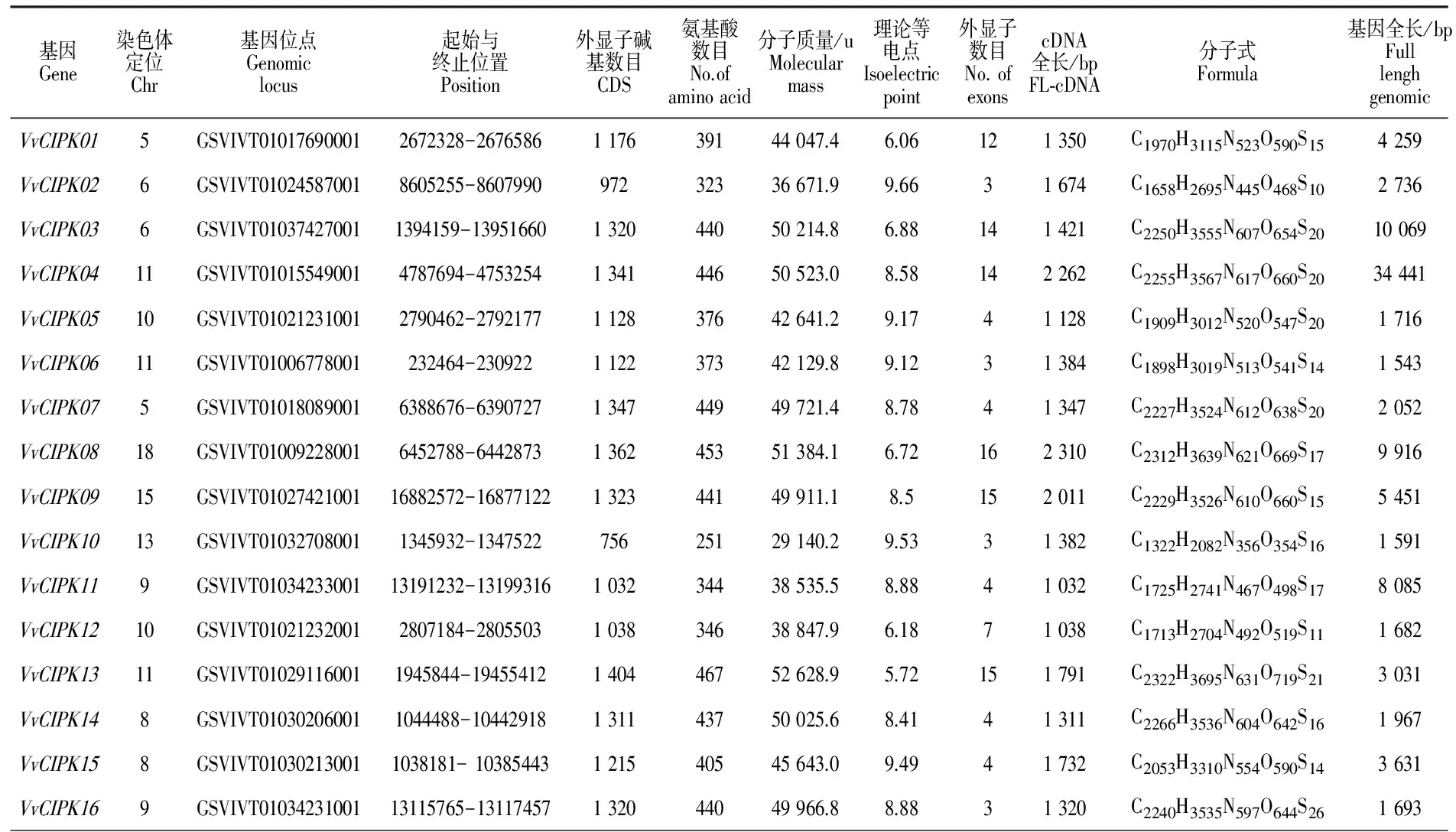
表2 葡萄 CIPK基因理化性質Table 2 The physical and chemical property of VvCIPK
2.3 葡萄CIPK基因家族基因結構分析
VvCIPK基因家族結構分析表明,該基因家族分為2組,一組包含外顯子個數小于7,另一組包含外顯子個數均大于10。外顯子個數小于7的基因有: VvCIPK02、 VvCIPK05、 VvCIPK06、 VvCIPK07、 VvCIPK10、 VvCIPK11、 VvCIPK12、 VvCIPK14、 VvCIPK15和 VvCIPK16。外顯子個數大于10的基因有: VvCIPK01、 VvCIPK03、 VvCIPK04、 VvCIPK08、 VvCIPK09和 VvCIPK13。 VvCIPK基因家族外顯子長度保守性差,沒有顯著規律(圖4)。
2.4 葡萄CIPK基因家族Motif序列分析
Motif分析表明:在 VvCIPK基因家族中共找到25個motif序列,結合聚類樹分析和基因結構分析結果可以將 VvCIPK01、 VvCIPK03、 VvCIPK04、 VvCIPK08、 VvCIPK09、 VvCIPK16和 VvCIPK13分為一組,這些序列上共有的motif排列順序為motif4、motif3、motif9、motif1、motif2、motif7、motif10和motif8,同時除 VvCIPK01以外,其余6條基因均聚到第1亞族內(GroupⅠ),但 VvCIPK01的外顯子分類又和 VvCIPK03、 VvCIPK04、 VvCIPK08、 VvCIPK09和 VvCIPK13相似。故推測這7條基因執行的功能相近。motif16到motif25這10個motif序列都只分布在葡萄CIPK基因家族中的某2個成員上,motif16只存在于 VvCIPK05和 VvCIPK11中,motif20只存在于 VvCIPK10和 VvCIPK13中,motif18只存在于 VvCIPK02和 VvCIPK12中,motif19只存在于 VvCIPK04和 VvCIPK16。但是分布的位置卻差異很大,故推測這些motif發揮功能的時間以及協作表達的蛋白上有可能存在差異(圖5)。

圖3 擬南芥、水稻、玉米和葡萄CIPK基因進化樹Fig.3 The phylogenetic tree using the CIPK full length amino acid sequence from grape Arabidopsis, rice and maize
2.5葡萄CIPK基因家族亞細胞定位和蛋白質二級結構分析
亞細胞定位結果表明,除了 VvCIPK09外,葡萄CIPK基因家族在細胞質中均有表達;除了 VvCIPK06外,葡萄CIPK基因家族在葉綠體內均有表達。 VvCIPK01、 VvCIPK02分別只在過氧化物酶體和細胞骨架中表達。在高爾基體中表達的基因有 VvCIPK03和 VvCIPK09;在細胞基質中表達的基因有 VvCIPK10和 VvCIPK12(表3)。
葡萄CIPK基因家族編碼蛋白質的二級結構主要有α-螺旋、β-轉角與不規則卷曲。二級結構分析表明: VvCIPK基因家族編碼的16條蛋白主要以α-螺旋和不規則卷曲為主(表4)。
2.6葡萄CIPK基因啟動子上游2kb順式作用元件分析
為了確定 VvCIPK基因家族啟動子上游2 kb 區域的順式作用元件,在該基因家族起始密碼子上游2 kb堿基序列中進行搜索,結果表明: VvCIPK基因家族成員都含有MYB轉錄因子和WRKY轉錄因子,但是ABRE、DRE和LTRE則有很大不同。在 VvCIPK基因家族中,除 VvCIPK02、 VvCIPK10、 VvCIPK11、 VvCIPK12、 VvCIPK16其余均含有ABRE響應元件; VvCIPK06、 VvCIPK12、 VvCIPK13、 VvCIPK14、 VvCIPK15中含有DRE。 VvCIPK13在ABRE和DRE上的響應均最高。 VvCIPK11和 VvCIPK16只含有MYB與WRKY轉錄因子(表5)。

圖4 葡萄CIPK基因家族的基因結構Fig.4 Gene structures of CIPK in grape

圖5 葡萄CIPK 基因家族motif分析Fig.5 Grape CIPK gene family motif analysis
2.7 葡萄 CIPK15基因的實時定量分析
結果表明:除 VvCIPK15外,其余15個基因在根、葉、莖中的表達量基本一致,并且在不同脅迫處理下的表達量沒有顯著性差異。 VvCIPK15在根、葉、莖中的表達差異性顯著。其中,莖中的表達量最少,根中的表達量最高,是對照的1.38倍(以莖為對照),并且在根和葉中均呈上調表達(圖6)。 VvCIPK15在不同處理下,基因的表達情況:只有在400 mmol/L山梨糖處理24 h后呈下調表達,其余各個處理下, VvCIPK15呈上調表達。經過質量分數為10% PEG處理24 h后 VvCIPK15的相對表達量最高,是對照的5.24倍(以25 ℃為對照);經過400 mmol/L NaCl處理24 h后 VvCIPK15的相對表達量是對照的4.90倍;經過50 μmol/L ABA處理24 h后 VvCIPK15的相對表達量是對照的4.49倍。同時,在-4 ℃、4 ℃和40 ℃經24 h處理后,該基因均呈上調表達,說明 VvCIPK15也受高、低溫脅迫誘導表達。故推測, VvCIPK15受高鹽、干旱和溫度脅迫的誘導,同時還受ABA的強烈誘導(圖7)。

表3 葡萄 CIPK基因亞細胞定位預測Table 3 Subcellular location prediction of CIPK gene in grape

表4 葡萄CIPK蛋白二級結構分析Table 4 The secondary structure of CIPK protein sequence in grape %

表5 VvCIPK基因上游2 kb區域順式作用元件的分布Table 5 Putative Cis-elements existed in the 2 kb upstream region of VvCIPK genes

圖6 葡萄 CIPK15 基因在不同器官中的表達Fig.6 The relative expression of VvCIPK15 gene in different organs

1.-4 ℃;2.4 ℃;3.25 ℃;4.400 mmol/L NaCl;5.40 ℃;6.400 mmol/L甘露醇400 mmol/L mannitol;7.400 mmol/L山梨糖 400 mmol/L sorbose;8.10%PEG;9.50 μmol/L ABA
圖7葡萄CIPK15基因在不同處理下的表達
Fig.7VvCIPK15geneexpressionunderdifferenttreatment
3 討 論
植物在不斷進化的過程中發展出一套應對各種非生物逆境的保護機制,這些逆境包括干旱、寒冷、高鹽、高溫和氧化等等。在這些不利因素下,植物可以通過啟動相關基因及改變蛋白結構等來保護細胞內的各種新陳代謝反應,從而維持植物體結構與功能的完整性[20]。有研究表明CBL-CIPK信號系統在各種逆境響應中起到了重要的作用[21]。
本試驗共得到16條葡萄CIPK基因,分別命名為 VvCIPK01~ VvCIPK16,其所處的位置、大小均有差異。與水稻、玉米、擬南芥CIPK基因家族包含基因個數相比,葡萄CIPK基因家族包含基因個數少于上述3種植物。本試驗依據進化結果將葡萄CIPK基因家族分為4個亞族。進化分析結果顯示: VvCIPK01、 VvCIPK03與水稻CIPK和玉米CIPK同源性高, VvCIPK07和水稻CIPK同源性高, VvCIPK基因家族的其他成員均與擬南芥CIPK基因家族同源性高。 ZmCIPK21基因組含有14個外顯子和13個內含子,蛋白結構上具有CIPK所共有的C端NAF保守結構域[22], VvCIPK01中有12個外顯子,故 VvCIPK01和 ZmCIPK21都屬于多外顯子的CIPK序列,并且 VvCIPK01的蛋白結構上C端具有NAF保守結構域。 ZmCIPK03與 VvCIPK03對比結果與 VvCIPK01和 ZmCIPK21對比結果相似,都屬于CIPK基因中多外顯子一類,并且均含有NAF保守結構域[23]。故推測聚類樹中與葡萄CIPK同源性高的基因在內部結構上具有相似性。在外顯子的分布上,葡萄、擬南芥、水稻、玉米、楊樹CIPK基因的外顯子都可以分為多外顯子和少外顯子2類。表明CIPK基因的進化比較早,這2個分支的祖先在單、雙子葉分化之前就已經存在于植物的基因組中[24-26]。對 VvCIPK編碼的蛋白質進行二級結構預測,發現他們以α-螺旋和不規則卷曲為主。這和甘蔗中CIPK編碼蛋白的二級結構在組成上有相似之處,都是以α-螺旋和不規則卷曲為主[27]。在對 VvCIPK表達部位進行預測后發現,它們大多數在細胞質和葉綠體中表達。但是CIPK基因家族在野大麥中的表達部位則主要聚集在細胞膜和細胞核上[28]。本試驗對啟動子上游2 kb順式作用元件分析發現: VvCIPK基因家族成員對于ABA、高鹽、干旱均有響應,其中,ABA響應最為強烈,干旱響應最弱。故推測該基因家族在逆境誘導下會有響應。
已有研究表明,植物CIPK基因在逆境脅迫中有重要作用。同時,干旱或者高鹽引起的脅迫信號至少通過ABA依賴和ABA不依賴的2條途經轉導[29]。本試驗熒光定量結果表明 VvCIPK15受ABA、PEG、NaCl以及低溫脅迫的誘導較強,說明該基因可能與干旱或滲透脅迫有關并且依賴ABA途徑。 ZmCIPK03、ZmCIPK42以及其他玉米CIPK基因家族成員對于PEG、NaCl以及低溫脅迫均會有不同程度的上調表達,但不是所有玉米CIPK基因家族成員的表達都依賴ABA途徑[7,22,30]。水稻CIPK基因家族也受ABA、高鹽、干旱、低溫等逆境誘導表達[6]。這一結果與本研究中葡萄 CIPK15的表達情況相似。說明 VvCIPK基因家族很可能在逆境響應中起到重要的作用。
Reference:
[1] 房經貴,章 鎮,陶建敏,等.江蘇發展葡萄的條件和策略[J].中外葡萄與葡萄酒,2001(3):7-8.
FANG J G,ZHANG ZH,TAO J M,etal.Conditions and strategy of development of grape in Jiangsu[J].GrapeandWineinChinaandForeignCountries,2001(3):7-8( in Chinese).
[2] 張俊文,魏建華,王宏芝,等.CBL-CIPK信號系統在植物應答逆境脅迫中的作用與機制[J].自然科學發展,2008,18(8):847-856.
ZHANG J W,WEI J H,WANG H ZH,etal.Functions and action mechanisms of CBL-CIPK signaling system in plants response treatment stress[J].DevelopmentofNaturalScience,2008,18(8):847-856( in Chinese).
[3] 趙晉鋒,余愛麗,王高鴻,等.植物CBL/CIPK網絡系統逆境應答研究進展[J].中國農業科技導報,2011,13(4):32-38.
ZHAO J F,YU A L,WANG G H,etal.Progress of CBL/CIPK signal system in response to stresses in plant[J].JournalofAgriculturalScienceandTechnology,2011,13(4):32-38(in Chinese with English abstract).
[4] 賈 如,雷夢琦,徐佳妮,等.植物細胞中鈣通道的分布及其在植物抗逆機制中作用的研究進展[J].植物生理學報,2014,50(12):1791-1800
JIA R,LEI M Q,XU J N,etal.Research progress of Ca2+channel and the effect of Ca2+on plant resistancemechanism in plant cells[J].PlantPhysiologyJournal,2014,50(12):1791-1800(in Chinese with English abstract) .
[5] NER K,STEFAN W,DRAGICA B,etal.Calcium sensors and their interacting protein kinases:genomics of the arabidopsis and rice CBL-CIPK signaling networks[J].PlantPhysiology,2004,134(1):43-58.
[6] YONG X,YUE M H,XIONG L Z.Characterization of stress-responsiveCIPKgenes in rice for stress tolerance improvement[J].PlantPhysiology,2007,144(1):1416-1428.
[7] XI F C,GU Z M,XIN D D,etal.Identification and characterization of putativeCIPKGenes in maize[J].JournalofGeneticsandGenomics,2011,38(2):77-87.
[8] 王 毅,武維華.植物鉀營養高效分子遺傳機制[J].植物學報,2009,44(1):27-36.
WANG Y,WU W H.Molecular genetic mechanism of high efficient potassium up take in plants[J].ChineseBulletinofBotany,2009,44(1):27-36(in Chinese with English abstract).
[9] CHEONG Y H,PANDEY G K,GRANT J J,etal.Two calcineurin B-like calcium sensors,interacting with protein kinase CIPK23,regulate leaf transpiration and root potassium uptake inArabidopsis[J].PlantJournal,2007,52(2):223-239.
[10] CULIAR T,PASCAUD F,VERDEIL J L,etal.A grapevine Shaker inward K+channel activated by the calcineurin B-like calcium sensor 1-protein kinase CIPK23 network is expressed in grape berries under drought stress conditions[J].PlantJournal,2010,61(1):58-69.
[11] 張成偉,王天宇,黎 裕.植物中CBL-CIPK途徑轉導特異Ca2+信號的分子機制[J].植物遺傳資源學報,2010,11(4):462-468,473.
ZHANG CH W,WANG T Y,LI Y.Molecular mechanisms of transducting specific calcium signal in CBL-CIPK pathway in plant[J].JournalofPlantGeneticResources,2010,11(4):462-468,473(in Chinese with English abstract).
[12] LI J,LONG Y,QI G N,etal.The Os-AKT1 channel is critical for K+uptake in rice roots and is modulated by the rice CBL1-CIPK23 complex[J].PlantCell,2014,26(8):3387-3402.
[13] 湯湖斌,閔康康,徐玲玲,等.CBL-CIPKs信號系統的研究進展[J].中國細胞生物學學報,2015,37(1):100-105.
TANG H B,MIN K K,XU L L,etal.Research progress in CBL-CIPKs signaling system [J].ChineseJournalofCellBiology,2015,37(1):100-105(in Chinese with English abstract).
[14] XU J,LI H,CHEN L,etal.A protein kinase,interacting with two calcineurin B-like proteins,regulates K+transporter AKT1 inArabidopsis[J].Cell,2006,125(7):1347-1360.
[15] LAN W,LEE S C,CHE Y,etal.Mechanistic analysis of AKT1 regulation by the CBL-CIPK-PP2CA interactions[J].MolecularPlant,2011,4(3):527-536.
[16] ZHANG Z B,ZHANG J W,CHEN Y J,etal.Genome-wide analysis and identification of HAK potassium transporter gene family in maize(ZeamaysL.)[J].MolecularBiologyReports,2012,39(8):8465-8473.
[17] BAILEY T L,BODEN M,BUSKE F A,etal.MEME SUITE:toolsfor motif discovery and searching[J].NucleicAcidsResearch,2009,37(8):202-208.
[18] 申 鵬,陳佰鴻.葡萄不同生育期總 RNA 提取及 SSH 建立[D].蘭州:甘肅農業大學,2013.
SHEN P,CHEN B H.Extraction of total rna in different growth periods of grapevine and construction of suppression subtractive hybridization[D].Lanzhou:Gansu Agricultural University,2013( in Chinese with English abstract).
[19] 許 明, 伊恒杰, 趙 帥,等. 顯齒蛇葡萄實時熒光定量PCR內參基因的篩選與驗證[J].中草藥,2017,48(6):1192-1198.
XU M,YI H J,ZHAO SH,etal.Screening and validation of reference genes for quantitative RT-PCR analysis in Ampelopsis grossedentata[J].ChineseTraditionalandHerbalDrugs,2017,48(6):1192-1198(in Chinese with English abstract).
[20] 李 琳,柳參奎.SnRK蛋白激酶家族及其成員SnRK2的功能[J].分子植物育種,2010,8(3):547-555.
LI L,LIU SH K.The SnRK protein kinase family and the function of SnRK2 protein kinase[J].MolecularPlantBreeding,2010,8(3):547-555(in Chinese with English abstract).
[21] 沈金秋,鄭仲仲,潘偉槐,等.植物CBL-CIPK信號系統的功能及其作用機理[J].植物生理學報,2014,50(4):641-650.
SHEN J Q,ZHENG ZH ZH,PAN W H,etal.Functions and action mechanisms of CBL-CIPK signaling system in plants[J].PlantPhysiologyJournal,2014,50(4):641-650(in Chinese with English abstract).
[22] 陳勛基,李建平,郝曉燕,等.玉米 ZmCIPK21基因的克隆與分析[J].核農學報,2012,26(6):862-867.
CHEN X J,LI J P,HAO X Y,etal.Cloning and chara cterization of amaize ZmCIPK21 gene[J].JournalofNuclearAgriculturalSciences,2012,26(6):862-867(in Chinese with English abstract).
[23] 袁志恒,申騰飛,王 琦,等.玉米CIPK3 蛋白激酶的克隆及表達分析[J].河南農業大學學報,2012,46(4):359-369.
YUAN ZH H,SHEN T F,WANG Q,etal.Cloning and expression analysis of a CBL-interacting protein kinase of maize[J].JournalofHenanAgriculturalUniversity,2012,46(4):359-369(in Chinese with English abstract).
[24] 陳析豐,顧志敏,劉 峰,等.生物與非生物脅迫下水稻CIPK基因的鑒定分析[J].中國水稻科學,2010,24(6):567-574.
CHEN X F,GU ZH M,LIU F,etal.Molecular analysis of rice CIPKs involved in biotic and abiotic stress responses[J].ChinaJournalRiceScience,2010,24(6):567-574(in Chinese with English abstract).
[25] YU Y H,XIA X L,YIN W L,etal.Comparative genomic analysis ofCIPKGene family inArabidopsisand populus[J].PlantGrowthRegulation,2007,52(2):101-110.
[26] KOLUKISAOGLU U,WEINL S,BLAZEVIC D,etal.Calcium sensors and their interacting protein kinases:Genomics of theArabidopsisand rice CBL-CIPK signaling networks[J].PlantPhysiology,2004,134(1):43-58.
[27] 黃 瓏,蘇煒華,張玉葉,等.甘蔗CIPK基因的同源克隆與表達[J].作物學報2015,41(3):499-506.
HUANG L,SU W H,ZHANG Y Y,etal.Cloning and expression analysis ofCIPKgene in sugarcane[J].ActaAgronomicaSinica,2015,41(3):499-5061(in Chinese with English abstract).
[28] 李率帥,闞國仕,魏建華,等.野大麥CIPK基因的亞細胞定位[J].遼寧農業科學,2011(4):1-5.
LI SH SH,KAN G SH,WEI J H,etal.The subcellular localization of CIPK fromHordeumbrevisubulatum[J].LiaoningAgriculturalSciences,2011(4):1-5(in Chinese with English abstract).
[29] ANGELO D C,WEINl S,BATISTIC O,etal.Altrnative complex formation of the Ca+-regulated protein kinase CIPK1 controls abscisic acid dependent and independent stress responses inArabidopsis[J].PlantJournal,2006,48(6):857-872.
[30] 陳勛基,陳 果,邵 琳,等.玉米 ZmCIPK42克隆及逆境脅迫后表達特異性分析[J].分子植物育種,2013,11(3):326-331.
CHEN X J,CHEN G,SHAO L,etal. ZmCIPK42 cloning and its specific expression profiles under stress in maize[J].MolecularPlantBreeding,2013,11(3):326-331(in Chinese with English abstract).
CorrespondingauthorMAO Juan,female, Ph.D,associate professor. Research area:biotechnology of fruit trees.E-mail:maojuan@gsau.edu.cn
(責任編輯:潘學燕Responsibleeditor:PANXueyan)
Genome-wideIdentificationandExpressionAnalysisoftheCIPKGeneFamilyinGrape
LU Zhihao,HUO Jianqiang,MA Yu,HU Wei and MAO Juan
(College of Horticulture, Gansu Agricultural University, Lanzhou 730070,China)
This work was based on known genes of rice, maize and arabidopsis. A total of 16 members of this family were identified in grape genome. Analyzing their physical and chemical properties revealed all of the genes of amino acid number distribute on 300-470 but VvCIPK10 which has 251 amino acid. Theoretical isoelectric point of the whole genes distributed on 6-9.Analyzing structure of genes indicated that a part of exon of VvCIPK were more than 10( VvCIPK01, VvCIPK03, VvCIPK04, VvCIPK08, VvCIPK09 and VvCIPK13), the others were less than 7( VvCIPK02, VvCIPK05, VvCIPK06, VvCIPK07, VvCIPK10, VvCIPK11, VvCIPK12, VvCIPK14, VvCIPK15 and VvCIPK16).Phylogenetic analysis indicated that all the proteins fell into four major clusters, and every cluster contained a part of genes of grape and arabidopsis. It indicated high homology relationship of those genes.Analyzing the secondary structure of VvCIPK protein sequence indicated that most ratio were alpha helix and irregular curly, the ratio of beta angle was the least. The whole genes chief expressed in cytoplasm by using subcellular location prediction. Analysis Cis-elements in the 2 kb upstream region indicated that the response of ABA and drought stress in VvCIPK13 was the most. Meanwhile the response of MYB and WRKY in VvCIPK were existence. Real-time quantitative analysis revealed that the expression of VvCIPK15 was the most in root. Meanwhile the expression of VvCIPK15 existed large difference under the different treatment.The inducible expression level of VvCIPK15 was significantly up-regulated under the PEG, NaCl, ABA stress. The expression was the most under the treatment of PEG. Second was NaCl. Third was ABA. The inducible expression level of VvCIPK15 was also significantly up-regulated under high or low temperature stress. This gene was only down-regulated in sorbose. VvCIPK15 may play a significance role in the process of drought,salt,cold and so on.
Grape; CIPKs gene family; Gene clone; Bioinformatic analysis; Real-time PCR
2016-06-08
2016-10-15
Student Research Training Program of Nation in Gansu Agricultural University(No.201510733005);the National Natural Science Foundation of China(No.31460500).
LU Zhihao,male,bachelor student.Research area:biotechnology of fruit trees. E-mail:1790665627@qq.com
日期:2017-11-17
網絡出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20171117.1101.018.html
2016-06-08
2016-10-15
甘肅農業大學國家級大學生科技創新項目(201510733005);國家自然科學基金(31460500)。
路志浩,男,在讀本科生,研究方向為果樹生物技術。E-mail: 1790665627@qq.com
毛 娟,女,博士,副教授,研究方向為果樹生物技術。E-mail: maojuan@gsau.edu.cn
S663.1
A
1004-1389(2017)11-1619-12

