漆酶與ABTS間的結合模式與作用機制研究
陶國翔,李愛秀*,張 敏,劉子泉
(1.武警后勤學院基礎部藥物設計實驗室,天津300309;2.武警后勤學院科研部,天津300309;3.武警后勤學院附屬醫院 全軍災害應急救援醫學重點實驗室,天津300162)
漆酶與ABTS間的結合模式與作用機制研究
陶國翔1,李愛秀1*,張 敏2,劉子泉3
(1.武警后勤學院基礎部藥物設計實驗室,天津300309;2.武警后勤學院科研部,天津300309;3.武警后勤學院附屬醫院 全軍災害應急救援醫學重點實驗室,天津300162)
選擇常見的電子轉移介質2,2′-連氮基-雙(3-乙基-苯并二氫噻唑啉-6-磺酸)(ABTS)為研究對象,通過探究漆酶與ABTS之間的結合模式,在分子水平上揭示兩者的相互作用機制,為發掘漆酶新介質、拓寬漆酶應用范圍奠定理論基礎。首先,基于分子對接建立變色栓菌漆酶-ABTS復合物模型;然后,與枯草芽孢桿菌漆酶-ABTS復合物晶體結構進行對比,綜合兩復合物結合特點,在分子水平上闡明漆酶與ABTS間的作用機制。結果表明,ABTS結構中的富電子基團深入活性位點,且靠近電子接收位點組氨酸;漆酶活性位點內多個中性氨基酸與ABTS發生疏水作用,穩定結合構象;最終在漆酶作用下ABTS生成陽離子中間體發揮介導作用。
漆酶;ABTS;漆酶-ABTS體系;分子對接;作用機制
漆酶(laccase,EC1.10.3.2)作為一種含銅氧化酶,主要存在于真菌、細菌、植物或昆蟲的分泌物中[1-2],其中真菌漆酶由于穩定性強、產量大、氧化電勢高等優勢,其理化性質得到深入研究,目前已有100種真菌漆酶得到純化,38個真菌漆酶晶體結構得到解析[3]。其中,變色栓菌漆酶是真菌漆酶中高產優良品種,常作為研究漆酶結構和功能的首選。在蛋白質數據庫(PDB)中有關變色栓菌漆酶的晶體結構編號為1KYA和1GYC,其中1KYA為變色栓菌漆酶內嵌配體的晶體結構,有助于確定漆酶結合位點及底物活性構象,為研究漆酶-底物間的結合模式與作用機制提供重要參考。
漆酶通過所含銅離子與底物之間的電子傳遞實現了對酚類、芳香胺類等漆酶天然底物的催化氧化[4]。研究發現,在漆酶催化體系中加入一種小分子“介質”(mediator),兩者共同構成“漆酶-介質體系(laccase mediator system,LMS)”[5],在LMS中,介質充當漆酶與底物之間電子傳遞的“電子梭”,減少漆酶與底物間空間阻礙,并間接提高漆酶氧化電勢,從而提升電子傳遞效率,實現了漆酶對更多底物的催化氧化,拓寬了作用底物范圍,同時提高了催化效率[6]。
高活性化合物2,2′-連氮基-雙(3-乙基-苯并二氫噻唑啉-6-磺酸)(ABTS)是漆酶的特殊底物,也是使用最廣泛的介質之一[7],這是由于ABTS在漆酶作用下的氧化產物較ABTS穩定性更強,可通過測定氧化產物的含量最終確定漆酶的活性[8]。作為介質,ABTS充當“電子梭”在漆酶和底物之間發揮電子傳遞作用,最終使底物降解。ABTS用于LMS的首次報道是漆酶-ABTS體系對紙漿中殘余木質素的降解[5],該體系對木質素的高效降解實現了對這類可再生資源的高值化利用[9];工業中,漆酶-ABTS體系可高效降解廢水中的含氮雜環化合物[10-11];農業中,漆酶-ABTS體系可對土壤、水體、大氣中殘留的有機磷酸酯農藥進行降解[12]。漆酶-ABTS體系對多種底物的催化降解,在多個領域發揮著重要作用,但是ABTS具有一定毒性和刺激性,且合成成本較高,限制了它的進一步應用,對漆酶-ABTS體系的深入研究,揭示分子機制并發掘新介質,有助于克服其自身缺陷,進一步開發LMS的應用潛力。
目前,已有研究者提出在漆酶作用下ABTS電子轉移的變化過程[13]:ABTS被氧化后分兩步失去電子最終生成陽離子ABTS2+,在ABTS2+的介導下漆酶實現對底物的催化降解,見圖1。但是,變色栓菌漆酶與ABTS分子間的結合模式及其相互作用機制尚不清楚。作者通過分子對接技術建立變色栓菌漆酶-ABTS復合物,并與已解析的枯草芽孢桿菌漆酶-ABTS晶體結構進行對比[14],驗證變色栓菌漆酶-ABTS復合物的合理性并探究其分子作用機制,為漆酶結構改造、發現新介質等奠定理論基礎。

圖1 ABTS電子轉移機制示意圖Fig.1 The schematic diagram of electron transfermechanism of ABTS
1 實驗
1.1 技術平臺
本研究所有計算在PC機上進行,利用分子模擬與分子設計軟件包(molecula operating environment,MOE 2009)完成。
1.2 漆酶和介質結構
真菌漆酶結構來源于變色栓菌漆酶-底物復合物晶體結構(PDB編號:1KYA),將1KYA漆酶晶體結構導入MOE軟件包,刪除雜原子、溶劑分子、配體分子等,保留漆酶A鏈,在Amber99力場下,采用Protonate 3D模塊對其加氫加電荷,作為漆酶初始構象[15]。細菌漆酶結構來源于枯草芽孢桿菌漆酶-ABTS復合物晶體結構(PDB編號:3ZDW)。
介質ABTS結構使用MOE-Build模塊繪制,并在Conformation search模塊下進行構象搜索,保留最低能量構象為對接初始構象。
1.3 研究方法
在MOE-Dock模塊下進行分子對接,以變色栓菌漆酶配體為中心,配體5 ?范圍內氨基酸構成的疏水區域為對接位點,設置力場為MMFF94x,放置函數為Triangle Mather,打分函數為London dG,優化函數為Forcefield,對接完成后,選取介質分子及對接位點氨基酸,在MMFF94x力場下進行能量優化[16]。
2 結果與討論
2.1 漆酶與ABTS的結合模式與作用機制
漆酶與ABTS相互作用示意圖見圖2。
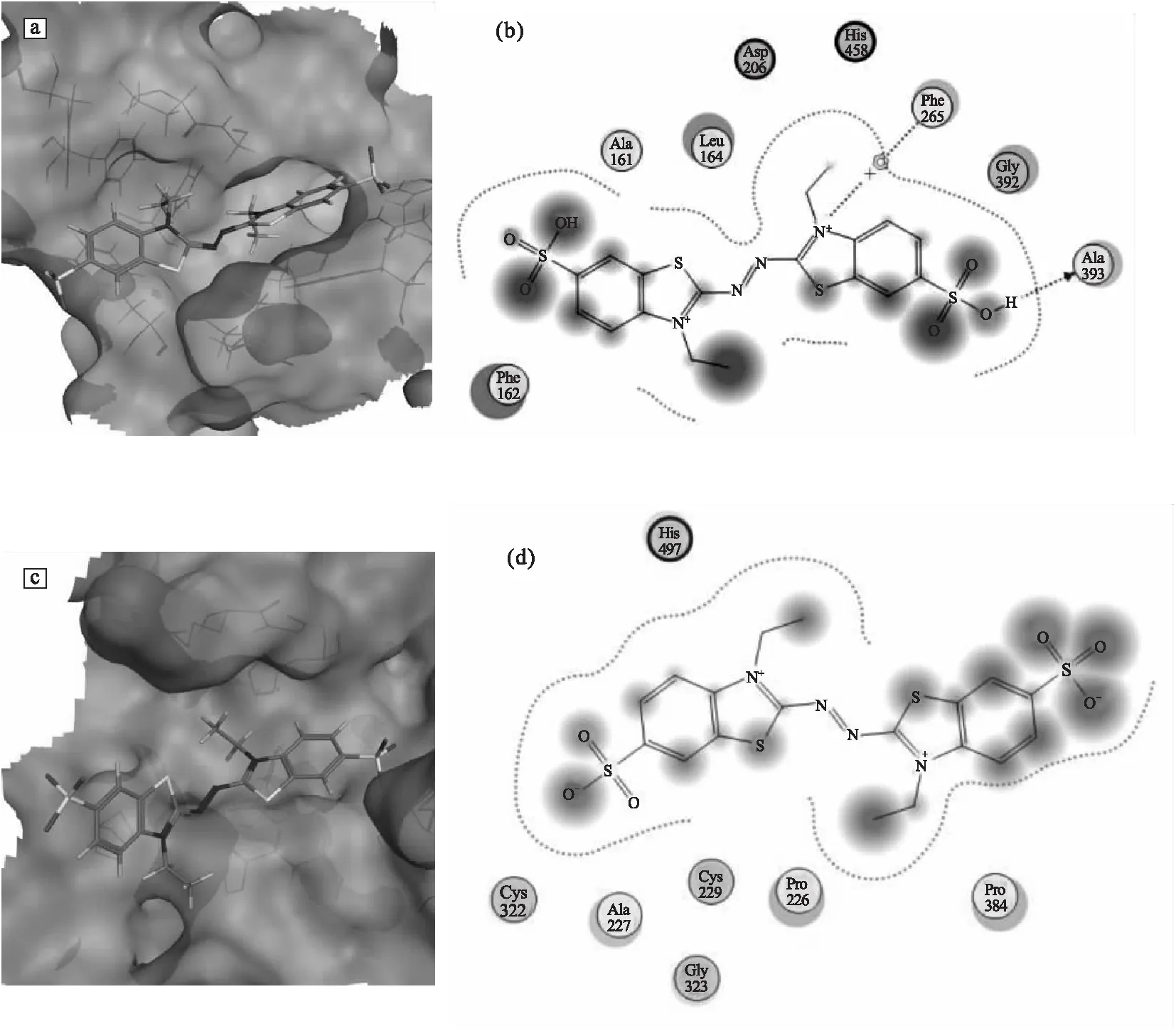
a.變色栓菌漆酶-ABTS的3D結合模式 b.變色栓菌漆酶-ABTS的2D相互作用 c.枯草芽孢桿菌漆酶-ABTS的3D結合模式 d.枯草芽孢桿菌漆酶-ABTS的2D相互作用圖2 漆酶與ABTS相互作用示意圖Fig.2 The schematic diagram of interaction between laccase and ABTS
從分子對接得到變色栓菌漆酶-ABTS的3D結合模式圖(圖2a)可知,ABTS結構中連氮基和與其相連的噻唑環深入到活性位點中,磺酸基暴露在活性位點外。從變色栓菌漆酶-ABTS的2D相互作用(圖2b)進一步觀察發現,ABTS失去電子后的ABTS2+與漆酶活性位點中的Ala161、Phe162、Leu164、Phe265、Gly392和Ala393產生疏水作用,并且介質中間體氮陽離子與Phe265產生π-陽離子相互作用。堿性氨基酸His458作為電子受體接收來自介質的電子,與酸性氨基酸Asp206共同維持體系pH值穩定。
來自細菌的枯草芽孢桿菌漆酶內嵌ABTS的復合物晶體結構已得到解析,晶體結構中漆酶與ABTS間的結合模式能較好地體現相互作用時的特點。利用MOE軟件包圖形顯示功能得到枯草芽孢桿菌漆酶-ABTS的3D結合模式(圖2c),該漆酶活性位點空腔淺而寬,ABTS結構中富含電子的連氮基和與其相連的噻唑環呈現“U”型形狀深入活性位點內部,該結合模式利于ABTS與漆酶間的電子傳遞。從枯草芽孢桿菌漆酶-ABTS的2D相互作用(圖2d)發現,漆酶活性位點內的中性氨基酸Pro226、Ala227、Cys229、Cys322、Gly323和Pro384與ABTS發生疏水作用。
通過對比兩個復合物結合模式發現,ABTS結構中富含電子的連氮基和與其相連的噻唑環均深入到漆酶活性位點,這種結合模式有助于ABTS與漆酶發生電子傳遞,漆酶-ABTS的2D相互作用圖證實了以上推斷,ABTS在漆酶作用下發生電子傳遞后生成ABTS2+。漆酶-ABTS相互作用過程中,漆酶活性位點內的中性氨基酸和堿性氨基酸組氨酸在二者相互作用過程中發揮重要作用。
2.2 討論
我們在前期研究另外一種機制的介質——氫轉移介質時,已建立了得到驗證的漆酶-介質對接模型[17]。本研究采取相同的對接參數得到變色栓菌漆酶-ABTS復合物。在該復合物中ABTS與漆酶結合穩定,且結合構象與復合物晶體結構中ABTS的結合構象相似;其中,漆酶-ABTS相互作用的氨基酸類型、數目、強度等與復合物晶體結構中漆酶-ABTS相互作用特點相似。可以看出,復合物在漆酶-ABTS結合穩定性、ABTS結合構象和氨基酸相互作用方面與復合物晶體結構均表現出相似的結合特點,也進一步說明所建立的變色栓菌漆酶-ABTS復合物模型是可靠的。
綜合漆酶-ABTS復合物和復合物晶體結構3ZDW的結合模式分析發現,漆酶與ABTS相互作用時,ABTS結構中的連氮基和噻唑環靠近活性位點的電子受體組氨酸His458/His497,可順利完成電子傳遞;活性位點的中性氨基酸與ABTS產生較強的疏水作用,穩定了ABTS與漆酶之間的結合構象,在中性氨基酸的疏水作用下,ABTS發生電子傳遞,生成陽離子中間體,該陽離子中間體在漆酶與底物之間發生電子傳遞起到介導催化反應的作用。
前期研究還發現,氫轉移介質與漆酶產生作用的關鍵是酸性氨基酸Asp206與介質中的供氫基團之間的氫鍵作用[17],而本研究的電子轉移介質ABTS并不與漆酶活性位點中的酸性氨基酸產生氫鍵作用,起主導作用的氨基酸為活性位點內的中性氨基酸和組氨酸。由此可見,介質在生成介質中間體過程中遵循不同反應機制的介質與漆酶發生相互作用時,起主導作用的氨基酸類型是不同的。
3 結論
通過分子對接得到變色栓菌漆酶-ABTS復合物模型,并與枯草芽孢桿菌漆酶-ABTS復合物晶體結構作對比,發現二者結合模式相似,從中總結出電子轉移介質ABTS與漆酶之間的結合模式與作用機制,提出了不同介導機制的介質與漆酶反應時,起主導作用的氨基酸的差異。主要表現在,漆酶-ABTS相互作用時,富含電子的基團深入漆酶活性位點中,該基團接近電子接收位點組氨酸利于發生電子傳遞,ABTS與漆酶活性位點中的中性氨基酸發生疏水作用,維持了ABTS與漆酶相互作用時構象的穩定,這對于反應的發生起到關鍵作用。
[1] UPENDRA N,PRIYANKA S,VEDA P,et al.Structure-function relationship among bacterial,fungal and plant laccase[J].Journal of Molecular Catalysis B:Enzymatic,2011,68:117-128.
[2] 于孟蘭,倪金鳳.昆蟲漆酶的研究進展[J].生物加工過程,2014,12(1):80-85.
[3] CLAUDIA M,EDWIN D,RAUL A,et al.Fungal laccase[J].Fungal Biology Reviews,2013,27:67-82.
[4] 羅爽,謝天,劉忠川,等.漆酶/介體系統研究進展[J].應用與環境生物學報,2015,21(6):987-995.
[5] BOURBONNAIS R,PAICE M G.Oxidation of non-phenolic substrates:an expanded role for laccase in lignin biodegradation[J].FEBS Letters,1990,267(1):99-102.
[6] 陶國翔,李愛秀,羅力,等.漆酶-介質體系中介質的研究進展及應用[J].解放軍預防醫學雜志,2017,35(1):65-68.
[7] GALLI C,MADZAK C,VADALA R,et al.Concerted electron/proton transfer mechanism in the oxidation of phenols by laccase[J].ChemBioChem,2013,14:2500-2505.
[8] 張鵬.以ABTS為底物測定漆酶活力的方法[J].印染助劑,2007,24(1):43-45.
[9] 邱衛華,陳洪章.木質素的結構、功能及高值化利用[J].纖維素科學與技術,2006,14(1):52-59.
[10] 王玲,陳旺生,鮑欣,等.共基質體系下漆酶介體系統降解氮雜環化合物的研究[J].環境污染與防治,2012,34(4):54-57.
[11] 詹琪,廖紅福,張敏,等.漆酶催化復合染料酸性黑ATT脫色的研究[J].環境科學學報,2014,34(5):1236-1241.
[12] MARIE T L,CLAUDE J,MARIE T F,et al.Application of laccase-mediator system (LMS) for the degradation of organophosphorus compounds[J].Chemico-Biological Interaction,2010,187:393-396.
[13] TAKUMI S,YUMI S,HIROSHI K,et al.Comparison of a series of laccase mediators in the electro-oxidation reactions of non-phenolic lignin model compounds[J].Electrochimica Acta,2013,106:440-446.
[14] FRANCISCO J,DAVID M,MARTINS R,et al.Substrate and dioxygen binding to the endospore coat laccase fromBacillussubtilis[J].The Journal of Biological Chemistry,2004,279(22):23472-23476.
[15] 吳瓊,康宏,王歡歡,等.AT1受體的中藥活性成分篩選模型及其作用機理研究[J].化學學報,2012,70(6):796-802.
[16] 陶國翔,李愛秀,劉子泉,等.木質素降解產物用于漆酶-介質體系的結構理論研究[J].化學與生物工程,2017,34(4):28-33.
[17] 陶國翔,李愛秀,封加棟,等.基于分子對接技術研究漆酶與介質間的結合模式與相互作用機制[J].化學與生物工程,2016,33(12):42-47.
BindingModeandInteractionMechanismofLaccaseandABTS
TAO Guo-xiang1,LI Ai-xiu1*,ZHANG Min2,LIU Zi-quan3
(1.DrugDesignLaboratoryoftheBasicScienceDepartment,LogisticsUniversityofChinesePeople′sArmedPoliceForce,Tianjin300309,China;2.ScientificResearchDepartment,LogisticsUniversityofChinesePeople′sArmedPoliceForce,Tianjin300309,China;3.KeyLaboratoryofDisasterandEmergencyRescueMedicine,AffiliatedHospitalofLogisticsUniversityofChinesePeople′sArmedPoliceForce,Tianjin300162,China)
In order to find new mediators and provide a theoretical basis for further study on extending the application scope of laccase,we selected the electron transfer mediator—2,2′-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid)(ABTS) as an object to reveal the binding mode and interaction mechanism at the molecular level between laccase and ABTS.On the basis of molecular docking,we built a complex model ofTrametesversicolorlaccase-ABTS,and compared the crystal structure ofBacillussubtilislaccase-ABTS complex.Moreover,we explained the interaction mechanism of laccase and ABTS at the molecular level with the binding characteristics of two complexes.The results indicated that the rich electronics group in ABTS penetrated into the laccase active site,and approached the electron acceptor histidine.Many neutral amino acids interacted with ABTS by hydrophobic interaction at laccase active site,and stablilized the binding conformation.Finally,ABTS turned into cationic intermediate and played a mediated role under the action of laccase.
laccase;ABTS;laccase-ABTS system;molecular docking;interaction mechanism
武警后勤項目(WJHQ2012-14),武警后勤學院重點項目(WHZ201201),天津市衛生局科技基金項目(2015KZ123),武警后勤學院基礎研究項目(WHJ2016025)
2017-06-30
陶國翔(1991-),男,河北南宮人,碩士研究生,研究方向:計算機輔助藥物設計,E-mail:taoguoxiang91@126.com;通訊作者:李愛秀,教授,E-mail:liaixiu2006@126.com。
10.3969/j.issn.1672-5425.2017.11.006
陶國翔,李愛秀,張敏,等.漆酶與ABTS間的結合模式與作用機制研究[J].化學與生物工程,2017,34(11):23-26.
O641 Q814.9
A
1672-5425(2017)11-0023-04

