混合溶液酸堿性的解題技巧
王謙謙(石家莊二中實驗學校,河北 石家莊 051430)
混合溶液酸堿性的解題技巧
王謙謙(石家莊二中實驗學校,河北 石家莊 051430)
25℃時,酸堿的PH之和為14(即PHA+PHB=14),若等體積混合,則關于混合溶液的酸堿性符合“誰弱顯誰性,都強顯中性”;若要求混合溶液顯中性,則關于酸堿的體積符合“誰強體積大,都強一般大”。
PH值;混合溶液的酸堿性;電離平衡;強電解質;弱電解質
弱電解質的電離平衡與鹽類水解部分是新課程的重點,難度較大。我把“酸堿等體積混合后溶液酸堿性的判斷”和“酸堿混合后溶液顯中性,酸堿體積的比較”的習題進行對照歸納,把解題的規律和技巧歸納成口訣,化繁為簡。
1 酸堿等體積混合后溶液酸堿性的判斷
我們由例題出發,梳理解題思路,歸納技巧口訣。
【例1】25℃時下列酸堿的PH之和為14,則酸堿等體積混合后,溶液顯酸性的是( )
A.HCl和NaOH B.HCl和NH3·H2O
C.CH3COOH和NaOH D.H2SO4和NaOH
答案為C
由常規解題思路出發:
A.①設HCl的PH值為A,則C(H+)=10-Amol/L
HCl=H++Cl-
10-A10-A
則C(HCl)=10-Amol/L
②設NaOH的PH值為B,且A+B=14,那么C(OH-)=10-(14B)mol/L=10-Amol/L
NaOH=Na++OH-
10-A10-A
則C(NaOH)=10-Amol/L
可知,HCl和NaOH物質的量濃度相等,體積相等,則物質的量相等。
HCl+NaOH=NaCl+H2O
HCl和NaOH物質的量之比為1:1,由化學方程式可知,恰好中和,生成NaCl溶液,顯中性——歸納為“都強顯中性”。
B.①同上,C(HCl)=10-Amol/L。
②設 NH3·H2O的PH 值為 B,同理 C(OH-)=10-Amol/L,但NH3·H2O是弱電解質,微弱電離:
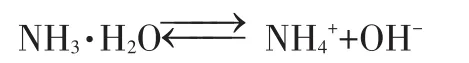
>>10-A10-A
所以C(NH3·H2O)>>10-Amol/L,等體積混合,NH3·H2O的物質的量比HCl大很多。
HCl+NH3·H2O=NH4Cl+H2O
由化學方程式可知,反應后生成少量NH4Cl(水解顯酸性),但同時剩余大量NH3·H2O,所以混合溶液顯堿性——歸納為“強酸弱堿混合,誰弱顯誰性”。
C.①同上,C(NaOH)=10-Amol/L。
②設CH3COOH的PH值為A,同理C(H+)=10-Amol/L,但CH3COOH是弱電解質,微弱電離:
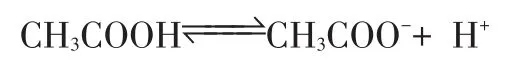
>>10-A10-A
所以C(CH3COOH)>>10-Amol/L,等體積混合,CH3COOH的物質的量比NaOH大很多。
CH3COOH+NaOH=CH3COONa+H2O
由化學方程式可知,反應后生成少量CH3COONa(水解顯堿性),但同時剩余大量CH3COOH,所以混合溶液顯酸性——歸納為“弱酸強堿混合,誰弱顯誰性”。
D.①設H2SO4的PH值為A,C(H+)=10-Amol/L
H2SO4=2H++SO42-
0.5×10-A10-A
則C(H2SO4)=0.5×10-Amol/L
②同上,C(NaOH)=10-Amol/L
因此NaOH的物質的量濃度是H2SO4物質的量濃度的2倍,體積相等,則NaOH的物質的量是H2SO4的物質的量的2倍。
H2SO4+2NaOH=Na2SO4+2H2O
H2SO4和NaOH 物質的量之比為1:2,由化學方程式可知,恰好中和,生成Na2SO4溶液,顯中性——歸納為“都強顯中性”,而與酸或堿的元數無關。
【總結】:25℃時,酸堿的PH之和為14(即PHA+PHB=14),等體積混合,

2 酸堿混合后溶液顯中性,酸堿體積的比較
【例2】25℃時,下列酸堿的PH之和都是14,要求混合后溶液顯中性,則下列關于酸堿的體積大小的說法正確的是( )
A.V(HCl) <V(NaOH) B.V(HCl) >V(NH3·H2O)
C.V(CH3COOH)>V(NaOH) D.V(H2SO4)=V(NaOH)
答案為BD
這道題可以借鑒例1的結論,即先假設每組物質都是等體積混合,根據剛總結的口訣,得出混合溶液的酸堿性,再根據最終要達到混合溶液顯中性的目的,進行相應酸或堿的添加。
A.先假設HCl和NaOH等體積混合,根據例1的口訣,都強顯中性,則混合溶液顯中性。
假設成立,即HCl和NaOH需要等體積混合。A錯誤。
小結:強酸強堿混合時,酸堿的體積符合都強一般大。
B.同樣先假設HCl和NH3·H2O等體積混合,根據例1的口訣,誰弱顯誰性,則混合溶液顯堿性,要想最終溶液為中性,還需要添加酸,則V(HCl)>V(NH3·H2O)。B正確。
小結:強酸弱堿混合時,酸堿的體積符合誰強體積大。
C.如果CH3COOH和NaOH等體積混合,誰弱顯誰性,則混合溶液顯酸性,若最終溶液為中性,還需要添加堿,則V(CH3COOH)<V(NaOH)。C錯誤。
小結:弱酸強堿混合時,酸堿的體積也符合誰強體積大。
D.按題意H2SO4和NaOH等體積混合,都強顯中性,則混合溶液顯中性。D正確。
小結:強酸強堿混合時,酸堿的體積也符合都強一般大,而與酸堿的元數無關。
【總結】:25℃時,酸堿的PH之和為14(即PHA+PHB=14),且要求混合后溶液顯中性,

3 口訣歸納,化繁為簡
例1和例2這類題型如果借助口訣,既做得快又做得對。對于后進生來說尤其管用。兩類題型總結如下:

在化學學習中,勤于歸納,勤于思考,有利于題目的清晰

