胰腺實性-假乳頭狀腫瘤和神經內分泌腫瘤中Claudin5和Claudin7的表達及意義
曹 鐘,魏建國,岑紅兵,劉立紅,常慧芳,敖啟林
·短篇論著·
胰腺實性-假乳頭狀腫瘤和神經內分泌腫瘤中Claudin5和Claudin7的表達及意義
曹 鐘1,魏建國2,岑紅兵1,劉立紅3,常慧芳4,敖啟林5
目的探討Claudin5和Claudin7在胰腺實性-假乳頭狀腫瘤(solid-pseudopapillary neoplasm, SPN)、神經內分泌腫瘤(neuroendocrine tumor, NET)中的表達及意義。方法采用免疫組化EnVision法檢測20例SPN和23例NET中β-catenin、CD10、CK、vimentin、CD99、NSE、Syn、PR、Claudin5和Claudin7的表達。結果(1)在SPN和NET中β-catenin、CD10、CK、vimentin、CD99、NSE、Syn、PR呈不同程度陽性表達。其中,β-catenin和CD10在SPN和NET中的陽性率差異有統計學意義(P<0.05),β-catenin診斷SPN的敏感性為90.0%,特異性為52.2%;CD10診斷SPN的敏感性為80.0%,特異性為69.6%。其余6種標志物差異無統計學意義(P>0.05)。(2)Claudin5在SPN中的陽性率為100%(20/20),明顯高于NET(13.0%,3/23),差異有統計學意義(P<0.05);其診斷SPN的特異性(100%)和敏感性(87.0%)均高于β-catenin和CD10。(3)Claudin7在胰腺NET中的陽性率為100%(23/23),而在所有SPN中均不表達;其診斷NET的特異性和敏感性均為100%。結論Claudin5和Claudin7分別在SPN和NET中呈腫瘤細胞胞膜陽性表達模式,是兩者的免疫組化特征。聯合檢測Claudin5、β-catenin、CD10和Claudin7有助于診斷和鑒別診斷SPN和NET。
胰腺腫瘤;實性-假乳頭狀腫瘤;神經內分泌腫瘤;Claudin5;Claudin7
胰腺實性-假乳頭狀腫瘤(solid-pseudopapillary neoplasm, SPN)較少見,其發病率占所有胰腺腫瘤的2%~3%,9%~15%患者可能發生轉移和局部侵犯。胰腺神經內分泌腫瘤(neuroendocrine tumor, NET)是一種相對少見的腫瘤,占所有胰腺腫瘤的1%~2%,具有比SPN更廣的生物學譜系。由于兩者形態學極其相似,部分SPN會發生神經內分泌分化,因此有必要采用免疫組化法鑒別兩者。傳統的免疫組化標志物特異性不高,時常給鑒別診斷帶來困難。Claudin蛋白是緊密連接(tight junction)蛋白家族,在許多腫瘤的發生、發展中扮演重要角色,近年來發現其在鑒別胰腺腫瘤中具有一定的意義。本文采用免疫組化EnVision法檢測20例SPN和23例NET中Claudin5和Claudin7中的表達,探討兩者對鑒別診斷SPN和NET的意義。
1 材料與方法
1.1材料收集湖北省黃岡市中心醫院、武漢市中心醫院和浙江省紹興市第一人民醫院2009年8月~2016年6月期間手術切除的20例SPN和23例NET標本。SPN診斷標準參照WHO(2010)消化系統腫瘤分類[1]。NET的診斷標準按照(2017)胃腸胰神經內分泌腫瘤病理診斷規范[2],依據核分裂象(<2;≥2,≤20;>20)和Ki-67陽性指數(≤2%;>2%,≤20%;>20%)將高分化神經內分泌腫瘤(neuroendocrine tunor, NET)組織學分為G1(低)、G2(中)和G3(高)。所有病例均由兩名高年資病理醫師復核。
1.2方法所有標本均經10%中性福爾馬林固定,常規脫水透明浸蠟切片,HE染色,同時行免疫組化染色。對所有標本行免疫組化EnVision兩步法檢測,所用一抗包括Claudin5兔單克隆抗體(購自Abcam公司,ab15106,稀釋度1 ∶500)、Claudin7兔單克隆抗體(Abcam公司,ab27487,稀釋度1 ∶1 000)。β-catenin、CD10、CK、vimentin、CD99、NSE、Syn、PR均為工作液,二抗和DAB試劑盒購自北京中杉金橋公司。Claudin5和Claudin7抗體經1 mmol/L pH 9.0的EDTA緩沖液,其余抗體經10 mmol/L pH 6.0枸櫞酸緩沖液高壓抗原修復后,按照使用說明書進行操作。用已知Claudin5陽性的血管瘤、Claudin7陽性的食管鱗狀細胞癌作陽性對照,用PBS取代一抗作陰性對照。
1.3結果判定所有一抗的染色強度進行半定量分級,根據腫瘤細胞膜、質及核中出現黃色、棕黃色及棕褐色顆粒,觀察每張切片中10個具有代表性的高倍視野,計算腫瘤細胞數,陽性結果評分分為2類:0~5%為陰性(-);≥5%為陽性(+)。
1.4統計學分析所有數據均采用SPSS 17.0軟件進行統計學分析。兩種腫瘤單個免疫標志物陽性率的比較采用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1臨床特征20例SPN中,男性3例,女性17例;年齡10~48歲,中位年齡27歲;腫瘤直徑4.6~8.5 cm;其中腫瘤位于胰頭6例、胰體6例、胰尾8例;4例發生出血、囊性變;5例發生周圍纖維包膜侵犯;1例腹腔轉移。8例患者有腹痛、腹脹等癥狀,12例體檢時被偶然發現。23例NET中,男性12例,女性11例;年齡32~57歲,中位年齡43歲;腫瘤直徑1.4~4.8 cm;其中位于胰頭5例、胰體11例、胰尾7例;組織學分級:G1型13例、G2型10例;1例發生出血、壞死;15例為無功能性腫瘤,8例有相應的臨床癥狀;所有病例均未見轉移。
2.2鏡檢20例SPN主要由實性區、假乳頭區及退變區呈不同比例構成,部分外層見纖維包膜。實體區見腫瘤細胞呈大片巢狀、條索狀排列,分布于玻璃樣變的纖維血管間。腫瘤細胞大小較一致,異型性小,圓形或橢圓形,細胞質較少、淡染,核圓形,可見核溝,未見核仁,少見核分裂。假乳頭區見腫瘤細胞呈單層或多層排列,圍繞纖維血管為軸心形成假乳頭狀或假菊形團結構,細胞形態與實體區相似。退變區可見出血、壞死,常見組織細胞浸潤及膽固醇結晶。腫瘤內見殘存的胰腺腺泡及導管。23例NET未見包膜,腫瘤細胞呈實體樣、梁狀、腺樣及腦回樣結構排列,間質為纖維組織,部分玻璃樣變。腫瘤細胞大小、形態一致,呈圓形或卵圓形,胞質少。
2.3免疫表型
2.3.1Claudin5診斷SPN的特異性和敏感性 Claudin5在SPN的腫瘤細胞中均呈彌漫強陽性膜表達(圖1A、B),其陽性率為100%(20/20);Claudin5在23例NET中陽性率為13.0%(3/23),呈胞質陽性表達(圖1C),強弱不等;其陽性率在兩腫瘤之間差異有統計學意義(P<0.05)(表1)。Claudin5在診斷SPN中的敏感性為100%,特異性為87.0%;此外,本組實驗亦發現Claudin5在43例胰腺腫瘤間質血管的內皮細胞中均呈胞質彌漫強陽性表達(圖1D)。
2.3.2Claudin7診斷胰腺NET的特異性和敏感性 Claudin7在20例SPN腫瘤細胞中均不表達(圖2A),陽性率為0.0(0/20);Claudin7在23例NET中的陽性率為100%(23/23),呈彌漫強陽性膜表達(圖2B),兩者之間差異有統計學意義(P<0.05)(表1)。Claudin7診斷NET的敏感性為100%,特異性為100%。
2.3.38種常規標志物在SPN和NET中表達的差異性 SPN中β-catenin、CD10、CK、vimentin、CD99、NSE、Syn、PR的陽性率分別為90.0%(18/20)、80.0%(16/20)、65.0%(13/20)、95.0%(19/20)、80.0%(16/20)、90.0%(18/20)、75.0%(15/20)、70.0%(14/20);NET中β-catenin、CD10、CK、vimentin、CD99、NSE、Syn、PR的陽性率分別為47.8%(11/23)、30.4%(7/23)、69.6%(16/23)、78.2%(18/23)、82.6%(19/23)、95.7%(22/23)、87.0%(20/23)、60.9%(14/23)。其中β-catenin和CD10在SPN和NET中的陽性率差異有統計學意義(P均<0.05);β-catenin診斷SPN的敏感性為90.0%,特異性為52.2%;CD10診斷SPN的敏感性為80.0%,特異性為69.6%。其余CK、vimentin、CD99、NSE、Syn、PR在SPN和NET中的陽性率差異均無統計學意義(P均>0.05,表1)。
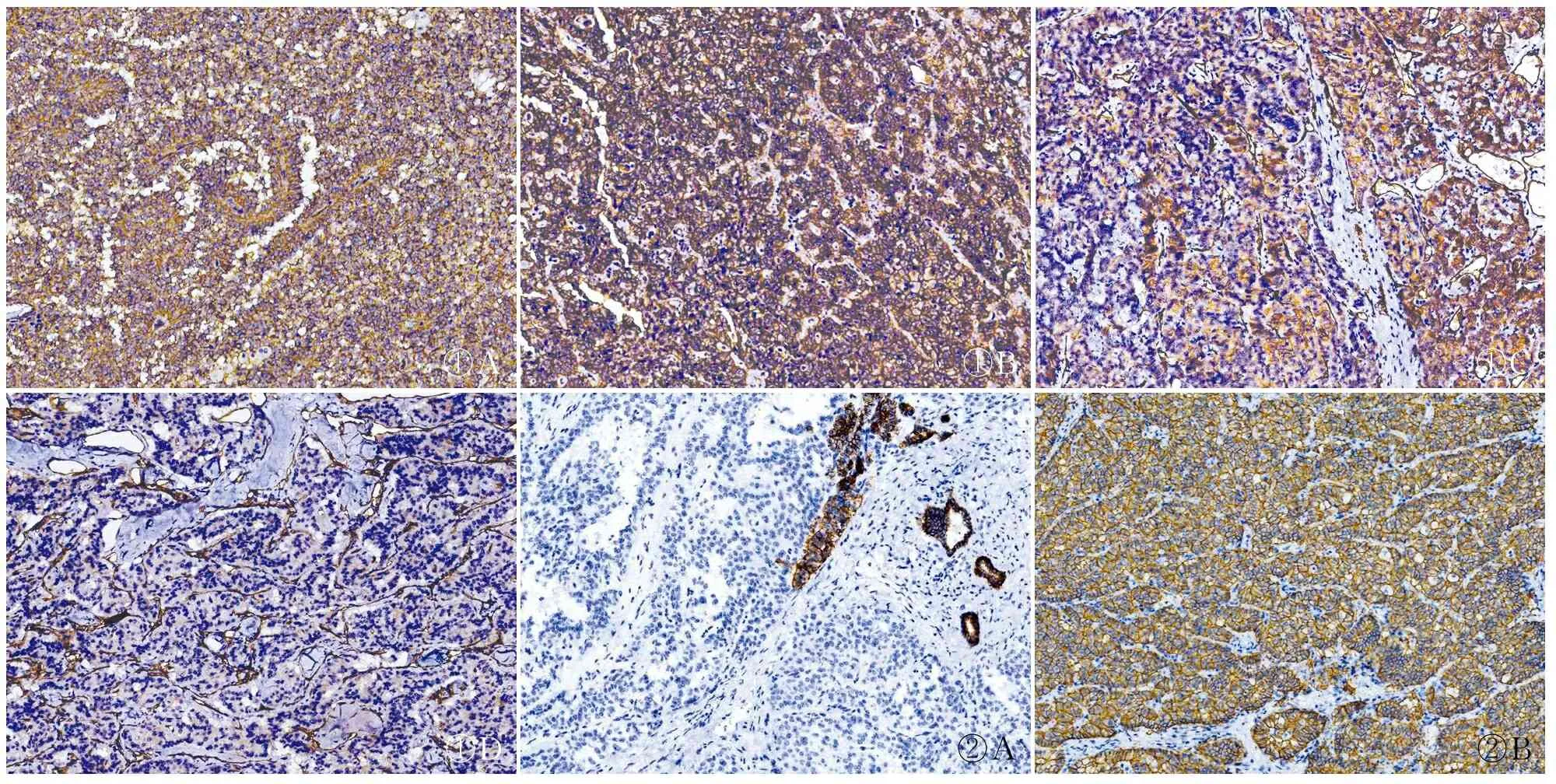
①A①B①C①D②A②B
圖1Claudin5的表達模式:A.胰腺實性-假乳頭狀腫瘤假乳頭狀區域中的表達;B.胰腺實性-假乳頭狀腫瘤實性區域中的表達;C. 胰腺神經內分泌腫瘤中的表達;D.胰腺腫瘤間質血管內皮細胞中的表達,EnVision法圖2Claudin7的表達模式:A.胰腺實性-假乳頭狀腫瘤中的表達;B.胰腺神經內分泌腫瘤中的表達,EnVision法
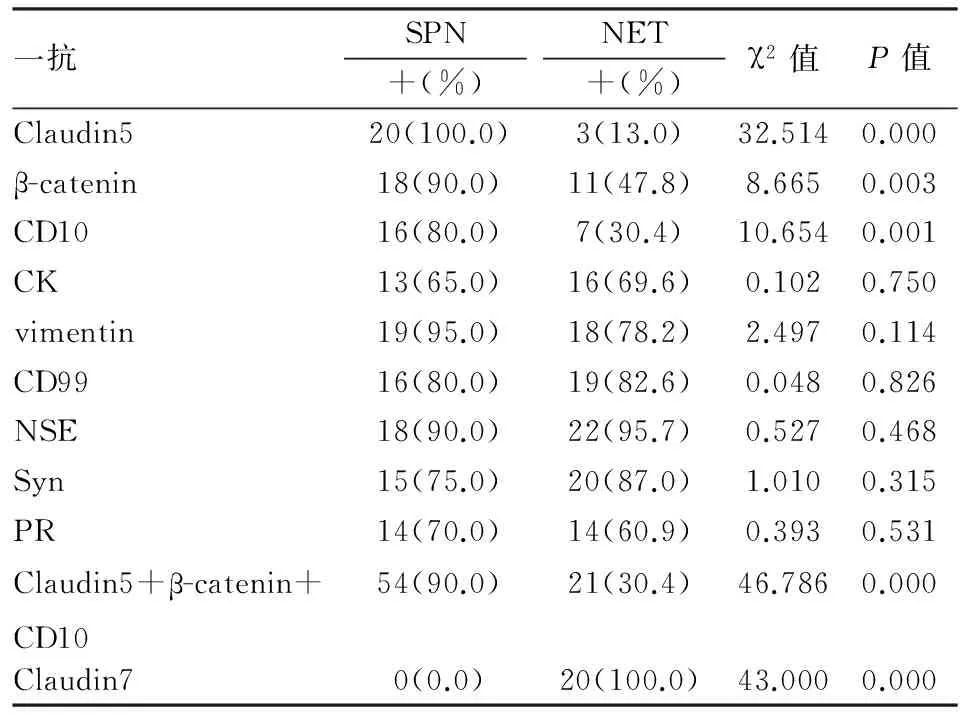
表1 10種標志物在SPN和NET中的陽性率差異性
3 討論
SPN于1959年由Frantz首先報道。其曾經被認為良性腫瘤,該腫瘤曾被命名為胰腺實性-乳頭狀囊性腫瘤、乳頭狀囊性腫瘤、Hamoudi或Frantz瘤。WHO(2010)消化系統腫瘤分類將該腫瘤命名為SPN[1],認為其是一種低級別惡性腫瘤。關于SPN的組織學發生目前處于爭議之中,多數學者認為其起源于胰腺原始多功能干細胞或胚胎神經嵴細胞[3]。SPN的大多數患者為年輕女性,多數患者無明顯癥狀,偶爾體檢發現腫瘤。周圍神經、胰腺間質和淋巴血管侵犯可以預測患者的預后,但并不能提示惡性。患者為男性、年齡較輕、腫瘤直徑>5 cm及腫瘤核分裂象增多則會提示腫瘤為惡性[4]。大體觀察SPN被纖維組織包裹,與周圍正常的胰腺組織分界清楚;鏡下組織形態學特點包含實體區、假乳頭狀結構及囊性變。當SPN腫瘤體積較小且發生神經內分泌分化或者腫瘤完全由實體區構成時,則與胰腺高分化NET鑒別較困難。SPN的假乳頭狀結構與NET的腺樣結構或假菊形團結構容易混淆。SPN的玻璃樣變間質與NET淀粉樣間質也不易區分。在細胞學方面:雖然SPN腫瘤細胞中出現大的、清晰的細胞質空泡變性和Cercariform細胞有助于區分NET[5]。但是,兩者具有更多相似的細胞學特征,如兩者均具有從中等到較多的細胞數量,大小、形態一致,均可呈多角形、立方狀,細胞質嗜酸性或透明,偶爾呈現漿細胞樣外觀,細胞核呈圓形或卵圓形,核質比較低,核分裂少見,具有明顯的核仁[6]。由于兩者的生物學行為不同,采用免疫組化法檢測必不可少。目前,診斷和鑒別SPN和NET標志物主要有P504S、CD10、E-cadherin/β-catenin、CK、Axin-1、vimentin、PR、AAT、Syn、CgA及CD56等。
Claudin蛋白屬于完整的緊密連接(tight junction, TJ)膜蛋白家族成員,在維持上皮細胞極向、黏附性和細胞旁通透性中起重要作用,與細胞某些功能失常和腫瘤的發生密切相關。目前在哺乳動物中已經發現有24余種Claudin蛋白。除Claudin13外,人類有23種Claudin基因得到識別和定位。相比正常的組織,Claudins蛋白在不同的腫瘤組織中呈現不同的表達模式,部分蛋白表達下降或者過表達均與腫瘤的發生及患者的預后有關,可能是腫瘤治療的靶位[7]。Claudin5在TJ蛋白中起內皮細胞屏障功能,通過直接調節ERG基因轉錄從而發揮作用,其在大腦、肺的所有節段的血管內皮細胞和腎臟入球小動脈、出球小動脈中呈過表達[8]。通過對本組43例胰腺腫瘤檢測,發現所有的腫瘤間質中的血管內皮細胞質均可見Claudin5表達,與文獻報道相符。Claudin7蛋白在許多腫瘤組織中出現下調,其表達減少誘導腫瘤細胞失去鈣黏附蛋白,促進細胞增生、侵襲;同時,其還可以通過ERK/MAPK細胞信號轉導途徑抑制腫瘤細胞遷徙和侵襲[9]。近年來,有學者發現Claudin5和Claudin7可以用來鑒別胰腺的SPN和NET。Comper等[10]檢測20例胰腺SPT、20例無功能內分泌腫瘤、7例腺泡細胞癌和2例胰母細胞瘤發現Claudin5在所有的SPT中呈強陽性膜表達,Claudin7則在少數病例中呈胞質陽性表達;相反,所有的內分泌腫瘤、腺泡細胞癌和胰母細胞瘤則呈Claudin7強陽性膜表達,Claudin5則全部為陰性;因此,這種表達模式有助于區分SPT和其他胰腺腫瘤。國內鄭洪彥等[11]發現Claudin5具有相同的鑒別作用。然而,也有學者認為Claudin7在細胞質中呈陽性是SPN的獨特特征[12]。本組實驗結果表明:20例SPN均呈Claudin5膜強陽性表達,其陽性率為100%(20/20),3例NET呈Claudin5胞質陽性表達,染色信號強弱不等;23例NET均呈Claudin7胞膜強陽性,其陽性率為100%(23/23),Claudin7在所有SPN中均陰性。Claudin5和Claudin7在兩者中的陽性率差異均有統計學意義(P<0.05)。Claudin5診斷SPN的敏感性為100%,特異性為87.0%;Claudin7診斷胰腺NET的敏感性為100%,特異性為100%。作者推測Claudin5和Claudin7在胰腺SPT和NET的不同表達模式可能與兩種蛋白分別參與不同腫瘤細胞間的黏附性有關。
在SPN中普遍發生的Wnt/β-catenin信號通路異常從而導致CTNNB1外顯子3中的β-catenin基因激活是重要的分子機制,因此Wnt/β-catenin信號通路是SPN的致瘤因子[13]。聯合檢測E-cadherin/β-catenin和CD10有助于診斷和鑒別診斷SPN和NET。本實驗結論支持上述結論。其余CD99、CK、Syn、CgA、CK、PR、AAT等標志物在不同研究中結論不同[14-15],在兩種腫瘤中出現的免疫表型重疊,鑒別仍舊存在困難。Claudin5和Claudin7分別在SPN和NET中呈腫瘤細胞膜的陽性表達模式,具有較高的特異性和敏感性,本實驗通過聯合檢測Claudin5、β-catenin、CD10和Claudin7可以有效地鑒別SPN和NET。
[1] Klimstra D S, Hruban R H, Kl?ppel G,etal. WHO classification of tumours of the digestive system[M]. Lyon: IARC Press, 2010:327-330.
[2] 《腫瘤病理診斷規范》項目組. 腫瘤病理診斷規范(胃腸胰神經內分泌腫瘤)[J]. 中華病理學雜志, 2017,46(2):76-78.
[3] 聶艷紅, 王紅霞, 劉 慧, 等. 網狀纖維染色及P504S在胰腺實性假乳頭狀瘤鑒別診斷中的價值[J]. 臨床與實驗病理學雜志, 2016,32(2):799-801.
[4] Estrella J S, Li L, Rashid A,etal. Solid pseudopapillary neoplasm of the pancreas:clinico-pathologic and survival analyses of 64 cases from a single institution[J]. Am J Surg Pathol, 2014,38(2):147-157.
[5] Samad A, Shah A, Stelow E B,etal. Cercariform cells:another cytologic feature distinguishing solid pseudopapillary neoplasms from pancreatic endocrine neoplasms and acinar cell carcinomas in endoscopic ultrasound-guilded fine-needle aspirates[J]. Cancer Cytopathol, 2013,121(6):298-300.
[6] Raddaoui E M, Almadi M A, Aljebreen A M,etal. Differential diagnosis between pancreatic neuroendocrine and solid pseudopapillary neoplasms on endoscopic ultrasound-guided fine-needle aspiration. An immunohistochemical study[J]. Saudi Med J, 2016,37(7):744-749.
[7] Kwon M J. Emerging roles of claudins in human cancer[J]. Int J Mol Sci, 2013,14(9):18148-18180.
[8] Yuan L, Le Bras A, Sacharidou A,etal. ETS-related gene(ERG) control endothelial cell permeability via transcriptional regulation of the Claudin 5(CLDN5) gene[J]. J Biol Chem, 2012,287(9):6582-6591.
[9] Lu Z, Ding L, Hong H,etal. Claudin-7 inhibits human lung cancer cell migration and invasion through ERK/MAPK signaling pathway[J]. Exp Cell Res, 2011,317(13):1935-1946.
[10] Comper F, Antonello D, Beghelli S,etal. Expression pattern of claudin 5 and 7 distinguishes solid-pseudopapillary from pancreatoblastoma,acinar cell and endocrine tumors of the pancreas[J]. Am J Surg Pathol, 2009,33(5):768-774.
[11] 鄭洪彥, 石艷宏, 張麗芳, 等. Claudin-5和CD99在胰腺實性-假乳頭狀腫瘤和神經內分泌腫瘤中的表達及其意義[J]. 中華病理學雜志, 2013,42(6):372-375.
[12] Gurevich L E, Kazantseva I A, Sokolova I N,etal. Solid pseudoppillary tumors of the pancreas: clinical and morphological characteristics,specific features of their immunophenotype, and diagnostic problems[J]. Arkh Patol, 2014,76(5):44-54.
[13] Huang S C, Ng K F, Yeh T S,etal. Clinicopathological analysis of β-catenin and Axin-1 in solid pseudopapillary neoplasms of the pancreas[J]. Ann Surg Oncol, 2012,19(Suppl3):S438-446.
[14] Uppin S G, Hui M, Thumma V,etal. Solid-pseudopapillary neoplasm of the pancreas:a clinicopathological and immunohistochemical study of 33 cases from a single institution in Southern India[J]. Indian J Pathol Microbiol, 2015,58(2):163-169.
[15] Ohara Y, Oda T, Hashimoto S,etal. Pacreatic neuroendocrine tumor and solid-pseudopapillary neoplasm: key immunohistochemical profiles for differential diagnosis[J]. World J Gastroenterol, 2016,22(38):8596-8604.
R 735.9
A
1001-7399(2017)10-1122-04
時間:2017-10-23 13:30 網絡出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20171023.1330.014.html
10.13315/j.cnki.cjcep.2017.10.014
接受日期:2017-05-25
1湖北省黃岡市中心醫院病理科,黃岡 438000
2浙江省紹興市第一人民醫院病理科,紹興 312000
3湖北省武漢市中心醫院病理科,武漢 430010
4湖北省武漢市第六醫院病理科,武漢 430000
5華中科技大學同濟醫學院附屬同濟醫院病理研究所/同濟醫學院病理學系,武漢 430030
曹 鐘,男,碩士,副主任醫師。Tel: (0713) 8625273,E-mail: caozhong1980@sina.com
敖啟林,男,副教授,碩士生導師,通訊作者。E-mail: aoqilin@263.net

