血清反應因子全長及N端片段過表達慢病毒載體的構建及其對心臟干細胞分化的影響
雷 洪,王可可,哈艷平,賈亞楠,李汝佳,申志華,郭峻莉,揭 偉
血清反應因子全長及N端片段過表達慢病毒載體的構建及其對心臟干細胞分化的影響
雷 洪1,王可可1,哈艷平1,賈亞楠2,李汝佳1,申志華2,郭峻莉3,揭 偉1
目的探討血清反應因子全長(SRF-Full)及N端片段(SRF-N,1-254aa)對TGF-β1誘導c-Kit+心臟干細胞(cardiac stem cell, CSC)分化的影響。方法從cDNA文庫擴增大鼠SRF-Full及SRF-N表達序列并克隆入酶切線性化慢病毒載體GV358(Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin),轉化感受態細胞篩選出陽性克隆并測序鑒定。將SRF-Full及SRF-N過表達質粒與病毒包裝輔助質粒共轉染工具細胞HEK293T,包裝慢病毒。磁激活細胞分選法分離乳SD大鼠c-Kit+CSC,將SRF-Full及SRF-N過表達慢病毒感染CSC并經TGF-β1誘導,定量PCR分析下游分化基因mRNA水平的變化。結果成功擴增出SRF-Full及SRF-N編碼序列并正確連接入線性化載體,獲得的陽性轉化子經測序無誤。將轉化子質粒與病毒包裝輔助質粒共轉染HEK293T后,獲得滴度為2×108TU/mL的慢病毒顆粒,Western blot檢測到預期Flag融合蛋白。重組慢病毒感染CSC后細胞核中見eGFP信號。TGF-β1誘導CSC出現心肌細胞分化基因(Nkx2.5、Gata4、cTnI)及平滑肌細胞分化基因(SM22α)的表達,內皮細胞分化(vWF)無影響,SRF-Full促進CSC的心肌細胞分化,而SRF-N則抑制這種分化。結論成功構建SRF-Full及SRF-N過表達重組慢病毒質粒。SRF-Full促進而SRF-N減弱TGF-β1誘導CSC的心肌細胞分化。
血清反應因子;血清反應因子N端片段;質粒構建;心臟干細胞;細胞分化
干細胞移植治療缺血性心臟病是當前心臟再生醫學研究的重點與熱點之一。研究表明,干細胞參與受損心肌組織修復的機制主要是旁分泌而非直接的細胞分化[1-3]。影響干細胞分化的因子眾多。血清反應因子(serum response factor, SRF)是一種高度保守且廣泛存在于多種生物體內的轉錄調控因子,屬于MADS轉錄因子家族,其通過結合CArG序列[CC(A/T)6GG]實現時空特異性調控超過200個下游靶基因的轉錄表達,這些基因涉及細胞生長、遷移、骨架形成和成肌過程。在人類慢性心衰組織中SRF可被Caspase 3剪接成N片段(SRF-N, 1-254aa)及C片段(SRF-C, 255-508aa)[4-5]。由于N片段含有MADS結合域但不含有催化結構域,因此,SRF-N可與SRF全長(SRF-Full)競爭性結合靶基因的CArG盒因而影響下游編碼心肌收縮等基因的轉錄激活,從而惡化心功能。作者假設心肌梗死等損傷后局部移植干細胞中SRF很可能同樣被剪切而產生SRF-N片段,進而對移植的干細胞生物學功能產生不利的影響。目前尚未見有關SRF-N與干細胞分化的報道。c-Kit+心臟干細胞(cardiac stem cell, CSC)是具有多向分化潛能的成體細胞,在心肌損傷再生研究中獲得較多的關注[6-8]。本文旨以轉化生長因子-β1(transforming growth factor-β1, TGF-β1)誘導c-Kit+CSC分化為模型,分析SRF-N對TGF-β1信號誘導下c-Kit+CSC分化的影響,為推進干細胞移植治療缺血性心臟病的轉化醫學奠定實驗基礎。
1 材料與方法
1.1材料
1.1.1細胞、質粒及菌株 乳SD大鼠c-Kit+CSC為原代分離。HEK293T細胞、大腸桿菌感受態細胞DH5α、慢病毒載體GV358(Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin)、慢病毒包裝輔助質粒pHelper 1.0及pHelper 2.0、陰性對照慢病毒均購自上海吉凱公司。
1.1.2主要試劑 cDNA文庫為上海吉凱公司產品;In-Fusio PCR Cloning試劑盒購自Clontech公司;Taq聚合酶購自SinoBio公司;dNTP、RT及Real-time PCR試劑盒為Takara公司產品;限制性內切酶購自NEB公司;質粒抽提試劑盒、瓊脂糖凝膠DNA回收試劑盒購自TIANGEN公司;Trizol、FBS、DMEM、Opti-MEM和Lipofectamine 2000購自Invitrogen公司;PCR引物由上海生工公司合成;抗Flag一抗為Sigma產品,HRP標記抗鼠二抗購自Santa Cruz公司;干細胞專用培養基購自廣州賽業公司;重組大鼠TGF-β1為Proptech產品。
1.1.3實驗動物 出生72 h以內的乳SD大鼠購自廣東醫科大學實驗動物中心,動物合格證號SYXK(粵)2015-0147,有關動物實驗操作均符合相關倫理學規定。
1.2方法
1.2.1SRF-Full和SRF-N慢病毒表達質粒的構建和鑒定 人SRF-Full可被Caspase 3剪切成含1-254 aa的SRF-N及255-508 aa的SRF-C片段[4-5],目前未見有關大鼠SRF剪切體的報道。根據大鼠及人類SRF蛋白一級結構特征,實驗設想同樣于254aa處將大鼠SRF-Full剪切成2個片段。根據GeneBank中大鼠SRF(NM_001109302)的基因序列信息,采用PCR法從cDNA文庫調取SRF-Full及SRF-N端蛋白質編碼序列。引物如下:SRF-Full序列,上游5′-GAGGATCCCCGGGTACCGGTCGCCACCATGTTACCGAGCCAAGCTG-3′,下游5′-TCCTTGTAGT CCATACCGGTTTCACTCTTGGTGCTGTGGGTG-3′,產物長度1 559 bp;SRF-N序列:上游5′-GAGGAT CCCCGGGTACCGGTCGCCACCATGTTACCGAGCCAAGCTGGG-3′,5′-TCCTTGTAGTCCATACCTTCCCCACTGCTGTCAGATTCC-3′,產物長度806 bp。引物含交換配對堿基、酶切位點(加粗,斜體)和增強序列(下橫線)。慢病毒質粒GV358經AgeⅠ酶切后得到線性化片段,將線性化載體和目的基因(SRF-Full及SRF-N)按摩爾數比例為1 ∶2混合,25 ℃ 30 min進行交換反應,形成帶有目的基因的重組慢病毒載體。將連接好的產物轉化大腸桿菌DH5α感受態細胞,挑選陽性克隆送Invitrogen公司進行測序鑒定,大量提取陽性克隆質粒DNA備用。
1.2.2重組SRF-Full及SRF-N過表達慢病毒的包裝、純化及鑒定 參考文獻報道[9]進行操作,HEK293T細胞接種15 cm細胞培養皿,37 ℃ 5%CO2培養箱內培養,待細胞密度達70%~80%時用于轉染。將20 μg重組質粒Ubi-SRF-Full-3FLAG-SV40-EGFP-IRES-puromycin、Ubi-SRF-N-3FLAG-SV40-EGFP-IRES-puromycin,15 μg輔助質粒pHepler 1.0及10 μg pHepler 2.0與Opti-MEM混勻于同一試管,總體積為2.5 mL,室溫孵育5 min;將100 μL Lipofectamine 2000與2.4 mL Opti-MEM混勻于另一試管,室溫下孵育5 min;將兩試管液體混合,室溫作用20 min后加入HEK293T細胞培養皿中,常規培養8 h后棄去上清并更換新鮮完全培養液20 mL,繼續培養48 h,收集富含慢病毒顆粒的細胞上清液,0.45 μm濾器得到粗提病毒液,將病毒粗提液轉移至過濾杯中,4 000g離心10~15 min后得到高滴度的慢病毒濃縮液,分裝后保存在-80 ℃。取一支病毒液,應用ELISA檢測HIV-1 p24抗原法判斷其滴度。取另外一支病毒液,按MOI值20感染HEK293T細胞,48 h后提取總蛋白,采用Western blot法檢測SRF-3Flag融合蛋白的表達。
1.2.3CSC的分離、培養、鑒定、病毒感染及誘導分化 參考干細胞分選法[10-12]分離原代乳SD大鼠c-Kit+CSC。乳鼠心臟機械剪碎后經胰酶及膠原酶多次消化成細胞懸液,血清終止消化,冷PBS洗滌細胞,800g離心10 min后棄上清,細胞沉渣用4 mL DMEM液混勻,加入抗c-Kit一抗(1 ∶250)及FBS(0.5%),垂直混合儀室溫下以5 r/min緩慢混合40 min,800g離心10 min棄上清,PBS洗2遍,細胞用4 mL DMEM混懸,加入10 μL偶聯二抗的磁珠,垂直混合儀室溫下以5 r/min緩慢混合30 min,將細胞懸液過磁柱,c-Kit+細胞在磁場中被吸附,棄去液體,用干細胞專用培養基沖洗磁柱,洗脫的細胞即為c-Kit+CSC。CSC置于37 ℃ 5%CO2飽和濕度的培養箱中培養,每3天換液(培養液中含抑制細胞分化的白血病抑制因子)。采用流式細胞術檢測c-Kit+細胞純度。取狀態良好的CSC接種于6孔板中(2×104/mL),24 h后細胞貼壁,狀態生長良好,棄去培養基,PBS洗2遍,以感染復數為100加入慢病毒顆粒和DMEM(1 mL)孵育,8~10 h后加1 mL完全培養液置于37 ℃ 5%CO2飽和濕度培養箱內培養24 h,然后吸去含病毒的培養液,每孔加入2 mL完全培養基培養,72 h后在熒光顯微鏡下觀察感染效果,以嘌呤霉素3 μg/mL進行篩選用于后續實驗。實驗分組:陰性對照慢病毒感染組(NC組)、全長SRF過表達慢病毒感染組(SRF-Full組)、SRF-N過表達慢病毒感染組(SRF-N組)。以終濃度10 ng/mL的外源性TGF-β1分別處理3組細胞,于第2、7天后提取總RNA。
1.2.4RNA提取、逆轉錄及定量PCR 參考文獻報道[13]進行。Trizol裂解細胞提取總RNA,取100 ng總RNA逆轉錄為cDNA,按照定量PCR試劑盒說明書進行。PCR反應體系為20 μL,含SYBR Premix Ex Taq 10 μL,cDNA 5 μL,上游及下游引物各1 μL,DEPC水3 μL。PCR反應條件為95 ℃預變性5 min,95 ℃ 10 s,60 ℃ 30 s共55個循環。采用2-ΔΔCt相對定量法,以β-actin為內參照分析心肌細胞、平滑肌細胞及內皮細胞標志基因mRNA水平的改變。PCR引物序列如下:Nkx2.5(NM_053651.1):上游5′-CAGGTCTATGAGCTGGAGCG-3′,下游5′-TTACACTTGTAGCGGCGGTT-3′;Gata4(NM_144730):上游5′-ATGGGTCCTCCATCCATCCA-3′,下游5′-GCTGTTCCAAGAGTCCTGCT-3′;cardiac Tropnin I3(cTnI, NM_017144.2):上游5′-TATGACCTGCGTGGCAAGTT-3′,下游5′-GCCCTCAGGTCCAAGGATTC-3′;SM22α(NM_031549):上游5′-CTGTAATGGCTTTGGGCAGT-3′,下游5′-CTCTTATGCTCCTGGGCTTTC-3′;vWF(NM_053889.1):上游5′-ACTTCACCTTCAGTGGCATCT-3′,下游5′-AGACAGCATCAGGGTCATCAG-3′;β-actin(NM_031144):上游5′-CCCATCTATGAGGTTACGC-3′,下游5′-TTTAATGTCACGCACGATTTC-3′。
1.2.5Western blot 提取SRF-Full、SRF-N及NC組病毒感染HEK293T 48 h后的總蛋白,BCA法定量蛋白濃度,取30 μg蛋白用于SDS-PAGE。蛋白轉移至PVDF膜,經脫脂奶粉封閉后加入一抗(Flag,1 ∶3 000;GAPDH,1 ∶3 000)4 ℃孵育過夜,TBST洗滌,羊抗小鼠HRP標記IgG二抗(1 ∶4 000)室溫孵育2 h,ECL發光后獲得目的蛋白條帶,膠片經凝膠成像系統掃描、拍照。
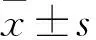
2 結果
2.1重組SRF-Full及SRF-N過表達慢病毒質粒的構建及鑒定從cDNA文庫成功獲得SRF-Full及SRF-N蛋白編碼序列,大小與預期結果一致。通過序列交換法,將此序列克隆入經Age I酶切后線性化慢病毒質粒GV358,轉化感受態DH5α細胞獲得陽性克隆,挑選陽性克隆經測序證實序列無誤(圖1),提示重組慢病毒質粒Ubi-SRF-Full-3FLAG- SV40-EGFP-IRES-puromycin及Ubi-SRF-N-3FLAG-SV40-EGFP-IRES-puromycin構建成功,大量提取質粒備用。
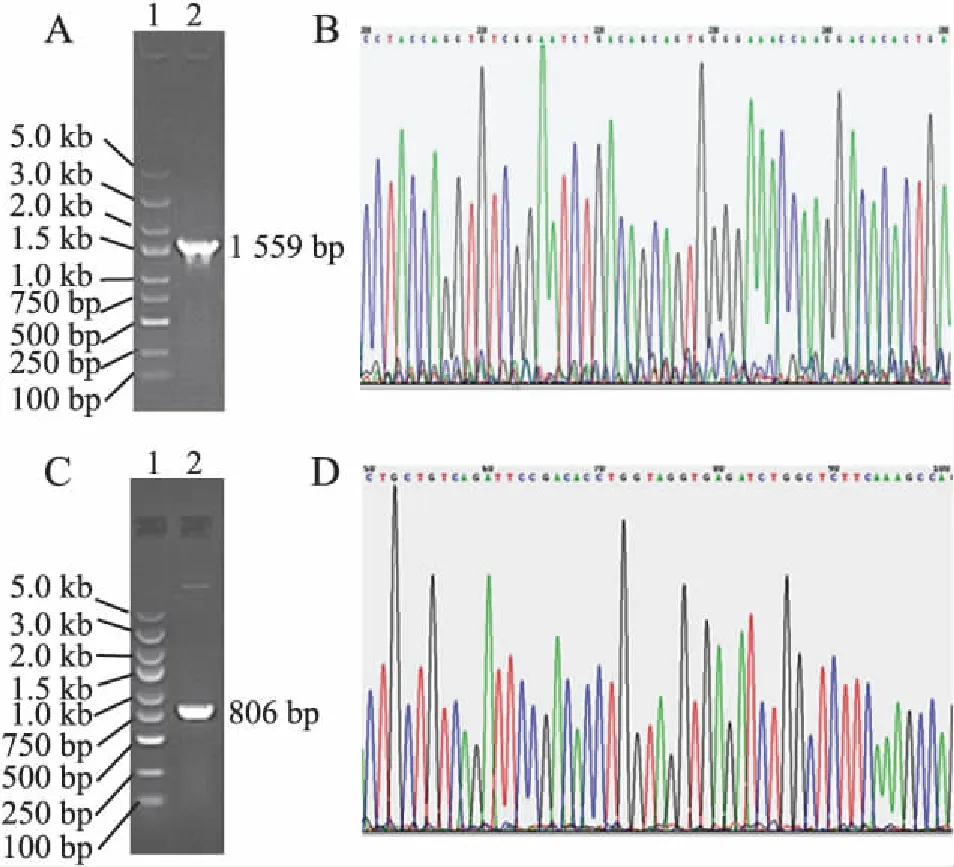
圖1 重組SRF-Full和SRF-N過表達慢病毒質粒的構建
A.從cDNA文庫中調取SRF-Full蛋白質編碼序列PCR產物凝膠電泳結果,1.DNA Marker,2.SRF-Full cDNA產物,長度為1 559 bp;B.重組SRF-Full過表達慢病毒質陽性克隆部分測序結果;C.從cDNA文庫中調取SRF-N蛋白質編碼序列PCR產物凝膠電泳結果,1.DNA Marker,2.SRF-N cDNA產物,長度為806 bp;D.重組SRF-N過表達慢病毒質陽性克隆部分測序結果
2.2SRF-Full及SRF-N過表達慢病毒顆粒的包裝、擴增及鑒定分別將Ubi-SRF-Full-3FLAG-SV40-EGFP-IRES-puromycin及Ubi-SRF-N-3FLAG-SV40-EGFP-IRES-puromycin、pHelper1.0和pHelper2.0三個質粒共轉染HEK293T細胞,在輔助質粒的支持下,成功獲得重組SRF-Full及SRF-N過表達慢病毒,ELISA法測得病毒滴度均為2×108TU/mL。提取慢病毒感染HEK293T細胞總蛋白后,成功應用Western blot法從RIPA裂解產物中檢測到SRF-Full-3Flag及SRF-N-3Flag融合蛋白的表達,蛋白大小與預期結果一致。同時,慢病毒感染HEK293T后在熒光顯微鏡下觀察到eGFP產生的綠色熒光信號(圖2)。上述結果提示本實驗成功獲得高滴度的SRF-Full及SRF-N過表達重組慢病毒。
2.3c-Kit+CSC的分選、鑒定及重組慢病毒感染采用文獻報道[10-12]的磁激活細胞分選法成功分選出c-Kit+CSC。剛分選的CSC胞體較小,呈圓形,部分細胞上附有磁珠,培養24 h后細胞貼壁生長,逐漸變成梭形,約7天有克隆形成,細胞呈漩渦狀生長,21天時生長匯合,細胞呈纖維狀。經流式細胞術檢測純化分選2次后c-Kit+細胞純度超過95%(圖3)。后續試驗均以純化2次傳代5次的細胞進行。CSC接種6孔板24 h后貼壁,按照感染復數指數(multiplicity of infection, MOI)為100加入重組SRF-Full、SRF-N過表達及NC對照慢病毒,24 h后鏡下觀察細胞形態無明顯變化,72 h后熒光顯微鏡下觀察到CSC中有明顯的胞核綠色熒光信號,提示SRF-Full及SRF-N過表達慢病毒成功進入細胞(圖4)。

圖2 重組慢病毒鑒定
A.Western blot法檢測SRF-Full-3Flag融合蛋白表達;1.陽性對照(Survivin-3FLAG-GFP);2.陰性對照HEK293T;3.SRF-Full-3Flag;B.SRF-Full過表達慢病毒感染HEK293T 96 h(明視野);C.SRF-Full過表達慢病毒感染HEK293T 96 h(熒光視野);D.Western blot法檢測SRF-N-3Flag融合蛋白表達;1.陽性對照(Survivin-3FLAG-GFP;2.陰性對照HEK293T;3.SRF-N-3Flag;E.SRF-N過表達慢病毒感染HEK293T 96 h(明視野);F.SRF-N過表達慢病毒感染HEK293T 96 h(熒光視野)
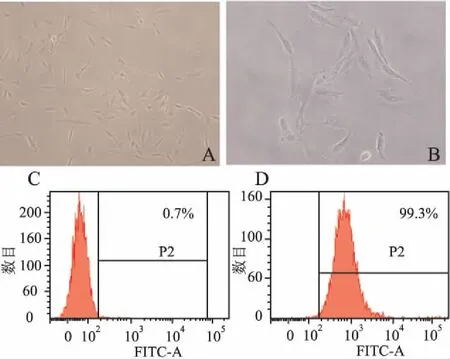
圖3 CSC形態及純度
A.CSC低倍視野;B.CSC高倍視野;C.IgG對照流式結果;D.純化2次CSC中c-Kit流式結果
圖4 重組慢病毒感染乳鼠c-Kit+CSC 72 h后熒光效果
2.4TGF-β1信號對c-Kit+CSC分化的影響c-Kit+CSC接種6孔板后給予10 ng/mL外源性TGF-β1誘導分化,于誘導第2、7天收獲細胞,定量PCR檢測心肌細胞分化標志基因(Nkx2.5、Gata4、cTnI)及平滑肌細胞分化基因(SM22α)和內皮細胞分化(vWF)mRNA水平的改變。結果顯示TGF-β1信號有效上調Nkx2.5、Gata4、cTnI及SM22α mRNA的水平,而對vWF mRNA無明顯誘導作用(圖5)。
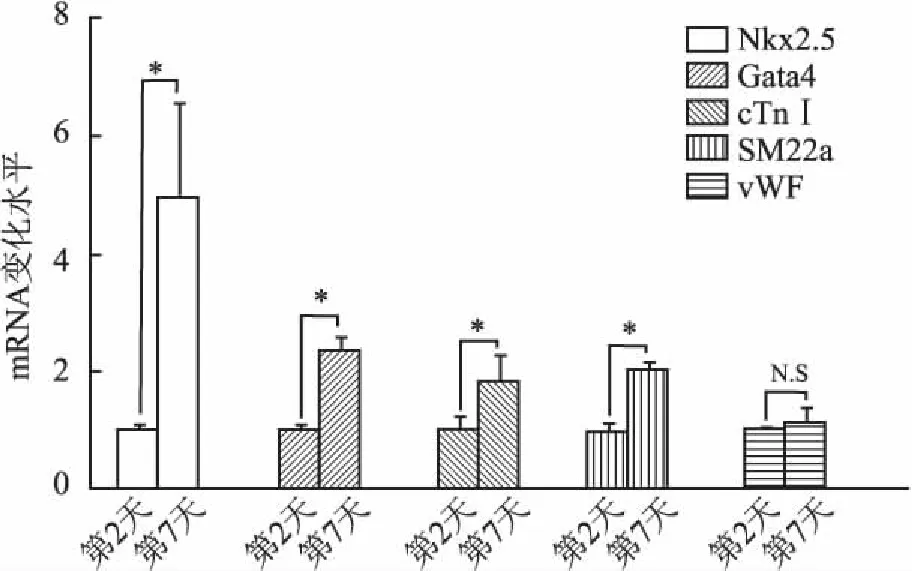
圖5 TGF-β1信號對c-Kit+CSC分化的影響*P<0.05;N.S表示差異無統計學意義
2.5SRF-Full及SRF-N過表達對TGF-β1信號誘導c-Kit+CSC分化的影響分別用SRF-Full組、SRF-N組和NC組按MOI值100感染CSC,7天后定量PCR檢測TGF-β1誘導的心肌細胞、平滑肌細胞標志基因(TGF-β1對CSC內皮細胞分化無明顯作用)mRNA水平的變化。結果顯示,與對照組相比,SRF-Full處理7天后心肌細胞早期分化標志基因Nkx2.5和Gata4 mRNA水平上升明顯,晚期分化標記基因cTnI未見明顯上升,平滑肌分化標志基因SM22α mRNA明顯上升(圖6)。
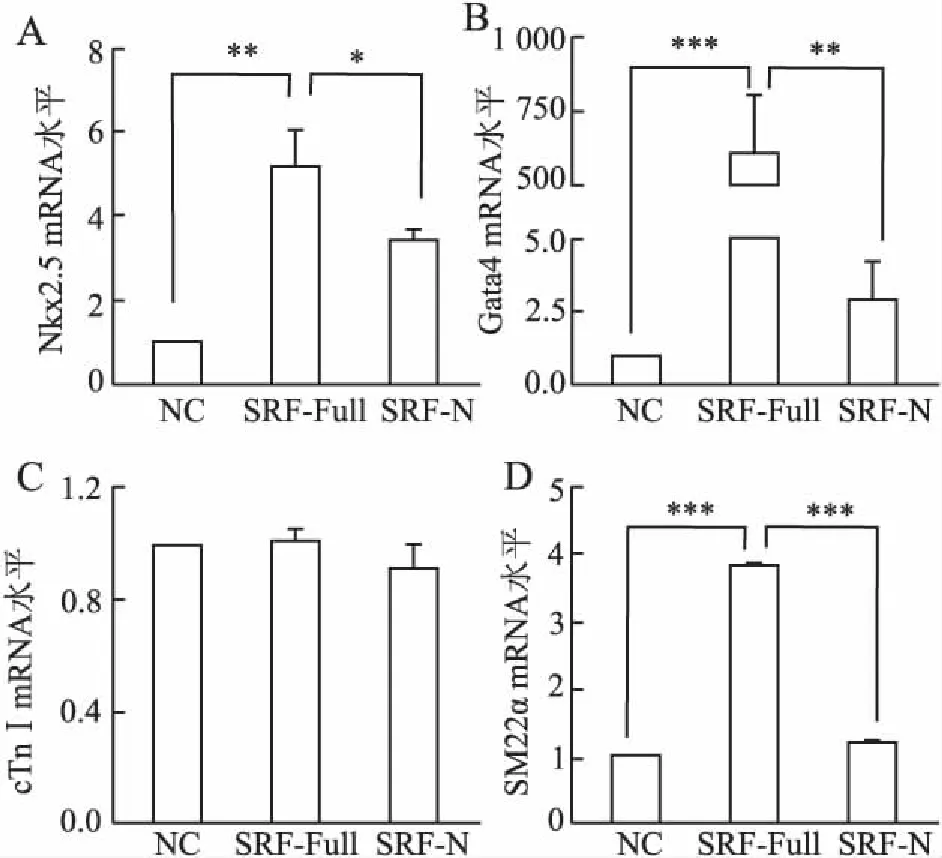
圖6 SRF-Full及SRF-N過表達對TGF-β1信號誘導c-Kit+CSC分化的影響
A.Nkx2.5 mRNA;B.Gata4 mRNA;C.cTnI mRNA;D.SM22α mRNA;*P<0.05;**P<0.001;***P<0.001
3 討論
SRF表達異常與人類某些疾病的病理生理過程關系密切,如腫瘤、纖維化、神經損傷再生及心功能衰竭等[14]。動物實驗表明,過表達SRF可誘導肥厚性心肌病,而基因敲除SRF可導致心臟發育畸形,表現為小梁形成障礙、心壁變薄和心腔擴張[15-16]。研究發現,老年大鼠相對年輕大鼠其急性心肌梗死后心臟中SRF升高趨勢減弱,提示老年心臟對急性應急的反應欠佳[17]。Chang等[5]報道,人類慢性心衰心臟組織中SRF-Full可被Caspase 3剪切成SRF-N和SRF-C,SRF-N具有DNA結合序列但失去調控序列因而可與全長SRF競爭性調節下游靶基因的表達,如抑制心肌細胞α-肌動蛋白的轉錄,導致心肌收縮力減弱,最終形成心力衰竭。上述動物水平及臨床前研究結果提示,維持合適的SRF表達及活性對心臟發育、自穩及心功能的保持至關重要。
干細胞移植治療心肌梗死的理想結果是移植的干細胞能通過有效分化來替代、補充受損的心肌組織、改善心功能。心肌細胞和平滑肌細胞眾多的分化標志基因其DNA序列均具有特殊的CArG盒元件,SRF通過與CArG序列結合,與其他輔助因子一起構成三元復合物,精細地調控分化基因的表達。因此,SRF對心肌梗死后移植干細胞的生物學功能至關重要。已經證實,基因敲除SRF后對胚胎干細胞成肌分化影響顯著[18]。本課題組前期實驗初步證實,與常氧培養為對照,乳大鼠心肌細胞經低氧刺激后總SRF表達水平減弱,但小片段的剪切片段卻增加明顯(未發表資料),目前對這些剪切片段的生物學功能尚不清楚。鑒于大鼠和人SRF蛋白同源性極大,本組實驗參考Chang等[5]的報道,將1-254 aa認為是SRF-N,該氨基酸序列具有保守的MADS序列,因而具備DNA結合能力。為此,本組實驗首先利用cDNA文庫,應用PCR調取了SRF-Full和SRF-N的編碼序列,將其分別克隆入慢病毒載體GV358,構建和篩選SRF-Full及SRF-N的過表達慢病毒質粒,經過有效的包裝,獲得高滴度的過表達慢病毒顆粒。進一步鑒定結果證實所包裝的慢病毒能表達Flag融合蛋白,可高效感染工具細胞。因此,SRF-Full和SRF-N過表達慢病毒的有效包裝及感染驗證,為后續干細胞中的功能研究奠定基礎。
c-Kit+CSC是心臟固有成體干細胞中最常見的一種類型,在較多的臨床前研究及部分Ⅰ期臨床研究中得到重視[6]。考慮到從幼年個體中分離的CSC較成年個體中CSC具有更高的細胞活性[19],因而本實驗應用成熟的MACS法從乳SD大鼠心臟組織中提取c-Kit+CSC,經2次純化后其純度為95%以上。在外源性TGF-β1誘導下,7天后心肌細胞分化標記基因Nkx2.5、Gata4和cTnI,平滑肌細胞分化標志基因SM22α的轉錄水平明顯增強,而內皮細胞分化相關基因vWF轉錄本卻未見明顯增加,提示c-Kit+CSC是多能干細胞,在TGF-β1誘導下主要向心肌細胞和平滑肌細胞分化為主。隨后,以MOI值為100將相應SRF-Full及SRF-N慢病毒感染CSC,熒光顯微鏡下觀察到明顯的胞核定位,這與SRF的核轉錄因子的本質相吻合。本組實驗選擇病毒感染后7天為觀察點,結果發現,與陰性對照病毒感染相比,過表達SRF-Full可明顯促進外源性TGF-β1誘導的心肌細胞分化,表現為心肌細胞早期分化標志基因Nkx2.5和Gata4轉錄水平的增加,而晚期分化標志基因cTnI及平滑肌分化標記基因SM22α的轉錄水平未見增加;相反,SRF-N在一定程度上減弱了TGF-β1誘導的心肌細胞分化。由此可見,SRF-N具有拮抗干細胞成肌分化的作用。
考慮到人類慢性心衰心臟組織中SRF-N水平增加的事實,很可能心肌梗死或心衰患者其心臟組織中移植的干細胞由于SRF-N的存在干擾了移植干細胞的成肌分化,從而不利于移植干細胞生物學功能的發揮,今后我們將從體內研究來進一步驗證這一假設。發現心肌梗死后有利或不利于移植干細胞生物學功能的因素并“揚長避短”,無疑對干細胞移植治療缺血性心臟病具有重要的臨床意義。總之,本組實驗首次從體外實驗角度證實SRF-N具有抑制CSC成肌分化的作用,為推進今后基于CSC移植治療心肌梗死的臨床轉化醫學提供新思路。
[1] Cai M, Shen R, Song L,etal. Bone marrow mesenchymal stem cells (BM-MSCs) improve heart function in swine myocardial infarction model through paracrine effects[J]. Sci Rep, 2016,6:28250.
[2] 王 歡, 鄧麗群, 王亞利, 等. 骨髓間充質干細胞通過旁分泌作用治療大鼠心肌梗死[J]. 中華移植雜志(電子版), 2013,7(2): 94-98.
[3] Gnecchi M, Danieli P, Malpasso G,etal. Paracrine mechanisms of mesenchymal stem cells in tissue repair[J]. Methods Mol Biol, 2016,1416:123-146.
[4] Davis F J, Gupta M, Pogwizd S M,etal. Increased expression of alternatively spliced dominant negative isoform of SRF in human failing hearts[J]. Am J Physiol Heart Circ Physiol, 2002,282(4):H1521-H1533.
[5] Chang J, Wei L, Otani T,etal. Inhibitory cardiac transcription factor, SRF-N, is generated by caspase 3 cleavage in human heart failure and attenuated by ventricular unloading[J]. Circulation, 2003,108(4):407-413.
[6] 蔣曉帆, 丁然然, 姜漢國, 等. Notch信號與心臟干細胞關系的研究進展[J]. 中國細胞生物學學報, 2014,36(6):818-825.
[7] Beltrami A P, Barlucchi L, Torella D,etal. Adult cardiac stem cells are multipotent and support myocardial regeneration[J]. Cell, 2003,114(6):763-776.
[8] Nigro P, Perrucci G L, Gowran A,etal. c-kit(+) cells: the tell-tale heart of cardiac regeneration?[J]. Cell Mol Life Sci, 2015,72(9):1725-1740.
[9] 王振良, 丁然然, 哈艷平, 等. HIF-1α過表達慢病毒載體的構建及對心肌細胞Notch配體Jagged1表達的影響[J]. 臨床與實驗病理學雜志, 2016,32(4):416-420.
[10] 哈艷平, 王振良, 雷 洪, 等. 過表達Notch1胞內域對c-Kit+骨髓間充質干細胞分化的影響[J]. 中國組織工程研究, 2016,20(6):785-792.
[11] Ding R, Jiang X, Ha Y,etal. Activation of Notch1 signalling promotes multi-lineage differentiation of c-Kit(POS)/NKX2.5(POS) bone marrow stem cells: implication in stem cell translational medicine[J]. Stem Cell Res Ther, 2015,6:91.
[12] Guo J, Jie W, Shen Z,etal. SCF increases cardiac stem cell migration through PI3K/AKT and MMP-2/-9 signaling[J]. Int J Mol Med, 2014,34(1):112-118.
[13] 王可可, 鄧雅妍, 賴建鴻, 等. 落新婦苷對高糖刺激的血管內皮細胞SDF-1α表達的影響[J]. 中國病理生理雜志, 2016,32(4):610-617.
[14] Miano J M. Role of serum response factor in the pathogenesis of disease[J]. Lab Invest, 2010,90(9):1274-1284.
[15] Zhang X, Azhar G, Chai J,etal. Cardiomyopathy in transgenic mice with cardiac-specific overexpression of serum response factor[J]. Am J Physiol Heart Circ Physiol, 2001,280(4):H1782-H1792.
[16] Parlakian A, Charvet C, Escoubet B,etal. Temporally controlled onset of dilated cardiomyopathy through disruption of the SRF gene in adult heart[J]. Circulation, 2005,112(19):2930-2939.
[17] Lu X G, Azhar G, Liu L,etal. SRF binding to SRE in the rat heart: influence of age[J]. J Gerontol A Biol Sci Med Sci, 1998,53(1):B3-B10.
[18] Niu Z, Yu W, Zhang S X,etal. Conditional mutagenesis of the murine serum response factor gene blocks cardiogenesis and the transcription of downstream gene targets[J]. J Biol Chem, 2005,280(37):32531-32538.
[19] Simpson D L, Mishra R, Sharma S,etal. A strong regenerative ability of cardiac stem cells derived from neonatal hearts[J]. Circulation, 2012,126(11 Suppl 1):S46-S53.
ConstructionofthefulllengthandN-terminalfragmentofserumresponsefactorover-expressinglentiviralplasmidanditsimpactsoncardiacstemcelldifferentiation
LEI Hong1, WANG Ke-ke1, HA Yan-ping1, JIA Ya-nan2, LI Ru-jia1, SHEN Zhi-hua2, GUO Jun-li3, JIE Wei1
(1DepartmentofPathology,2DepartmentofPathophysiology,SchoolofBasicMedicineSciences,GuangdongMedicalUniversity,Zhanjiang524023,China;3CardiovascularInstitute,theFirstAffiliatedHospitalofHainanMedicalUniversity,Haikou570102,China)
PurposeTo analyze the effects of full length and N-terminal fragment of serum response factor (SRF-Full and SRF-N) on TGF-β1-induced differentiation in c-Kit+ cardiac stem cells (CSC).MethodsRat SRF-Full and SRF-N (1-254 aa) coding sequences were obtained from cDNA library and cloned into the linearized lentviral vector GV358 (Ubi-MCS-3FLAG-SV40-EGFP-IRES-puromycin) to generate the recombinant vectors, and then positive clones were selected and sequenced after transducing the competent cells with recombinant vectors. The recombinant lentvirus were packaged through transfecting the HEK293T cells with SRF-Full, SRF-N overexpressing plasmids and viral packaging plasmids. Neonatal SD rat c-Kit+ CSCs were isolated via magnetic activated cell sorting, and TGF-β1-induced differentiation in SRF-Full and SRF-N overexpression virus-infected CSCs was assessed by quantitative PCR.ResultsSRF-Full and SRF-N coding sequences were successfully obtained and properly cloned into the linearized GV358. The positive clones were selected and further confirmed by sequencing. With the help of packaging plasmids, the SRF-Full and SRF-N overexpressing plasmids-transfected HEK293T cells successfully produced the lentiviral particles with the titer of 2×108TU/mL, and the SRF-Full-Flag and SRF-N-Flag fusion protein were detected by Western blot in virus-infected HEK293T cells. Addition of TGF-β1 significantly induced up-regulated mRNAs in cardiomyocyte markers (Nkx2.5, Gata4, cTnI) and smooth muscle cell marker (SM22α) but not the epithelia cell marker (vWF) in CSCs. Overexpression of SRF-Full facilitated TGF-β1-triggered cardiomyocyte differentiation. However, SRF-N exerted anti-differentiation effects in TGF-β1-treated cells.ConclusionThe SRF-Full and SRF-N overexpressing recombinant lentiviral vectors are successfully constructed. SRF-Full facilitates while SRF-N suppresses TGF-β1-induced cardiomyocyte differentiation in c-Kit+ CSCs.
serum response factor; N-terminal fragment of serum response factor; plasmid construction; cardiac stem cell; cell differentiation
Q 21
A
1001-7399(2017)10-1109-07
時間:2017-10-23 13:30 網絡出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20171023.1330.011.html
10.13315/j.cnki.cjcep.2017.10.011
接受日期:2017-06-21
國家自然科學基金(81460042)、廣東省教育廳科技創新項目基金(KJCX20130088)、廣東省“揚帆計劃”高層次人才項目(4YF16007G)、2015年國家留學人員科技活動擇優資助項目
1廣東醫科大學基礎醫學院病理學系、2病理生理學教研室,湛江 524023
3海南醫學院第一附屬醫院心血管研究所,海口 570102
雷 洪,女,碩士研究生。E-mail: 511622913@qq.com
揭 偉,男,博士,副教授,碩士生導師,通訊作者。Tel: (0759)2388584,E-mail: wei.jie@gdmc.edu.cn

