卵巢癌中Tiam1蛋白過表達的臨床病理學意義
楊 洋,孫 潔,朱 光,樸俊杰,林貞花
·論 著·
卵巢癌中Tiam1蛋白過表達的臨床病理學意義
楊 洋,孫 潔,朱 光,樸俊杰,林貞花
目的探討卵巢癌中Tiam1過表達的臨床病理學意義。方法采用免疫組化SP兩步法檢測Tiam1蛋白在98例漿液性卵巢癌組織、64例黏液性囊腺癌組織以及27例良性病變組織中的表達,并分析其過表達與卵巢癌臨床病理特征的關系。應用Kaplan-Meier進行生存分析。結果Tiam1蛋白主要表達于卵巢癌細胞胞質和胞核中。在漿液性卵巢癌組織中,Tiam1蛋白的陽性率和強陽性率分別為84.7%(83/98)和70.4%(69/98);在黏液性囊腺癌組織中,Tiam1蛋白的陽性率和強陽性率分別為87.5%(56/64)和73.4%(47/64),顯著高于良性卵巢腫瘤組織(22.2%和7.4%)(P均<0.01)。Tiam1蛋白表達水平與卵巢癌組織學分級、FIGO分期和轉移情況密切相關(P均<0.05);與患者年齡及絕經情況無關(P均>0.05)。Kaplan-Meier生存分析顯示,Tiam1蛋白高表達的卵巢癌患者總生存期和無瘤生存期均明顯低于Tiam1蛋白低表達患者(P均<0.05),且Tiam1蛋白高表達的轉移性卵巢癌患者總生存期也明顯低于Tiam1蛋白低表達患者(P<0.05)。結論Tiam1蛋白在卵巢癌組織中明顯高表達,其表達水平與卵巢癌患者的預后密切相關。
卵巢腫瘤;Tiam1;免疫組織化學;預后;生存分析
卵巢癌是臨床最常見的婦科惡性腫瘤之一,也是女性癌癥死亡的常見病因[1]。由于該病的發病部位較為隱蔽,且早期癥狀不明顯,患者通常在初診時已為晚期,一般預后差,生存期短[2]。因此,探尋早期識別卵巢癌、有效預測患者預后的分子靶標已成為當今醫學界研究的熱點。
Tiam1首次發現于小鼠T淋巴瘤細胞中,位于人類第21號染色體q22上,是Rac1特定的鳥嘌呤核苷酸交換因子[3-4]。近年研究發現,Tiam1在多種惡性腫瘤中呈高表達,如胰腺癌[4]、乳腺癌、肝癌和鼻咽癌[5]等。同時,Tiam1高表達參與腫瘤的進程,如細胞凋亡[6-7]、淋巴結轉移等[8]。Li等[9]報道Tiam1蛋白異常表達與乳腺癌的發生、發展密切相關,可作為預測乳腺癌臨床預后的獨立風險因素。目前,Tiam1在卵巢癌組織的表達及其發生、發展的關系尚未見報道。本文應用免疫組化SP兩步法檢測189例卵巢癌中Tiam1蛋白的表達及其與臨床病理特征的關系,探討Tiam1蛋白對卵巢癌預后的評估價值。
1 材料與方法
1.1材料收集2005年5月~2013年5月吉林大學第二醫院存檔的189例卵巢癌標本,包括漿液性卵巢癌98例、黏液性囊腺癌64例、良性病變組織27例,其中漿液性囊腺瘤19例、黏液性囊腺瘤8例。所有病例臨床資料完整,患者在術前均未接受過放、化療。統計189例卵巢癌標本的臨床病理資料,包括患者年齡(>48歲和≤48歲)、絕經情況、組織分化程度、FIGO分期(根據美國癌癥聯合委員會的最新分期標準)以及淋巴結轉移等。
1.2主要試劑Tiam1鼠抗人單克隆抗體購自美國圣克魯斯公司(sc-872),免疫組化SP兩步法試劑盒購自北京中杉金橋公司。
1.3免疫組化染色所有標本均經過10%中性福爾馬林固定、常規脫水、透明、浸蠟、石蠟包埋、4 μm厚連續切片以及免疫組化染色。具體步驟按本組前期實驗進行[10],主要包括:4 μm厚組織切片,常規脫蠟,梯度乙醇水化,抗原熱修復,滴加Tiam1抗體(稀釋比例1 ∶200),4 ℃孵育過夜;滴加二抗,孵育45 min,DAB顯色,蘇木精對比染色,中性樹膠封固。由于本實驗室前期研究顯示Tiam1蛋白在卵巢癌組織中呈陽性[7],因此選擇Tiam1蛋白強陽性染色的切片作為陽性對照,以PBS代替一抗的染色結果作為陰性對照。
1.4判斷標準根據Beesley分級法,以細胞質和細胞核中出現棕褐色顆粒的比例作為判定Tiam1蛋白陽性染色的標準。根據細胞染色強度判斷:無著色為0分,淡黃色為1分,棕黃色為2分,棕褐色為3分;根據陽性細胞數判斷:≤5%為0分,6%~25%為1分,26%~50%為2分,51%~75%為3分,>75%為4分。將兩項結果相乘:0分為(-),1~4分為(+),5~8分為(),9~12分為()。以“-”為陰性,“+”為陽性,“~”為強陽性。
1.5統計學方法應用統計學軟件SPSS 17.0進行統計學分析,采用χ2檢驗或Fisher精確檢驗法進行病理分析,運用Kaplan-Meier進行生存分析。P<0.05為差異有統計學意義。
2 結果
2.1Tiam1蛋白在卵巢病變組織中的表達Tiam1在卵巢良性病變組織中呈低表達;在卵巢癌組織中呈強陽性且主要表達于細胞質和細胞核中。卵巢漿液性癌中Tiam1蛋白的陽性率和強陽性率分別為84.7%(83/98)和70.4%(69/98);黏液性囊腺癌中Tiam1蛋白的陽性率和強陽性率分別為87.5%(56/64)和73.4%(47/64);卵巢良性病變中Tiam1蛋白的陽性率和強陽性率分別為22.2%(6/27)和7.4%(2/27)。卵巢漿液性癌和黏液性囊腺癌組織中Tiam1蛋白的陽性率和強陽性率顯著高于卵巢良性病變組織,差異均有顯著性(P<0.01,表1,圖1)。
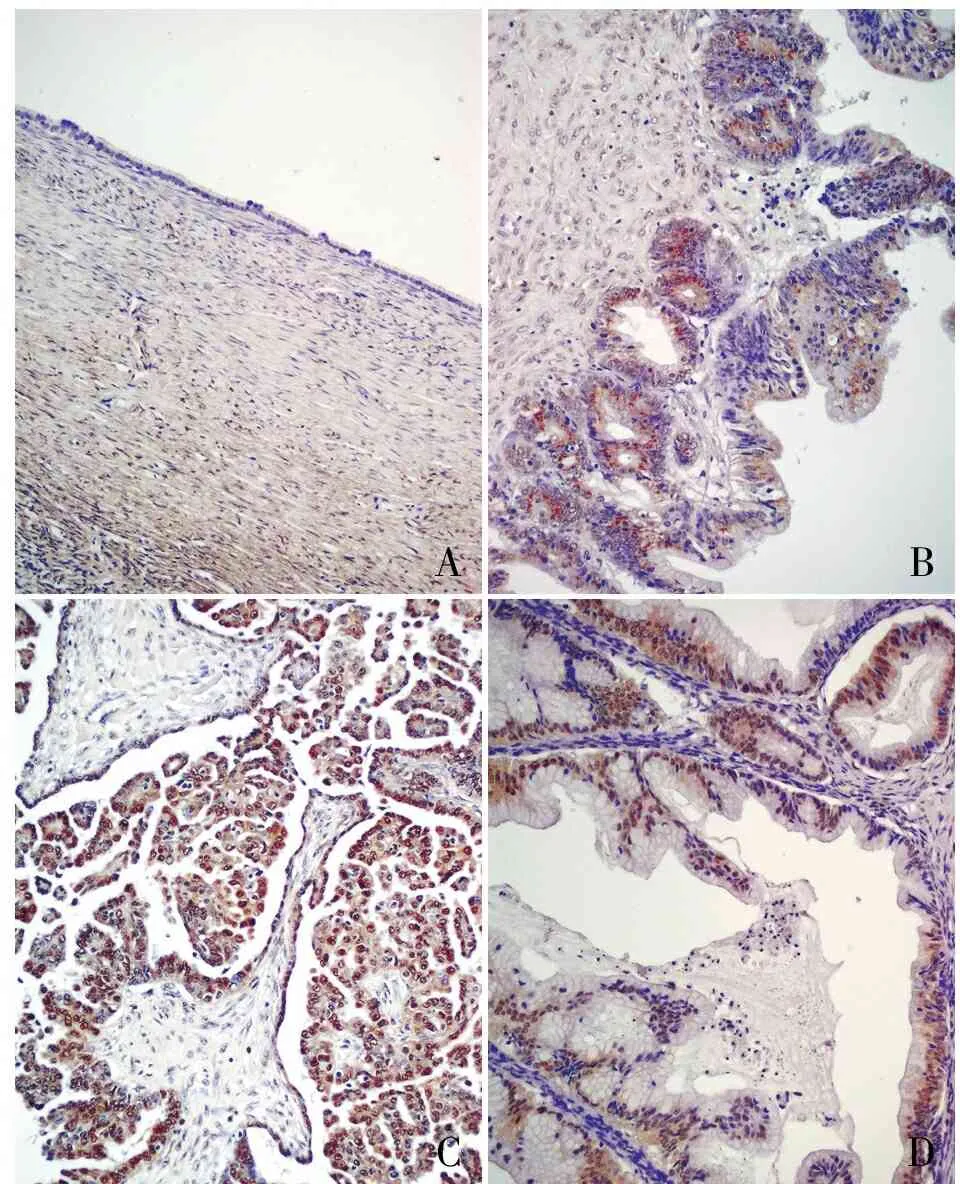
ABCD
圖1Tiam1在卵巢病變組織中的表達,SP兩步法:A.Tiam1蛋白在卵巢良性病變組織中呈陰性;B.Tiam1蛋白在交界性腫瘤中呈陽性;C.Tiam1蛋白在漿液性卵巢癌中呈強陽性,主要表達于細胞質和細胞核;D.Tiam1蛋白在黏液性囊腺癌中呈強陽性
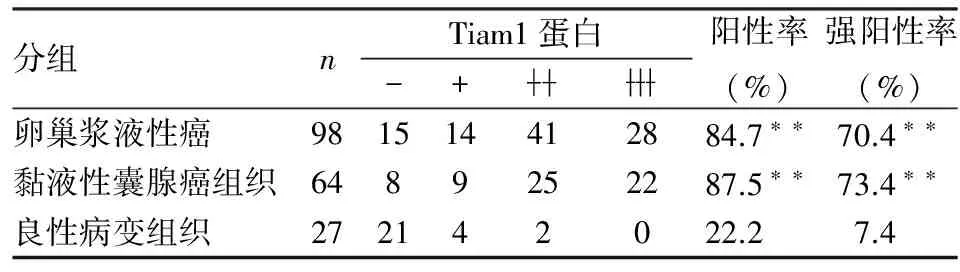
表1 Tiam1蛋白在卵巢病變組織中的表達
**P<0.01
2.2Tiam1蛋白過表達與卵巢癌臨床病理特征的關系為了解Tiam1蛋白在卵巢癌發生、發展中的作用,我們對其過表達與卵巢癌臨床病理特征的關系進行分析發現,Tiam1蛋白的表達水平與卵巢癌患者年齡及絕經情況無關,但與組織學分級、FIGO分期和轉移情況密切相關(P均<0.05)。其中,Tiam1蛋白在低分化組織中的強陽性率(78.4%)明顯高于高分化組織(52.1%)和中分化組織(76.6%,P=0.006);Tiam1蛋白在晚期(III+IV)組織中的強陽性率(77.0%)明顯高于早期(Ⅰ+Ⅱ)組織(62.7%,P=0.019);在有轉移的組織中其強陽性率(79.2%)明顯高于無轉移的組織(55.4%,P=0.001,表2)。
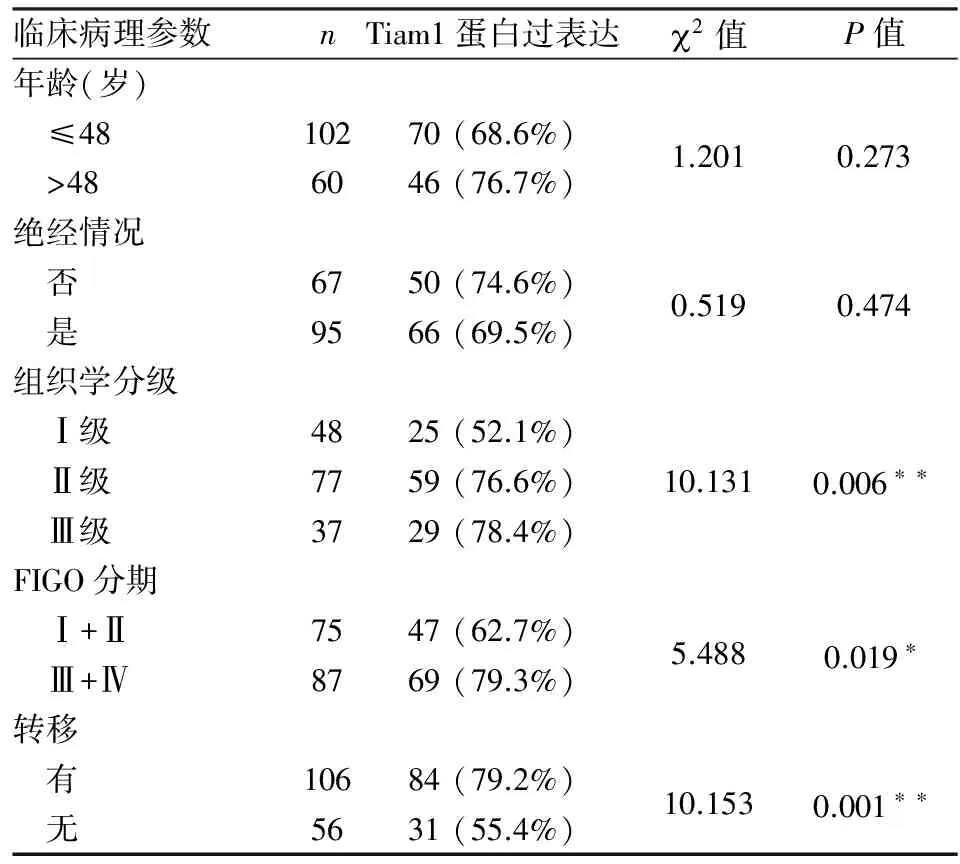
表2 Tiam1蛋白過表達與卵巢癌臨床病理特征的關系
*P<0.05,**P<0.01
2.3生存分析Kaplan-Meier生存分析顯示,Tiam1對卵巢癌患者生存期有顯著影響。Tiam1蛋白高表達的卵巢癌患者的總生存期和無瘤生存期均明顯低于Tiam1蛋白低表達者(Log-rank分別為4.850和4.488,P值分別為0.028和0.034,圖2)。Tiam1蛋白高表達的轉移性卵巢癌患者總生存期也明顯低于Tiam1蛋白低表達患者(Log-rank=7.968,P=0.006,圖3)。
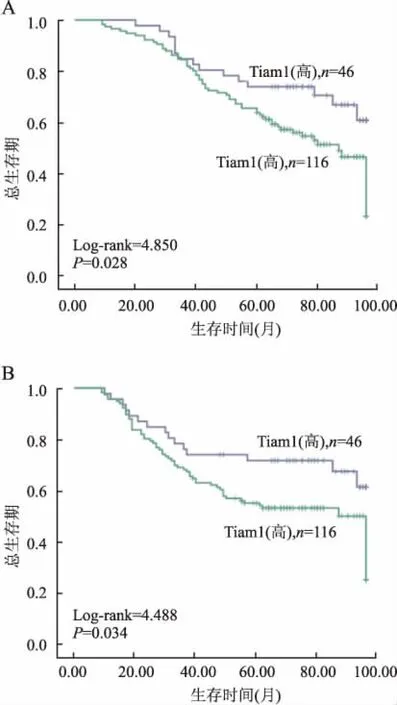
圖2 Tiam1表達與卵巢癌患者預后的Kaplan-Meier生存曲線
A. Tiam1表達與總生存期之間的關系;B.Tiam1表達與無瘤生存期之間的關系
3 討論
卵巢癌是全球高發的婦科惡性腫瘤之一。由于缺乏對卵巢癌的有效早期診斷以及分子治療靶點的識別,近30年來卵巢癌患者的5年生存率較低。目前,臨床上用于診斷卵巢癌的標志物主要為上皮來源標志物,如CA125和人附睪蛋白4(HE4)。CA125是來源于胚胎發育期體腔上皮并可與單克隆抗體OC125結合的糖蛋白,該蛋白主要見于上皮源性卵巢腫瘤患者的血清中,但因其診斷特異性差,所以未用于卵巢癌的篩查。HE4來源于附睪上皮的分泌型糖蛋白。該蛋白在正常組織和良性腫瘤中呈低表達或不表達,在卵巢癌和子宮內膜癌中呈高表達。HE4與CA125相比,其在卵巢良惡性腫瘤的鑒別中具有較大的優勢,但一般僅用于卵巢癌患者的治療監測。因此,發現更為有效的卵巢癌早期診斷以及預后評估分子標志物至關重要。
Tiam1最早于1994年由荷蘭癌癥研究發現,它可以促使Racl由失活狀態轉變為激活狀態,進而參與調控細胞骨架重組、細胞遷移、細胞浸潤及增強細胞能動性等過程[11-13]。Michiels等[14]研究顯示,Tiam1-Rac信號軸參與腫瘤細胞的浸潤與轉移;而Tiam1-Rac信號軸還可調控其他信號通路,如c-Jun氨基末端激酶通路(p38 MAPK)和細胞外信號調節的激酶通路,提示Tiam1-Rac信號通路參與基因的轉錄過程中。另外,作為鳥嘌呤核苷酸交換因子,Tiam1蛋白已被證明在一定范圍內可以通過調節Rho GTP酶參與腫瘤的信號轉導[15],進而抑制腫瘤的發生、發展及轉移[11,16]。因此,Tiam1表達/功能的改變可能會促進腫瘤發生、發展。
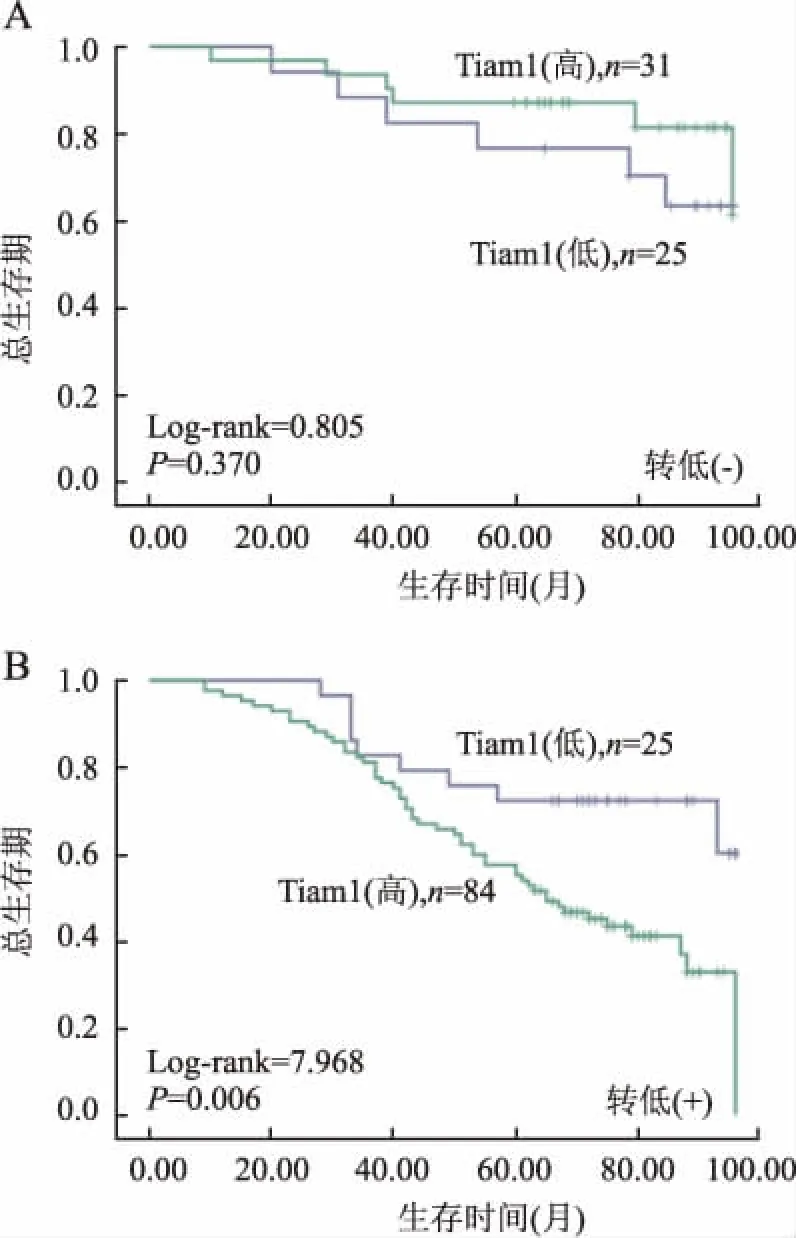
圖3 Tiam1表達與卵巢癌有無轉移患者預后的Kaplan-Meier生存曲線
A.Tiam1表達與卵巢癌無轉移患者總生存期之間的關系;B.Tiam1表達與卵巢癌轉移患者總生存期之間的關系
近年多項研究致力于Tiam1蛋白在腫瘤進展和轉移過程中的調控機制。Liu等[15]報道Tiam1蛋白在肺癌中呈高表達,進一步分析發現Tiam1高表達與肺癌的轉移密切相關。Yu等[13]研究證實,Tiam1蛋白在結直腸癌組織中呈顯著的高表達且與腫瘤的轉移密切相關,而將Tiam1基因沉默后則顯著抑制結直腸癌細胞的增殖和轉移能力。目前,Tiam1蛋白在卵巢癌中的作用尚未闡明。本組采用免疫組化SP兩步法染色明確Tiam1蛋白在卵巢癌中的表達,其主要定位于細胞質和細胞核。與卵巢良性病變組織相比,Tiam1蛋白在卵巢癌呈陽性或強陽性(P均<0.01)。與Li等[17]的研究結果一致,其報道顯示Tiam1在原發性和轉移性卵巢癌組織中的表達顯著高于正常卵巢組織。提示Tiam1蛋白高表達與卵巢癌的惡性程度密切相關。進一步分析Tiam1蛋白過表達與卵巢癌臨床病理特征的關系發現,Tiam1蛋白在晚期卵巢癌組織中的強陽性率顯著高于早期卵巢癌。此外,Tiam1蛋白的高表達與卵巢癌的轉移密切相關,提示Tiam1蛋白在卵巢癌的進展過程中發揮重要作用。相同的是,與高分化的卵巢癌相比,低分化卵巢癌的Tiam1強陽性率亦顯著升高。以上均提示Tiam1蛋白的表達可能在卵巢癌的發生、發展中發揮重要作用。作為腫瘤轉移誘導的關鍵基因,Tiam1蛋白在惡性腫瘤中高表達的分子機制有待于進一步分析。
許多研究表明,Tiam1可初步預測胃腺癌[18]、鼻咽癌[6]和食管癌[19]等多種腫瘤的預后,即Tiam1蛋白高表達患者生存期短、預后差。Ding等[20]研究顯示Tiam1高表達是肝癌預后的評估指標之一;Li等[9]通過免疫組化染色發現,Tiam1高表達是影響乳腺癌患者不良預后的獨立風險因素,可作為患者預后的重要輔助指標。本組運用Log-rank分析法發現Tiam1蛋白高表達與卵巢癌患者的總生存期及無瘤生存期密切相關,即Tiam1蛋白高表達的患者生存時間明顯少于低表達的患者。進一步分析生存期顯示,與無轉移的卵巢癌患者相比,Tiam1蛋白高表達的轉移性卵巢癌患者的總生存期明顯縮短,提示Tiam1蛋白高表達可成為卵巢癌患者不良預后的重要分子指標。
綜上所述,Tiam1參與卵巢癌的演進過程,在卵巢癌的轉移、侵襲中起著非常重要的作用,對于判斷卵巢癌的進展及預后具有重要的臨床價值,Tiam1的表達水平有望成為卵巢癌預后不良的有效監測指標。但Tiam1在惡性腫瘤中高表達的具體機制和途徑尚不清楚,有待進一步的分子生物學研究證實。
[1] Siegel R, Ma J, Zou Z,etal. Cancer statistics, 2014[J]. CA Cancer J Clin, 2014,64(1):9-29.
[2] 徐 明,楊 洋,車拴龍,等. NQO1過表達在卵巢黏液性囊腺癌預后評估中的意義[J]. 中國病理生理雜志, 2016,32(8):1461-1465.
[3] Habets G G, Scholtes E H, Zuydgeest D,etal. Identification of an invasion-inducing gene, Tiam-1, that encodes a protein with homology to GDP-GTP exchangers for Rho-like proteins[J]. Cell, 1994, 77(4):537-549.
[4] Cvitkovic E, Bachouchi M, Boussen H,etal. Leukemoid reaction, bone marrow invasion, fever of unknown origin, and metastatic pattern in the natural history of advanced undifferentiated carcinoma of nasopharyngeal type: a review of 255 consecutive cases[J]. J Clin Oncol, 1993,11(12):2434-2442.
[5] Engers R, Mueller M, Walter A,etal. Prognostic relevance of Tiam1 protein expression in prostate carcinomas[J]. Br J Cancer, 2006,95(8):1081-1086.
[6] Qi Y, Huang B, Yu L,etal. Prognostic value of Tiam1 and Rac1 overexpression in nasopharyngeal carcinoma[J]. ORLJ Otorhinolaryngol Relat Spec, 2009,71(3):163-171.
[7] Otsuki Y, Tanaka M, Kamo T,etal. Guanine nucleotide exchange factor, Tiam1, directly binds to c-Myc and interferes with c-Myc-mediated apoptosis in rat-1 fibroblasts[J]. J Biol Chem, 2003, 278(7):5132-5140.
[8] Bourguignon L Y, Zhu H, Shao L,etal. Ankyrin-Tiam1 interaction promotes Rac1 signaling and metastatic breast tumor cell invasion and migration[J]. J Cell Biol, 2000,150(1):177-191.
[9] Li Z, Liu Q, Piao J,etal. Clinicopathological implications of Tiam1 overexpression in invasive ductal carcinoma of the breast[J]. BMC Cancer, 2016,16(1):681.
[10] Li H, Cui X, Chen D,etal. Clinical implication of Tiam1 overexpression in the prognosis of patients with serous ovarian carcinoma[J]. Oncol Lett, 2016,12(5):3492-3498.
[11] Mertens A E, Roovers R C, Coilard J G. Regulation of Tiaml-Rac signalling[J]. FEBS Lett, 2003, 546(1):11-16.
[12] Bourguignon L Y, Zhu H, Shao L,etal. Ankyrin-Tiaml interaetion promotes Racl signaling and metastaticbreast tumor cell invasion and migration[J]. J Cell Biol, 2000,150(1):177-191.
[13] Yu L N, Zhang Q L, Li X,etal. Tiaml transgenic mice display increased tumor invasive and metastatic potential of colorectal cancer after 1,2-dimethylhydrazine treatment[J]. PLoS One, 2013,8(9):e73077.
[14] Michiels F, Habets G G, Stam J C,etal. A role for Rac in Tiam1-induced membrane ruffling and invasion[J]. Nature, 1995,375(6529):338-340.
[15] Liu S, Li Y, Qi W,etal. Expression of Tiam1 predicts lymph node metastasis and poor survival of lung adenocarcinoma patients[J]. Diagn Pathol, 2014,9:69.
[16] Minard M E, Kim L S, Price J E,etal. The role of the guanine nucleotide exchange factor Tiam1 in cellular migration, invasion, adhesion and tumor progression[J]. Breast Cancer Res Treat, 2004,84(1):21-32.
[17] Li J, Liang S, Jin H,etal. Tiam1, negatively regulated by miR-22, miR-183 and miR-31, is involved in migration, invasion and viability of ovarian cancer cells[J]. Oncol Rep, 2012,27(6):1835-1842.
[18] 張 源,楊 洋,車拴龍,等. 胃腺癌預后評估中Tiaml蛋白過表達的意義[J]. 臨床與實驗病理學雜志, 2016, 32(2):128-130,135.
[19] Wu Q Y, Wang Y, Tong J C,etal. Expression and clinical significance of Tiam1 gene in esophageal carcinoma[J]. Int J Clin Exp Med, 2015,8(11):21229-21234.
[20] Ding Y, Chen B, Wang S,etal. Overexpression of Tiam1 in hepatocellular carcinomas predicts poor prognosis of HCC patients[J]. Int J Cancer, 2009,124 (3):653-658.
ClinicalimplicationofTiam1proteinoverexpressioninovariancarcinoma
YANG Yang, SUN Jie, ZHU Guang, PIAO Jun-jie, LIN Zhen-hua
(DepartmentofPathology,YanbianUniversityMedicalCollege,Yanji133002,China)
PurposeTo investigate the clinicopathological significance of Tiam1 overexpression in ovarian carcinoma.MethodsTiam1 protein was detected in 98 serous carcinomas, 64 ovarian mucinous cystadenocarcinomas and 27 benign ovarian tumors using immunohistochemical of SP two-step staining. Correlations between Tiam1 overexpression and clinicopathological features of ovarian carcinoma were evaluated. Overall survival and disease-free survival rates of ovarian carcinoma patients were calculated by Kaplan-Meier method.ResultsTiam1 protein showed a cytoplasmic and nuclear staining pattern in ovarian carcinoma. The positive rate and strongly positive rate of Tiam1 protein were 84.7% (83/98) and 70.4% (69/98) in serous carcinoma, the positive rate and strongly positive rate of Tiam1 protein were 87.5% (56/64) and 73.4% (47/64) in ovarian mucinous cystadenocarcinoma, both of which were significantly higher than those in benign ovarian tumor (bothP<0.01). High-level expression of Tiam1 was positively correlated with the histological grade, FIGO stage, and metastasis in ovarian carcinoma (bothP<0.05), while independent of age and menopausal status (bothP>0.05). Kaplan-Meier survival analysis showed that overall survival and disease-free survival of ovarian cancer patients with high expression of Tiam1 protein were significantly lower than those of patients with lower expression of Tiam1 protein (P<0.05), overall survival in metastatic ovarian cancer patients with high expression of Tiam1 protein was significantly lower than those in patients with low Tiam1 protein expression (P<0.05).ConclusionTiam1 expression is significantly high in ovarian carcinoma. Tiam1 protein is closely associated with ovarian carcinoma progression, which may be a new potential prognostic biomarker and a therapeutic target for ovarian carcinoma.
ovarian neoplasm;Tiam1;immunohistochemistry; prognosis; survival analysis
時間:2017-9-18 6:23 網絡出版地址:http://kns.cnki.net/kcms/detail/34.1073.R.20170918.0623.001.html
R 737.31
A
1001-7399(2017)09-0945-05
10.13315/j.cnki.cjcep.2017.09.001
接受日期:2017-07-25
國家自然科學基金(61371067)
延邊大學醫學院病理學教研室,延吉 133002
楊 洋,女,博士研究生。E-mail: 313828301@qq.com
林貞花,女,教授,博士生導師,通訊作者。Tel:(0433)2435056,E-mail: zhlin720@ybu.edu.cn

