基于線粒體DNA COⅠ基因鑒別畜禽肉中雞源性成分
唐修君+樊艷鳳+葛慶聯+賈曉旭+張靜+劉茵茵+張小燕+王玨+高玉時

摘 要:為建立畜禽肉中雞源性成分的快速檢測方法,以線粒體DNA細胞色素C氧化酶亞基Ⅰ(COⅠ)基因序列為靶點,比較羊、牛、豬、兔、鴿、鵪鶉、雞、鴨、鵝9 種動物COⅠ基因的差異位點,設計篩選雞特異性引物,進行常規聚合酶鏈式反應(polymerase chain reaction,PCR)和熒光定量PCR檢測。結果表明:所設計的引物僅對雞肉DNA模板有擴增條帶和典型擴增曲線,且循環閾(cycle threshold,Ct)值為21.78,對其他動物DNA模板無擴增。方法特異性較強,靈敏度較高,達pg級,可以用于畜禽肉與肉制品中雞源性成分的快速、有效、準確檢測。
關鍵詞:雞源性成分;線粒體DNA;COⅠ基因;熒光定量PCR
Identification of Chicken Origin Ingredients in Livestock and Poultry Meat Based on Mitochondrial DNA COI Gene
TANG Xiujun, FAN Yanfeng, GE Qinglian, JIA Xiaoxu, ZHANF Jing, LIU Yinyin, ZHANG Xiaoyan, WANG Jue, GAO Yushi*
(Institute of Poultry, Chinese Academy of Agricultural Sciences, Yangzhou 225125, China)
Abstract: In this study, a quick method to identify ingredients of chicken origin in livestock and poultry meat was developed by polymerase chain reaction (PCR) and fluorescence quantitative PCR using mitochondrial DNA cytochrome C coxidase subunit Ⅰ (CO Ⅰ) gene as target gene. The mitochondrial DNA CO Ⅰ genes from chicken, duck, goose, pig, cattle, sheep, rabbit, pigeon and quail revealed distinct loci. Based on this, a set of chicken-specific primers was designed. The results showed that the designed primers could only amplify template DNA from chicken with a cycle threshold (Ct) value of 21.78. The PCR assay had a high specificity and sensitivity (at pg level) and it could be used to detect ingredients of chicken origin in livestock and poultry meat quickly and accurately.
Key words: chicken origin ingredients; mitochondrial DNA; cytochrome C coxidase subunit I (CO I) gene; fluorescence quantitative PCR
DOI:10.7506/rlyj1001-8123-201708009
中圖分類號:TS207.3 文獻標志碼:A 文章編號:1001-8123(2017)08-0044-05
作為人類重要的營養來源,肉類與人們的生活和健康密切相關,然而在利益驅動下肉制品摻雜、摻假事件時有發生,“掛鵝頭賣鴨肉”、非法使用添加劑牛肉膏等食品安全事件不斷出現,嚴重侵害了消費者的權益。肉類來源鑒別的傳統方法是依靠感官評價和肉類形態學手段,但這些已遠不能滿足監管部門對肉制品摻雜、摻假現象的監控,因此加強肉類產品中動物源性成分的檢測技術研究意義重大。
隨著分子生物學技術的不斷發展,以DNA為基礎的聚合酶鏈式反應(polymerase chain reaction,PCR)技術以其獨特的優勢被越來越多地應用于畜禽肉源性成分的鑒別,并已逐步成為肉類產品中動物源性成分鑒定的核心方法[1-4]。近年來,實時熒光定量PCR技術憑借其特異性良好、自動化程度高、檢測周期短以及擴增目的片段較小等優勢在動物源性成分鑒別中成為研究熱點,極大地提高了動物源性成分定性檢測的效率和靈敏度[5-6]。林彥星等[7]根據鴨mt DNA Cox基因保守序列設計特異性引物和Taq Man探針,建立了畜禽肉制品中鴨源性成分的熒光定量PCR檢測方法。孫晶瑩等[8]根據牛線粒體DNA片段設計合成了2 對特異性引物,以生牛肉、熟牛肉和牛肉制品為研究對象,建立了牛肉制品中牛源性成分的多重實時熒光PCR檢測方法。熒光定量PCR技術的絕對優勢使其能夠實現樣品的定量檢測,并且能夠簡化實驗步驟,可以同時實現對目標片段的定性和定量檢測,但由于其靈敏度較高,檢測結果易產生假陽性,因此對實驗室條件和檢驗人員的要求較高。
動物線粒體基因組序列具有高度物種特異性、拷貝數多以及在食品加工過程中未完全降解等特點,是進行動物源性成分鑒別的良好靶基因[9-11]。近年來陸續報道了一些基于12S rRNA[12]、Cyt b[13]等序列的線粒體基因片段進行肉品中動物源性成分鑒別的方法,但所用到的動物品種相對較少。為進一步完善畜禽肉中雞源性成分的檢測技術,本研究擬選擇線粒體DNA COⅠ基因為靶基因,根據羊、牛、豬、兔、鴿、鵪鶉、雞、鴨、鵝9 種動物COⅠ基因的差異位點設計、篩選雞特異性引物,建立基于常規PCR和熒光定量PCR技術的畜禽肉中雞源性成分的快速鑒別方法,為肉制品的摻雜識別提供依據。endprint
1 材料與方法
1.1 材料與試劑
新鮮的羊肉、牛肉、豬肉、兔肉、鴿肉、鵪鶉肉、雞肉、鴨肉、鵝肉 揚州市邗江區竇莊農貿市場;火
腿腸 金鑼集團有限公司;臘雞腿 上海萬有全集團有限公司。
基因組DNA抽提試劑盒 北京天根生化科技有限公司;
2×PCR Mix 南京博爾迪公司;電泳上樣緩沖液
寶生物工程(大連)有限公司;瓊脂糖 美國Promega公司;熒光染料預混液:AceQ qPCR SYBR Green Master Mix 南京諾唯贊生物科技有限公司。
1.2 儀器與設備
BioPhotometer Plus核酸蛋白檢測儀、5331 PCR儀 德國Eppendorf公司;7500實時熒光PCR擴增儀 美國ABI公司;GBox凝膠成像分析系統 基因有限公司。
1.3 方法
1.3.1 DNA提取
將9 種動物肉樣分別攪碎至肉糜狀,備用。使用Beyotime基因組DNA小量抽提試劑盒提供的蛋白酶K法提取各樣本的DNA。經核酸蛋白檢測儀測定,9 種動物肉樣的DNA模板質量濃度在110~210 ng/μL之間,其中雞肉為174.57 ng/μL。
1.3.2 引物設計與合成
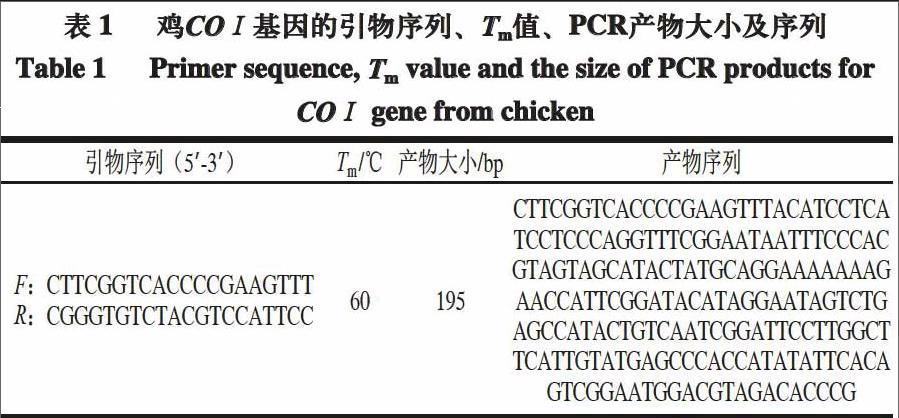
以Genbank上公布的羊、牛、豬、兔、鴿、鵪鶉、雞、鴨、鵝的線粒體DNA COⅠ基因序列為靶基因,通過Arraydesigner 2.0、Oligo 6.0和Primer Premier 5.0軟件進行比對分析,設計合成雞特異性引物,由生工生物工程(上海)股份有限公司負責合成,引物序列、DNA熔解溫度(melting temperature,Tm)、PCR擴增片段大小和產物序列如表1所示。
1.3.3 常規PCR擴增與測序
20 μL反應體系:2×PCR Mix 10 μL、10 μmol/L正向引物和反向引物各0.2 μL、模板1 μL、雙蒸滅菌水8.6 μL。反應條件:95 ℃預變性5 min,95 ℃變性30 s,60 ℃退火30 s,72 ℃延伸60 s,30 個循環,最后72 ℃延伸10 min。反應結束后用15 g/L瓊脂糖凝膠電泳對PCR產物進行檢測,電泳結束后割膠回收、純化,交由上海華大基因科技有限公司進行雙向測序,將測序結果與GenBank上的已知序列進行比對。
1.3.4 熒光定量PCR擴增
15 μL反應體系:Mix 7.5 μL、染料(Dye)0.3 μL、1 μmol/L正向引物和反向引物各0.5 μL、模板1 μL、雙蒸滅菌水5.2 μL。反應條件:50 ℃酶激活2 min,95 ℃預變性10 min,95 ℃變性15 s,60 ℃延伸1 min,40 個循環。反應結束后,觀察各動物模板DNA的擴增曲線及循環閾(cycle threshold,Ct)值,判定引物的特異性。若無典型擴增曲線且Ct值大于35,則檢測體系無特異性擴增。
1.3.5 靈敏度實驗
將DNA模板分別稀釋101~108 倍,測定方法的靈敏度,反應條件同1.3.3和1.3.4節。
1.3.6 實際樣品檢測
隨機抽取市售火腿腸和臘雞腿作為樣品,利用本研究建立的方法進行檢測。
1.4 數據處理
應用7500實時熒光PCR擴增儀自帶軟件對PCR擴增產物進行高分辨率熔解曲線分析,確定擴增產物的Tm值和熔解曲線。
2 結果與分析
2.1 常規PCR擴增結果
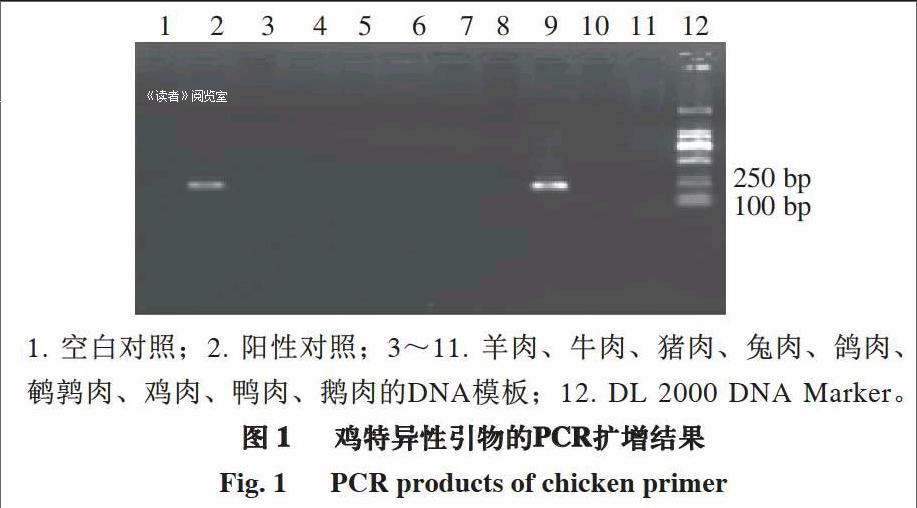
由圖1可知,用雞特異性引物分別與不同動物的DNA模板進行擴增時,僅雞的DNA模板擴增出195 bp的條帶,而其他物種的DNA模板無擴增。由圖2可知,將雞的DNA模板按10倍梯度進行稀釋,當稀釋倍數達104,即DNA模板質量濃度為17.457 pg/μL時仍有特異性條帶出現,表明檢測靈敏度達到pg級。
2.2 熒光定量PCR擴增結果
以設計篩選的雞特異性引物作為引物,以9 種動物的肌肉DNA為模板,進行熒光定量PCR擴增檢測。由圖3及表2可知,只有雞的肌肉DNA模板出現了典型擴增曲線,且Ct值為21.78,而其他動物的肌肉DNA模板均未出現典型擴增曲線。
2.3 熒光定量PCR的靈敏度檢測
將雞的DNA模板分別稀釋101~108 倍,采用2 種體積的引物(上、下游引物濃度均為10 μmol/L)進行方法的靈敏度檢測,確定方法的檢測下限。由圖4~5及表3可知,當引物體積為0.05 μL時,稀釋103 倍的雞DNA模板有典型擴增曲線,且Ct值小于35,此時雞DNA模板質量濃度為175 pg/μL;當引物體積為0.20 μL時,稀釋104 倍的雞DNA模板有典型擴增曲線,且Ct值小于35,此時雞DNA模板質量濃度為17.5 pg/μL。表明所建立的熒光定量PCR方法靈敏度較高,達到pg級。
2.4 實際樣品測定
對大、中型超市和農貿市場的相關樣品進行抽檢,火腿腸及臘雞腿肉樣品均通過優化后的十六烷基三甲基溴化銨(hexadecyltrimethy ammonium bromide,CTAB)法[14]進行DNA提取。由表4可知,標識主要原料肉為雞肉的火腿腸和臘雞腿中檢測出雞源性成分,而標識主要原料肉為豬肉和牛肉的火腿腸中未檢測出雞源性成分,表明該方法可以用于畜禽肉與肉制品中雞源性成分的快速、有效檢測。
3 討 論
近年來,肉類摻假等食品安全事件屢屢發生,建立畜禽肉中動物源性成分的快速鑒別技術顯得尤為重要[15-17]。目前我國肉類摻假識別方面的技術相對落后,肉類制品摻假的定量檢測方法和相關國家標準仍為空白[18]。隨著人們對食品安全的日益重視以及分子生物學等技術的飛速發展,動物源性成分的多種檢測技術相繼涌現[3,19],其中以核酸檢測為基礎的食品中肉類成分的鑒別與分析技術已逐漸成熟[20-21]。endprint
熒光定量PCR技術近年來迅速發展,具有簡單、快速、靈敏度和準確性高等優點,不僅可以提高肉與肉制品中動物源性成分定性檢測的準確性,而且使得定量檢測成為可能,應用前景非常廣闊[22-24]。齊春萌等[25]根據鴕鳥線粒體細胞色素C氧化酶亞基Ⅰ(COXⅠ)基因序列設計特異性引物和Taq Man探針,建立了肉制品中鴕鳥源性成分的實時熒光PCR鑒定方法。許如蘇等[26]基于馬的種屬保守序列設計特異性引物和Taq Man-LNA探針,建立了可快速檢測肉制品中馬源性成分的Taq Man-LNA熒光PCR檢測方法。馮震等[27]以線粒體細胞色素b(cytochrome b,Cytb)基因的核苷酸序列為檢測靶點,設計并優化引物,建立了基于熒光定量PCR技術的生鮮肉中牛、羊源性成分的檢測方法,并對方法的特異性和靈敏度進行了驗證。
目前,有關畜禽肉中雞源性成分檢測方法的研究報道相對較少,而且已有報道中涉及到的動物種類較少[28-29]。
本研究根據羊、牛、豬、兔、鴿、鵪鶉、雞、鴨、鵝9 種動物線粒體DNA COⅠ基因序列的位點差異設計雞特異性引物,進行常規PCR和熒光定量PCR擴增檢測。結果表明,所選定的引物對只有在雞模板DNA存在的情況下才會發生反應,產生特異性擴增條帶和擴增曲線,而與羊、牛、豬、兔、鴿、鵪鶉、鴨、鵝8 種動物的DNA模板均無反應,可見所設計篩選的引物特異性較好,可以用于畜禽肉中雞源性成分的快速、準確檢測。該方法的建立不僅可以完善我國肉與肉制品中雞肉摻假的定量檢測方法,也為打擊肉類產品的摻雜、摻假等違法違規行為提供了技術保障,對于政府部門的監督管理工作具有極其重要的意義。
4 結 論
本研究以線粒體DNA COⅠ基因為靶基因,設計篩選出了雞特異性引物,采用常規PCR和實時熒光定量PCR技術建立了畜禽肉中雞源性成分的快速、準確定量分析方法,方法特異性較好,靈敏度較高,可達pg級。
參考文獻:
[1]MURUGAIAH C, NOOR Z M, MASTAKIM M, et al. Meat species identification and Halal authentication analysis using mitochondrial DNA[J]. Meat Science, 2009, 83(1): 57-61. DOI:10.1016/j.meatsci.2009.03.015.
[2]MANE B G, MENDIRATTA S K, TIWARI A K. Polymerase chain reaction assay for identi?cation of chicken in meat and meat products[J]. Food Chemistry, 2009, 116(3): 806-810. DOI:10.1016/j.foodchem.2009.03.030.
[3]GHOVVATI S, NASSIRI M R, MIRHOSEINI S Z, et al. Fraud identi?cation in industrial meat products by multiplex PCR assay[J]. Food Control, 2009, 20(8): 696-699. DOI:10.1016/j.foodcont.2008.09.002.
[4]張馳, 楊軍, 王曉麗. 基于線粒體編碼基因差異對食品中牛肉與豬肉成分的鑒別[J]. 食品科技, 2011, 36(1): 83-88.
[5]KESMEN Z, GΜLLUCE A, SAHIN F, et al. Identi?cation of meat species by Taq Man-based real-time PCR assay[J]. Meat Science, 2009, 82(4): 444-449. DOI:10.1016/j.meatsci.2009.02.019.
[6]王穎, 史艷宇, 劉金華, 等. 熒光定量PCR方法檢測畜肉食品中豬源性成分[J]. 食品安全質量檢測學報, 2013, 4(5): 1529-1534.
[7]林彥星, 張彩虹, 阮周曦, 等. 實時熒光定量PCR檢測畜禽肉制品中鴨源性成分[J]. 動物醫學進展, 2016, 37(11): 48-53. DOI:10.3969/j.issn.1007-5038.2016.11.010.
[8]孫晶瑩, 孫麗君, 王曉紅, 等. 肉制品中牛源性成分多重實時熒光PCR檢測方法的建立及初步應用[J]. 食品安全質量檢測學報, 2016, 7(9): 3756-3760.
[9]BALLIN N Z, VOGENSEN F K, KARLSSON A H. Species determination: can we detect and quantify meat adulteration?[J]. Meat Science, 2009, 83(2): 165-174. DOI:10.1016/j.meatsci.2009.06.003.
[10]何瑋玲, 張馳, 楊靜, 等. 食品中4 種肉類成分多重PCR的快速鑒別方法[J]. 中國農業科學, 2012, 45(9): 1873-1880. DOI:10.3864/j.issn.0578-1752.2012.09.024.
[11]張晶鑫, 樊艷鳳, 唐修君, 等. 基于線粒體DNA 16S rRNA基因鑒別畜禽肉中鴨源性成分研究[J]. 中國家禽, 2016, 38(17): 41-44. DOI:10.16372/j.issn.1004-6364.2016.17.009.endprint
[12]王蘭萍, 耿榮慶, 王偉, 等. 基于線粒體12S rRNA基因序列鑒別牛肉的種源[J]. 家畜生態學報, 2013, 34(2): 19-21. DOI:10.3969/j.issn.1673-1182.2013.02.005.
[13]錢云開, 王海洋, 崔宗巖, 等. 實時熒光PCR法快速檢測肉類中貉源性成分[J]. 中國食品衛生雜志, 2016, 28(5): 602-605. DOI:10.13590/j.cjfh.2016.05.009.
[14]何海寧, 洪霞, 馮玉升, 等. 加工食品中動物源DNA的提取和多重PCR檢測方法的建立[J]. 食品與機械, 2015, 31(6): 79-83.
[15]陳冬, 柏凡, 周明亮, 等. 基于線粒體12S rRNA基因鑒別混合牛肉及制品的牛種來源[J]. 遺傳, 2008, 30(8): 1008-1014. DOI:10.3321/j.issn:0253-9772.2008.08.010.
[16]曾少靈, 秦智鋒, 阮周曦, 等. 多重實時熒光PCR檢測牛、山羊和綿羊源性成分[J]. 生物工程學報, 2009, 25(1): 139-146. DOI:10.3321/j.issn:1000-3061.2009.01.021.
[17]唐修君, 樊艷鳳, 賈曉旭, 等. 基于線粒體16S rRNA基因鑒別畜禽肉中5 種動物源性成分[J]. 食品科技, 2015, 40(12): 86-89.
[18]徐瓊, 張奕南, 顧文佳, 等. Taq Man實時熒光PCR法定量檢測生肉中豬源性成分的建立[J]. 食品科技, 2016, 41(2): 309-313.
[19]馬靈飛, 周圍, 張雅珩, 等. 基于脂肪酸差異的肉制品中豬源性成分鑒別方法的研究[J]. 分析測試學報, 2016, 35(10): 1295-1300. DOI:10.3969/j.issn.1004-4957.2016.10.013.
[20]石盼盼, 李旭, 吳昊, 等. 肉及肉制品中動物源性成分核酸檢測方法研究進展[J]. 食品研究與開發, 2016, 37(10): 211-214. DOI:10.3969/j.issn.1005-6521.2016.10.052.
[21]李宗夢, 趙良娟, 趙宏, 等. 肉及肉制品動物源性成分鑒別技術研究進展[J]. 食品研究與開發, 2014, 35(18): 122-127. DOI:10.3969/j.issn.1005-6521.2014.18.032.
[22]MART?N I, GARC?A T, FAJARDO V, et al. SYBR-Green real-time
PCR approach for the detection and quanti?cation of pig DNA in feedstuffs[J]. Meat Science, 2009, 82(2): 252-259. DOI:10.1016/j.meatsci.2009.01.023.
[23]LAUBE I, ZAGON J, BROLL H. Quantitative determination of commercially relevant species in foods by real-time PCR[J]. International Journal of Food Science and Technology, 2007, 42(3): 336-341. DOI:10.1111/j.1365-2621.2006.01249.x.
[24]范麗麗, 李培, 傅春玲, 等. 食品中雞源性成分實時熒光PCR檢測方法的建立[J]. 食品科學, 2014, 35(2): 248-251. DOI:10.7506/spkx1002-6630-201402048.
[25]齊春萌, 楊昕霆, 薛晨玉, 等. 肉制品中鴕鳥源性成分的實時熒光PCR檢測[J]. 中國食品學報, 2016, 16(7): 246-251. DOI:10.16429/j.1009-7848.2016.07.033.
[26]許如蘇, 周廣彪, 段建發, 等. Taq Man-LNA熒光PCR快速檢測肉制品中馬源性成分的研究[J]. 中國動物檢疫, 2015, 32(7): 62-66. DOI:10.3969/j.issn.1005-944X.2015.07.017.
[27]馮震, 楊美成. 生鮮肉中牛源性和羊源性成分定量檢測方法的建立[J].
食品安全質量檢測學報, 2016, 7(3): 877-886.
[28]汪永信, 安虹, 程堅, 等. 雙重實時熒光PCR法檢測食品和飼料中的雞源性成分[J]. 生物技術通報, 2012(1): 134-138.
[29]金萍, 結莉, 陸俊, 等. Taq Man探針熒光聚合酶鏈式反應實時同步鑒定動物源性食品中豬肉、雞肉源性成分[J]. 肉類研究, 2016, 30(9): 17-22. DOI:10.15922/j.cnki.rlyj.2016.09.004.endprint

