肌注氟苯尼考在鴨疫里氏桿菌感染鴨體內的藥動學特征
梅獻,萬鵬,韓東東,裴鵬飛,曾慶林,李曉虹,曾振靈
?
肌注氟苯尼考在鴨疫里氏桿菌感染鴨體內的藥動學特征
梅獻,萬鵬,韓東東,裴鵬飛,曾慶林,李曉虹,曾振靈
(華南農業大學獸醫學院/廣東省獸藥研制與安全評價重點實驗室,廣州 510642)
研究并比較肌注氟苯尼考在2周齡健康和鴨疫里氏桿菌感染鴨體內的藥代動力學特征。240只鴨隨機分為2組,各120只鴨,其中一組用鴨疫里氏桿菌腿部感染,分別以30 mg·kg-1體重單劑量肌內注射氟苯尼考,采血點為給藥前和給藥后5、10、15、20、30、45 min和1、1.5、2、4、8、10、14 h。采用高效液相色譜法 (HPLC) 測定血漿氟苯尼考的濃度,采用紫外檢測器檢測,檢測波長為223 nm,流動相為乙腈和水,其體積比為26和74 ,流速為1 mL·min-1,色譜柱為Agilent C18 (4.6 mm×150 mm,5 μm),進樣量為20 μL。藥動學分析軟件 WinNonlin 5.2.1以非房室模型擬合處理血藥濃度-時間數據,計算相關的藥動學參數,并用統計學軟件SPSS17.0對藥動學參數進行檢驗統計學分析。氟苯尼考在健康鴨體內的峰濃度(Cmax)為(22.88±3.11) μg·mL-1,表觀分布容積(Vd/F)為(2.39±0.81) L·kg-1,體清除率(ClB/F)為(0.64±0.11) L·h-1·kg-1,消除半衰期(t1/2β)為 (2.57±0.51) h和藥時曲線下面積(AUC)為(47.28±7.87) μg·mL-1·h;氟苯尼考在感染鴨體內的峰濃度(Cmax)為(19.77±1.82) μg·mL-1,表觀分布容積(Vd/F)為(2.44±0.46) L·kg-1,體清除率(ClB/F)為(0.63±0.08) L·h-1·kg-1,消除半衰期(t1/2β)為(2.74±0.54) h和藥時曲線下面積(AUC)為(48.11±6.62) μg·mL-1·h 。統計分析氟苯尼考在健康鴨和感染鴨的藥動學參數,結果表明,除了Cmax差異顯著(<0.05),其他參數差異均不顯著(>0.05)。兩者的主要藥動學參數相比較,感染鴨體內的Cmax顯著低于(<0.05)健康鴨體內的Cmax,其他參數無顯著性差異。氟苯尼考以30 mg·kg-1體重肌內注射在健康和感染鴨體內具有吸收迅速,峰濃度高,體內分布廣泛,消除較快的特點。
氟苯尼考;鴨疫里氏桿菌;藥代動力學;腿部感染;鴨
0 引言
【研究意義】自1982年郭玉璞[1]首次報道鴨疫里氏桿菌()病以來,目前該病已成為嚴重危害中國養鴨業的主要細菌性傳染病之一。鴨疫里氏桿菌主要侵害2—7周齡的鴨,臨床剖檢癥狀主要表現為纖維素性心包炎、肝周炎、氣囊炎和腦膜炎等,抗生素治療是預防和治療鴨疫里氏桿菌感染的主要方法[2,3]。氟苯尼考(florfenicol)是由美國先靈-葆雅公司研制出的一種動物專用的酰胺醇類廣譜抗生素。中國于 1999 年批準氟苯尼考為國家二類新獸藥。目前,氟苯尼考用于敏感菌所致的畜禽細菌性疾病的治療[4-7]。動物疾病模型是近些年來獸醫藥代動力學常用的研究手段。由于疾病會影響患病動物機體對藥物的吸收、分布、代謝和排泄過程,因此動物疾病模型在醫學科學的研究中占有重要的地位[8]。王麗平等[9]比較研究了健康和人工感染豬鏈球菌2型強毒力株HA9801和弱毒力株SS2-H對ICR小鼠體內肝臟藥物代謝酶活性的變化。結果表明,豬鏈球菌感染可調節小鼠肝臟藥物代謝酶CytP450、Cytb5、NCCD、ERND、AH和GSH-S-T活性。劉滌潔等[10]研究了不同給藥途徑恩諾沙星(2.5 mg·kg-1)在健康和人工誘發乳房炎奶山羊的藥動學比較,結果發現乳房炎的發生可以改變恩諾沙星在奶山羊體內的代謝。本文對2周齡鴨采取人工感染鴨疫里氏桿菌制造病理模型,進行藥動學研究。【前人研究進展】1997年CRAENE[11]報道牛單劑量靜注氟苯尼考(20 mg·kg-1),能很好滲透進入腦脊液中,可作為治療腦膜炎的首選藥物。CHEN等[12]研究了1999—2009年臺灣分離的222株鴨疫里氏桿菌對22種抗生素的敏感性,其中氨芐西林、阿莫西林/克拉維酸、頭孢噻吩、氟苯尼考、大觀霉素、多西環素、紅霉素對鴨疫里氏桿菌敏感。余金金等[13]對600只35日齡疑似患鴨疫里氏桿菌的病肉鴨,無菌挑取病鴨心包積液接種到巧克力瓊脂平板培養基上培養并增菌后,分別用氟苯尼考、阿莫西林、恩諾沙星粉進行紙片藥敏試驗,結果顯示氟苯尼考有效率高于阿莫西林組和恩諾沙星組。氟苯尼考在體內外抗鴨疫里氏桿菌均取得了良好的效果[14-15]。【本研究切入點】目前國內外尚無氟苯尼考在鴨疫里氏桿菌感染鴨體內藥代動力學研究的報道。本研究探討了氟苯尼考在健康和鴨疫里氏桿菌感染鴨體內的藥代動力學,為臨床上合理使用氟苯尼考治療鴨疫里氏桿菌病提供實驗依據。【擬解決的關鍵問題】人工感染鴨疫里氏桿菌模型的構建。通過比較氟苯尼考在健康和鴨疫里氏桿菌鴨體內的藥動學,對臨床上治療鴨疫里氏桿菌病具有重要參考價值。
1 材料與方法
1.1 材料
1.1.1 儀器與試劑 2695型高效液相色譜儀,包含四元梯度高精密度輸液泵、2489型紫外檢測器、真空在線脫氣系統;氟苯尼考原料藥(含量為98%,批號:03062016),購自廣州翔博生物科技有限公司;氟苯尼考標準品(含量為99.3%,批號:K0301305,購自中國獸醫藥品監察所;乙腈(色譜級)、甲醇(色譜級),購自美國Thermo Fisher公司。試驗用水由Milli-Q超純水系統制造。其他試劑為國產分析純或化學純試劑。Millipore 10kD型超濾管購自美國Millipore公司。
1.1.2 溶劑配制 氟苯尼考標準儲備液:精密稱取氟苯尼考標準品10.07 mg于10 mL 棕色容量瓶中,用適量乙腈溶解,然后用超純水定容至刻度,使藥液濃度為1 mg·mL-1,分裝后置于-20°C冰箱保存。臨用前,以流動相(V乙腈﹕V水=26﹕74)稀釋成所需濃度的工作液。
氟苯尼考注射液:稱取0.3061 g的氟苯尼考原料藥至10 mL棕色容量瓶中,先用少量二甲基甲酰胺溶解,再用PEG-200定容至刻度,現配現用。
1.1.3 試驗動物與菌株 試驗動物:1日齡櫻桃谷鴨,購自佛山某家禽有限公司。飼喂無抗生素的全價飼料至2周齡后進行試驗。試驗時鴨體重為90—110 g。
鴨疫里氏桿菌:臨床菌株,血清Ⅰ型,由本教研室分離、鑒定后凍干粉保存[16]。
1.1.4 試驗時間與地點 2016年1月至2017年1月在華南農業大學/廣東省獸藥研制與安全評價重點實驗室。
1.2 建立鴨疫里氏桿菌感染模型
1.2.1 菌液準備 將鴨疫里氏桿菌接種于10 mL含5%新生牛血清的TSB肉湯培養基中培養,細菌達到對數生長期時4 000 r/min離心10 min。除去液體后,底部細菌用10 mL 0.85 %無菌生理鹽水重懸一次,最后將菌液濃度調整為109CFU(菌落形成單位)·mL-1左右,備用。
1.2.2 鴨疫里氏桿菌感染模型 鴨腿部肌內注射約109CFU·mL-1準備的菌液0.5 mL,對照組腿部肌內注射等量的0.85 %無菌生理鹽水,分別于3、6、9、12 h后心臟采血0.1 mL,血樣用0.85 %無菌生理鹽水10倍系列稀釋,系列稀釋液各取0.1 mL于含5 %新生牛血清的TSA瓊脂板上涂板,置于37℃含5% CO2培養箱內培養18—24 h,對菌落數大于30并且小于300的稀釋度計數,單位CFU·mL-1。
1.3 氟苯尼考在鴨體內的藥代動力學
1.3.1 氟苯尼考在健康鴨體內的藥代動力學 120只健康鴨隨機分為5組,每組3只,8個平行,分別單劑量(30 mg·kg-1b.w.)腿部肌內注射氟苯尼考注射液后,參照QIU[3]的拼點方法,于給藥前和給藥后5、10、15、20、30、45 min和1、1.5、2、4、8、10、14 h通過頸靜脈采血,每個時間點采集0.4 mL左右血樣,置于含肝素鈉的2 mL離心管中4 °C條件下,3 500 r/min離心10 min,取上清液為待測血漿,-20°C冰箱保存,備用。
1.3.2 氟苯尼考在感染鴨體內的藥代動力學 在鴨體內成功建立鴨疫里氏桿菌感染模型的基礎上,建立模型后6 h時,將120只感染鴨隨機分為5組,每組3只,8個平行,分別單劑量(30 mg·kg-1b.w.)腿部肌內注射氟苯尼考注射液后,拼點方法、采血時間和血漿樣品的制備均同上。
1.4 鴨血漿中氟苯尼考的高效液相色譜測定
1.4.1 色譜條件 色譜柱:Agilent C18(4.6 mm× 150 mm,5 μm); 流動相:V乙腈﹕V水=26﹕74; 流速1 mL·min-1; 紫外檢測波長223 nm; 進樣量20 μL; 柱溫:30°C。
1.4.2 樣品前處理 參考文獻[17]的方法,血漿樣品解凍后,用乙酸乙酯提取2次,合并上清液,在45°C水浴中氮氣吹干,流動相復溶,HPLC 測定。
1.4.3 標準曲線與線性范圍 準確吸取健康鴨空白血漿180 μL,加入20 μL的氟苯尼考標準工作液,制得濃度為32,16,8,4,1,0.8,0.4,0.1 μg·mL-1的標準添加樣品,按照樣品前處理的方法處理,用最小二乘法進行線性回歸,得到標準曲線方程和相關系數。
1.5 數據處理
采用 WinNonlin 5.2.1軟件進行分析,以非房室模型對鴨血漿氟苯尼考濃度-時間數據進行處理,并用統計學軟件SPSS17.0對藥動學參數進行檢驗統計學分析。
2 結果
2.1 鴨疫里氏桿菌在鴨體內的生長情況
本試驗成功建立了人工感染鴨疫里氏桿菌模型,結果表明,鴨腿部肌內注射約109.0CFU·mL-1的鴨疫里氏桿菌菌液,感染6 h后,鴨精神沉郁、縮頸呆立、腿軟、嗜睡、共濟失調,食欲減少兩眼流淚,眼眶周圍羽毛被粘濕,鼻有分泌物,拉黃綠色稀便的癥狀逐漸明顯。感染6—9 h之間,血樣菌量比較穩定。鴨疫里氏桿菌在鴨心臟血液內的細菌數量見表1。
2.2 檢測方法的特異性
在上述色譜工作條件下,氟苯尼考的峰形良好,噪音低,信號強度高。氟苯尼考的保留時間為6.34 min。
表1 不同時間點鴨疫里氏桿菌在鴨心臟血液內的細菌數量
鴨血漿中氟苯尼考在 0.1—32 μg·mL-1范圍內線性良好,在0.2、2、16 μg·mL-13個濃度添加水平的平均回收率分別為(86.94±7.51) %、(89.97±10.61) %和(95.41±5.99) %,批內和批間變異系數分別小于10%和15%。鴨血漿樣品中氟苯尼考的定量限為0.1 μg·mL-1,檢測限為 0.05 μg·mL-1。
2.3 肌內注射氟苯尼考在鴨血漿中的藥動學特征
健康和感染鴨分別以單劑量30 mg·kg-1b.w.肌內注射氟苯尼考后,不同時間的血藥濃度實測值見表2,血漿中氟苯尼考濃度-時間數據采用非房室模型擬合,計算藥代動力學參數。鴨血漿中氟苯尼考濃度-時間曲線見圖1。氟苯尼考在鴨血漿中的藥動學參數見表3。
表2 健康和感染鴨肌內注射氟苯尼考的平均血藥濃度
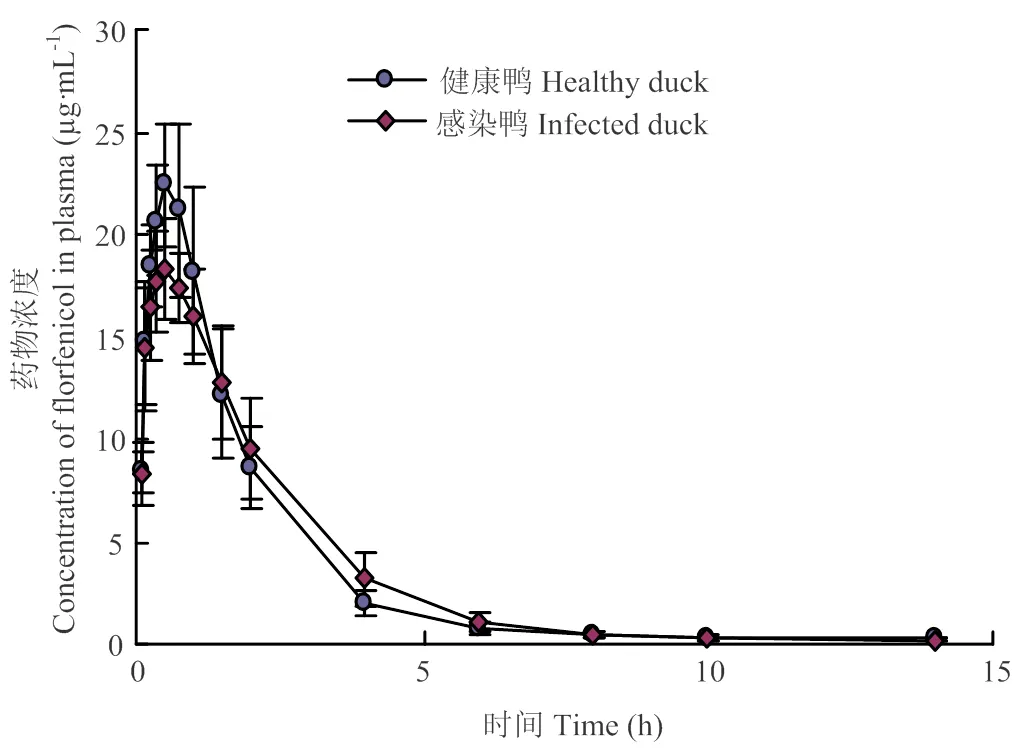
圖1 健康和感染鴨肌內注射氟苯尼考的血藥濃度-時間曲線圖
表3 健康和感染鴨肌內注射氟苯尼考的藥動學參數
*表示兩者相比差異顯著(<0.05)
* means that there was significant difference between the two groups (<0.05)
3 討論
3.1 鴨疫里氏桿菌感染模型的選擇
目前關于人工誘發鴨疫里氏桿菌感染模型的方法有很多種,如氣管注射、嗉囊注射、口腔滴入、腳蹼注射、肌內注射、皮下注射、口服等[18-20],本研究采用的接種途徑是腿部肌內注射約109.0CFU·mL-1的菌液0.5 mL,操作簡單,重復性好。
3.2 氟苯尼考在健康鴨體內的藥動學特征
鴨以30 mg·kg-1b.w.肌內注射氟苯尼考后,氟苯尼考在健康鴨體內的峰濃度(Cmax)為(22.88±3.11)μg·mL-1,表觀分布容積(Vd/F)為(2.39±0.81)L·kg-1,體清除率(ClB/F)為(0.64±0.11)L·h-1·kg-1,消除半衰期(t1/2β)為(2.57±0.51)h和藥時曲線下面積(AUC)為(47.28±7.87)μg mL-1·h。上述結果表明,肌注氟苯尼考在健康鴨體內的藥動學特征是吸收快,血藥峰濃度高,體內分布廣泛,消除較快。
本試驗結果得到的氟苯尼考在鴨體內的t1/2β,比El-Banna等[21]報道的番鴨體內單劑量(30 mg·kg-1)肌內注射氟苯尼考的t1/2β(444.9± 8.100)min和段新華等[22]報道的麻鴨體內單劑量(20 mg·kg-1)肌內注射氟苯尼考的t1/2β(6.81±0.74)h短,結果差異可能是由于鴨的品種和年齡不同。在相同的給藥途徑和給藥劑量下,Cmax遠大于SHEN等[23]報道的肉雞(8.85±1.20)μg·mL-1和EL-BANNA等[21]報道的番鴨(2.99±0.023)μg·mL-1,與ABD等[24]報道的兔21.65 μg·mL-1相近。AUC大于犬(26.43 ±3.62)μg mL-1·h[25]。ClB/F與大鼠(0.66± 0.04)L·h-1·kg-1[26]、雞(0.73±0.12)L·h-1·kg-1[27]相似。Vd/F與家兔(2.772±0.303)L·kg-1[28]比較接近。
3.3 氟苯尼考在感染鴨體內的藥動學特征
在感染鴨體內的Cmax為(19.77±1.82)μg·mL-1,Vd/F為(2.44±0.46)L·kg-1,ClB/F(0.63±0.08)L·h-1·kg-1,t1/2β為(2.74±0.54)h和AUC為(48.11±6.62)μg mL-1·h。兩者的主要藥動學參數比較可看出,氟苯尼考在感染鴨體內的Cmax降低,且具有顯著性差異(<0.05);其他藥物學參數差異不顯著(>0.05),這可能是患病鴨影響了肌注氟苯尼考的吸收過程。據報道,鴨疫里氏桿菌感染鴨初期,其器官細胞會出現以出血為主的病理特征,隨著感染時間的增加,細胞開始腫脹,接著會發生變性壞死,器官功能受到損傷[18, 20],影響了藥物的吸收,故達峰濃度有所降低。此研究結果與王加才[29]報道的在健康和大腸桿菌感染肉雞單次灌服氟苯尼考(30 mg·kg-1)藥動學參數對比得出的某些結果相似,即大腸桿菌感染雞峰濃度低于健康組。
3.4 臨床給藥方案建議
氟苯尼考具有較好的抗菌效果[30],臨床上常用氟苯尼考預防和治療鴨疫里氏桿菌病,對于已感染該病的鴨應考慮到患病機體的部分器官功能可能已經受到損傷,可適當增加給藥劑量,給藥途徑可以考慮肌內注射或飲水給藥。鴨感染鴨疫里氏桿菌后食欲減退且該病發生發展均較快,故不建議使用拌料的方式給藥。臨床推薦給藥方案,對于敏感的鴨疫里氏桿菌感染,劑量為30 mg·kg-1,每天用藥1—2次,連用2—3d。
4 結論
健康和鴨疫里氏桿菌感染鴨單次肌內注射(30mg·kg-1b.w.)氟苯尼考后,氟苯尼考在鴨體內的藥動學特征是吸收快,血藥峰濃度高,分布廣泛,消除較快。鴨疫里氏桿菌感染顯著影響峰濃度(<0.05),可使其降低。
[1] 郭玉璞, 陳德威, 范國雄, 劉瑞萍. 北京鴨小鴨傳染性漿膜炎的調查研究.畜牧獸醫學報, 1982(2): 35-41.
GUO Y P, CHEN D W, FAN G X, LIU R P. Studys on infections serositis in white Beijing ducklings.1982(2): 35-41. (in Chinese)
[2] 吳華, 李勝利, 侯百枝, 陳華, 胡功政. 鴨疫里氏桿菌病藥物防治研究進展. 動物醫學進展, 2007, 28(4):96-100.
WU H, LI S L, HOU B Z, CHEN H, HU G Z.Advance in medicines to combatin duck.2007, 28(4):96-100. (in Chinese)
[3] QIU Z Z, CAO C F, QU Y, LU Y, SUN M Z, ZHANG Y N, ZHONG J L, ZENG Z L.activity of cefquinome againstusing the pericarditis model in the duck.,2016, 39(3): 299-304.
[4] 李先強. 氟苯尼考研究進展. 中國獸藥雜志, 2016,11: 5-8.
LI X Q. Advance in the research of florfenicol.2016, 11: 5-8. (in Chinese)
[5] YANG B, GAO J D, CAO X Y, WANG Q Y, SUN G Z, YANG J J. Lung microdialysis study of florfenicol in pigs after single intramuscular administration. Journal of Veterinary Pharmacology and Therapeutics, DOI:10.1111/jvp. 12387, 2017.
[6] SIDHU P, RASSOULI A, ILLAMBAS J, POTTER T, PELLIGAND L, RYCROFT A, LEES P. Pharmacokinetic-pharmacodynamic integration and modelling of florfenicol in calves., 2014, 37(3): 231-242.
[7] KIM M H, GEBRU E, CHANG Z Q, CHOI J Y, HWANG M H, KANG E H, LIM J H, YUN H I, PARK S C. Comparative pharmacokinetics of tylosin or florfenicol after a single intramuscular administration at two different doses of Tylosin-Florfenicol combination in pigs.,2008, 70(1): 99-102.
[8] 譚元燕. 喹賽多對雞沙門氏菌的PK-PD同步模型研究[D]. 武漢:華中農業大學, 2013.
TAN Y Y. Pharmacokinetic-pharmacodynamic modeling of cyadox againstin broiler [D]. Wuhan: Huazhong Agricultural University, 2013. (in Chinese)
[9] 王麗平,陸承平. 人工感染豬鏈球菌對小鼠肝臟藥物代謝酶的抑制作用. 中國農業科學, 2009, 42(3): 1078-1083.
WANG L P, LU C P. Inhibition of hepatic drug-metabolizing enzymes in mice duringtype 2 infection.2009, 42(3): 1078-1083. (in Chinese)
[10] 劉滌潔,馮淇輝,陳杖榴. 恩諾沙星在健康及實驗性感染乳房炎奶山羊間的比較藥動學. 中國農業科學, 2003, 36(9): 1100-1104.
LIU D J, FENG Q H, CHEN Z L. Study of comparative pharmacodynamics of enrofloxacin healthy and msatitis lactating goats experimentally infected with staphylococcus aureus., 2003, 36(9): 1100-1104. (in Chinese)
[11] CRAENE D B A, DEPREZ P, D'HAESE E, NELIS H J, BOSSCHE D W V, LEENHEER D A P. Pharmacokinetics of florfenicol in cerebrospinal fluid and plasma of calves.r, 1997, 41(9): 1991-1995.
[12] CHEN Y P, LEE S H, PAN M J, CHEN C L, SHIEN J H, CHANG T C, TSAI H J. Antimicrobial susceptibility ofisolated from ducks and geese and the Mutations of gyrase associated with quinolone resistance., 2012, 38(1): 7-18.
[13] 余金金, 溫小鵬. 不同藥物對鴨傳染性漿膜炎的療效觀察. 江西畜牧獸醫雜志, 2015(1): 8-9.
YU J J, WEN X P.Effection of different drugs on.2015(1): 8-9. (in Chinese)
[14] LI Y F, ZHANG Y N, DING H Z, MEI X,LIU W, ZENG J X, ZENG Z L.susceptibility of four antimicrobials againstisolates: a comparison of minimum inhibitory concentrations and mutant prevention concentrations for ceftiofur, cefquinome, florfenicol, and tilmicosin., 2016, 12(1): 250.
[15] 梁建明. 鴨疫里默氏菌病診治與體會. 福建畜牧獸醫, 2013(6): 61.
Liang J M. Diagnosis and experience of.2013(6): 61. (in Chinese)
[16] SUN N, LIU J H, YANG F, LIN D C, LI G H, CHEN Z L, ZENG Z L. Molecular characterization of the antimicrobial resistance ofisolated from ducks., 2012, 158(3-4): 376-383.
[17] WANG G Y, TU P, CHEN X, GUO Y G, JIANG S X. Effect of three polyether ionophores on pharmacokinetics of florfenicol in male broilers., 2013, 36(5): 494-501.
[18] 安婷. 鴨疫里默氏桿菌在人工感染雛鴨體內的動態研究[D]. 雅安:四川農業大學, 2009.
AN T. Study on the dynamic variation in ducklings by artificially infected with[D]. Ya'an: Sichuan Agricultural University, 2009. (in Chinese)
[19] 俞吉杰. 硫酸頭孢喹肟對鴨傳染性漿膜炎的藥效藥動學研究[D]. 南京:南京農業大學, 2008.
YU J J. Study on pharmacokinetics and pharmacodynamics of cefquinome in ducks infected by[D]. Nanjing: Nanjing Agricultural University, 2008. (in Chinese)
[20] 段澤. RA分子流行病學調查和FQ-PCR檢測人工感染RA在雛鴨體內的動態分布規律研究[D]. 雅安:四川農業大學, 2006.
DU Z. Molecular epidemiology survey of RA and researches of the dynamic distribution regular pattern in ducks artificially infected with RA[D] . Ya'an: Sichuan Agricultural University, 2006. (in Chinese)
[21] EL-BANNA H A. Pharmacokinetics of florfenicol in normal and Pasteurella-infected Muscovy ducks., 1998, 39(4): 492-496.
[22] 段新華, 楊帆. 靜脈和肌內注射后氟苯尼考在麻鴨體內藥動學的初步研究. 中國家禽, 2016(4): 19-22.
DUAN X H, YANG F. Pharmacokinetics of florfenicol after intravenous and intramuscular administration in partridge ducks.2016(4): 19-22. (in Chinese)
[23] SHEN J Z, WU X A, HU D F, JIANG H Y. Pharmacokinetics of florfenicol in healthy and Escherichia coli-infected broiler chickens, Research in veterinary science,2002, 73(2): 137-140.
[24] ABD E A, GOUDAH A, ABO E K, EL-ZORBA H Y, SHIMODA M, ZHOU H H. Pharmacokinetics and bioavailability of florfenicol following intravenous, intramuscular and oral administrations in rabbits,,2004, 28(6): 515-524.
[25] BIRDANE Y O, BIRDANE F M. Pharmacokinetics of florfenicol following intravenous and intramuscular administration in dogs.,2015, 6:323-329.
[26] 董宏偉, 李忠杰, 呂淑榮, 劉萬卉. 氟苯尼考注射液在大鼠體內代謝及生物利用度研究. 煙臺大學學報(自然科學與工程版), 2014, 27(2): 122-125.
Dong H W, Li Z J, Lü S R, Liu W H. Metabolism and bioavailability of florineicol injection in rats.2014, 27(2):122-125. (in Chinese)
[27] 張旭, 薛克友, 王大菊, 趙芬琴,謝欣梅. 氟苯尼考在雞體內的藥動學及其體內抗菌后效應研究. 中國獸藥雜志, 2008, 42(12): 39-42.
ZHANG X, XUE K Y, WANG D J, ZHAO F Q, XIE X M. Studies on pharmacokinetics of florfenicol in chicken and its post-antibiotic effects., 2008, 42(12): 39-42. (in Chinese)
[28] 陳紅偉, 李英倫. 單劑量氟苯尼考內服及肌注在家兔體內藥代動力學研究. 中國獸醫學報, 2008, 28(2): 166-169.
CHEN H W, LI Y L. The pharmacokinetics of florfenicol following a single oral and intramuscular administration to rabbits.2008, 28(2):166-169.(in Chinese)
[29] 王加才. 氟苯尼考超微粉在肉雞體內的藥動學與藥效學研究[D]. 南京:南京農業大學, 2006.
WANG J C. Study on pharmacokinetics and pharmacodymics of florfenicol ultrafine power in chicken[D]. Nanjing: Nanjing Agricultural University, 2006. (in Chinese)
[30] 李孝文,董偉,楊昆,陳小軍,劉兆穎,孫志良. 氟苯尼考雙混懸乳劑的體外藥效學研究. 中國農業科學, 2011, 44(19): 4102-4109.
LI X W, DONG W, YANG K, CHEN X J, LIU Z Y, SUN Z L. Studies on pharmacodynamicsof the florfenicol dual suspension emulsion.. 2011, 44(19): 4102-4109. (in Chinese)
(責任編輯 林鑒非)
Pharmacokinetics of Florfenicol in Ducks Infected withafter Intramuscular Administration
MEI Xian, WAN Peng, HAN DongDong, PEI PengFei, ZENG QingLin, LI XiaoHong, ZENG ZhenLing
(Guangdong Provincial Key Laboratory of Veterinary Pharmaceutics Development and Safety Evaluation, College of Veterinary Medicine, South China Agricultural University, Guangzhou 510642)
The pharmacokinetic properties of florfenicol were studied and compared in both healthy ducks and ducks infected withafter intramuscular administration.A total of 240 ducks were randomly divided into 2 equal groups of 120 ducks each, one groups infected within the thigh. The two groups were injected with florfenicol injection following intramuscular (i.m.) administration at a single dosage of 30 mg·kg-1body weight, respectively. Plasma samples were collected at 0, 5, 10, 15, 20, 30, 45 minutes and 1, 1.5, 2, 4, 6, 8, 10, and 14 hours after administration. The florfenicol concentration in plasma samples was analyzed using a high performance liquid chromatography (HPLC) method, with UV detector at 223 nm. The mobile phase (acetonitrile:water v/v 26/74) was delivered at a constant flow rate of 1mL·min-1. The column used was an Agilent C18(4.6 mm×150 mm, 5 μm) column. A 20 μL aliquot of the reconstituted sample was injected onto the HPLC column. The drug concentration-time data were analyzed by non-compartmental analysis of pharmacokinetic software WinNonlin 5.2.1. Statistical analysis of pharmacokinetic parameters was carried out by statistical software SPSS17.0.The main pharmacokinetic parameters in healthy and infected ducks were as follows : the elimination half-life (t1/2β) was (2.57±0.51) h and (2.74±0.54) h. the peak time (Tmax) was (0.54±0.14) h and (0.55±0.18) h. the peak drug concentration (Cmax) was (22.88±3.11) μg·mL-1and (19.77±1.82) μg·mL-1; the apparent distribution volume (Vd/F) was (2.39±0.81) L·kg-1and (2.44±0.46) L·kg-1; the total body clearance (ClB/F) was (0.64±0.11) L·h-1·kg-1and (0.63±0.08) L·h-1·kg-1; the area under the drug concentration-time curve (AUClast) was (47.28±7.87) μg·mL-1·h and (48.11±6.62) μg·mL-1·h, respectively. The pharmacokinetic parameters of florfenicol in healthy ducks and infected ducks were analyzed statistically. The results showed that there was no significant difference between the other parameters except Cmax(<0.05).The peak drug concentration (Cmax) in infected ducks was significantly lower (<0.05) than that in healthy ducks. There was no significant difference between the other pharmacokinetic parameters. The characteristics of rapid absorption, high plasma concentration, wide distribution and faster elimination were showed following im florfenicol injection with a single dosage of 30 mg·kg-1body weight in healthy and infected ducks.
florfenico1;; pharmacokinetics ; thigh infection; ducks
2017-04-21;接受日期:2017-07-25
教育部創新團隊發展計劃(IRT13063)、廣東省自然科學基金研究團隊項目(S2012030006590)
梅獻,E-mail:context2012@sina.com。通信作者曾振靈,Tel:020-85281204;E-mail:zlzeng@scau.edu.cn

