趨化因子Fractalkine通過調控IL-6/STAT3信號通路對人胰腺癌細胞株增殖和侵襲的影響研究*
李海洋,黃李雅,吳 陽,劉 慧
(1.寧夏醫科大學,銀川 750004;2.寧夏醫科大學總醫院消化內科,銀川 750004;3.陜西中醫藥大學第二附屬醫院消化內科,陜西咸陽 712000)
·論著· doi:10.3969/j.issn.1671-8348.2017.28.002
趨化因子Fractalkine通過調控IL-6/STAT3信號通路對人胰腺癌細胞株增殖和侵襲的影響研究*
李海洋1,黃李雅2△,吳 陽3,劉 慧1
(1.寧夏醫科大學,銀川 750004;2.寧夏醫科大學總醫院消化內科,銀川 750004;3.陜西中醫藥大學第二附屬醫院消化內科,陜西咸陽 712000)
目的探討趨化因子Fractalkine(FKN)通過調控白細胞介素(IL)-6/信號傳導與轉錄激活因子(STAT)3信號通路對人胰腺癌細胞株PANC-1和SW-1990增殖、侵襲的影響。方法以腺病毒為載體構建、合成FKN-小干擾RNA(siRNA)并轉染PANC-1和SW-1990。應用CCK-8法和Transwell檢測細胞增殖和侵襲力,蛋白質印跡法(Western blot)和實時熒光定量聚合酶鏈式反應(RT-qPCR)法檢測FKN、IL-6和STAT3蛋白及mRNA的表達。結果轉染FKN-siRNA 24 h時,PANC-1及SW-1990各組細胞吸光度值(A值)無明顯變化,在48 h和72 h時,FKN-siRNA組A值明顯高于對照組和FKN-siRNA陰性組(P<0.05)。轉染FKN-siRNA后,PANC-1及SW-1990 FKN-siRNA組細胞侵襲力明顯強于對照組和FKN-siRNA陰性組(P<0.05)。PANC-1及SW-1990轉染FKN-siRNA后,與對照組和FKN-siRNA陰性組相比較,FKN-siRNA組細胞FKN蛋白和mRNA的表達明顯減少(P<0.05),IL-6與STAT3蛋白和mRNA的表達明顯增加(P<0.05)。結論趨化因子FKN可能通過IL-6/STAT3信號通路對胰腺癌細胞生物學活性發揮了抑制作用。
趨化因子Fractalkine;轉染;胰腺癌細胞株;白細胞介素6;STAT3
胰腺癌是一種常見的惡性腫瘤,其發病率在全球范圍內呈上升趨勢。在我國,近10年胰腺癌的發病率居惡性腫瘤的第6位,胰腺癌患者的中位生存時間為3~5個月,1年生存率小于10%[1],其嚴重危害著人民的身體健康。目前胰腺癌的早期診斷及有效治療還是尚待解決的問題。趨化因子Fractalkine(FKN)是CX3C家族中的唯一成員,在腫瘤的發生、發展過程中起著一定的作用,如介導癌細胞黏附、浸潤及轉移,促進腫瘤血管生成等,由于其具有特殊的白細胞趨化及分子黏附作用,FKN在各腫瘤中發揮著不同的作用,即抑制腫瘤生長和促進腫瘤生長。白細胞介素-6(IL-6)是一種多效能細胞因子,其結合可溶性IL-6受體 (soluble interleukin-6 receptor,sIL-6R) 形成IL-6/sIL-6R復合物,繼而活化細胞膜表面的gpl30,誘導信號傳導與轉錄激活因子(STAT)3活化[2],IL-6/STAT3信號通路與腫瘤的發生、發展也有著密切的聯系。本實驗擬通過以腺病毒為載體,包裝構建FKN-小干擾RNA(siRNA)并沉默FKN在人胰腺癌細胞株PANC-1及SW1990中的表達,探討FKN對人胰腺癌細胞株生物學特性的影響和IL-6/STAT3信號通路在人胰腺癌細胞株中的作用變化,尋求臨床治療胰腺癌新的思路和方法。
1 材料與方法
1.1實驗材料
1.1.1主要試劑 FKN、STAT3、IL-6和辣根過氧化物酶標記的二抗等抗體(美國abcam公司),內參GAPDH(北京中杉金橋生物公司);CCK-8(美國Sigma公司),Transwell小室(美國Millipore Carrlgtwahill公司),Matrigel膠(美國B&D公司);TRIzoI和反轉錄試劑盒(美國Thermo Fisher scientific公司);RT-qPCR試劑盒(美國KAPA Biosystems公司)。
1.1.2細胞株、腺病毒載體 人胰腺癌細胞株PANC-1及SW1990(上海北納創聯生物技術有限公司)在寧夏醫科大學總醫院外科實驗室傳代培養。上海生工生物工程有限公司設計、構建、合成、鑒定、測序并擴增以腺病毒為載體的FKN-siRNA。
1.2方法
1.2.1細胞轉染 將人胰腺癌細胞株PANC-1及SW1990使用含10%胎牛血清的DMEM高糖培養基,置于37 ℃、5%CO2的培養箱中培養。取對數生長期細胞按每孔1×105接種于6孔板中,加入完全培養基置于37 ℃、5%CO2的培養箱中培養,待細胞融合度達到70%以上時,加入腺病毒包裝的FKN-siRNA(10 mmol/L)對細胞進行轉染,轉染適當時間后繼續后續的實驗。
1.2.2CCK-8法檢測細胞增殖活性 取對數生長期細胞按每孔1×105接種于96孔板中(每孔100 μL),將培養板置于37 ℃、5%CO2的培養箱中培養12 h。設置對照組、FKN-siRNA組及FKN-siRNA陰性組,每組均設3個復孔,分別在24、48、72 h時向每孔加入10 μL的CCK-8溶液,將培養板放入培養箱內孵育2 h,用酶標儀測定各孔在450 nm處的吸光度值(A值)。
1.2.3細胞侵襲實驗 將Transwell小室置于24孔板中,在小室內膜上加入1∶8稀釋的Matrigel膠(每孔60 μL),放置于培養箱4~5 h。設置對照組、FKN-siRNA組及FKN-siRNA陰性組,每組均設3個復孔,并向各Transwell小室中加入細胞懸液每孔100 μL(每孔1×105),向24板下室中加入600 μL含胎牛血清的DMEM高糖培養基,置于37 ℃、5%CO2的培養箱中常規培養24 h。取出Transwell小室,棄去孔中培養基,用棉簽輕輕擦去膜上層的細胞,結晶紫染色,在高倍顯微鏡下隨機觀察5個視野細胞,計數。
1.2.4蛋白質印跡法(Western blot)檢測FKN、IL-6和STAT3蛋白的表達 提取人胰腺癌細胞株總蛋白,并采用BCA法檢測蛋白濃度,加入蛋白樣品進行SDS-PAGE電泳,100 V恒定電壓轉膜110 min,將蛋白轉移到PVDF膜上,5%脫脂奶粉封閉90 min后,分別加入FKN、IL-6和STAT3一抗(1∶1 000)4 ℃孵育過夜,TBST洗滌后加入辣根過氧化物酶標記的二抗(1∶10 000),室溫搖床孵育90 min,SuperSignal West Pico化學發光底物發光,使用Image Quant LAS 4000進行曝光,采用Image J軟件對FKN、IL-6、STAT3和內參GAPDH蛋白條帶進行分析,以內參GAPDH與FKN、IL-6和STAT3分別相比較的值作為其蛋白相對表達量。
1.2.5實時熒光定量聚合酶鏈式反應(RT-qPCR)法檢測FKN、IL-6和STAT3 mRNA的表達 應用TRIzol提取細胞總RNA后,反轉錄成cDNA。PCR引物由上海生工生物工程股份有限公司合成。FKN:上游引物5′-CTG CCC TGA CTA GAA ATG GT-3′,下游引物5′-CAG TCG GTT CCA AAG TAA GG-3′,141 bp;IL-6:上游引物5′-TGC CTT CTT GGG ACT GAT-3′,下游引物5′-CTG GCT TTG TCT TTC TTG TTA-3′,384 bp;STAT3:上游引物5′-GAT GCT GGA GGA GAG AAT CG-3′,下游引物5′-TGT GTT TGT GCC CAG AAT GT-3′,265 bp;GAPDH:上游引物5′-ACC ACA GTC CAT GCC ATC AC-3′,下游引物5′-TCC ACC ACC CTG TTG CTG TA-3′,460 bp。根據KAPA SYBR FAST qPCR試劑盒要求加入各反應體系量,采用CFX ConnetTM熒光定量PCR儀進行擴增定量,FKN、IL-6和STAT3 mRNA的相對表達量通過2-△△CT法計算得到,結果采用倍數表示。
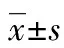
2 結 果
2.1FKN-siRNA轉染后對人胰腺癌細胞株PANC-1及SW-1990增殖的影響 通過CCK-8法檢測細胞的增殖活性顯示:PANC-1及SW-1990轉染FKN-siRNA 24 h時,各組細胞A值無明顯變化,在48 h和72 h時,FKN-siRNA組A值明顯高于對照組和FKN-siRNA陰性組,差異有統計學意義(P<0.05)。見圖1、2。

圖1 PANC-1不同時點各組的吸光度曲線

圖2 SW-1990不同時點各組的吸光度曲線
2.2FKN-siRNA轉染后對人胰腺癌細胞株PANC-1及SW-1990侵襲的影響 PANC-1及SW-1990轉染FKN-siRNA后, FKN-siRNA組細胞侵襲力明顯強于對照組和FKN-siRNA陰性組,差異有統計學意義(P<0.05)。見表1。
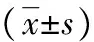
表1 PANC-1及SW-1990各組穿膜細胞數比較
2.3Western blot檢測FKN、IL-6和STAT3蛋白的表達 PANC-1及SW-1990轉染FKN-siRNA后,與對照組和FKN-siRNA陰性組相比較,FKN-siRNA組細胞FKN蛋白的表達明顯減少(P<0.05),IL-6與STAT3蛋白的表達明顯增加(P<0.05)。見圖3、4。

圖3 PANC-1中FKN、IL-6及STAT3蛋白的表達

圖4 SW-1990中FKN、IL-6及STAT3蛋白的表達
2.4RT-qPCR法檢測FKN、IL-6和STAT3 mRNA的表達 PANC-1轉染FKN-siRNA后顯示:對照組細胞FKN mRNA的表達是FKN-siRNA組1.74倍,FKN-siRNA陰性組細胞FKN mRNA是FKN-siRNA組的1.83倍,FKN-siRNA組細胞中FKN mRNA的表達明顯下降(P<0.05);FKN-siRNA組細胞IL-6和STAT3 mRNA的表達分別是對照組的2.03倍和1.79倍,FKN-siRNA陰性組的1.95倍和1.81倍,FKN-siRNA組細胞IL-6和STAT3 mRNA的表達明顯升高(P<0.05)。SW-1990轉染FKN-siRNA后顯示:對照組細胞FKN mRNA的表達是FKN-siRNA組1.81倍,FKN-siRNA陰性組細胞FKN mRNA的表達是FKN-siRNA組的1.77倍,FKN-siRNA組細胞FKN mRNA表達明顯下降(P<0.05);FKN-siRNA組細胞IL-6和STAT3 mRNA的表達分別是對照組的1.76倍和1.80倍,FKN-siRNA陰性組的1.71倍和1.79倍,FKN-siRNA組細胞IL-6和STAT3 mRNA的表達明顯升高(P<0.05) 。
3 討 論
趨化因子FKN是CX3C亞家族中的唯一成員,與其他趨化因子區別在于它是一種跨膜糖蛋白,其具有獨特的趨化和黏附雙重作用。多項研究表明,FKN在腫瘤的發生、發展過程中發揮著重要的作用。一方面,FKN可以介導腫瘤細胞與內皮細胞的黏附、侵襲和轉移,誘導腫瘤血管的形成從而促進腫瘤生長[2-3]。另一方面,FKN又可以趨化NK細胞、CD8+T細胞及CD4+T細胞等免疫細胞到腫瘤的局部,減少侵襲及轉移的發生,進而抑制腫瘤的發生[4]。FKN在胰腺癌中發揮著何種作用,這需要進一步探討研究。
本實驗研究發現,通過對人胰腺癌細胞株PANC-1和SW1990轉染FKN-siRNA后,細胞侵襲力明顯增強,反映出FKN可能在胰腺癌細胞株中發揮著抑制作用,這種假設是否成立,并且趨化因子FKN是否還在其他消化系統腫瘤中起到類似的抑制作用。Jones等[5]研究發現,將FKN導入到小鼠肝癌細胞中,然后種植在小鼠體內,可以增強抗腫瘤免疫,從而抑制肝癌的生長;Tang等[6]發現高表達FKN的結直腸癌患者預后要好于低表達FKN的患者。以上研究初步證實趨化因子FKN在消化系統腫瘤中能夠抑制腫瘤的發生、發展,這與本實驗結果相一致。 Ohta等[7]研究顯示,通過結合腫瘤細胞表面的膜型FKN后可以激活NK細胞,從而發揮抗腫瘤作用,進一步證明了FKN具有抑制腫瘤發生、發展的作用。
筆者研究發現,IL-6/STAT3信號通路在多種腫瘤中起著非常重要的作用。有研究表明,結直腸癌患者的血清和癌組織中IL-6的水平均升高,且與腫瘤大小、腫瘤轉移、預后和生存率相關[8-10],并且90%以上的結直腸癌細胞發生STAT3的持續活化,其加強了腫瘤細胞的增殖和腫瘤的生長[11]。在宮頸鱗狀細胞癌中亦發現了STAT3的持續激活[12]。IL-6/STAT3信號通路作為重要的炎癥信號轉導途徑之一,已證明IL-6/STAT3信號通路在胰腺癌的發生、發展過程中起著重要的誘導、促進作用[13-14]。本實驗顯示:與對照組和FKN-siRNA陰性組相比較,FKN-siRNA組細胞FKN的蛋白及mRNA的表達減少,IL-6、STAT3的蛋白及mRNA的表達增加;細胞侵襲試驗證實FKN-siRNA組細胞侵襲力較對照組與FKN-siRNA陰性組強。這都初步闡明FKN在胰腺癌中抑制腫瘤的發生、發展,IL-6/STAT3信號通路在胰腺癌的發生、發展中起著重要的作用。黃陳等[15]研究顯示,通過AG490可以抑制胰腺癌中SATA3的活化,從而降低腫瘤細胞的增殖和侵襲力,促進細胞凋亡。本實驗發現,隨著趨化因子FKN表達的下調,IL-6/STAT3表達明顯升高,說明趨化因子FKN與STAT3信號通路之間存在著一定的相關性,在一定程度上認為FKN是通過IL-6/STAT3信號通路對胰腺癌的增殖和侵襲產生影響。
本研究初步探討了FKN對胰腺癌增殖和侵襲的影響及與IL-6/STAT3信號通路之間的關系,結果顯示FKN對胰腺癌細胞生物學活性起著抑制作用,并且通過IL-6/STAT3信號通路對胰腺癌的增殖和侵襲產生影響。這揭示著通過阻斷趨化因子FKN及IL-6/STAT3信號通路可能為胰腺癌的臨床治療提供新的理論依據和治療策略。
[1]Goldstein D,Carroll S,Apte M,et al.Modern management of pancreaticcarcinoma[J].Int Med J,2004,34(8):475-481.
[2]Doumas S,Paterson JC,Norris PM,et al.Fractalkine (CX3CL1) and fractalkine receptor (CX3CR1) in squamous cell carcinoma of the tongue:Markers of nerve invasion?[J].Oral Maxill Surg,2015,19(1):61-64.
[3]Tang J,Xiao L,Cui R,et al.CX3CL1 increases invasiveness and metastasis by promoting epithelial-to-mesenchymal transition through the TACE/TGF-α/EGFR pathway in hypoxic androgen independent prostate cancer cells[J].Oncol Rep,2016,35(2):1153.
[4]HyakudomiM,MatsubaraT,HyakudomiR,etal.Increasedexpressionoffractalkineiscorrelatedwitha better prognosis and an increased number of both CD8+T cells and natural killer cells in gastric adenocarcinoma[J].Ann Surg Oncol,2008,15(6):1775-1782.
[5]Jones SA,Horiuchi S,Topley N,et al.The soluble interleukin 6 receptor:mechanisms of production and implications in disease[J].FASEB J,2001,15(1):43-58.
[6]Tang L,Hu HD,Hu P,et al.Gene therapy with CX3CL1/Fractalkine induces antitumor immunity to regress effectively mouse hepatocellular carcinoma[J].Gene Ther,2007,14(16):1226-1234.
[7]Ohta M,Tanaka F,Yamaguchi H,et al.The high expression of Fractalkine results in a better prognosis for colorectal cancer patients[J].Int J Oncol,2005,26(1):41-47.
[8]Zhang X,Wei H,Chen Q,et al.Activation of human natural killer cells by recombinant membrane-expressed fractalkine on the surface of tumor cells[J].Oncol Rep,2007,17(6):1371-1375.
[9]Belluco C,Nitti D,Frantz M,et al.Interleukin-6 blood level is associated with circulating carcinoembryonic antigen and prognosis in patients with colorectal cancer[J].Ann Surg Oncol,2000,7(2):133-138.
[10]Galizia G,Orditura M,Romano C,et al.Prognostic significance of circulating IL-10 and IL-6 serum levels in colon cancer patients undergoing surgery[J].Clin Immunol,2002,102(2):169-178.
[11]Corvinus FM,Orth C,Moriggl R,et al.Persistent STAT3 activation in colon cancer is associated with enhanced cell proliferation and tumor growth[J].Neoplasia,2005,7(6):545-555.
[12]劉麗麗,戰雪梅,孫崇偉,等.轉錄信號傳導子與激活子3在宮頸癌組織中的表達及臨床意義[J].中華腫瘤防治雜志,2007,14(6):447-449.
[13]Lesina M,Kurkowski MU,Ludes K,et al.Stat3/Socs3 activation by IL-6 transsignaling promotes progression of pancreatic intraepithelial neoplasia and development of pancreatic cancer[J].Cancer Cell,2011,19(4):456-469.
[14]Hamada S,Masamune A,Yoshida N,et al.IL-6/STAT3 plays a regulatory role in the interaction between pancreatic stellate cells and cancer cells[J].Dig Dis Sci,2016,61(6):1561-1571.
[15]黃陳,裘正軍,劉辰,等.阻斷STAT3信號轉導通路對人胰腺癌細胞生長的影響[J].腫瘤,2006,26(5):414-417.
EffectsofchemokineFractalkineonproliferationandinvasionofhumanpancreaticcancercelllinesbyregulatingIL-6/STAT3signalpathway*
LiHaiyang1,HuangLiya2△,WuYang3,LiuHui1
(1.NingxiaMedicalUniversity,Yinchuan,Ningxia750004,China;2.DepartmentofGastroenterology,GeneralHospitalofNingxiaMedicalUniversity,Yinchuan,Ningxia750004,China;3.DepartmentofGastroenterology,SecondAffiliatedHospital,ShaanxiTraditionalChineseMedicineUniversity,Xianyang,Shaanxi712000,China)
ObjectiveTo explore the effects of chemokine Fractalkine(FKN) on the proliferation and invasion of human pancreatic cancer cell lines PANC-1 and SW-1990 by regulating IL-6/STAT3 signal pathway.MethodsAdenovirus served as the vector to construct and synthesizing FKN-small interfering RNA(siRNA),then which was transfected into PANC-1 and SW-1990.The proliferation and invasion ability of cells was determined by CCK-8 assay and Transwell assay.Expression of FKN,IL-6 and STAT3 protein and mRNA was detected by Western blot and RT-qPCR.ResultsAfter transfecting FKN-siRNA for 24 h,the absorbance values(A value) in the PANC-1 and SW-1990 groups had no significant changes,the A value at 48,72 h in the FKN-siRNA group was significantly higher than that in the control group and FKN-siRNA negative group (P<0.05).After transfecting FKN-siRNA,the cellular invasive ability in the PANC-1 and SW-1990 FKN-siRNA group was significantly stronger than that in the control group and FKN-siRNA negative group(P<0.05).After transfecting FKN-siRNA in cell lines PANC-1 and SW-1990,compared with the control group and FKN-siRNA negative group,the FKN protein and mRNA expression in the FKN-siRNA group was significantly decreased(P<0.05),while IL-6 and STAT3 protein and mRNA expression was significantly increased(P<0.05).ConclusionChemokine FKN might play the inhibiting effect on the biological activity of pancreatic cancer cells by regulating IL-6/STAT3 signal pathway.
chemokine Fractalkine;transfection;pancreatic cancer cell lines;interleukin-6;STAT3
國家自然科學基金資助項目(81460367);寧夏自然科學基金資助項目(NZ14118)。
李海洋(1988-),在讀碩士,主要從事胰腺疾病的基礎與臨床研究。△
,E-mail:txmbw@126.com。
R567
A
1671-8348(2017)28-3893-03
2017-05-18
2017-07-06)

