IL-1β下調Rho激酶活性介導膿毒癥大鼠血管鈣失敏的機制研究*
梁家林,劉良明,李 濤
(1.空軍杭州航空醫學鑒定訓練中心醫學療養部,杭州 310013;2.第三軍醫大學大坪醫院野戰外科研究所二室/創傷、燒傷與復合傷國家重點實驗室,重慶 400042)
IL-1β下調Rho激酶活性介導膿毒癥大鼠血管鈣失敏的機制研究*
梁家林1,劉良明2△,李 濤2
(1.空軍杭州航空醫學鑒定訓練中心醫學療養部,杭州 310013;2.第三軍醫大學大坪醫院野戰外科研究所二室/創傷、燒傷與復合傷國家重點實驗室,重慶 400042)
目的探討白細胞介素(IL)-1β下調Rho激酶活性介導膿毒癥大鼠血管鈣失敏的機制。方法SD大鼠32只,按隨機數字表完全隨機分為假手術組、盲腸結扎穿孔(CLP) 3 h組、CLP 6 h組、CLP 12 h組,每組8只。經CLP復制膿毒癥大鼠模型,檢測不同時點血漿IL-1β濃度及腸系膜上動脈(SMAs)鈣敏感性,分析二者之間的相關性。培養SMAs來源的血管平滑肌細胞(VSMCs)并與不同濃度重組人IL-1β孵育24 h,觀察IL-1β對其肌球蛋白輕鏈(MLC20)磷酸化水平、Rho激酶活性、G蛋白表達水平及RhoGEFs活性的影響。結果經CLP 3 h后SMAs鈣敏感性開始下降(P<0.05),而血漿IL-1β在CLP 6 h后開始上升(P<0.05),SMAs鈣敏感性變化趨勢與血漿IL-1β濃度變化呈明顯負相關(P<0.05)。IL-1β可降低VSMCs MLC20磷酸化水平及Rho激酶活性(P<0.05),上調Gα11表達而下調Gα12表達(P<0.05),但對Gαq和Gα13表達無明顯作用(P>0.05)。IL-1β可明顯降低RhoGEF和PDZ-RhoGEF活性(P<0.05),升高p63 RhoGEF活性(P<0.05)。結論IL-1β通過下調Gα12表達,引起PDZ-RhoGEF和Rho激酶的活性下降,導致MLC20磷酸化水平下降從而介導膿毒癥大鼠血管鈣失敏的發生;另外也能通過上調Gα11表達,引起p63 RhoGEF活性增加而介導膿毒癥大鼠血管鈣敏感性增加,但總效應是使鈣敏感性降低。
膿毒癥;白細胞介素1β;鈣失敏;G蛋白;RhoGEF
膿毒癥、膿毒性休克是重癥監護室最常見的并發癥之一,盡管對其研究投入了大量的人力、物力,但其病死率始終居高不下[1]。血管低反應性(即血管對血管活性藥物的反應性下降甚至不反應)是導致其高病死率的重要原因[2]。目前認為血管低反應性的發生機制主要有:(1)受體失敏,血管舒、縮相關受體如血管腎上腺素能受體[3]等表達下降和(或)親和力下降;(2)膜超極化,鉀通道的過度激活使得血管平滑肌細胞(VSMCs)膜的超極化[4];(3)鈣失敏假說,即VSMCs肌肉收縮相關蛋白對鈣的敏感性降低,引起力/鈣比下降[5]。
膿毒癥伴隨著細胞因子如腫瘤壞死因子α(TNF-α)、白細胞介素(IL)-1β、IL-6等的瀑布式釋放,體內、外研究均證實IL-1β能夠介導膿毒癥血管收縮反應性降低,作用機制有NO依賴性和NO非依賴性機制[6],但是針對以上機制進行矯治卻只能部分逆轉IL-1β介導的血管低反應性,提示還存在著其他重要機制[7]。
基礎研究顯示,Rho激酶能磷酸化CPI-17和肌球蛋白輕鏈磷酸酯酶(myosin light chain phosphatase,MLCP),磷酸化的CPI-17和MLCP均能抑制MLCP的活性,使得肌球蛋白輕鏈激酶(myosin light chain kinase,MLCK)和MLCP的活性比值上升,使肌球蛋白輕鏈(MLC20)磷酸化水平增加,使VSMCs收縮增加[8]。Rho激酶的活性受RhoA調控,RhoA又主要受RhoGEFs調控,而RhoGEFs的活性受Gαq/11和Gα12/13兩大家族調節[9]。VSMCs主要存在的RhoGEFs有PDZ-RhoGEF、p115 RhoGEF、p63 RhoGEF和LARG,Gαq/11調節LARG和p63 RhoGEF的活性,而Gα12/13調節PDZ-RhoGEF、LARG和p115 RhoGEF的活性[10]。IL-1β是否通過Rho激酶介導膿毒癥大鼠血管的鈣失敏發生?如果是,它又是通過調節哪種或哪幾種G蛋白的活性進而引起下游相應的RhoGEF活性改變,進而引起Rho激酶活性下降而導致血管鈣失敏。筆者前期研究顯示,IL-1β通過下調PKC、Rho激酶活性引起血管鈣失敏,從而介導內毒素休克家兔血管低反應性的發生,而且發現Rho激酶較PKC發揮更重要的作用[11]。本研究重點探索IL-1β是如何調節Rho激酶活性,但因為商品化的抗兔抗原一抗很難獲得,難以開展分子機制研究,而抗大鼠抗原的一抗卻很豐富,因此,本研究以膿毒癥大鼠為動物模型研究IL-1β調節Rho激酶活性的作用機制。
1 材料與方法
1.1實驗動物 實驗動物使用通過第三軍醫大學倫理委員會批準并嚴格按規定執行。SPF級成年健康雌性SD大鼠,體質量(210±10)g,由第三軍醫大學大坪醫院野戰外科研究所實驗動物中心提供。
1.2主要試劑與儀器 大鼠IL-1β ELISA試劑盒(NeoBioscience公司),重組大鼠IL-1β(PeproTech公司),兔抗大鼠p63 RhoGEF抗體(Proteintech公司),山羊抗大鼠PDZ-RhoGEF抗體(Santa Cruz公司),兔抗大鼠Gα12、Gα13、Gαq抗體及小鼠抗大鼠Gα11抗體(Santa Cruz公司),兔抗大鼠MYPT1抗體及磷酸化MYPT1抗體 (Thr850,Millipore公司),小鼠抗人β-actin抗體(Pierce公司),RhoGEF exchange assay biochem 試劑盒(Cytoskeleton公司),逆轉錄試劑盒及PCR反應混合試劑(Promega公司),DMEM/F12 1∶1及新西蘭胎牛血清(Hyclone公司),配制Krebs-Henseleit重碳酸鹽緩沖液(K-H液)的試劑均為國產分析純。Power lab八道生理記錄儀及壓力傳感器(AD Instrument公司),恒溫離體器官灌流槽(Letica公司),垂直板狀電泳儀(Bio-Rad公司),多功能讀板機(Bio-TEDSynergy HT),CO2細胞培養箱(SHEL/JB)。
1.3方法
1.3.1膿毒癥模型的復制及標本獲取 SD大鼠32只,按隨機數字表完全隨機分為假手術組、盲腸結扎穿孔(CLP) 3 h組、CLP 6 h組、CLP 12 h組,每組8只。采用CLP復制膿毒癥模型,參考文獻[12],并適當調整:(1)1 mL/kg 3%戊巴比妥鈉腹腔麻醉;(2)開腹(從腹白線處),切口長約3.0 cm,找到盲腸,清除腸系膜(注意避免損傷血管),用4號線在離盲端1.5 cm處結扎盲腸,再用三棱錐在結扎盲端中央處穿孔,使成前端大小約0.5 cm×0.5 cm×0.5 cm而后端大小約0.4 cm×0.4 cm×0.4 cm的三角形孔;(3)依次用4號線和1號線關腹。假手術組大鼠只進行麻醉和開、關腹操作。在CLP手術后3、6、12 h(補適量3%戊巴比妥鈉麻醉大鼠),開腹經腹主動脈取1.5 mL動脈血,加1 U肝素抗凝,離心(3 000 g×10 min,4 ℃),取上清液,即為血漿,分裝保存于-80 ℃冰箱用于IL-1β測定;小心游離出腸系膜上動脈(SMAs)主干,用角膜剪剪除周圍結締組織(一定要注意保護血管內皮完整),制成長2~3 mm的血管環,用于Ca2+反應性測定。另取各組SMAs分支,用RIPA裂解液提取各組總蛋白。
1.3.2IL-1β體外單因素處理及標本獲取 按文獻[13]所述培養SMAs來源的VSMCs。實驗分為對照組、1 ng/mL IL-1β組、10 ng/mL IL-1β組和100 ng/mL IL-1β組,每組各6瓶細胞。待VSMCs傳代細胞(第三代)生長100%融合后,磷酸鹽緩沖液(PBS)洗2次,加入DMEM/F12每瓶2 mL饑餓細胞12 h后,加入等體積生理鹽水(對照組)或使終濃度為上述濃度的IL-1β溶液孵育24 h。用RIPA裂解液提取各組細胞的總蛋白。
1.3.3膿毒癥大鼠血管鈣敏感性、血漿IL-1β水平變化及相關性分析 取1.3.1制備的血管環,分別測定各組血管環對Ca2+的敏感性,方法同文獻[5]。以張力(收縮力/血管環重量)為量化標準,用最大張力(Emax)來評價血管鈣敏感性。將1.3.1所得的血漿從-80 ℃冰箱中取出,按大鼠IL-1β ELISA試劑盒操作說明,測量各組在450 nm處吸光度(A)值。用CurveExpert 1.3軟件進行曲線擬合,得出標準曲線和公式,求出各組血漿的IL-1β濃度。用各組的Emax值和IL-1β濃度進行相關性分析,得出二者之間是否存在相關性。
1.3.4IL-1β對大鼠VSMCs MLC20磷酸化水平及Rho激酶活性的影響 取 1.3.2處理好的總蛋白(每組n=3),用蛋白質印跡法(Western blot)檢測,以磷酸化MLC20(MLC20-p)/非磷酸化MLC20(MLC20)表示MLC20磷酸化水平,以磷酸化MYPT1(Rho激酶底物,MYPT1-p)/非磷酸化MYPT1(MYPT1)表示Rho激酶活性。
1.3.5IL-1β對大鼠VSMCs的Gα11、Gαq、Gα12、Gα13的表達影響 取1.3.2處理好的總蛋白(每組n=3),用Western blot檢測各組的Gα11、Gαq、Gα12、Gα13表達。
1.3.6IL-1β對大鼠VSMCs的RhoGEF、PDZ-RhoGEF和p63 RhoGEF活性的影響 取1.3.2處理好的總蛋白(每組n=3),應用RhoGEF exchange assaybiochem kit檢測各組的RhoGEF、PDZ-RhoGEF和p63-RhoGEF活性。RhoGEF活性用總蛋白直接檢測。p63 RhoGEF和PDZ-RhoGEF活性檢測如下:(1)免疫沉淀,聯合總蛋白、Protein A/G 20 μL、PDZ-RhoGEF或p63 RhoGEF一抗1 μg,在 4 ℃孵育24 h,離心(3 000 g×5 min,4 ℃),去上清液得沉淀,用1 mL RIPA裂解液洗沉淀,離心(3 000 g×5 min,4 ℃),去上清液,重復2次,得到的沉淀即為與磁珠結合的抗原抗體復合物;(2)洗脫,沉淀中加入30~50 μL洗脫緩沖液(0.2 mol/L甘氨酸,pH 2.5),輕輕地蓋上蓋子并混勻,立即離心(3 000 g×3 min,4 ℃),小心的轉移上清液 (避免轉移任何免疫介質),立即在每20 μL上清液中加入1 μL 1.5 mol/L Tris,pH 9.0 以中和洗脫液;(3)按照試劑盒操作步驟進行活性檢測,以測得的熒光值-基底熒光值代表RhoGEF的活性。
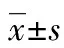
2 結 果
2.1膿毒癥大鼠血管鈣敏感性及血漿IL-1β濃度變化 在CLP后3、6和12 h,大鼠SMAs對Ca2+敏感性的量-效曲線均出現右移,Emax均降低(P<0.05),見圖1A。血漿IL-1β水平在CLP后6 h和12 h均明顯升高(P<0.05),見圖1B。血漿IL-1β水平與同時期SMAs的鈣敏感性呈明顯負相關(r=-0.821,P<0.05)。

a:P<0.05,與假手術組比較
圖1膿毒癥大鼠血管鈣敏感性及血漿IL-1β濃度變化
2.2IL-1β對大鼠VSMCs MLC20磷酸化水平及Rho激酶活性的影響 與對照組相比,IL-1β能明顯降低大鼠VSMCs MLC20-p/MLC20及MYPT1-p/MYPT1 (P<0.05)。見圖2。

a:P<0.05,與對照組比較
圖2 IL-1β對大鼠VSMCs MLC20磷酸化水平及Rho激酶活性的影響
2.3IL-1β對大鼠VSMCs的Gαq、Gα11、Gα12、Gα13表達水平的影響 以G蛋白/內參β-actin表示各G蛋白的表達水平。與對照組相比,VSMCs的Gα11表達水平在各濃度IL-1β孵育后明顯升高(P<0.05),Gα12表達水平明顯降低(P<0.05),Gα13和Gαq表達水平無明顯改變(P>0.05)。見圖3。

*:P<0.05,與對照組比較
圖3 IL-1β對大鼠VSMCs的Gαq、Gα11、Gα12、Gα13表達水平的影響
2.4IL-1β對大鼠VSMCs的RhoGEF、p63 RhoGEF和PDZ-RhoGEF活性的影響 與對照組相比,VSMCs的RhoGEF和PDZ-RhoGEF活性在各濃度IL-1β組明顯降低(P<0.05),p63 RhoGEF活性卻明顯升高(P<0.05)。見圖4。

a:P<0.05,與對照組比較
圖4 IL-1β對大鼠VSMCs的RhoGEF及p63 RhoGEF和PDZ-RhoGEF活性的影響
3 討 論
研究顯示,Rho激酶是調節血管鈣敏感性的重要作用分子,Rho激酶是一種絲氨酸/蘇氨酸激酶,其調節機制為:(1)直接磷酸化MLC20;(2)磷酸化CPI-17從而抑制MLCP進而抑制MLC20去磷酸化;(3)直接抑制MLCP,最終使MLC20的Ser-19位點磷酸化,增加肌球蛋白與肌動蛋白結合,使粗肌絲橫橋上的ATP酶活性得到提高,啟動橫橋擺動,增強肌絲滑行能力使血管平滑肌收縮[14]。
筆者前期研究結果提示,IL-1β能通過下調Rho激酶活性介導內毒素休克家兔血管鈣失敏的發生,為進一步探索其調節機制,結合實際,本研究利用膿毒癥大鼠模型及大鼠SMAs來源的VSMCs重點研究了IL-1β是如何下調Rho激酶活性從而介導膿毒癥血管鈣失敏發生的。盡管前期實驗提示IL-1β能通過下調Rho激酶活性介導內毒素休克家兔血管鈣失敏發生,但首先還是要驗證IL-1β是否通過下調Rho激酶活性介導膿毒癥大鼠血管鈣失敏的發生,結果得到了驗證。值得注意的是,CLP 3 h后血管鈣敏感性開始下降,而血漿IL-1β卻在CLP 6 h后開始升高,這是因為膿毒癥后血漿IL-1β升高晚于TNF-α等其他細胞因子升高,而TNF-α等其他細胞因子對血管鈣敏感性也可能有調節作用。結果顯示在血漿IL-1β水平升高后血管鈣敏感性進一步降低,相關性分析顯示二者呈明顯負相關,在整體水平提示IL-1β可能介導膿毒癥大鼠血管鈣敏感性下降。為排除膿毒癥時其他細胞因子的影響,進一步確認其介導作用,筆者在離體水平培養SMAs來源的VSMCs,并利用IL-1β單獨作用于它們,結果顯示IL-1β能明顯降低VSMCs的MLC20磷酸化水平及Rho激酶活性,而MLC20磷酸化水平及Rho激酶活性是反映鈣敏感性的重要指標,從而在離體水平驗證了IL-1β能通過下調Rho激酶活性介導膿毒癥大鼠血管鈣失敏發生。
那么IL-1β是如何調節Rho激酶活性而介導膿毒癥大鼠血管鈣失敏發生的呢?本研究檢測了VSMCs上調節RhoGEF活性的G蛋白的表達水平,并通過檢測其下游的相應RhoGEF活性來反映其自身的活性水平。結果顯示,IL-1β對G蛋白的表達調控存在差異性:下調Gα12的表達,上調Gα11的表達,對Gα13和Gαq表達卻無明顯作用。不難理解的是下調Gα12的表達,因為IL-1β能介導膿毒癥血管鈣失敏發生,而G蛋白表達水平與鈣敏感性是正相關的。對于上調Gα11的表達就不好解釋了,有報道TNF-α能上調VSMCs Gαq家族表達[15],Gα11是Gαq家族成員,TNF-α與IL-1β在功能上存在相似性,故IL-1β上調Gα11的表達是有可能的。檢測了G蛋白表達水平,但不知其活性狀態,目前對于G蛋白活性狀態的檢測較困難,為此筆者檢測了其下游相應RhoGEF(PDZ-RhoGEF、p63 RhoGEF活性)和總RhoGEF活性以反映G蛋白活性狀態,結果其活性水平與其相應的上游G蛋白表達變化方向一致,且總RhoGEF活性下降,提示IL-1β通過Gα12/PDZ-RhoGEF/RhoA/Rho激酶介導血管鈣失敏的發生,另外通過Gα11/p63 RhoGEF/RhoA/Rho激酶上調血管鈣敏感性。
綜上所述,IL-1β可通過下調Rho激酶的活性介導膿毒癥大鼠血管鈣敏感性降低,進一步研究發現,IL-1β一方面通過下調Gα12表達,下調PDZ-RhoGEF活性而下調Rho激酶活性;另一方面通過上調Gα11表達,上調p63 RhoGEF活性而上調Rho激酶活性,但兩方面途徑的總效用使總RhoGEF活性下降,進而使Rho激酶活性下降而介導膿毒癥血管鈣失敏的發生。
[1]Simpson SQ,Gaines M,Hussein Y,et al.Early goal-directed therapy for severe sepsis and septic shock:a living systematic review[J].J Crit Care,2016,29(36):43-48.
[2]Kimmoun A,Ducrocq N,Levy B.Mechanisms of vascular hyporesponsiveness in septic shock[J].Curr Vasc Pharmacol,2013,11(2):139-149.
[3]Liang JL,Yang GM,Li T,et al.Interleukin 1β attenuates vascular α1 adrenergic receptors expression following lipopolysaccharide-induced endotoxemia in rabbits:involvement of JAK2-STAT3 pathway[J].J Trauma Acute Care Surg,2014,76(3):762-770.
[4]Gao Y,Yang Y,Guan Q,et al.IL-1β modulate the Ca2+-activated big-conductance K channels(BK)via reactive Oxygen species in cultured rat aorta smooth muscle cells[J].Mol Cell Biochem,2009,338(1/2):59-68.
[5]Xu J,Yang G,Li T,et al.Involvement of Cpi-17 and zipper-interacting protein kinase in the regulation of protein kinase C-alpha,protein kinase C-epsilon on vascular calcium sensitivity after hemorrhagic shock[J].Shock,2010,33(1):49-55.
[6]Takizawa S,Ozaki H,Karaki H.Interleukin-1beta-induced,nitric oxide-dependent and -independent inhibition of vascular smooth muscle contraction[J].Eur J Pharmacol,1997,330(2/3):143-150.
[7]Soler M,Camacho M,Vila L.Imidazolineoxyl N-Oxide preventsthe impairment of vascular contraction caused by interleukin-1beta through several mechanisms[J].J Infect Dis,2003,188(6):927-937.
[8]Hodge RG,Ridley AJ.Regulating Rho GTPases and their regulators[J].Nat Rev Mol Cell Biol,2016,17(8):496-510.
[9]Somlyo AP,Somlyo AV.Ca2+sensitivity of smooth muscle and nonmuscle myosin II:modulated by G proteins,kinases,and myosin phosphatase[J].Physiol Rev,2003,83(4):1325-1358.
[10]Kather JN,Kroll J.Rho guanine exchange factors in blood vessels:Fine-tuners of angiogenesis and vascular function[J].Exp Cell Res,2013,319(9):1289-1297.
[11]Liang JL,Yang GM,Li T,et al.Effects of interleukin-1β on vascular reactivity after lipopolysaccharide-induced endotoxic shock in rabbits and its relationship with PKC and Rho kinase[J].J Cardiovasc Pharmacol,2013,62(1):84-89.
[12]Rittirsch D,Huber-Lang MS,Flierl MA,et al.Immunodesign of experimental sepsis by cecal ligation and puncture[J].Nat Protoc,2009,4(1):31-36.
[13]Yang GM,Xu J,Li T,et al.Role of via receptor in AVP-Induced restoration of vascular hyporeactivity and its relationship to MLCP-MLC(20) phosphorylation pathway[J].J Surgical Res,2010,161(2):312-320.
[14]Puetz S,Lubomirov LT,Pfitzer G.Regulation of smooth muscle contraction by small GTPases[J].Physiology,2009,24(6):342-356.
[15]Hotta K,Emala CW,Hirshman CA.TNF-alpha upregulates G(i)alpha and G(q)alpha protein expression and function in human airway smooth muscle cells[J].Am J Physiol Lung Cell Mol Physiol,1999,276(3):L405-411.
StudyonmechanismofIL-1βmediatingvascularcalciumdesensitizationinsepticratsthroughdown-regulatingRhokinaseactivity*
LiangJialin1,LiuLiangming2△,LiTao2
(1.DepartmentofMedicalRehabilitation,HangzhouAeromedicalIdentificationandTrainingCenterofAirForce,Hangzhou,Zhejiang310013,China;2.SecondDepartment,InstituteofFieldSurgeryResearch/StateKeyLaboratoryofTrauma,BurnsandCombinedInjury,DapingHospital,ThirdMilitaryUniversity,Chongqing400042,China)
ObjectiveTo investigate the mechanism of interleukin-1β(IL-1β) mediating the vascular calcium desensitization of septic rats by down-regulating Rho kinase activity.MethodsThirty-two SD rats were randomly divided into the sham operation group,cecal ligation and puncture (CLP) 3 h group,CLP 6 h group and CLP 12 h group,8 cases in each group.The septic rat was duplicated by CLP.Then the plasma IL-1β level and calcium sensitivity of superior mesenteric arteries (SMAs) were detected at different time points.Their correlation was analyzed.VSMCc derived from SMAs were cultured and incubated with different concentrations of human recombinant IL-1β for 24 h.Then the influences of IL-1β on the MLC20phosphorylation level,Rho kinase activity,G protein expression level and RhoGEF activity were observed.ResultsThe calcium sensitivity of SMAs after CLP 3 h began to decrease(P<0.05),while plasma IL-1β level began to increase after CLP 6 h (P<0.05),the change trend of SMAs calcium sensitivity was negatively correlated with plasma IL-1β level change(P<0.05).IL-1β could decrease the phosphorylation level of VSMCs myosin light chain(MLC20) and Rho kinase activity(P<0.05),up-regulate Gα11 expression and down-regulate Gα12 expression,but had no obvious effect on Gαq and Gα13 expression(P>0.05).IL-1β could significantly reduce RhoGEF and PDZ-RhoGEF activity(P<0.05) but significantly increase p63 Rho GEF activity(P<0.05).ConclusionIL-1β induces the decrease of PDZ-RhoGEF and Rho kinase activity by down-regulating Gα12 expression,causes the decrease of MLC20phosphorylation level,thus mediates the occurrence of calcium desensitization in septic rat;in addition,IL-1β may cause the increase of p63 RhoGEF activity by up-regulating Gα11 expression,thus mediates the increase of vascular calcium sensitivity in septic rats,but the total effect is the decrease of calcium sensitivity.
sepsis;interleukin-1 beta;calcium desensitization;G protein;RhoGEF
10.3969/j.issn.1671-8348.2017.28.001
國家杰出青年科學基金資助項目(30625037)。
梁家林(1982-),主治醫師,博士,主要從事膿毒癥血管低反應性發生機制的研究。△
,E-mail:liangmingliu@yahoo.com。
R631+.2
A
1671-8348(2017)28-3889-04
2017-03-02
2017-04-28)

