小麥 TaNIP4-1基因的克隆及生物信息學分析
曹榮珍,聞珊珊
(西北農林科技大學農學院,陜西楊凌 712100)
小麥 TaNIP4-1基因的克隆及生物信息學分析
曹榮珍,聞珊珊
(西北農林科技大學農學院,陜西楊凌 712100)
水通道蛋白不僅控制著水分和一些小分子溶質的跨膜運輸,也是植物體應對非生物脅迫的重要組成部分。為了進一步研究小麥水通道蛋白的功能,本研究以NCBI和Ensemble Plant數據庫中查找出的已報道的小麥水通道蛋白基因序列為模板,針對其保守區設計了19對引物,應用PCR的方法從5個小麥品種中克隆出19個基因片段。通過比對鑒定到一個此前未曾報道的新基因,并對其進行生物信息學分析,將其命名為 TaNIP4-1。理化特性分析表明,該基因位于3A染色體短臂,基因全長1 315 bp,CDS序列長度864 bp,含有3個外顯子和2個內含子,編碼含有288個氨基酸的多肽,含有保守的沙漏模型,有6個跨膜區和2個保守的NPA基序。亞細胞定位預測結果表明該基因位于質膜上。該基因啟動子序列含有與逆境響應相關的順式調控元件,而對7日齡的麥苗進行干旱和鹽脅迫處理后,其qRT-PCR結果顯示,干旱和鹽處理5 h后, TaNIP4-1基因在小麥葉片中的表達量明顯上調;鹽處理7 d后, TaNIP4-1基因在小麥根部的表達量顯著上調。由此可見, TaNIP4-1基因參與了小麥應對逆境的過程。
小麥;水通道蛋白; TaNIP4-1;生物信息學
近年來,氣候變化影響了世界范圍的小麥產量[1],提高小麥的耐旱耐鹽性是應對嚴峻氣候變化和確保我國糧食安全的重大需求。然而,人們對小麥抗逆分子機制的認知并不充足[2]。小麥通過信號識別、信號傳導和代謝調節來應對逆境,最終重新建立不同器官和細胞內的水勢和離子穩態。植物體對逆境的承受力最終取決于其對膜代謝活性的調節和細胞間水分運輸的能力[3]。
水通道蛋白(aquaporin,AQP)是主要控制水分轉移的膜通道蛋白。AQP屬于主要膜內在蛋白(major membrane intrinsic protein,MIP)超家族,主要分為四個進化枝,包括占比例最大的質膜內在蛋白(plasma membrane intrinsic proteins,PIPs);存在于共生根瘤類菌體周圍膜上的類Nod26膜內在蛋白(nodulin26 - like intrinsic proteins,NIPs);位于液泡膜上的液泡膜內在蛋白(tonoplast intrinsic proteins,TIPs)以及小分子堿性膜內在蛋白(small and basic intrinsic proteins,SIPs)[4]。這四種類型的AQP具有高度保守的結構,六個跨膜的α螺旋通過五個短環連接,第二和第五個環包含高度保守的天冬酰胺-脯氨酸-丙氨酸基序(NPA,Asn-Pro-Ala),分別位于細胞膜兩側,其在形成具有底物特異性膜通道的過程中起重要作用[5]。不同的水通道蛋白亞家族具有不同的底物轉運特性,在某些情況下,除運輸水分外,也可以進行一些小分子物質運輸,如氨分子[6]和CO2分子[7]等。NIP家族成員對水分轉運的能力弱于PIP和TIP,主要進行某些有機物質和礦物質的轉運,如硼、硅、硒、砷、銻元素等[8-9]。
擬南芥中的AQP家族成員為35個[10],水稻和玉米中分別為33和31個[11-12]。與這些植物相比,關于小麥中水通道蛋白基因的研究相對較少,目前報道的在小麥非生物逆境脅迫中起作用的水通道蛋白基因主要有 TdPIP1;1、 TdPIP2;1、 TaAQP7、 TaNIP和 TaTIP2;2等[13-15]。有學者將來自小麥的 TaTIP2;2在擬南芥中過表達,最終降低了植株的耐旱能力,顯示了 TaTIP2;2對植株的耐旱行為具有負調控作用[14]。本研究將生物信息學分析與PCR手段相結合,得到了一個我們此前經生物信息學分析未能鑒定到的水通道蛋白基因,并對其特性進行分析,為該基因的功能研究奠定了基礎。
1 材料與方法
1.1 植物材料與培養
所用小麥品種為科農199、Brundge 96、西農979、晉麥47和小偃22。科農199來自于中國科學院遺傳與發育生物學研究所高彩霞課題組,Brundge 96來自于美國華盛頓州立大學作物與土壤學院Diter von Wettstein課題組,西農979、晉麥47和小偃22來自于西北農林科技大學高翔課題組。五個小麥品種在冬春性、分蘗、抽穗、抗逆性等方面均有不同,擴大了對目標片段進行初步鑒定的基因組背景范圍;之后再選取耐旱性較好的科農199[16]進行脅迫處理和基因表達分析。
培養條件:每天光照14 h,溫度25 ℃,暗培養10 h,溫度20 ℃,濕度均為60%。
將正常生長7 d的科農199幼苗參照王稼苜等的方法,采用16.1%的PEG6000進行輕度干旱處理[17],參照劉丹等的方法,采用0.35 mol·L-1NaCl做鹽脅迫處理[18],然后在1 h、5 h、1 d、7 d四個時期分別取正常生長和經處理的幼苗的葉和根,提取RNA,-80 ℃保存,用于基因的表達分析。
1.2 基因組DNA與RNA提取及cDNA合成
參照CTAB法從上述5個小麥品種的葉片中提取基因組DNA(gDNA),參照Trizol法從科農199(Kenong 199)正常生長及經處理后幼苗的葉和根中提取RNA,cDNA使用StarScript II First-strand cDNA Synthesis Mix(GenStar,北京)合成,-20 ℃保存。
1.3 引物設計與PCR擴增
從NCBI數據庫、Uniprot數據庫和Ensembl plant數據庫中查找小麥水通道蛋白序列,用Clustalx 1.83軟件進行多重序列比對,剔除來自不同數據庫中的相同基因序列;然后用MEGA 6.0做進化樹分析,根據進化樹分析結果,將獲得的AQP序列大致分為PIP1、PIP2、TIP、NIP、SIP 5個組,每個組內根據序列同源情況再分為幾個小組,依據分組情況及序列保守性,選擇合適的位點設計引物[15],所設引物見表1。以從5個小麥品種中提取的gDNA作為模板進行PCR擴增,PCR擴增反應總體系為20 μL:250 ng的gDNA模板,Taq酶0.1 μL(大連寶生物工程有限公司),dNTPs(25 μmol·L-1)2 μL,10×Buffer緩沖液2 μL,上下游引物(5 μmol·L-1)各1 μL,最后用ddH2O補至終體積。PCR反應程序為:94 ℃預變性5 min,94 ℃變性45 s,58~60 ℃退火45 s,72 ℃延伸90 s,35個循環,然后72 ℃延伸10 min,12 ℃保溫。
1.4 基因片段克隆與測序
將擴增的PCR產物通過1%瓊脂糖凝膠分離后,回收目的片段,并將其連在pUCm-T載體上,挑取單克隆測序。測序由上海生物工程技術服務有限公司完成。
1.5 序列生物信息學分析
將測序結果在NCBI和Ensembl plant數據庫中利用BLAST工具進行比對,從中找出未知功能的基因對其進行生物學分析。用SMART數據庫和NCBI的Conserved Domains在線服務器預測這些候選基因序列的保守結構域,其理化性質由ExPASy軟件分析,亞細胞定位通過TargetP 1.1預測[19],蛋白激酶特異性磷酸化位點用KinasePhos軟件預測,跨膜螺旋結構域用TMHMM Sever v.2.0預測。用MEGA 6.0軟件構建系統進化樹,利用Gene Structure Display Server預測基因的結構[20],用PlantCARE對基因啟動子序列進行分析,用PHYRE 2 軟件建立其3D模型[21]。
1.6 TaNIP4-1基因的表達分析
根據 TaNIP4-1基因的cDNA序列設計的實時定量PCR(qRT-PCR)正向引物為5′-GAAC ACGGTGGGCAGCG-3′,反向引物為5′-GCACC AGCTCCCGGATG-3′。qRT-PCR反應在Roche LightCycler 480儀器上進行,以小麥Actin基因作為內參,其正向和反向引物序列分別為5′-CAC ACTGGTGTTATGGTAGG-3′和5′-AGAAGGTGTGATGCCAAAT-3′。RT-qPCR反應總體系為15 μL:SYBR Mixture 7.5 μL,cDNA模板2 μL,ddH2O 5 μL,正反向引物各0.25 μL。其反應條件為95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,反應重復40個循環,每個樣品三次生物學重復,以確保結果可靠。用公式2-△△Ct計算基因表達量,此外,還要計算其標準差。

表1 水通道蛋白基因擴增所用PCR引物Table 1 Primers for amplifing the variable region of the aquaporin genes
2 結果與分析
2.1 TaNIP4-1基因的獲得
以提取的5個不同品種的gDNA為模板,利用設計的19對引物(表1)進行PCR擴增,對擴增后的產物進行1%瓊脂糖凝膠電泳,其產物如圖1所示。同一對引物擴增的PCR產物大小一致時,只選其中一個片段回收純化,做T克隆后測序。經測序的19個PCR產物大小為459~1 180 bp。將這些產物的測序結果分別在NCBI和Ensembl plant數據庫中進行比對,發現大部分基因片段與庫中的小麥水通道蛋白基因相匹配,且匹配度均在95%以上;而A18/S18的PCR產物并沒有在NCBI數據庫中找到與該產物匹配度很高的基因,在Ensembl plant數據庫中與之相匹配的小麥基因為 TRIAE_CS42_3AS_TGACv1_211831_AA0694780.1,其功能尚未可知。
從NCBI數據庫中找到已報道的擬南芥、水稻和玉米以及小麥的NIP亞族中水通道蛋白基因的氨基酸序列。利用MEGA 6.0軟件結合最大似然法將它們進行系統進化分析,進化樹測試參數設為1 000。根據圖2進化樹分析結果可知, TRIAE_CS42_3AS_TGACv1_211831_AA0694780.1基因與 OsNIP4-1最為接近,且小麥與水稻均為單子葉植物,故將該基因歸為NIP4組,并參照擬南芥中水通道蛋白命名法將其命名為 TaNIP4-1。

1:科農199;2:Brundge 96;3:西農979;4:晉麥47;5:小偃22
1:Kenong 199;2:Brundge 96;3:Xinong 979;4:Jinmai 47;5:Xiaoyan 22
圖1小麥水通道蛋白可變區PCR擴增結果
Fig.1Amplifiedfragmentsofvariableregioninaquaporingenesofwheat
2.2 TaNIP4-1基因的生物信息學分析
2.2.1 保守結構域分析
將 TRIAE_CS42_3AS_TGACv1_211831_AA0694780.1基因的CDS序列提交到NCBI的 CDD在線服務器和SMART數據庫中,分析該基因的保守結構域,分析結果顯示該基因屬于MIP超家族,A18/S18引物設計來源于之前數據庫中已注明的小麥水通道蛋白NIP亞族的基因。
2.2.2 TaNIP4-1蛋白的理化特性分析
從Ensemble plant數據庫中獲得的信息可知,該基因位于3A染色體短臂,其DNA序列長度為1 315 bp,CDS序列長度為864 bp,含有3個外顯子和2個內含子,編碼的氨基酸數目為288,等電點為9.38,為弱堿性蛋白,相對分子質量為29.8 kDa,穩定系數為37.17,為穩定型蛋白;脂肪族指數為106.32,總平均親水系數為0.614,即該蛋白為疏水性蛋白;含有絲氨酸和酪氨酸磷酸化位點各一個。
2.2.3 蛋白的多重序列比對分析
從NCBI數據庫中找出已報道的玉米和水稻中的NIP亞族蛋白序列,并將它們與該基因蛋白序列通過Clustal-X 軟件(1.81版本)進行比對,分析其保守區氨基酸序列,其結果見圖3。發現該基因編碼蛋白的氨基酸序列與所選的其他植物的水通道NIP亞家族的氨基酸序列具有高度同源性。該水通道蛋白基因家族NPA基序(Asn-Pro-Ala)含有2個保守NPA基序及6個保守跨膜區。

圖2 TRIAE_CS42_3AS_TGACv1_211831_AA0694780.1基因系統進化樹分析
2.2.4 亞細胞定位分析
水通道蛋白能否正常發揮功能,除了與它的選擇性有關外,還依賴于該蛋白在亞細胞中的準確定位。實際上,除了部分蛋白能自身進行準確而及時的定位外,很多蛋白需要依靠分子間的互作才能正確進行定位,且只有正確轉位后才能行使其轉運功能。通過Target P 1.1 sever對TaNIP4-1進行亞細胞定位預測,發現該蛋白既沒有葉綠體轉運肽,也沒有線粒體信號肽。使用TMHMM Sever v.2.0預測該基因的跨膜結構域,從圖4中可以發現,該基因含有6個跨膜區,符合水通道蛋白的典型跨膜結構。
2.2.5 TaNIP4-1蛋白的3D模型
為了解 TaNIP4-1蛋白的結構性質,通過PHYRE 2服務器建立了該蛋白的3D模型。該模型構建時的置信度均為100%,氨基酸序列覆蓋率為93%,因此,此蛋白質結構被認為是高度可靠的。從圖5可以看出,該蛋白是由保守的沙漏模型及α螺旋束形成的6個長螺旋和兩個額外的短螺旋組成的膜蛋白。
2.2.6 TaNIP4-1基因的啟動子區序列分析
基因啟動子區中的順式作用元件可以與許多轉錄因子結合,進而調節其附近基因的轉錄,因此,這些元件在植物的脅迫反應中有重要作用。利用PlantCARE軟件預測 TaNIP4-1基因起始密碼子上游1 500 bp的DNA序列,發現該基因啟動子區既包含Box-4、G-Box、I-Box、ACE等光響應元件,也含有激素響應元件,如ABRE為ABA響應元件,GARE-motif為赤霉素響應元件,CGTCA-motif和TGACG-motif為茉莉酸甲酯響應元件;此外,還包含有多個逆境脅迫響應元件,如MBS為干旱誘導響應元件,Box-W1為真菌誘導響應元件,而TC-rich repeats元件則參與抗性和脅迫反應。這些順式作用元件的分析在一定程度上為了解并深入研究 TaNIP4-1的功能奠定了基礎。
2.2.7 非生物脅迫下 TaNIP4-1基因表達分析
已有研究表明水通道蛋白在植物逆境脅迫中起著重要作用,為了進一步驗證和鑒定 TaNIP4-1基因對非生物脅迫的響應,用qRT-PCR分析在干旱和鹽脅迫處理下,小麥葉片和根組織中 TaNIP4-1基因的表達情況。從圖6可以看出,干旱和鹽脅迫處理下, TaNIP4-1基因基本呈一致的表達趨勢。在小麥葉片中,干旱和鹽分別處理1 h 后, TaNIP4-1基因表達上調,但并不顯著,而在處理5 h后,該基因表達上調趨勢明顯,但處理1 d 后,該基因表達下調,且在處理7 d后,其表達量急劇下降。在小麥根部,經干旱處理后, TaNIP4-1基因表達基本呈先下降后上升趨勢,但表達量差異并不顯著;經鹽脅迫處理后,該基因表達仍呈先下降后上升趨勢,且在處理7 d后, TaNIP4-1基因表達顯著上調。TaNIP4-1很可能是小麥根部應對鹽脅迫反應過程中的次級水通道蛋白。可見,無論在葉片還是根部, TaNIP4-1基因都參與了小麥應對非生物脅迫的響應過程。

圖3 TaNiP4-1基因蛋白序列與玉米和水稻中的NIp亞族蛋白的序列比對 (藍色背景的為NPA motif,其他顏色的依次為6個跨膜區)

圖4 TaNIP4-1基因的跨膜域分析

圖5 TaNIP4-1蛋白的3D模型預測
3 討 論
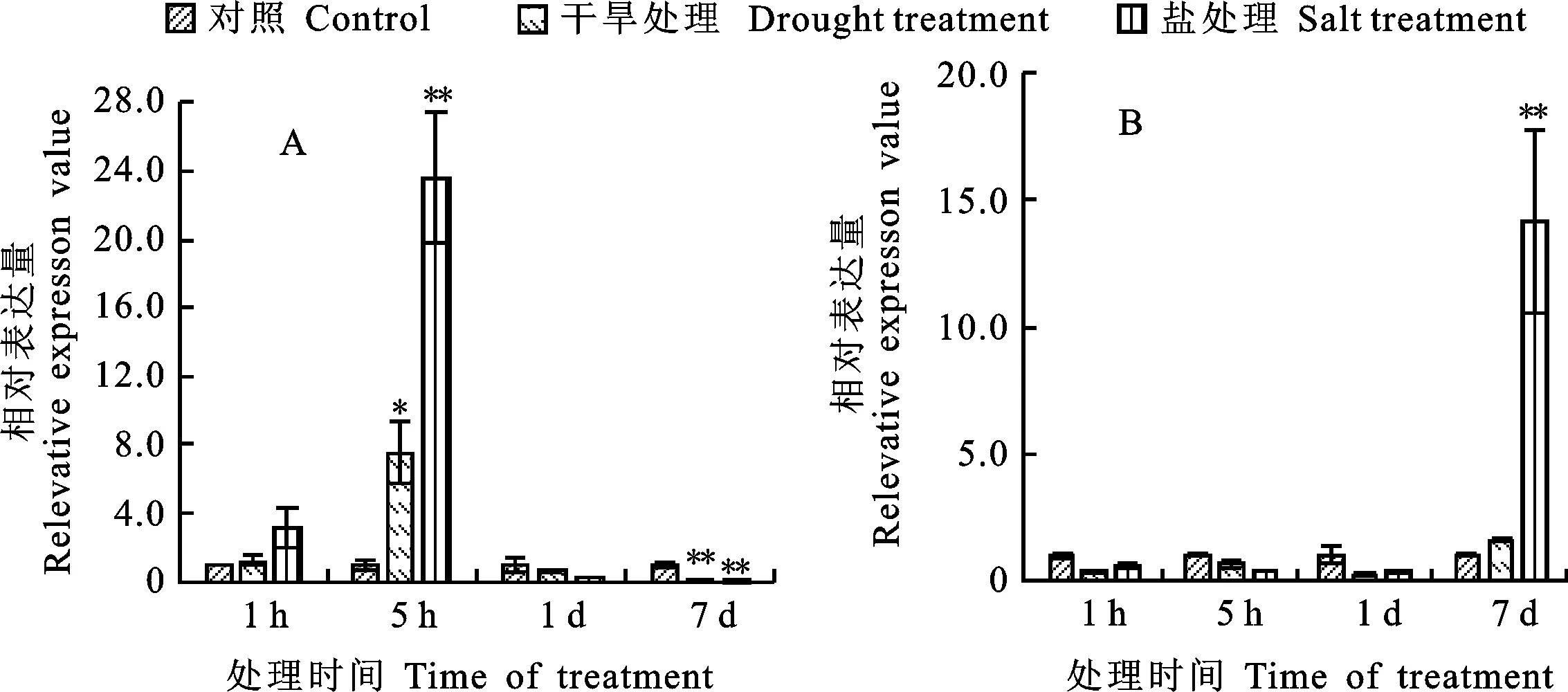
*和**分別表示干旱處理和鹽處理與對照的差異在0.05和0.01水平上顯著。
* and ** indicate significant difference between stress treatment and control at 0.05 and 0.01 level,respectivly.
圖6干旱和鹽脅迫下TaNIP4-1基因在小麥葉(A)和根(B)中的相對表達量
Fig.6RelativeexpressionlevelofTaNIP4-1geneinwheatleavesandrootsunderdroughtandsaltstresses
植物一方面通過光合作用吸收CO2作為生產有機物質的原料,另一方面通過呼吸作用提供能量、散失水蒸氣維持機體的平衡。而呼吸作用的正常進行,依賴于源源不斷的由植物體根部產生至體表氣孔下方結束的水分運輸[22]。水分由土壤進入根部及進一步運輸到各個器官需要經過逐級轉運。在植物體內,水轉運的方式基本分三種:非質體轉運、共質體轉運和細胞間轉運[23]。非質體轉運一般是指水分子通過細胞壁和細胞間隙轉運的過程;共質體轉運是水分子通過連續的細胞質之間的結合處(胞間連絲)進行的轉運;細胞間轉運則指水分子通過細胞進行的轉運,它包括水分子穿過質體膜和液泡膜的過程,但不涉及胞間連絲[24]。運水量最大的是細胞間轉運,而控制細胞間轉運的水通道蛋白也就成了控制植物體內水分運輸的關鍵。然而水通道蛋白的小分子物質轉運卻不限于水分子,也包括環境中已經溶解的小分子,如硼酸分子[25]等。在整個植物體水分轉運系統中,AQP定位于各個器官最基本的單位:細胞,乃至細胞亞單位上,以最終端的方式出現,對細胞乃至細胞器的含水量進行最基本的調控[12]。因而,AQP的功能表現對植物體應對各種環境變化來說意義非凡。
植物AQP可以發生磷酸化,甲基化,去乙酰化,氨基端乙酰化以及泛素化等修飾過程,因此其分子表現形式遠大于家族成員的數量[15,20]。AQP受到上游信號如環境pH值、鈣離子濃度和活性氧基團的廣泛調控,作為響應,AQP及時接收信號并進行植物器官中水分以及其他物質的傳遞[26]。AQP在植物再生、細胞延伸、氣孔開放、果實成熟和種子發芽中均起關鍵作用[27]。在許多植物物種中,AQP都對植物體應對非生物脅迫產生積極影響。干旱的環境會促進小麥水通道蛋白 TaAQP7提升轉錄水平,而過表達 TaAQP7的煙草植株表現出耐旱能力的提升[28]。同時,AQP的表達也受到環境條件影響。本研究中,應用分子生物學手段鑒定出小麥中尚未被發現的水通道蛋白基因 TaNIP4-1,并對其進行鹽和干旱脅迫下的表達分析,確認該基因參與了小麥逆境脅迫應答響應過程。目前,AQP中關于PIP和TIP亞族的研究相對較多,而涉及NIP亞族的則很少,尤其是在小麥抗逆方面,因此 TaNIP4-1基因的發掘對NIP亞族基因功能的補充以及解析小麥應對逆境的響應機制有重要意義。對于 TaNIP4-1基因的功能及其具體的作用方式還有待進一步研究。
[1]ALI S,LIU Y,ISHAQ M,etal.Climate change and its impact on the yield of major food crops:Evidence from Pakistan [J].Foods,2017,6(6):e39.
[2]ALI MA,AZEEM F,ABBAS A,etal.Transgenic strategies for enhancement of nematode resistance in plants [J].TrontiersinPlantsScience,2017,8:750.
[3]HEINEN R B,YE Q,CHAUMONT F.Role of aquaporins in leaf physiology [J].JournalofExperimentalBotany,2009,60(11):2971.
[4]DANIELSON JA,JOHANSON U.Unexpected complexity of the aquaporin gene family in the mossPhyscomitrellapatens[J].BMCPlantBiology,2008,8:45
[5]ZHAO C X,SHAO H B,CHU L Y.Aquaporin structure-function relationships:water flow through plant living cells [J].ColloidsandSurfacesBBiointerfaces,2008,62(2):163.
[6]COSKUN D,BRITTO DT,LI M,etal.Rapid ammonia gas transport accounts for futile transmembrane cycling under NH3/NH4+toxicity in plant roots [J].PlantPhysiology,2013,163(4):1859.
[7]MORI IC,RHEE J,Shibasaka M.CO2transport by PIP2 aquaporins of barley [J].PlantandCellPhysiology,2014,55(2):251.
[8]BIENERT G P,SCHSSLER M D,JAHN T P .Metalloids:essential,beneficial or toxic major intrinsic proteins sort it out[J].TrendsinBiochemicalSciences,2007,33:20.
[9]ZHAO XQ,MITANI N,YAMAJI N,etal.Involvement of silicon influx transporter OsNIP2;1 in selenite uptake in rice[J].PlantPhysiology,2010,153:1871.
[10]JOHANSON U,KARLSSON M,JOHANSSON I,etal.The complete set of genes encoding major intrinsic proteins in Arabidopsis provides a framework for a new nomenclature for major intrinsic proteins in plants [J].PlantPhysiology,2001,126(4):1358.
[11]CHAUMONT F,BARRIEU F,WOJCIK E,etal.Aquaporins constitute a large and highly divergent protein family in maize [J].PlantPhysiology,2001,125(3):1206.
[12]SAKURAI J,ISHIKAWA F,YAMAGUCHI T,etal.Identification of 33 rice aquaporin genes and analysis of their expression and function [J].Plant&CellPhysiology,2005,46(9):1568.
[13]HUANG C,ZHOU S,HU W,etal.The wheat aquaporin gene TaAQP7 confers tolerance to cold stress in transgenic tobacco [J].ZeitschriftfürNaturorschungC,2014,69(3-4):142.
[14]XU C,WANG M,ZHOU L,etal.Heterologous expression of the wheat aquaporin gene TaTIP2;2 compromises the abiotic stress tolerance ofArabidopsisthaliana[J].PLoSOne,2013,8(11):e79618.
[15]PANDEY B,SHARMA P,PANDEY D M,etal.Identification of new aquaporin genes and single nucleotide polymorphism in bread wheat [J].EvolutionaryBioinformaticsOnline,2013,9(9):437.
[16] 姚艷榮,賈秀領,馬瑞昆,等.冬小麥田間水分反應特性產量評價指標研究[J].中國農學通報,2009,25(17):70.
YAO Y R,JIA X L,MA R K,etal.Study on the evaluation index of water response characteristics of winter wheat [J].ChineseAgriculturalScienceBulletin,2009,25(17):70.
[17] 王稼苜,張志勇,歐行奇等,PEG脅迫對8個不同小麥品種幼苗根系的影響[J].河南科技學院學報,2015,43(3):1.
WANG J M,ZHANG Z Y,OU X Q,etal.Effects of PEG stress on seedling roots of eight different wheat cultivars [J].JournalofHenanInstituteofScienceandTechnology,2015,43(3):1.
[18] 劉 丹,王建賀,王從磊,等.不同鹽濃度脅迫對小麥萌發和幼苗生長的影響[J].中國農學通報,2016,32(24):49.
LIU D,WANG J H,WANG C L,etal.Effects of different salt concentration stress on wheat germination and seedling growth [J].ChineseAgriculturalScienceBulletin,2016,32(24):49.
[19]WANG M,YUE H,FENG K,etal.Genome-wide identification,phylogeny and expressional profiles of mitogen activated protein kinase kinase kinase(MAPKKK) gene family in bread wheat(TriticumaestivumL.)[J].BMCGenomics,2016,17(1):668.
[20]MENG D,LI Y,BAI Y,etal.Genome-wide identification and characterization of WRKY transcriptional factor family in apple and analysis of their responses to waterlogging and drought stress [J].PlantPhysiology&BiochemistryPpb,2016,103:71.
[21]LI X,FENG B,ZHANG F,etal.Bioinformatic analyses of Subgroup-A members of the wheat bZIP transcription factor family and functional identification of TabZIP174 involved in drought stress response[J].FrontiersinPlantScience,2016,7:1643.
[22]XUE D,ZHANG X,LU X,etal.Molecular and evolutionary mechanisms of cuticular wax for plant drought tolerance [J].FrontiersinPlantScience,2017,8:621.
[23]STEUDLE E,PETERSON C A.How does water get through roots [J].JournalofExperimentalBotany,1998,49(322):775.
[24]UEHARA M,WANG S,KAMIYA T,etal.Identification and characterization of anArabidopsismutant with altered localization of NIP5;1,a plasma membrane boric acid channel,reveals the requirement for D-galactose in endomembrane organization [J].Plant&CellPhysiology,2014,55(4):704.
[25]MAUREL C,BOURSIAC Y,LUU DT,etal.Aquaporins in plants [J].PhysiologicalReview,2015,95(4):1321.
[26] FORREST K L,BHAVE M.The PIP and TIP aquaporins in wheat form a large and diverse family with unique gene structures and functionally important features [J].Functional&IntegrativeGenomics,2008,8(2):115.
[27] FRANGNE N,MAESHIMA M,SCHFFNER A R,etal.Expression and distribution of a vacuolar aquaporin in young and mature leaf tissues ofBrassicanapusin relation to water fluxes[J].Planta,2001,212(2):270.
[28] ZHOU S,HU W,DENG X,etal.Overexpression of the wheat aquaporin gene, TaAQP7,enhances drought tolerance in transgenic tobacco [J].PLoSOne,2012;7(12):e52439.
CloningandBioinformaticsAnalysisofTaNIP4-1inWheat
CAORongzhen,WENShanshan
(College of Agronomy, Northwest Agriculture and Forestry University, Yangling, Shaanxi 712100, China)
Aquaporins can not only transport water and some small molecules through the membrane, but also have an effect on abiotic stress. In order to study the function of aquaporins involved in drought resistance mechanism of wheat, reported wheat aquaporin gene sequences were selected from the NCBI and Ensemble Plant databases. A total of 19 pairs of primers were designed, and 19 gene fragments were cloned from five wheat cultivars’s genome using PCR. An aquaporin gene, which has not been identified in the previous bioinformatics analysis, was found via BLAST analysis and some bioinformatics analysis was further carried out. The results showed that one of the 19 genes was not yet reported and it was named as TaNIP4-1 according to the phylogenetic tree and conserved domain analysis. The physical and chemical properties analysis showed that the gene is located on the chromosome 3AS,DNA sequence length is 1315 bp,coding sequence length is 864 bp, containing three exons and two introns, encoding 288 amino acids and the protein is hydrophobic. In addition, the transmembrane domain analysis and 3D model indicated that the protein contains a conservative hourglass model with six transmembrane regions and two conserved NPA motif. Subcellular localization prediction results indicated that the gene is localized on the plasma membrane, while promoter analysis revealed this gene contained cis-acting regulatory elements which were related to drought.The qRT-PCR results showed that the expression level of TaNIP4-1 in wheat leaves was obviously increased after 5 h both under drought and salt treatments,and the expression level of TaNIP4-1 in wheat roots was significantly up-regulated after 7 days under salt treatment. Thus, these results suggested that this gene was response to the abiotic stress.
Wheat; Aquaporin; TaNIP4-1; Bioinformatics
2017-05-22
2017-08-26
西北農林科技大學引進人才科研啟動項目(Z111021401);西北農林科技大學基本科研-創新一般項目(Z109021508)
E-mail:1573869152@qq.com
聞珊珊(E-mail:sswen@nwsuaf.edu.cn)
S512.1;S330
A
1009-1041(2017)10-1285-09

