人工濕地氮去除關鍵功能微生物生態學研究進展
陳 亮,劉 鋒,*,肖潤林,吳金水,*
1 中國科學院亞熱帶農業生態研究所,亞熱帶農業生態過程重點實驗室, 長沙 410125 2 中國科學院亞熱帶農業生態研究所,長沙農業環境監測研究站, 長沙 410125
人工濕地氮去除關鍵功能微生物生態學研究進展
陳 亮1,2,劉 鋒1,2,*,肖潤林1,2,吳金水1,2,*
1 中國科學院亞熱帶農業生態研究所,亞熱帶農業生態過程重點實驗室, 長沙 410125 2 中國科學院亞熱帶農業生態研究所,長沙農業環境監測研究站, 長沙 410125
人工濕地是一種能有效處理水體氮素污染的生態技術,其中微生物是驅動人工濕地系統中氮素去除的重要引擎。近20年來,隨著分子生物學技術的廣泛應用,有關人工濕地氮去除功能微生物生態學方面研究取得了一些重要進展。以硝化-反硝化作用和厭氧氨氧化作用這兩種重要的人工濕地微生物脫氮途徑為主,針對氨氧化細菌/古菌、厭氧氨氧化菌和反硝化菌等關鍵脫氮功能微生物的研究,重點歸納總結了目前有關這幾類關鍵功能菌群在人工濕地中的豐度、活性、多樣性、分布特征與影響因素,及其對廢水中氮去除的作用,并在此基礎上對今后的重點研究工作提出了展望。面向未來人工濕地氮去除關鍵功能微生物的研究應側重其在污水凈化和溫室氣體減排等方面的生態功能研究,同時加強其代謝過程與機制以及不同功能菌群間的關聯研究。
人工濕地;氨氧化細菌/古菌;厭氧氨氧化菌;反硝化菌
隨著社會經濟和農業生產的發展,大量外源氮素進入自然水體中造成了嚴重的河流湖泊等水環境富營養化問題。當前,人工濕地已成為有效削減水體中外源氮素的重要技術手段,在處理非點源污染帶來的氮負荷更是如此。人工濕地是由基質(原位土壤或人工填料)、生長在其上的水生植物和附著與懸浮在二者上的微生物所組成的生態系統。根據污水在系統中流動方式的差異,人工濕地污水處理系統通常可分為表面流(surface flow constructed wetlands, SFCW)和潛流(subsurface flow constructed wetlands, SSFCW)兩種類型,后者又分為水平流(horizontal subsurface flow constructed wetlands, HSSFCW)和垂直流(vertical subsurface flow constructed wetlands, VSSFCW)兩種進水方式;與傳統污水處理工藝相比,人工濕地具有氮去除效果好、耐沖擊負荷能力強、運行管理費用低和生態環境友好等優點[1]。
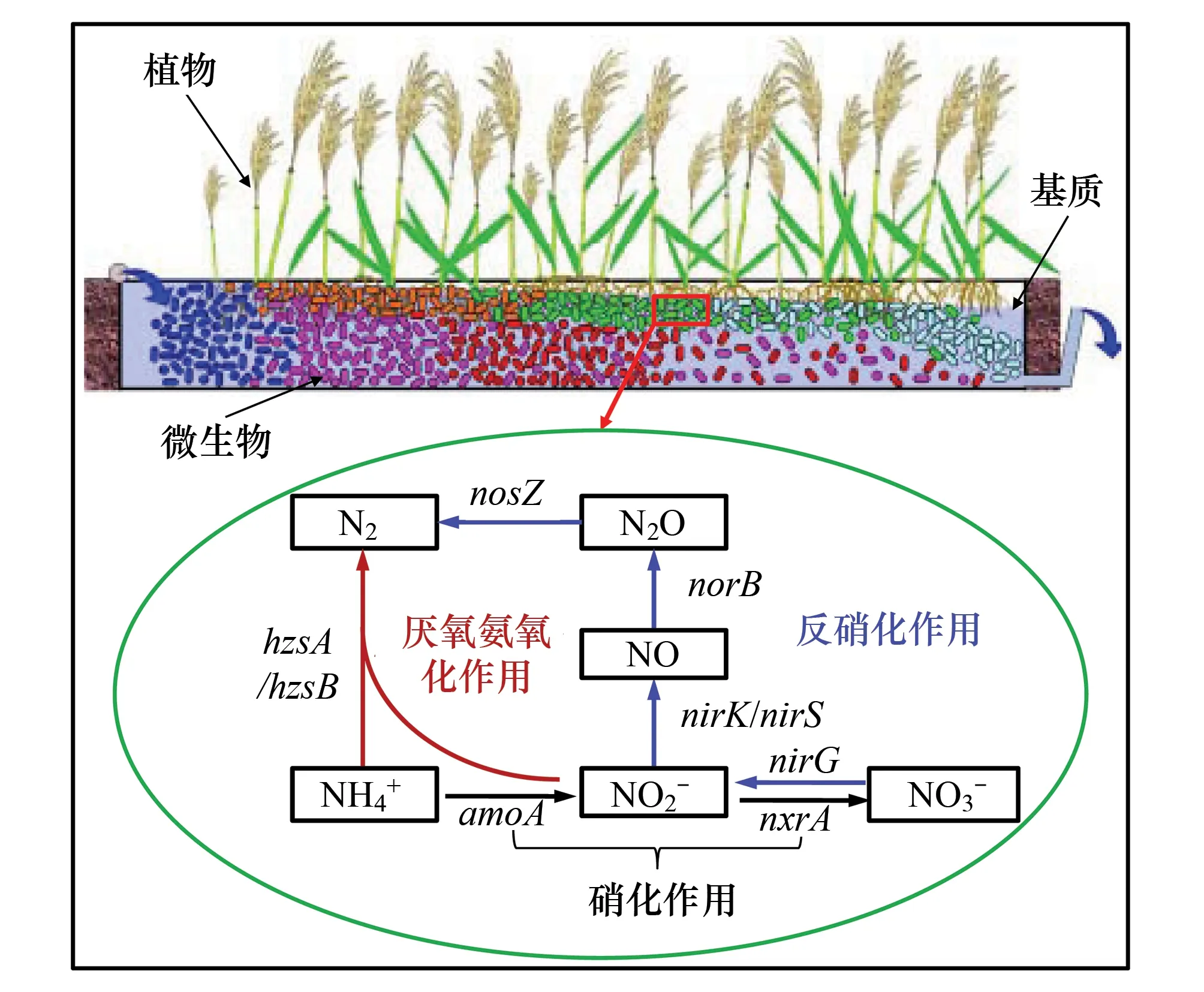
圖1 人工濕地氮去除關鍵微生物過程及相應功能基因 Fig.1 The key microbial N-removal pathways and their related functional genes in constructed wetland

1 氨氧化細菌或古菌(AOB/AOA)
氨氧化是硝化作用的第一個反應步驟,也是限速步驟,是人工濕地氮去除過程的重要環節。典型的氨氧化過程通常認為是一個主要由變形菌門(Proteobacteria)中的一小部分細菌類群所進行的專性好氧的化能自養過程,這類細菌被稱為氨氧化細菌(AOB)。然而近年來越來越多的證據顯示,在自然界原核生物組成中占重要比例的中溫泉古菌(non-thermophilic Crenarchaeota)(后單獨劃分為奇古菌門(Thaumarchaeota))也具有氨氧化能力,這類古菌被稱作氨氧化古菌(AOA)[6]。這兩類具有氨氧化作用的微生物普遍存在于海洋沉積物、湖泊底泥和陸地土壤等不同的生境中。在典型的微生物群落中,AOB所占的比例通常<0.1%,且主要集中在亞硝化球菌屬(Nitrosococcus)、亞硝化單胞菌屬(Nitrosomonas)和亞硝化螺菌屬(Nitrosospira)這3個屬[7]。相比之下,AOA無論在數量和多樣性上普遍都要高于AOB,已知的主要種屬有Nitrosopumilus、Nitrosophaera、Nitrosocaldus、Nitrosotalea等,但目前尚未確定是否所有的奇古菌均具有氨氧化能力[8]。

氨氧化微生物作為驅動人工濕地氮轉化的一類重要功能微生物得到了研究者的廣泛關注(表1)。氨氧化菌群落在人工濕地中的不同區域分布不同,植物根系是微生物最活躍的區域,根區為微生物提供了結構不同的附著表面并形成了根系分泌物和輸氧濃度梯度,通常AOB數量和種類在氧含量較高的基質表層和植物根區相對較多[12]。如靖元孝等[13]研究的風車草(Cyperusalternifolius)人工濕地系統中,根區的硝化微生物數量和硝化強度遠高于非根區。此外,AOB的群落結構在人工濕地系統中通常比較穩定,Roberts等[14]利用FISH技術對潛流濕地系統生物膜中氨氧化細菌Nitrosomonas的原位分析發現氨氧化菌從生物膜形成的初期就已經存在,在5個月的實驗期間其占總細菌種群的比例約1%,但在提高氨氮濃度的一段時間里,Nitrosomonas很快增加到總細菌種群的7%。Ibekwe等[15]采用變性梯度凝膠技術(DGGE)研究處理奶牛場廢水的人工濕地中AOB組成變化情況,發現AOB種類在系統中以Nitrosospira為主且在試驗期間沒有發生優勢種群變化。在人工濕地系統中,AOB主要以Nitrosomonas和Nitrosospira這兩種屬居多,且前者比后者具有更低的基質親和力和更高的活性,因此Nitrosospira通常發現存在于低氨氮環境中且更能忍受外界物理化學環境條件的變化,而高氨氮濃度環境下更易導致Nitrosomonas成為占主導地位的唯一優勢種[16- 18]。許多不同的環境因素包括溫度、pH和鹽度,以及氨氮和有機碳負荷等都會影響氨氧化微生物的多樣性及組成。Dong等[9]對處理養豬廢水的“濕地-塘-濕地”組合人工表面流濕地系統中潛在硝化速率和AOB群落進行了研究,研究發現AOB數量和硝化速率與濕地中氨氮濃度均呈顯著正相關關系。Sims等[19]對一污水處理廠出水的表面流人工濕地中AOA和AOB進行了為期兩年的季節性采樣分析,q-PCR結果顯示人工濕地底泥和水中的AOA豐度在冬夏季都普遍高于AOB,進一步采用末端限制性片段長度多態性分析(T-RFLP)發現在冬季AOB普遍具有較低的峰強,表明其對溫度的敏感度要高于AOA,研究還發現人工濕地的硝化作用強度只與AOB豐度呈顯著相關,表明該濕地中硝化作用主要是由AOB驅動的。人工濕地不同種類的植物以及其它微生物也會對氨氧化菌群結構造成影響。黃娟等[20]對低溫域(0—15℃)下黃菖蒲、菖蒲和香蒲人工濕地系統中硝化強度和AOB/AOA數量的研究表明不同植物根際氨氧化過程的主要功能微生物具有一定差異,AOA和AOB對于濕地土壤氮轉化均具有不可忽視的作用,并與植物本體、土壤硝化過程微環境之間有一定的耦合關系。Schramm等[21]研究證實氨氧化菌和異養微生物間存在競爭,隨著生物膜成熟異養微生物的增加會降低氨氧化菌的種群數量。這些研究表明人工濕地系統中普遍存在氨氧化微生物,且其豐度、群落結構和代謝活性受溫度、pH、溶解氧、氧化還原電位、氨氮濃度、植物等外界環境因素的影響。
2 反硝化細菌
微生物的反硝化作用是將氮素以N2O或N2形式從人工濕地中最終去除的過程。反硝化菌為兼性厭氧菌,多為化學異養型菌,在對氮轉化的過程中只獲得能量,并以有機物為電子供體和細胞生長碳源。具有反硝化能力的微生物種類較多,土壤中重要的反硝化細菌包括芽孢桿菌屬(Bacillus)、假單胞菌屬(Pseudomonas)、微球菌(Micrococcus);水體中主要的反硝化菌有假單胞菌屬(Pseudomonas)、產氣單胞菌屬(Aeromonas)和弧菌屬(Vibrio);其它反硝化菌有氣桿菌屬(Aerobacter)、產堿桿菌屬(Alcalogenes)、短桿菌(Brevibacterium)、黃桿菌屬(Flavobactrium)等[29]。
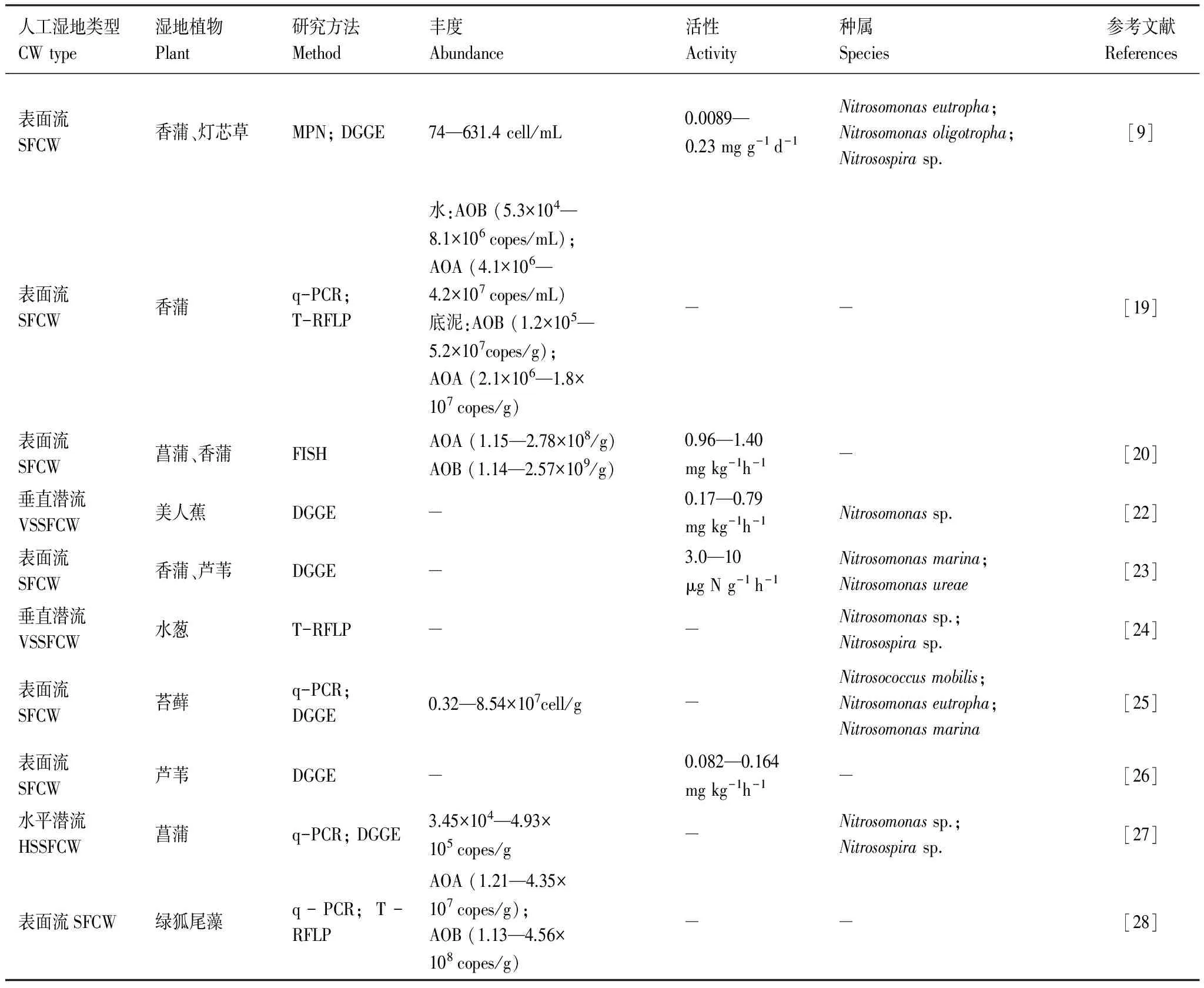
表1 人工濕地系統中氨氧化微生物(AOA/AOB)的國內外研究概括
反硝化作用的4個過程分別由硝酸還原酶(Nar)、亞硝酸還原酶(Nir)、氧化氮還原酶(Nor)和氧化亞氮還原酶(Nitrous oxide reductase, Nos)進行催化,相應編碼基因分別為nar、nir、nor、nos[30]。目前針對環境樣品研究者較多選擇nirK/nirS和nosZ作為分子標記基因來研究反硝化菌群落多樣性和豐度情況。反硝化菌活性的測定普遍采取的是乙炔抑制法[31-32]。該方法利用乙炔能夠抑制N2O還原成N2的原理,向采得的樣品柱通入一定量乙炔氣,培養一段時間后,從中抽取一定量氣體,用氣相色譜分析N2O的濃度,據此計算反硝化速率。
對人工濕地系統中反硝化菌群落的研究普遍發現具有較高的豐度和多樣性。Ruiz-Rueda等[33]在處理市政廢水的表面流濕地中發現存在豐富的反硝化功能基因nirS。Chon等[34]采用定量PCR技術檢測處理污水處理廠出水的人工濕地中反硝化功能基因(narG、nirS和nosZ)豐度都在106—109copies/g間,并呈現季節性差異。Kjellin等[35]通過DGGE研究nosZ功能基因多樣性發現越靠近人工濕地進水口反硝化菌群落越簡單,且延長水力停留時間會導致表面流濕地底泥中反硝化菌的群落結構更復雜,說明底泥中碳氮濃度會對反硝化菌群具有重要影響,濃度越高菌群結構越簡單優勢種更明顯。Song等[32]認為要使濕地中具有最大的反硝化速率必須兼有最佳的環境條件和代謝活性,該研究利用T-RFLP技術監測了一個新建人工濕地中反硝化群落的年際變化情況,結果發現第二年濕地中反硝化菌的群落結構更簡單且穩定,活性也比第一年強,相關分析表明反硝化作用主要受濕地環境中溫度,pH和有機碳(DOC)濃度的影響很大。一般來說氧的存在會抑制反硝化酶,但有的人工濕地中存在能夠在有氧條件下進行反硝化的微生物[11],這種好氧反硝化菌含有不受氧氣抑制的周質硝酸鹽還原酶(Nap)。溫度變化對反硝化菌有強烈影響,在溫度低于5℃時反硝化速度很慢,并且在溫度低進行的反硝化通常不徹底會產生N2O和NO。通常增加人工濕地中DOC含量會提高反硝化速率,但Burchell等[36]研究表明冬季低溫(7.5℃)情況下反硝化速率對增加有機質并沒有響應。反硝化的最佳pH值為6—8,低于5時反硝化菌的活性受到很大抑制。植物對人工濕地反硝化菌群的影響主要是通過根際分泌有機碳,許多研究證實有植物比無植物情況下對NO3-N的去除效率更高,且反硝化功能基因、速率大小會因植物種類不同而不同[33,37-39]。
3 厭氧氨氧化細菌




表2 人工濕地系統中厭氧氨氧化菌的國內外研究概括
4 關鍵功能微生物對人工濕地中氮去除的效應

微生物是人工濕地氮去除能力的重要評價指標,最常見的研究方法是用微生物數量和活性作為評價污染物去除率的參考指標,探討微生物群落的組成和分布,從而了解人工濕地處理廢水時微生物在其中的作用過程。目前明確闡述關鍵功能微生物類群在人工濕地氮去除作用與機制的研究還較少,如某些氮轉化功能微生物對溫室氣體的釋放具有一定的調節作用,而如何應用它們控制溫室氣體的排放還有待深入研究。
5 展望
綜上所述,現代分子生物學技術的發展為人工濕地微生物生態研究開啟了新紀元,有關氮轉化功能菌群在復雜的人工濕地系統中的存在、多樣性組成及活性等得到了廣泛研究,這對于我們深刻理解人工濕地氮去除的復雜過程具有重要推動作用。如何提高廢水中氮的處理效率依然是未來人工濕地技術需解決的重要問題之一,而氮轉化相關功能微生物的研究可謂重點。面向未來的人工濕地功能微生物與氮去除研究,應以新技術新方法為手段,重點開展以下幾個方面的研究。
(1)進一步探索與挖掘新型氮轉化功能微生物在人工濕地中的群落分布與生態功能。厭氧氨氧化菌、氨氧化古菌和一步硝化菌的發現更新了人們已有的對氮循環的認識,而新型氮轉化功能種群在人工濕地系統中的研究報道還非常少,許多問題有待更多研究。例如厭氧氨氧化菌在不同類型和尺度的人工濕地系統以及不同時空變化下的普遍性和活性強度如何還不清楚,如何進一步發揮其在某些特殊廢水處理中的應用潛力也需更多研究。盡管氨氧化古菌在一些人工濕地系統中能夠檢測到很高豐度和多樣性,但大多研究表明氨氧化作用主要是由氨氧化細菌主導,對于這類含amoA基因的氨氧化古菌在系統中大量存在和分布具有的生理功能或生態學意義尚不清楚。因此,進一步采用先進分子生物學技術(如高通量測序技術等)并結合各種原位分析手段(如基于DNA分析的穩定同位素探測技術(DNA-SIP)等)明確這兩類氨氧化菌群在人工濕地氮轉化過程中的作用和其它潛在的生態功能是未來研究的一個重點。
(2)加強人工濕地中氮去除關鍵微生物的代謝過程與機制的研究。在很多情況下,相關的監測及通量(如進出水中氮濃度變化、氨揮發、N2O釋放等)和反應速率(如硝化、反硝化速率、厭氧氨氧化速率等)與氮轉化功能微生物的群落多樣性信息并沒有建立直接關聯,而環境因素對其功能作用的表達又具有重要影響,因此加強對這些關鍵微生物的作用過程及影響因素的認識是發展調控人工濕地氮去除有效方法的重要前提。
(3)不同氮去除關鍵微生物菌群間的關聯研究。當前研究多只針對某一類功能微生物菌群及過程獨立開展,同一系統中硝化、反硝化和厭氧氨氧化等菌群間的關系以及它們各自驅動的氮轉化過程是如何交替發生的尚不清楚。因此在特定人工濕地系統中研究不同氮轉化功能菌群間的耦合關系,以及這種耦合關系下對廢水中氮去除的貢獻作用,通過關聯微生物豐度和功能活性與各形態氮轉化通量,構建相關氮去除模型,為最終調控人工濕地微生物過程提高氮去除率提供科學依據。
[1] Vymazal J. Removal of nutrients in various types of constructed wetlands. Science of the Total Environment, 2007, 380(1/3): 48- 65.
[2] 盧少勇, 金相燦, 余剛. 人工濕地的氮去除機理. 生態學報, 2006, 26(8): 2670- 2677.
[3] Truu M, Juhanson J, Truu J. Microbial biomass, activity and community composition in constructed wetlands. Science of the Total Environment, 2009, 407(13): 3958- 3971.
[4] Faulwetter J L, Gagnon V, Sundberg C, Chazarenc F, Burr M D, Brisson J, Camper A K, Stein O R. Microbial processes influencing performance of treatment wetlands: a review. Ecological Engineering, 2009, 35(6): 987- 1004.
[5] 邊玉, 閻百興, 歐洋. 人工濕地微生物研究方法進展. 濕地科學, 2014, 12(2): 235- 242.
[6] Brochier-Armanet C, Boussau B, Gribaldo S, Forterre P. Mesophilic crenarchaeota: proposal for a third archaeal phylum, the Thaumarchaeota. Nature Reviews Microbiology, 2008, 6(3): 245- 252.
[7] Purkhold U, Pommerening-Rōser A, Juretschko S, Schmid M C, Koops H P, Wagner M. Phylogeny of all recognized species of ammonia oxidizers based on comparative 16S rRNA andamoA sequence analysis: implications for molecular diversity surveys. Applied and Environmental Microbiology, 2000, 66(12): 5368- 5382.
[8] 張麗梅, 賀紀正. 一個新的古菌類群—奇古菌門(Thaumarchaeota). 微生物學報, 2012, 52(4): 411- 421.
[9] Dong X L, Reddy G B. Ammonia-oxidizing bacterial community and nitrification rates in constructed wetlands treating swine wastewater. Ecological Engineering, 2012, 40: 189- 197.
[10] Sims A, Horton J, Gajaraj S, McI ntosh S, Miles R J, Mueller R, Reed R, Hu Z Q. Temporal and spatial distributions of ammonia-oxidizing archaea and bacteria and their ratio as an indicator of oligotrophic conditions in natural wetlands. Water Research, 2012, 46(13): 4121- 4129.
[11] Coban O, Kuschk P, Kappelmeyer U, Spott O, Martienssen M, Jetten M S M, Knoeller K. Nitrogen transforming community in a horizontal subsurface-flow constructed wetland. Water Research, 2015, 74: 203- 212.
[12] Kyambadde J, Kansiime F, Dalhammar G. Distribution and activity of ammonium-oxidizing bacteria in Nakivubo wastewater channel and wastewater treatment wetland, Uganda. Clean Soil Air Water, 2006, 34(1/2): 137- 145.
[13] 靖元孝, 楊丹菁. 風車草(Cyperusalternifolius)人工濕地系統氮去除及氮轉化細菌研究. 生態科學, 2004, 23(1): 89- 91.
[14] Silyn-Roberts G, Lewis G.Insituanalysis ofNitrosomonasspp. In wastewater treatment wetland biofilms. Water Research, 2001, 35(11): 2731- 2739.
[15] Ibekwe A M, Grieve C M, Lyon S R. Characterization of microbial communities and composition in constructed dairy wetland wastewater effluent. Applied and Environmental Microbiology, 2003, 69(9): 5060- 5069.
[16] Okabe S, Satoh H, Watanabe Y.Insituanalysis of nitrifying biofilms as determined by in situ hybridization and the use of microelectrodes. Applied and Environmental Microbiology, 1999, 65(7): 3182- 3191.
[17] Purkhold U, Wagner M, Timmermann G, Pommerening-R?ser A, Koops H P. 16S rRNA and amoA-based phylogeny of 12 novel betaproteobacterial ammonia-oxidizing isolates: extension of the dataset and proposal of a new lineage within the nitrosomonads. International Journal of Systematic and Evolutionary Microbiology, 2003, 53: 1485- 1494.
[18] B?ckman J S K, Hermansson A, Tebbe C C, Lindgren P E. Liming induces growth of a diverse flora of ammonia-oxidising bacteria in acid spruce forest soil as determined by SSCP and DGGE. Soil Biology and Biochemistry, 2003, 35(10): 1337- 1347.
[19] Sims A, Gajaraj S, Hu Z Q. Seasonal population changes of ammonia-oxidizing organisms and their relationship to water quality in a constructed wetland. Ecological Engineering, 2012, 40: 100- 107.
[20] 黃娟, 楊思思, 李潤青, 傅大放. 低溫域濕地植物根際硝化強度及氨氧化微生物研究. 環境科學研究, 2014, 27(8): 857- 864.
[21] Schramm A, Larsen L H, Revsbech N P, Ramsing N B, Amann R, Schleifer K H. Structure and function of a nitrifying biofilm as determined byinsituhybridization and the use of microelectrodes. Applied and Environmental Microbiology, 1996, 62(12): 4641- 4647.
[22] 黃德鋒, 李田. 復合垂直流濕地氨氧化菌種群結構及活性的空間分布. 環境科學, 2008, 29(8): 2160- 2165.
[23] Ruiz-Rueda O, Hallin S, Baeras L. Structure and function of denitrifying and nitrifying bacterial communities in relation to the plant species in a constructed wetland. FEMS Microbiology Ecology, 2009, 67(2): 308- 319.
[24] Domingos S S, Dallas S, Skillman L, Felstead S, Ho G. Nitrogen removal and ammonia-oxidising bacteria in a vertical flow constructed wetland treating inorganic wastewater. Water Science and Technology, 2011, 64(3): 587- 594.
[25] Wang F, Liu Y, Ma Y X, Wu X R, Yang H Z. Characterization of nitrification and microbial community in a shallow moss constructed wetland at cold temperatures. Ecological Engineering, 2012, 42: 124- 129.
[26] 仝欣楠, 王欣澤, 何小娟, 孔海南. 人工蘆葦濕地氨氮污染物去除及氨氧化菌群落多樣性分析. 環境科學研究, 2014, 27(2): 218- 224.
[27] Wang L, Li T. Effects of seasonal temperature variation on nitrification, anammox process, and bacteria involved in a pilot-scale constructed wetland. Environmental Science and Pollution Research, 2015, 22(5): 3774- 3783.
[28] Li X, Zhang M M, Liu F, Li Y, He Y, Zhang S A, Wu J S. The significance ofMyriophyllumelatinoidesfor swine wastewater treatment: Abundance and community structure of ammonia-oxidizing microorganisms in sediments. PLoS One, 2015, 10(10): e0139778.
[29] Grant W P, Long P E. Environmental Microbiology. Glasgow, UK: Thomson Science and Professional, 1981.
[30] 鄭平. 環境微生物學(第2版). 杭州: 浙江大學出版社, 2012.
[31] Tiedje J M. Denitrification // Page A L, Ed. Methods of Soil Analysis. Part 2. Chemical and Microbiological Properties. Madison: American Society of Agronomy, 1982, 1011- 1026.
[32] Song K, Lee S H, Kang H. Denitrification rates and community structure of denitrifying bacteria in newly constructed wetland. European Journal of Soil Biology, 2011, 47(1): 24- 29.
[33] Ruiz-Rueda O, Trias R, Garcia-Gil L J, Baeras L. Diversity of the nitrite reductase genenirS in the sediment of a free-water surface constructed wetland. International Microbiology, 2007, 10(4): 253- 260.
[34] Chon K, Chang J S, Lee E, Lee J, Ryu J, Cho J. Abundance of denitrifying genes coding for nitrate (narG), nitrite (nirS), and nitrous oxide (nosZ) reductases in estuarine versus wastewater effluent-fed constructed wetlands. Ecological Engineering, 2011, 37(1): 64- 69.
[35] Kjellin J, Hallin S, W?rman A. Spatial variations in denitrification activity in wetland sediments explained by hydrology and denitrifying community structure. Water Research, 2007, 41(20): 4710- 4720.
[36] Burchell M R, Skaggs R W, Lee C R, Broome S, Chescheir G M, Osborne J. Substrate organic matter to improve nitrate removal in surface-flow constructed wetlands. Journal of Environmental Quality, 2007, 36(1): 194- 207.
[37] Bachand P A M, Horne A J. Denitrification in constructed free-water surface wetlands: II. Effects of vegetation and temperature. Ecological Engineering, 2000, 14(1/2): 17- 32.
[38] Lin Y F, Jing S R, Wang T W, Lee D Y. Effects of macrophytes and external carbon sources on nitrate removal from groundwater in constructed wetlands. Environmental Pollution, 2002, 119(3): 413- 420.
[39] Hallin S, Hellman M, Choudhury M I, Ecke F. Relative importance of plant uptake and plant associated denitrification for removal of nitrogen from mine drainage in sub-arctic wetlands. Water Research, 2015, 85: 377- 383.
[40] Mulder A, Van De Graaf A A, Robertson L A, Kuenen J G. Anaerobic ammonium oxidation discovered in a denitrifying fluidized bed reactor. FEMS Microbiology Ecology, 1995, 16(3): 177- 184.
[41] Thamdrup B, Dalsgaard T. Production of N2through anaerobic ammonium oxidation coupled to nitrate reduction in marine sediments. Applied and Environmental Microbiology, 2002, 68(3): 1312- 1318.
[42] Dalsgaard T, Canfield D E, Petersen J, Thamdrup B, Acua-González J. N2production by the anammox reaction in the anoxic water column of Golfo Dulce, Costa Rica. Nature, 2003, 422(6932): 606- 608.
[43] Kuypers M M M, Sliekers A O, Lavik G, Schmid M, J?rgensen B B, Kuenen J G, Damsté J S S, Strous M, Jetten M S M. Anaerobic ammonium oxidation by anammox bacteria in the Black Sea. Nature, 2003, 422(6932): 608- 611.
[44] Zhang Y, Ruan X H, den Camp H J M O, Smits T J M, Jetten M S M, Schmid M C. Diversity and abundance of aerobic and anaerobic ammonium-oxidizing bacteria in freshwater sediments of the Xinyi River (China). Environmental Microbiology, 2007, 9(9): 2375- 2382.
[45] Zhu G B, Wang S Y, Wang W D, Wang Y, Zhou L L, Jiang B, den Camp H J M O, Risgaard-Petersen N, Schwark L, Peng Y Z, Hefting M M, Jetten M S M, Yin C Q. Hotspots of anaerobic ammonium oxidation at land-freshwater interfaces. Nature Geoscience, 2013, 6(2): 103- 107.
[46] Wang S Y, Zhu G B, Peng Y Z, Jetten M S M, Yin C Q. Anammox bacterial abundance, activity, and contribution in Riparian sediments of the Pearl River Estuary. Environment Science & Technology, 2012, 46(16): 8834- 8842.
[47] Hu B L, Shen L D, Zheng P, Hu A H, Chen T T, Cai C, Liu S, Lou L P. Distribution and diversity of anaerobic ammonium-oxidizing bacteria in the sediments of the Qiantang River. Environmental Microbiology Reports, 2012, 4(5): 540- 547.
[48] Hou L J, Zheng Y L, Liu M, Li X F, Lin X B, Yin G Y, Gao J, Deng F Y, Chen F, Jiang X F. Anaerobic ammonium oxidation and its contribution to nitrogen removal in China′s coastal wetlands. Scientific Reports, 2015, 5: 15621.
[49] Zhu G B, Wang S Y, Wang Y, Wang C X, Risgaard-Petersen N, Jetten M S M, Yin C Q. Anaerobic ammonia oxidation in a fertilized paddy soil. The ISME Journal, 2011, 5(12): 1905- 1912.
[50] Yang R X, Li H, Nie S N, Su J Q, Weng B S, Zhou G B, Yao H Y, Gilbert J A, Zhu Y G, Nojiri H. Potential contribution of anammox to nitrogen loss from paddy soils in southern China. Applied and Environmental Microbiology, 2015, 81(3): 938- 947.
[51] Strous M, Fuerst J A, Kramer E H M, Logemann S, Muyzer G, van de Pas-Schoonen K T, Webb R, Kuenen J G, Jetten M S M. Missing lithotroph identified as new Planctomycete. Nature, 1999, 400(6743): 446- 449.
[52] Schmid M, Twachtmann U, Klein M, Strous M, Juretschko S, Jetten M, Metzger J W, Schleifer K H, Wagner M. Molecular evidence for genus level diversity of bacteria capable of catalyzing anaerobic ammonium oxidation. Systematic and Applied Microbiology, 2000, 23(1): 93- 106.
[53] Kartal B, Rattray J, van Niftrik L A, van de Vossenberg J, Schmid M C, Webb R I, Schouten S, Fuerst J A, Damsté J S, Jetten M S M, Strous M.Candidatus“Anammoxoglobus propionicus” a new propionate oxidizing species of anaerobic ammonium oxidizing bacteria. Systematic and Applied Microbiology, 2007, 30(1): 39- 49.
[54] Quan Z X, Rhee S K, Zuo J E, Yang Y, Bae J W, Park J R, Lee S T, Park Y H. Diversity of ammonium-oxidizing bacteria in a granular sludge anaerobic ammonium-oxidizing (anammox) reactor. Environmental Microbiology, 2008, 10(11): 3130- 3139.
[55] Lam P, Lavik G, Jensen M M, van de Vossenberg, Schmid M, Woebken D, Gutiérrez D, Amann R, Jetten M S M, Kuypers M M M. Revising the nitrogen cycle in the Peruvian oxygen minimum zone. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(12): 4752- 4757.
[56] Dang H Y, Zhou H X, Zhang Z N, Yu Z S, Hua E, Liu X S, Jiao N Z. Molecular detection ofCandidatusScalinduapacifica and environmental responsees of sediment anammox bacterial community in the Bohai Sea, China. PLos One, 2013, 8(4): e61330.
[57] Sonthiphand P, Hall M W, Neufeld J D. Biogeography of anaerobic ammonia-oxidizing (anammox) bacteria. Frontiers in Microbiology, 2014, 5: 399.
[58] 聶三安, 於辰佳, 李虎, 楊小茹. 水稻土厭氧氨氧化活性測定的同位素示蹤法方法探討. 農業現代化研究, 2015, 36(4): 680- 683.
[59] Francis C A, Beman J M, Kuypers M M. New processes and players in the nitrogen cycle: the microbial ecology of anaerobic and archaeal ammonia oxidation. The ISME journal, 2007, 1(1): 19- 27.
[60] Dong Z Q, Sun T H. A potential new process for improving nitrogen removal in constructed wetlands-Promoting coexistence of partial-nitrification and anammox. Ecological Engineering, 2007, 31(2): 69- 78.
[61] Dong X L, Reddy G B. Soil bacterial communities in constructed wetlands treated with swine wastewater using PCR-DGGE technique. Bioresource Technology, 2010, 101(4): 1175- 1182.
[62] Ligi T, Truu M, Oopkaup K, N?lvak H, Mander U, Mitsch W J, Truu J. The genetic potential of N2emission via denitrification and anammox from the soils and sediments of a created riverine treatment wetland complex. Ecological Engineering, 2015, 80: 181- 190.
[63] Erler D V, Eyre B D, Davison L. The contribution of anammox and denitrification to sediment N2production in a surface flow constructed wetland. Environmental Science & Technology, 2008, 42(24): 9144- 9150.
[64] Nie S A, Li H, Yang X R, Zhang Z J, Weng B S, Huang F Y, Zhu G B, Zhu Y G. Nitrogen loss by anaerobic oxidation of ammonium in rice rhizosphere. The ISME Journal, 2015, 9(9): 2059- 2067.
[65] Jin R C, Yang G F, Yu J J, Zheng P. The inhibition of the anammox process: a review. Chemical Engineering Journal, 2012, 197: 67- 79.
[66] Waki M, Yasuda T, Suzuki K, Komada M, Abe K. Distribution of anammox bacteria in a free-water-surface constructed wetland with wild rice (Zizanialatifolia). Ecological Engineering, 2015, 81: 165- 172.
[67] Tao W D, Wang J. Effects of vegetation, limestone and aeration on nitritation, anammox and denitrification in wetland treatment systems. Ecological Engineering, 2009, 35(5): 836- 842.
[68] Zhi W, Yuan L, Ji G D, He C G. Enhanced long-term nitrogen removal and its quantitative molecular mechanism in tidal flow constructed wetlands. Environmental Science & Technology, 2015, 49(7): 4575- 4583.
[69] Li X, Zhang M M, Liu F, Li Y, He Y, Zhang S N, Wu J S. Abundance and distribution of microorganisms involved in denitrification in sediments of aMyriophyllumelatinoidespurification system for treating swine wastewater. Environmental Science and Pollution Research, 2015, 22(22): 17906- 17916.
[70] Liu F, Zhang S N, Wang Y, Li Y, Xiao R L, Li H F, He Y, Zhang M M, Wang D, Li X, Wu J S. Nitrogen removal and mass balance in newly-formedMyriophyllumaquaticummesocosm during a single 28-day incubation with swine wastewater treatment. Journal of Environmental Management, 2016, 166: 596- 604.
[71] Paredes D, Kuschk P, Mbwette T S A, Stange F, Müller R A, K?ser H. New aspects of microbial nitrogen transformations in the context of wastewater treatment-a review. Engineering in Life Sciences, 2007, 7(1): 13- 25.
[72] Zhu G B, Wang S Y, Feng X J, Fan G N, Jetten M S M, Yin C Q. Anammox bacterial abundance, biodiversity and activity in a constructed wetland. Environmental Science & Technology, 2011, 45(23): 9951- 9958.
ResearchadvancesinmicrobialecologyforN-removalinconstructedwetlands
CHEN Liang1,2, LIU Feng1,2,*, XIAO Runlin1,2, WU Jinshui1,2,*
1KeyLaboratoryofAgro-ecologicalProcessesinSubtropicalRegion,InstituteofSubtropicalAgriculture,ChineseAcademyofSciences,Changsha410125,China2ChangshaResearchStationforAgricultural&EnvironmentalMonitoring,InstituteofSubtropicalAgriculture,ChineseAcademyofSciences,Changsha410125,China
A constructed wetland (CW) is an effective technology for the treatment of nitrogen (N) pollution in water bodies, with microorganisms being important engines driving N-removal. Over the past two decades, with the development of culture-independent molecular techniques, break-through progress has occurred in microbial ecology for N-removal in CWs. Nitrification-denitrification and anammox processes have been recognized as the two main microbial pathways for N-removal in CWs. In the present study, we reviewed the available literature regarding research progress in N-removal communities including archaeal and bacterial ammonia oxidizers, anammox bacteria, and denitrifying bacteria in CWs. Case studies on bacterial abundance, activities, diversity, distribution, influence factors, and contribution to N-removal are summarized, and future perspectives for this research field are presented. Future microbial ecology studies of N-removal in CWs should focus on the role of microorganisms in purification of sewage and emission reduction in greenhouse gases, and improve research on their N-metabolic processes, mechanisms, and interactions.
constructed wetland; ammonia oxidizing bacteria/archaea; anammox bacteria; denitrifying bacteria
中國博士后基金項目(2014M560648; 2015T80878);國家自然科學基金項目(41601272)
2016- 06- 15; < class="emphasis_bold">網絡出版日期
日期:2017- 04- 25
*通訊作者Corresponding author.E-mail: liufeng@isa.ac.cn; jswu@isa.ac.cn
10.5846/stxb201606151159
陳亮,劉鋒,肖潤林,吳金水.人工濕地氮去除關鍵功能微生物生態學研究進展.生態學報,2017,37(18):6265- 6274.
Chen L, Liu F, Xiao R L, Wu J S.Research advances in microbial ecology for N-removal in constructed wetlands.Acta Ecologica Sinica,2017,37(18):6265- 6274.

