響應曲面法優化鴨肫酶解制備抗氧化肽工藝
, , ,,,,*
(1.貴州大學釀酒與食品工程學院,貴州貴陽 550025;2.貴州大學生命科學學院,貴州貴陽 550025)
響應曲面法優化鴨肫酶解制備抗氧化肽工藝
蘇偉1,齊琦2,文飛1,唐素婷1,母應春1,邱樹毅1,*
(1.貴州大學釀酒與食品工程學院,貴州貴陽 550025;2.貴州大學生命科學學院,貴州貴陽 550025)
在單因素實驗基礎上應用響應面法對鴨肫抗氧化肽制備工藝進行優化。在前期篩選酶解鴨肫的最佳蛋白實驗中得到木瓜蛋白酶為酶解鴨肫蛋白的最佳作用酶,優化的鴨肫抗氧化肽最佳工藝條件為:酶解時間4.0 h、加酶量0.5%、酶解溫度55 ℃、料液比1∶3 g/mL。在此條件下,酶解鴨肫蛋白的水解度可達28.30%,DPPH·清除率為75.10%。結果表明該鴨肫抗氧化肽工藝制備可行,鴨肫蛋白水解度與DPPH自由基清除能力之間不存在相關性。
鴨肫,蛋白質,酶解,響應面實驗
三穗鴨原產于貴州省東部低山丘陵河谷地帶,以三穗縣為中心,分布于鎮遠、岑鞏、天柱、臺江、劍河、錦屏等縣[1]。目前,對于鴨肫的研究主要是其腌制工藝方面的研究,對于其抗氧化活性等功能特性研究報告較少[2-3]。卿曉紅、熊綠蕓[4]等人曾對貴州三穗鴨肉及蛋的蛋白質、氨基酸、礦物質、維生素等營養成分做了粗略的研究分析,但關于三穗鴨鴨肫方面的研究目前尚未見報道。鴨肫即鴨胃,形狀扁圓,肉質緊密,緊韌耐嚼,不油膩。野鴨肫味甘、性平、咸[5],有健胃之效,上腹飽脹、消化不良者,可多吃鴨肫[6]。鴨肫的主要營養成分有碳水化合物、蛋白質、脂肪、煙酸、維生素C、維生素E和鈣、鎂、鐵、鉀、磷、鈉、硒等礦物質。鴨肫鐵元素含量較豐富,貧血病患者尤其適用。
自由基具有重要的生理學功能,適宜的自由基濃度對人體有益[7]。然而,當機體細胞內自由基的產生和清除機制失去平衡時,會發生氧化應激反應,將會導致血脂紊亂、動脈粥樣硬化等一系列疾病的發生[8-9]。因此補充抗氧化劑對于人類健康生活十分重要。人工合成的抗氧化劑雖然能有效地清除自由基,但是有一定的毒副作用。所以,抗氧化肽的制備主要通過食源性蛋白酶解獲得,所得的抗氧化肽具有天然的抗氧化活性[10-15]。目前,生物酶解已成為制備抗氧化肽的主要方式[16-17],通過生物酶解,將會提高抗氧化氨基酸的暴露程度[18],從而加大其抗氧化能力,但所采用的蛋白酶種類及其工藝條件在很大程度上影響著酶解產物的抗氧化功效[19-26]。本實驗在單因素實驗的基礎上設計響應面實驗優化鴨肫蛋白質的酶解條件,以期為鴨肫的開發利用及深加工提供理論依據。
1 材料與方法
1.1材料與儀器
鴨肫 貴州省三穗縣千里山生態食品股份有限公司;木瓜蛋白酶(酶活力80 萬U/g) 南寧龐博生物工程有限公司;氫氧化鈉、甲醛 成都金山化學試劑有限公司,DPPH 美國Sigma 公司。
BS124S電子分析天平 賽多利斯科學儀器北京有限公司;DK-98-IIA型電熱恒溫水浴鍋 天津市泰斯特儀器有限公司;78-1磁力加熱攪拌器 常州澳華儀器有限公司;pHS-3C 上海佑科儀器儀表有限公司;SpectraMax-190酶標儀 美國Molecular Devices公司。
1.2實驗方法
1.2.1 鴨肫預處理 取放置于冰箱冷凍的鴨肫,自來水解凍1 h,去筋,剁碎,用粉碎機將其粉碎成漿液。
參照王桂林[27]等的方法對鴨肫進行脫脂。將粉碎后的鴨肫加入石油醚浸泡12 h,倒出石油醚,于通風櫥中晾置2 h,讓殘留石油醚徹底揮發,裝袋保藏于冰箱中備用。
1.2.2 水解度測定 水解液中氨基氮含量參照林孌[28-33]等的方法由甲醛電位滴定法測得,樣品中總氮由凱氏定氮法測得。水解度計算公式如下:
水解度(hydrolysis degree,DH,%)=水解后生成的氨基氮含量/樣品中總氮含量×100
式(1)
1.2.3 DPPH自由基的清除率的測定 將2 mL DPPH自由基溶液(0.2 mol/L,95%乙醇溶液)置于試管中加入2 mL酶解液,振蕩混勻,室溫避光反應30 min后,在517 nm處測其吸光值(Ai)。對照組為2 mL DPPH自由基容液加上95%乙醇溶液在測定波長下的吸光值(Ac),2 mL酶解液和2 mL 95%乙醇溶液混和后測定波長下的吸光值為(Aj)。DPPH自由基的清除能力用R表示:
R(%)=[1-(Ai-Aj)/Ac]×100
式(2)
1.2.4 酶解工藝流程 原料預處理→加水勻漿→調節pH→恒溫酶解→滅酶→冷卻→過濾→水解液→測水解度
1.2.5 單因素實驗及響應面實驗設計
1.2.5.1 單因素實驗 本課題由于在前期實驗基礎上,已進行了酶解鴨肫的最佳蛋白篩選實驗,并得到木瓜蛋白酶為酶解鴨肫蛋白的最佳作用酶[3],在此基礎上進行有關鴨肫抗氧化肽的響應面設計。
在酶解溫度45 ℃、加酶量0.2%、pH為5.5、料液比為1∶3 g/mL的條件下,調節酶解時間1、2、3、4、5、6 h,考察酶解時間對DPPH自由基清除率、水解度的影響。
在酶解時間3 h、加酶量0.2%、pH為5.5、料液比為1∶3 g/mL的條件下,調節酶解溫度40、45、50、55、60 ℃,考察酶解溫度對DPPH自由基清除率、水解度的影響。
在酶解時間3 h、酶解溫度50 ℃、pH為5.5、料液比為1∶3 g/mL的條件下,調節加酶量0.1%、0.2%、0.4%、0.6%、0.8%,考察酶解溫度對DPPH自由基清除率、水解度的影響。
在酶解時間3 h、酶解溫度50 ℃、加酶量為0.2%、料液比為1∶3 g/mL的條件下,調節pH5.5、6.0、6.5、7.0、7.5、8.0,考察pH對DPPH自由基清除率、水解度的影響。
在酶解時間3 h、酶解溫度50 ℃、加酶量為0.2%、pH為5.5的條件下,調節料液比1∶1、1∶2、1∶3、1∶4、1∶5 g/mL,考察料液比對DPPH自由基清除率、水解度的影響。
1.2.5.2 響應面實驗設計 在單因素實驗的基礎之上,以酶解溫度A、加酶量B、料液比C、酶解時間D為變量,水解度及DPPH自由基清除率為響應值進行優化,實驗因素水平編碼表1。

表1 因素水平編碼表Table 1 Factors and levels table
1.2.6 數據處理 采用Design Expert.V8.0.6軟件進行響應面實驗設計及數據分析。
2 結果與分析
2.1木瓜蛋白酶水解鴨肫蛋白單因素實驗
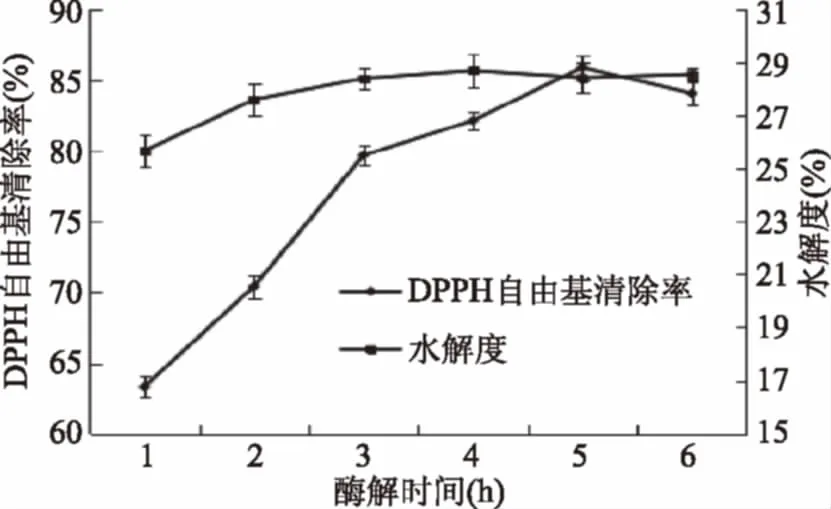
圖1 木瓜蛋白酶酶解時間對鴨肫蛋白水解度和DPPH·清除率的影響Fig.1 Effect of enzymatic hydrolysis time of papainon hydrolysis degree and DPPH·clearance rate of duck gizzard protein
2.1.1 酶解時間對水解度和DPPH自由基清除率的影響 從圖1可以看出,酶解過程中隨著水解時間的延長,鴨肫對DPPH·的清除率均呈先上升后下降的趨勢。酶解時間>3 h后,水解度基本保持不變,不再隨著時間的增加而變化,DPPH·清除率上升趨勢變得緩慢,在5 h才達到最大值,兩者不呈一致性。依據酶反應動力學可知這是由于在反應初期的酶活力及底物濃度較高,環境中的蛋白質含量較少,有利于水解反應向著正反應方向進行,但隨著時間的延長,由于酶的活性部分的損失和底物濃度的下降,使得水解反應變得緩慢,最終水解趨于完全,酶解速率基本不變[34]。酶解時間過長蛋白肽會被水解成更小的肽或氨基酸,會減弱其抗氧化性[35-36],與吳靖娜[37]、何婷[38]等研究結果相似。綜合考慮酶解時間為3 h時鴨肫蛋白水解度和DPPH·清除率都較佳。
2.1.2 酶解溫度對水解度和DPPH自由基清除率的影響 圖2中顯示,隨著酶解溫度的升高,在50 ℃時DPPH·清除率最大,水解度在酶解溫度為50~55 ℃時水解度趨于平緩,當酶解溫度高于55 ℃時,水解度呈現出下降的趨勢。可能是由于蛋白酶本身也是蛋白質,酶解溫度是酶活力影響的關鍵因素,酶解溫度對其影響比較敏感,當酶解溫度為蛋白酶的最適酶解溫度時,其活力最強,對原料的水解作用也最大;當酶解溫度超過最適酶解溫度時,其結構會發生變化而導致變性,這就導致了水解作用的減弱和終止[31]。故選取50 ℃為最適酶解溫度。

圖2 木瓜蛋白酶酶解溫度對鴨肫蛋白水解度和DPPH·清除率的影響Fig.2 Effect of papain enzyme hydrolysis temperatureon hydrolysis degree and DPPH·scavenging rate of duck gizzard protein
2.1.3 加酶量對水解度和DPPH自由基清除率的影響 加酶量對水解度的影響主要受蛋白酶與底物蛋白的結合位點,還受底物與蛋白酶形成的中間復合物的量的影響,反應初期,由于底物蛋白與酶的結合位點還沒被完全占據,形成的中間復合物的量也比較少,隨著加酶量的增加,從圖3所示,加酶量在0.1%~0.4%之間時水解度和DPPH自由基清除率均呈現出一定的上升趨勢。加酶量>0.4%后,隨著加酶量的逐漸增大,DPPH·清除率增加趨勢變得緩慢,水解度呈現下降的趨勢。這是由于隨著酶的不斷加入,底物的蛋白結合位點被逐漸占據,中間復合物也達到飽和狀態[32,40],此時便會導致水解度上升緩慢甚至出現下降的趨勢,最后趨于平緩,圖3中加酶量超過0.4% 后都出現了這一現象。因此,0.4%為木瓜蛋白酶水解鴨肫最佳的加酶量。

圖3 木瓜蛋白酶加酶量對鴨肫蛋白水解度和DPPH·清除率的影響Fig.3 Effect of papain enzyme amounton hydrolysis degree and DPPH·scavenging rate of duck gizzard protein
2.1.4 pH對水解度和DPPH自由基清除率的影響 pH直接影響到酶和底物蛋白分子的某些解離基團的解離狀態,從而影響到酶和底物的結合或催化,使蛋白酶的水解效果受到影響[41],只有在最適的pH條件下,酶解作用才能在最佳狀態下完成,此時的pH為酶的最適pH。從圖4可以看出,木瓜蛋白酶最適pH在6.0左右,在pH為6.0時鴨肫的水解度和DPPH·清除率均達到最大值,這與通常木瓜蛋白酶酶解最適pH在6.0~7.0之間的結論相一致。

圖4 木瓜蛋白酶酶解pH對鴨肫蛋白水解度和DPPH·清除率的影響Fig.4 Effect of papain hydrolysis pHon hydrolysis degree and DPPH·clearance rate of duck gizzard protein

圖5 不同料液比對木瓜蛋白酶酶解鴨肫蛋白水解度和DPPH·清除率的影響Fig.5 Effects of different liquid ratioon hydrolysis degree and DPPH·scavenging rate of duck gizzard protein

表2 Box-Behnken實驗設計及結果Table 2 Box-Behnken experiment design and results
注:p<0.01,為高度顯著,用“**”表示;p<0.05,為顯著,用“*”表示;p>0.05,為不顯著。
2.1.5 不同料液比對水解度和DPPH自由基清除率的影響 酶解反應是在水溶液中進行的,而且這個反應過程是一個酶促反應,水在反應中有利于分子的擴散和運動[42],從圖5可以看出,料液比在1∶2~1∶4 g/mL范圍內,隨著料液比的增大,DPPH·清除率呈現出先增大后減小的趨勢,水解度上升的趨勢變得緩慢。當料液比較小時,溶液中的分子擴散不僅慢,且分布不均,所以導致在低料液比條件下,水解度較低,但料液比較高時,酶濃度被大大稀釋,酶分子與原料蛋白的結合也會受到影響,所以水解度呈現出下降的趨勢。另外,也有可能是酶解體系中的中間產物濃度增大,從而降低了酶水解反應的效率[43-44]。
2.2響應面設計優化實驗


表4 DPPH·清除率回歸方程各項的方差分析Table 4 Variance analysis of scavenging ability of DPPH·
注:p<0.01,為極顯著,用“**”表示;p<0.05,為顯著,用“*”表示;p>0.05,為不顯著。
從圖6可以看出,BC(加酶量和料液比)、CD(料液比和酶解時間)之間有顯著交互作用,并對鴨肫蛋白酶解效果有顯著影響,與方差分析表結果一致。
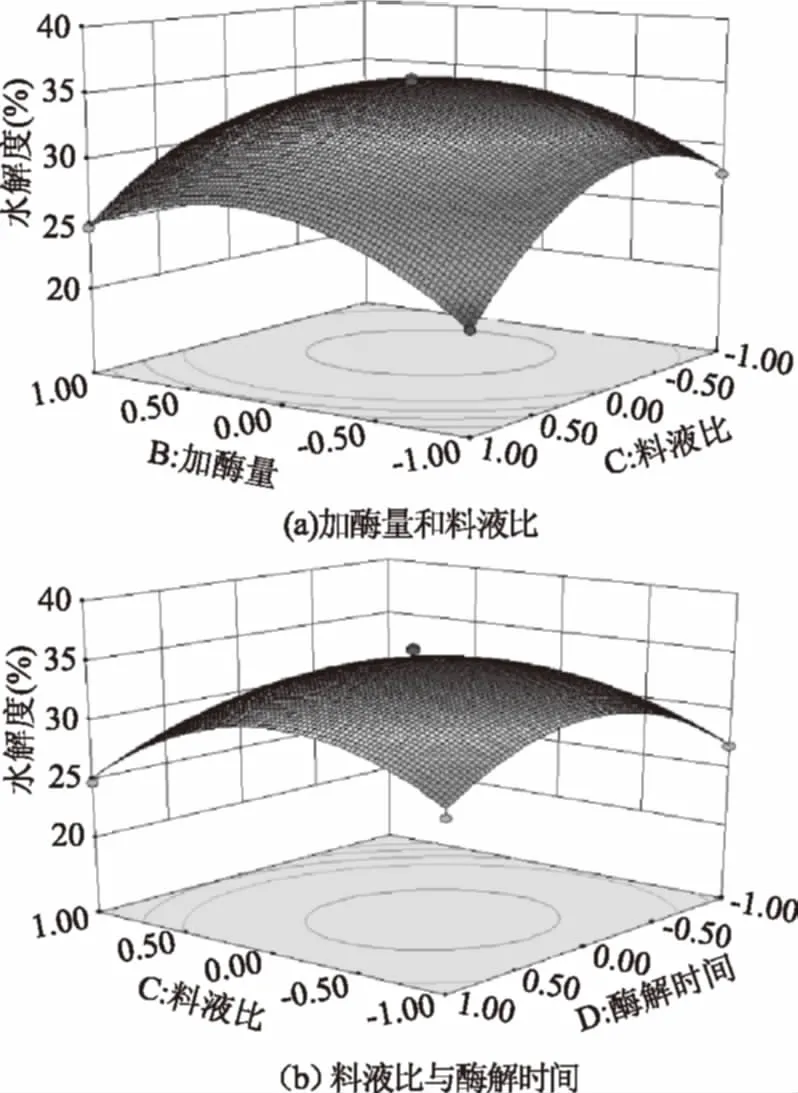
圖6 兩因素交互作用對鴨肫蛋白酶解水解度的影響Fig.6 Response surface and contour plotsfor the effect of operating parameterson the enzymatic hydrolysis of duck gizzard protein
對響應值(鴨肫蛋白水解度)與各個因素進行回歸擬合,四個因素回歸擬合得到與鴨肫蛋白水解度(Y)的回歸方程如下:
Y(%)=34.88+0.99A+0.77B-2.41C+1.45D-0.68AB-0.18AC-0.59AD+1.20BC+0.25BD+1.00CD-5.95A2-4.45B2-5.11C2-4.66D2
2.2.2 DPPH·清除率響應面優化及結果 對響應值(對DPPH·清除率)與各個因素進行回歸擬合,四個因素回歸擬合得到與對DPPH·清除率(Y)的回歸方程如下:
Y(%)=50.62+4.00A+2.15B-2.98C+5.59D+13.79AD-3.10BC+8.59BD-3.62CD。

圖7 兩因素交互作用對DPPH·清除效果的影響Fig.7 Response surface and contour plotsfor the effect of scavenging ability of DPPH·
利用Design Expert軟件對多元二次方程模型進行酶解工藝條優化,其最佳酶解條件為:酶解時間3.87 h、加酶量0.49%、料液比1∶2.69 g/mL、酶解溫度54 ℃,此條件酶解鴨肫蛋白,水解度理論上可達到28.30%,DPPH·清除率可達到75.22%。考慮實際操作的可行性,將上述最佳酶解條件修正為酶解時間4.0 h、加酶量0.5%、酶解溫度54 ℃、料液比1∶3 g/mL。為了檢驗預測模型的準確性,在最佳條件下進行驗證實驗,實際測得蛋白質的水解度為28.42%,DPPH·清除率為75.1%,預測值和實際值無顯著性差異,表明該模型能較好的預測鴨肫蛋白質的酶解條件具有可行性。
2.3鴨肫蛋白水解度與DPPH自由基清除能力的關系

圖8 鴨肫蛋白水解度與DPPH自由基清除能力的關系Fig.8 Correlation between the hydrolysis degreeand the DPPH· scavenging rate
如圖8所示,鴨肫蛋白水解度與DPPH自由基清除能力之間不存在相關性,體系中酶解程度加深及水解度增大后,產物中具有較強抗氧化活性的肽類部分被水解為具有較弱抗氧化活性或無抗氧化活性的肽類及游離氨基酸,導致DPPH自由基清除率減小。從圖8可以看出,R2=0.047,鴨肫蛋白水解度與DPPH自由基清除能力不完全一致,說明兩響應值之間不存在相關性。
3 結論
利用響應面設計優化了鴨肫蛋白質的酶解條件,并對水解度及DPPH自由基清除率之間的關系進行分析,結果表明最佳酶解條件為:酶解時間4.0 h、加酶量0.5%、酶解溫度54 ℃、料液比1∶3 g/mL,在此條件下酶解鴨肫蛋白質,蛋白質的水解度為28.42%,DPPH·清除率為75.1%,實際值與預測值相符,因此利用響應曲面法優化鴨肫蛋白質的酶解條件是可行的,且酶解條件簡便、溫和高效。水解度及DPPH·清除率之間不存在相關性。
[1]張福平,林家棟,陳眷華,等. 貴州三穗縣鴨產業發展現狀及對策[J]. 貴州畜牧獸醫,2010,34(4):8-9.
[2]崔震昆,謝宗福,朱琳,等. 湯爆鴨肫制作的工藝探討[J]. 農產品加工(學刊),2009,(1):35-37
[3]蘇偉,文飛,母應春,等. 鴨肫酶解工藝優化及降膽固醇活性研究[J]. 食品科技,2016,(3):144-149.
[4]卿曉紅,熊綠蕓. 貴州三穗鴨肉蛋的營養成分分析[J]. 貴州農學院學報,1997,16(2):63-65.
[5]邵虎,蔡進進. 五香醬野鴨肫的生產工藝[J]. 肉類工業,2007(12):7-8.
[6]Arulmathi P,Elangovan G,Begum A F,et al. Optimization of Electrochemical Treatment Process Conditions for Distillery Effluent Using Response Surface Methodology[J]. Scientific World Journal,2015(2015):581-463.
[7]Teng D. Optimization of enzymatic hydrolysis parameters for antioxidant capacity of peptide from goat placenta[J]. Food Bioprod Process,2011,89(3):202-208.
[8]Roberts C K,Sindhu K K. Oxidative stress and metabolic syndrome[J]. Life Siences,2009,84(21):705-712.
[9]Zhong S. Antioxidant properties of peptide fractions from silver carp(Hypophthalmichthysmolitrix)processing by-product protein hydrolysates evaluated by electron spin resonance spectrometry[J]. Food Chemistry,2011,126(4):1636-1642.
[10]Wang B,Li Z R,Chi C F,et al. Preparation and evaluation of antioxidant peptides from ethanol-soluble proteins hydrolysate of sphynalewini muscle[J]. Peptides,2012,36(2):240-250.
[11]Gimenez B,Aleman A,Montero P,et al. Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid[J]. Food Chemistry,209,114(3):976-983.
[12]Bougatef A,Nedjar-Arroume N,Manni L,et al. Purification and identification of novel antioxidant peptides from enzymatic hydrolysates of sardinelle(Sardinellaaurita)by-products proteins[J]. Food Chenmistry,2010,118(3):559-565.
[13]Pinto E Silva M E M,Mazzilli R N,Cusin F. Composition of hydrolysates from meat[J]. Journal of Food Composition and Analysis,1999,12(3):219-225.
[14]Shahidi F,Han X Q,Synowiecki J.Production and characteristics of protein hydrolysates from capelin(Mallotusvillosus)[J]. Food Chemistry,1995,53(3):285-293.
[15]Lahl W J,Braum S D. Enzymatic production of protein hydrolysates for food use[J]. Food Technology,1994,48(10):68-71.
[16]Babini E,Tagliazucchi D,Martini S,et al. LC-ESI-QTOF-MS identification of novel antioxidant peptides obtained by enzymatic and microbial hydrolysis of vege
Table proteins[J]. Food Chemistry,2017(228):186-196.
[17]Castro R J S D,Cason V G,Sato H H. Binary mixture of proteases increases the antioxidant properties of white bean(Phaseolusvulgaris,L.)protein-derived peptides obtained by enzymatic hydrolysis[J]. Biocatalysis & Agricultural Biotechnology,2017(10):291-297.
[18]謝永洪,劉學文,王文賢,等. 雞肉蛋白酶水解工藝條件的研究[J]. 農業工程學報,2004,20(5):207-210.
[19]楊二剛,童群義. 復合酶水解雞肉工藝條件的優化[J]. 安徽農業科學,2008,36(14):6083-6084.
[20]盧曉蕊,歐陽杰,魯軍,等. 采用二次回歸法確定雞肉蛋白酶法水解條件[J]. 食品與發酵工業,2007,33(7):85-87.
[21]趙謀明,周雪松. 木瓜蛋白酶水解雞肉蛋白及其產物氨基酸分析研究[J]. 食品科學,2005,26(增刊1):6-9.
[22]倪國華,宋煥祿. 雞肉蛋白酶解物的分離[J]. 食品與發酵工業,2002,28(12):48-51.
[23]周雪松,趙謀明. 雞肉蛋白酶解產物穩定性的研究[J]. 食品研究與開發,2007,28(8):1-4.
[24]曾卓,王金水,付雅麗. 雞肉蛋白的酶解特性及酶解產物的抗氧化性研究[J]. 食品工業科技,2008,29(6):126-128.
[25]蔡鳳英,王金水,史軍,等. 雞肉蛋白酶解物制備天然調味基料的研究[J]. 食品工業科技,2007,28(8):190-193.
[26]王桂林,張桂珍,陳智平,等. 蠶蛹蛋白的提取及應用研究[J].南昌大學學報,1994,16(2):33-37.
[27]林孌. 文蛤肉酶解工藝研究[D]. 福州:福建農林大學,2006.
[28]李俠,張利寬,劉春萌,等. 響應面法優化蕎麥蛋白酶解工藝[J].食品科學,2012,33(22):145-148.
[29]熊尉杰. 利用米渣制備大米肽的研究[D]. 長沙:湖南農業大學,2010.
[30]鄧楠. 海產品下腳料酶解液制備肉味香精[D]. 青島:中國海洋大學,2012.
[31]肖文華,方玉桂,常婷婷,等. 雞可食性組織中癸氧喹酯殘留的HPLC檢測方法[J]. 揚州大學學報:農業與生命科學版,2014,35(4):41-45.
[32]王慧林. 可控酶解鴿肉蛋白研制寡肽鮮味劑[D]. 南昌:南昌大學,2012.
[33]李漫男. 酶解花生粕蛋白—糖美拉德反應制備呈味基料研究[D]. 鄭州:河南工業大學,2010.
[34]蘇偉,文飛,母應春,等. 鴨肫酶解工藝優化及降膽固醇活性研究[J]. 食品科技,2016(3):144-149.
[35]鄧楠. 海產品下腳料酶解液制備肉味香精[D]. 青島:中國海洋大學,2012.
[36]周文曉. 單核苷酸的制備及分離[D]. 濟南:山東輕工業學院,2011.
[37]溫建豐,楊文鴿,徐大倫. 響應面法優化花蟹肉制備抗氧化肽的酶解工藝[J]. 核農學報,2013(12):1881-1886.
[38]何婷,崔春,龍小濤,等. 藍園鲹制備抗氧化肽酶解工藝的研究[J]. 食品科技,2008(2):70-74.
[39]吳靖娜,許旻,蔡水淋,等. 鮑內臟抗氧化活性肽制備工藝研究[J]. 揚州大學學報(農業與生命科學版),2015(4):58-63.
[40]王鏡巖,朱圣庚,徐長法. 生物化學[M]. 北京:高等教育出版社,2002:15-82.
[41]康永鋒,康俊霞,吳文惠,等. 響應面法優化超聲波-微波協同酶解制備鮭魚抗氧化肽[J]. 中國油脂,2012(8):25-28.
[42]Saiga A,Tanabe S,Nishimura T. Antioxidant Activity of Peptides Obtained from Porcine Myofibrillar Proteins by Protease Treatment[J]. Journal of Agricultural & Food Chemistry,2003,51(12):3661-7.
[43]程謙偉,劉昭明,孟陸麗,等. 堿性蛋白酶水解制備赤豆蛋白肽的工藝研究[J]. 糧油加工,2010(2):43-45.
[44]于美娟,馬美湖,單楊,等. 采用兩酶復合水解豬血紅蛋白(Hb)制備水解蛋白的研究[J]. 食品科學,2007,28(1):196-200.
Optimizationofenzymatichydrolysisconditionsforduckgizzardantioxidantpeptidepreparationbyresponsesurfacemethodology
SUWei1,QIQi2,WENFei1,TANGSu-ting1,MUYing-chun1,QIUShu-yi1,*
(1.College of Liquor and Food,Guizhou University,Guiyang 550025,China;2.College of Life Sience,Guizhou University,Guiyang 550025,China)
Based on the single factor experiment,the response surface method was used to optimize the preparation process of duck gizzard antioxidant peptide. In the pre-screening of the best protein for enzymatic hydrolysis of duck gizzard,papain was obtained as the best enzyme for enzymatic hydrolysis of duck gizzard protein. The optimum conditions were as follows:the time of enzymolysis was 4.0 h,the amount of enzyme was 0.5%,the enzymolysis temperature was 55 ℃,and the ratio of solid to liquid was 1∶3 g/mL. Under these conditions,the hydrolyzate degree of hydrolyzed duck gizzard protein was 28.30% and the DPPH· clearance rate was 75.10%. The results showed that the duck gizzard antioxidant peptide preparation process was feasible,there was no correlation between the hydrolysis degree of duck gizzard and DPPH· scavenging ability.
duck’s gizzard;protein;enzymolysis;response surface method
TS251.9
B
1002-0306(2017)19-0177-07
10.13386/j.issn1002-0306.2017.19.033
2017-03-24
蘇偉(1974-),男,博士,副教授,研究方向:應用生物技術,E-mail:wsu@gzu.edu.cn。
*通訊作者:邱樹毅(1963-),男,博士,教授,研究方向:生物工程,E-mail:syqiu@gzu.edu.cn。
貴州省科技廳農業公關項目(黔科合NY[2010]3038號)。

