短短芽孢桿菌M01產(chǎn)抗菌物質(zhì)工藝條件優(yōu)化及其主要抑菌成分探究
王忠忠, 龔國利,2
(1.陜西科技大學(xué) 食品與生物工程學(xué)院, 陜西 西安 710021; 2.西安市微生物藥物工程實(shí)驗(yàn)室, 陜西 西安 710021)
短短芽孢桿菌M01產(chǎn)抗菌物質(zhì)工藝條件優(yōu)化及其主要抑菌成分探究
王忠忠1, 龔國利1,2
(1.陜西科技大學(xué) 食品與生物工程學(xué)院, 陜西 西安 710021; 2.西安市微生物藥物工程實(shí)驗(yàn)室, 陜西 西安 710021)
采用選育的短短芽孢桿菌株M01進(jìn)行抗菌活性物質(zhì)發(fā)酵工藝及其主要抑菌成分的研究.通過單因素和正交試驗(yàn),優(yōu)化得出一條發(fā)酵生產(chǎn)抗菌物質(zhì)的最佳工藝,其工藝條件分別為初始pH6.0,接種量8%,發(fā)酵溫度28 ℃,發(fā)酵周期48 h,優(yōu)化后生產(chǎn)的抗菌物質(zhì)的抑菌活性比優(yōu)化前提高了38.7%.此外,經(jīng)80%的冷乙醇提取抗菌物質(zhì),對(duì)其進(jìn)行透析脫鹽,Sephadex-50凝膠過柱初步分離純化,SDS-PAGE分析發(fā)現(xiàn)分子量為62.0 kD、 40.0 kD、 29.0 kD、20.1 kD的蛋白可能是菌株M01抑菌活性物質(zhì)的主要成分,其中29.0 kD左右的蛋白可能是菌株M01抑菌活性物質(zhì)的重要成分.
短短芽孢桿菌M01; 抑菌活性; 正交優(yōu)化; 主要抑菌成分
Abstract:A new strain ofBrevibacillusbrevisM01 was carried out to reserach the main components of the active antibacterial substance and optimize its fermentation conditions.The optimum conditions to produce the antimicrobial substances were as follows:Initial pH6.0,inoculation amount 8%,fermentation temperature 28 ℃ and fermentation cycle 48 h by single factor and orthogonal experiment,after optimization,the activity of antibacterial substances was 38.7% higher than before.In addition,the 80% of cold ethanol was used to extract the antimicrobial substance that was desalted and purified by Sephadex-50 gel column,and SDS-PAGE analysis showed that the protein with molecular weight of 62.0 kD,40.0 kD,29.0 kD and 20.1 kD could be the main component of the antimicrobial active substance of strain M01,and the protein of about 29.0 kD may play an important role in it.
Keywords:BrevibacillusbrevisM01; antimicrobial activity; orthogonal optimization; main antibacterial ingredients
0 引言
短短芽孢桿菌(Brevibacillusbrevis)于1996年根據(jù)遺傳信息的差異性從短芽孢桿菌屬中劃分以來,現(xiàn)已確定的有二十多種,其中大多數(shù)菌種都具有重要的生物學(xué)意義.
據(jù)報(bào)道,短短芽孢桿菌(B.brevis)能夠分泌短桿菌肽(gramieidin)、短桿菌酪肽(tyrocidine)、胞外多糖[1]、幾丁質(zhì)酶[2]以及羥苯乙酯[3]等多種抗菌物質(zhì)抑制病原菌的生長[4,5].例如,Murray T等[6]探究發(fā)現(xiàn)的十肽抗生素,短桿菌肽S已被證明具有高效的殺菌能力. Li S等[2]報(bào)道的短短芽孢桿菌產(chǎn)生的高穩(wěn)定性的幾丁質(zhì)酶在蔬菜霉菌病的防治中已表現(xiàn)出顯著的抗菌效果.Wafaa M等[7]報(bào)道的短短芽孢桿菌產(chǎn)生的抗菌活性物質(zhì)能夠成功抑制番茄和生菜體內(nèi)外的灰霉病.Bapat S等[8]報(bào)道的短短芽孢桿菌有可能作為一種生防試劑治愈豌豆和黃瓜農(nóng)作物的鐮刀菌枯萎病.同時(shí),短短芽孢桿菌產(chǎn)生的胞外拮抗物質(zhì)能夠誘導(dǎo)霉菌病原體的腫脹,導(dǎo)致其細(xì)胞破裂而死亡[9].并且該菌能以活體形式寄居到大量的真菌植物病原體中,有效的抑制病原體的生長[10,11],因此在農(nóng)業(yè)生物防治上具有廣闊的應(yīng)用前景.
在這項(xiàng)研究中,采用的菌株短短芽孢桿菌M01是由本課題組實(shí)驗(yàn)室分離保存,其產(chǎn)生的抗菌物質(zhì)對(duì)大腸桿菌,金黃色葡萄球菌,枯草芽孢桿菌,黑曲霉等細(xì)菌和真菌都具有良好的抗性.因此對(duì)該菌產(chǎn)抗菌物質(zhì)工藝條件的探究具有重要的工業(yè)化生產(chǎn)意義,此外,對(duì)抗菌活性物質(zhì)主要成分進(jìn)行了初步的分析,發(fā)現(xiàn)蛋白類物質(zhì)是該抗菌物質(zhì)的主要抑菌成分,但具體是哪種蛋白成分還需進(jìn)一步的確定.
1 材料與方法
1.1 主要原料與試劑
(1)供試菌株:短短芽孢桿菌M01,指示菌:金黃色葡萄球菌CVCC1885.
(2)NA:牛肉膏0.5%,蛋白胨1%,氯化鈉0.5%,瓊脂1.5%,pH 7.2.
(3)發(fā)酵培養(yǎng)基:豆餅粉1.5%,蛋白胨2.0%,氯化鈣0.20%,Tween-20 1%,pH 7.2.指示細(xì)菌培養(yǎng)基NA.
(4)試劑:Sephadex-50、大孔樹脂XAD-16、過硫酸銨、30%丙烯酰胺溶液、 蛋白marker均購自上海生工生物工程有限公司.
1.2 菌株M01生長曲線的測(cè)定
取菌株M01菌懸液0.5 mL加入含50 mL的發(fā)酵培養(yǎng)基中,輕微振蕩,使菌體分布均勻,將接種后的培養(yǎng)基置于搖床上,37 ℃,220 r/min培養(yǎng)0、4、6、8、10、12、14、16、22、30、38、44、50 h,分別依次取樣,4 ℃保存,待全部完成培養(yǎng)后在波長600 nm下進(jìn)行比濁測(cè)定.以未接種的液態(tài)發(fā)酵培養(yǎng)基作對(duì)照,記錄光密度值OD600,以培養(yǎng)時(shí)間為橫坐標(biāo),光密度值OD600為縱坐標(biāo),繪制菌株M01的生長曲線.
1.3 不同工藝條件對(duì)菌株M01產(chǎn)抗菌活性物質(zhì)的影響
1.3.1 初始pH對(duì)菌株M01抑菌活性的影響
以4%(V/V)的接種量接種菌株M01菌懸液至60 mL(300 mL搖瓶,下同)的發(fā)酵培養(yǎng)基中,將發(fā)酵培養(yǎng)基初始pH值分別調(diào)為3、4、5、6、7、8、9、10、11,28 ℃,180 r/min搖瓶培養(yǎng)48 h,取其離心上清液用0.45μm細(xì)菌過濾器過濾,吸取濾液230μL,采用瓊脂打孔擴(kuò)散法分別進(jìn)行不同初始pH值對(duì)菌株M01抑菌活性影響的測(cè)定,以空白發(fā)酵培養(yǎng)基作對(duì)照(CK),每組試驗(yàn)重復(fù)三次.
1.3.2 溫度對(duì)菌株M01抑菌活性的影響
以4%(V/V)的接種量接種菌株M01菌懸液至60 mL的發(fā)酵培養(yǎng)基中,分別以24、26、28、30、32、34、37、40、45 ℃的溫度條件,180 r/min搖瓶培養(yǎng)48 h,取其離心上清液用0.45μm細(xì)菌過濾器過濾,吸取濾液230μL,采用瓊脂打孔擴(kuò)散法分別進(jìn)行不同溫度對(duì)菌株M01抑菌活性影響的測(cè)定,以空白發(fā)酵培養(yǎng)基作對(duì)照(CK),每組試驗(yàn)重復(fù)三次.
1.3.3 發(fā)酵周期對(duì)菌株M01抑菌活性的影響
以4%(V/V)的接種量接種菌株M01菌懸液至60 mL的發(fā)酵培養(yǎng)基中,28 ℃,180 r/min搖瓶培養(yǎng)8、16、24、36、48、60、72、84 h,取其離心上清液用0.45μm細(xì)菌過濾器過濾,吸取濾液230μL,采用瓊脂打孔擴(kuò)散法分別進(jìn)行不同發(fā)酵時(shí)間對(duì)菌株M01抑菌活性影響的測(cè)定,以空白發(fā)酵培養(yǎng)基作對(duì)照(CK),每組試驗(yàn)重復(fù)三次.
1.3.4 接種量對(duì)菌株M01抑菌活性的影響
分別以2%~14%的接種量接種菌株M01菌懸液至60 mL的發(fā)酵培養(yǎng)基中,28 ℃,180 r/min搖瓶培養(yǎng)48 h,取其離心上清液用0.45μm細(xì)菌過濾器過濾,吸取濾液230μL,采用瓊脂打孔擴(kuò)散法分別進(jìn)行不同接種量對(duì)菌株M01抑菌活性影響的測(cè)定,以空白發(fā)酵培養(yǎng)基作對(duì)照(CK),每組試驗(yàn)重復(fù)三次.
1.4 菌株M01抗菌活性物質(zhì)的提取方法選擇及提取
1.4.1 菌株M01發(fā)酵離心上清液活性物質(zhì)萃取
以4%(V/V)的接種量接種菌株M01菌懸液至60 mL的發(fā)酵培養(yǎng)基中,28 ℃,180 r/min搖瓶發(fā)酵48 h,11 000 r/min離心10 min,取其離心上清液用0.45μm細(xì)菌過濾器過濾,吸取濾液150 mL,分別加入等體積的正丁醇、氯仿、乙酸乙酯、二甲基亞砜、石油醚等有機(jī)溶劑過夜萃取,將有機(jī)相與水相分離,水相溶液經(jīng)0.45μm濾膜過濾,有機(jī)相濃縮至5 mL.采用瓊脂打孔擴(kuò)散法分別測(cè)定水相和有機(jī)相溶液的抑菌活性,以空白有機(jī)溶劑作對(duì)照.
1.4.2 大孔樹脂XAD-16吸附法提取菌株M01活性抗菌物質(zhì)
500 mL的發(fā)酵離心上清液加入25 g大孔樹脂XAD-16,室溫條件下,140 r/min振蕩6h,將大孔樹脂與上清液分離,向含有吸附物的大孔樹脂中加入4倍體積的丙酮溶液進(jìn)行2 h解吸,采用瓊脂打孔擴(kuò)散法分別測(cè)定丙酮解析液和XAD-16吸附過濾后的上清液抑菌活性,以空白丙酮溶液作對(duì)照.
1.4.3 硫酸銨分段鹽析法提取菌株M01主要抗菌活性物質(zhì)
菌株M01發(fā)酵離心上清液中緩慢加入固體硫酸銨粉末,使其終濃度分別達(dá)到30%、40%、50%、60%、70%、80%,于4 ℃靜止過夜,11 000 r/min離心15 min,分別收集上清及沉淀,將沉淀溶于25 mmol/L磷酸鹽緩沖液(PBS)中,采用瓊脂打孔擴(kuò)散法分別測(cè)定上清及沉淀的抑菌活性,以終濃度為80%的硫酸銨對(duì)空白發(fā)酵培養(yǎng)基作相同的處理,其沉淀溶于25 mmol/L磷酸鹽緩沖液(PBS)中作對(duì)照.
1.4.4 低溫乙醇沉淀法提取菌株M01主要抗菌活性物質(zhì)
菌株M01發(fā)酵離心上清液中緩慢加入冰冷無水乙醇,使其終濃度分別達(dá)到30%、40%、50%、60%、70%、80%,于4 ℃靜止過夜.11 000 r/min離心15 min,分別收集上清及沉淀,將沉淀溶于25 mmol/L PBS緩沖液中,以終濃度為80%的冷乙醇對(duì)空白發(fā)酵培養(yǎng)基作相同的處理,其沉淀溶于25 mmol/L 磷酸鹽緩沖液(PBS)中作對(duì)照.采用瓊脂打孔擴(kuò)散法分別測(cè)定上清及沉淀的抑菌活性.
1.5 菌株M01胞外抗菌粗提物初步純化
經(jīng)80%冰冷無水乙醇沉淀下來的抗菌活性物質(zhì)溶解于25 mmol/L PBS緩沖液中,置于分子量為8~14 kDa的透析袋中透析脫鹽,以5%的柱床體積上樣量進(jìn)行Sephadex-50過柱純化,流速0.4 mL/min,每管8 mL收集洗脫液(緩沖液35 mmol/L Tris-HCl),將收集管內(nèi)的洗脫液置于透析袋內(nèi),PEG20000包埋濃縮30 min,采用瓊脂打孔擴(kuò)散法測(cè)定各收集管洗脫液抑菌活性.
1.6 SDS-PAGE分析
取具有抑菌活性組分的各收集管的濃縮液16μL至200μL的Ep管中,加入4μL蛋白上樣緩沖液,混勻,沸水浴煮沸10 min使其充分變性,加樣開始電泳分析.SDS-PAGE電泳條件:配膠:5%的濃縮膠,15%的分離膠,電壓:濃縮恒壓90 V,分離恒壓160 V.
2 結(jié)果與討論
2.1 菌株M01生長曲線
菌株M01生長曲線如圖1所示.由圖1可以看出,菌株M01的指數(shù)生長期處于4~18 h,18 h后是該菌的生長穩(wěn)定期,根據(jù)此生長曲線進(jìn)行試驗(yàn),發(fā)現(xiàn)菌株M01在生長過程中抗菌物質(zhì)活性變化趨勢(shì)如圖2所示.由圖2可知,菌株M01在指數(shù)生長后期就開始產(chǎn)抗菌物質(zhì),生長穩(wěn)定后期抗菌物質(zhì)的抑菌活性達(dá)到最大.這一發(fā)現(xiàn)可為菌株種子液的制備以及發(fā)酵周期的選定提供理論參考,提高抗菌物質(zhì)的產(chǎn)量及生產(chǎn)效率.
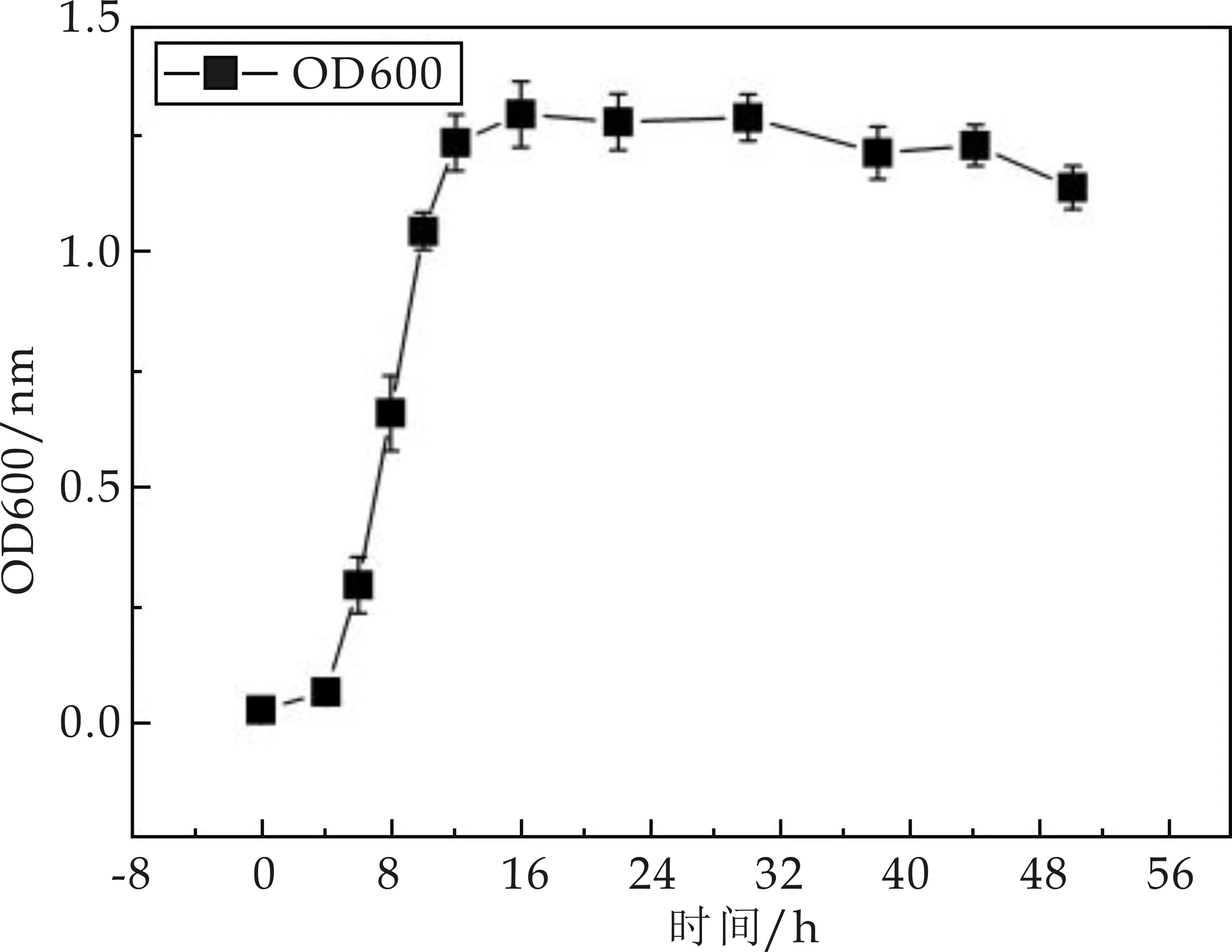
圖1 菌株M01生長曲線
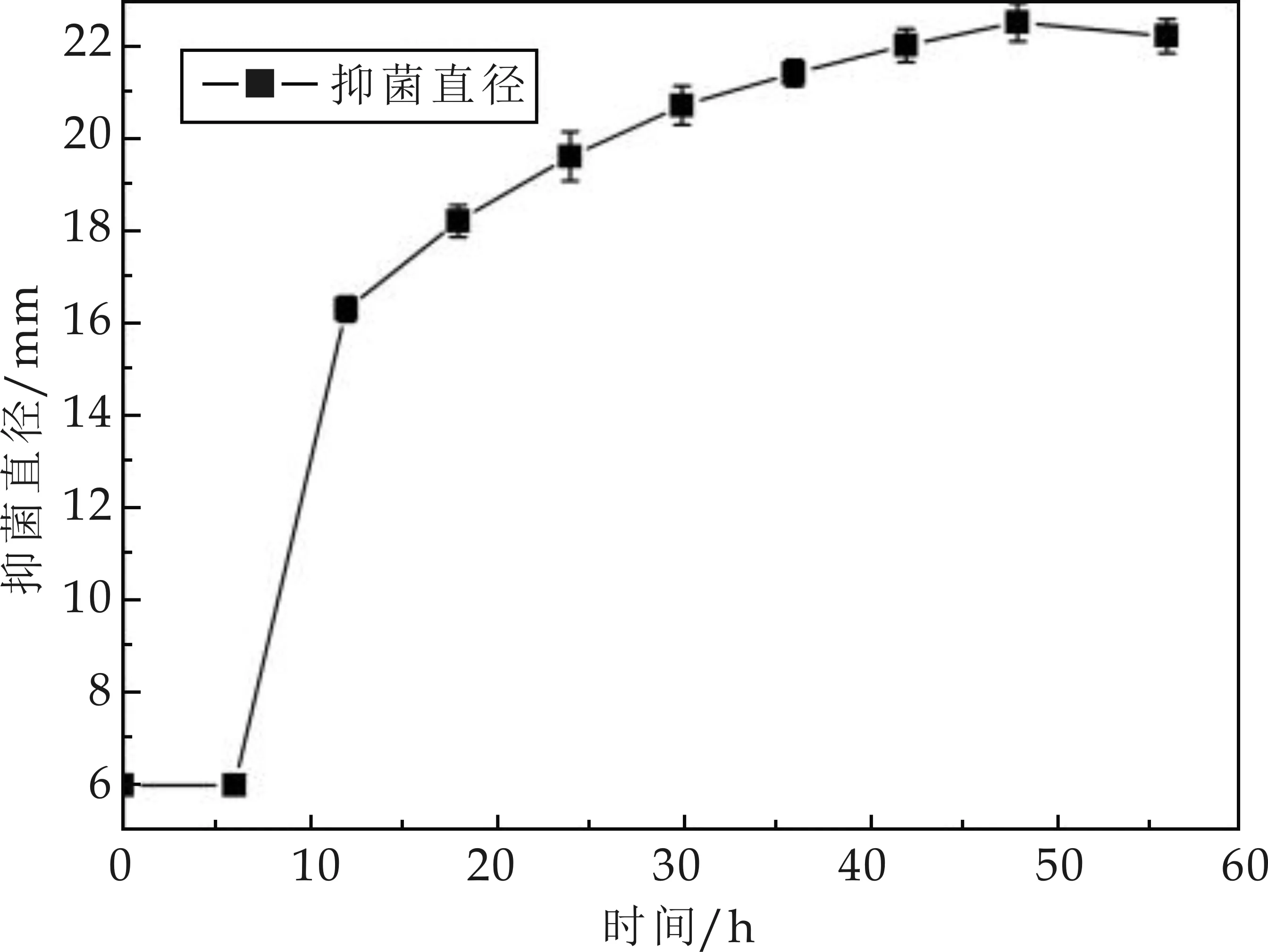
圖2 菌株M01生長過程抗菌物質(zhì) 活性變化趨勢(shì)
2.2 不同工藝條件對(duì)菌株M01發(fā)酵生產(chǎn)抗菌物質(zhì)的影響
2.2.1 抗菌物質(zhì)生產(chǎn)周期的確定
發(fā)酵時(shí)間對(duì)菌株M01產(chǎn)生的抗菌物質(zhì)的抑菌活性影響如圖3所示.由圖3可知,菌株M01在發(fā)酵開始后的前48 h,該抗菌物質(zhì)的抑菌活性隨著時(shí)間的增加而提高,發(fā)酵開始后的48~84 h,該抗菌物質(zhì)的抑菌活性隨著時(shí)間的增加而下降,因此生產(chǎn)該抗菌物質(zhì)的最適發(fā)酵時(shí)間是48 h,此時(shí)抗菌物質(zhì)的抑菌活性最高,其抑菌直徑達(dá)15.6 mm.
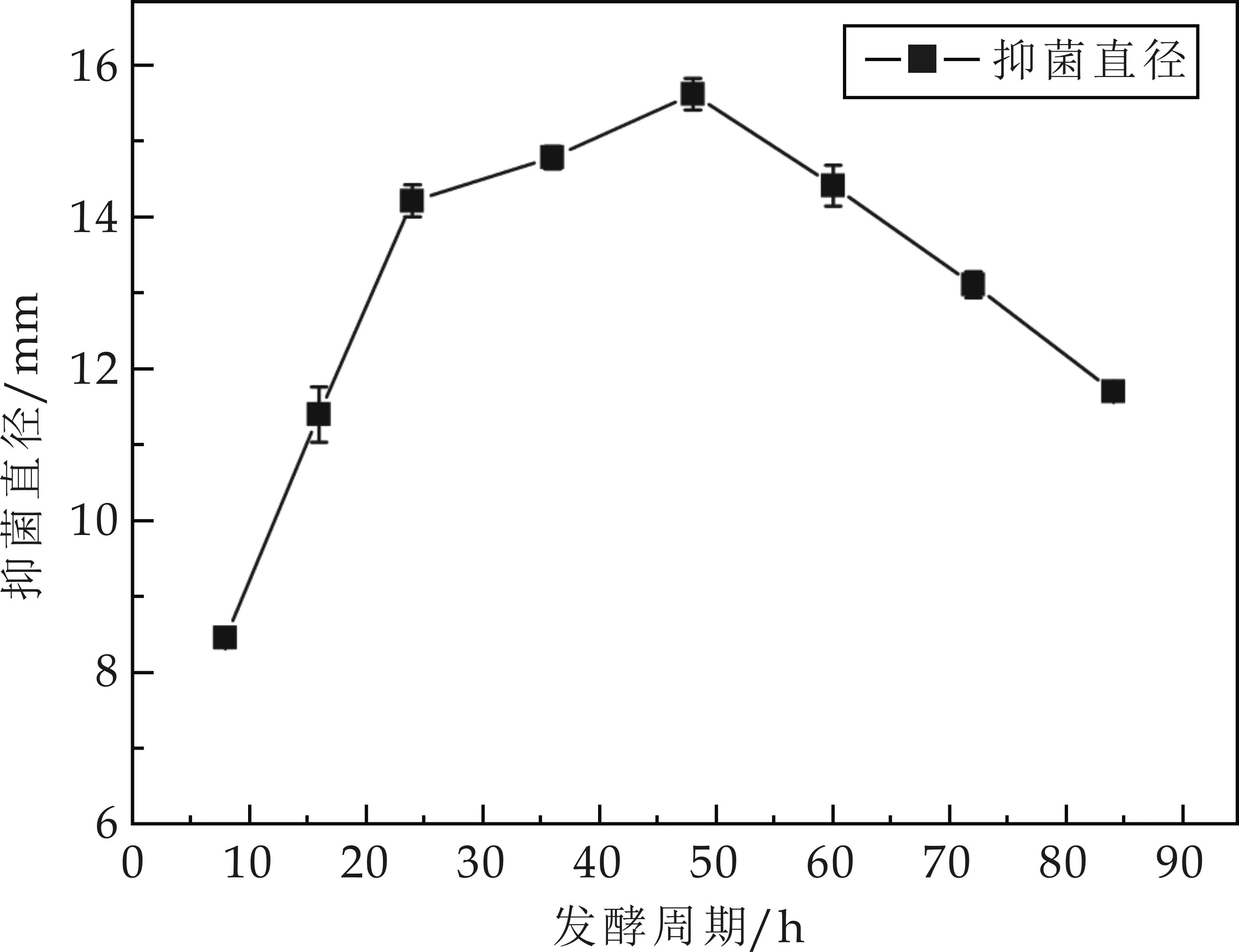
圖3 發(fā)酵時(shí)間對(duì)抗菌物質(zhì)活性影響
2.2.2 發(fā)酵溫度對(duì)菌株M01發(fā)酵生產(chǎn)抗菌物質(zhì)的影響
發(fā)酵溫度對(duì)菌株M01產(chǎn)生抗菌物質(zhì)的抑菌活性大小有著重要的影響,不同的溫度條件下產(chǎn)生的抗菌物質(zhì)的抑菌活性有所差異,溫度對(duì)菌株M01產(chǎn)生的抗菌物質(zhì)抑菌活性大小的影響趨勢(shì)如圖4 所示.由圖4可知,在研究的溫度變化范圍內(nèi),當(dāng)發(fā)酵溫度處于28 ℃時(shí),菌株M01產(chǎn)生的抗菌物質(zhì)的抑菌活性最好,其抑菌直徑達(dá)15.87 mm,總體的變化趨勢(shì)是隨著溫度的增加,抗菌物質(zhì)的抑菌活性先增大后減小.
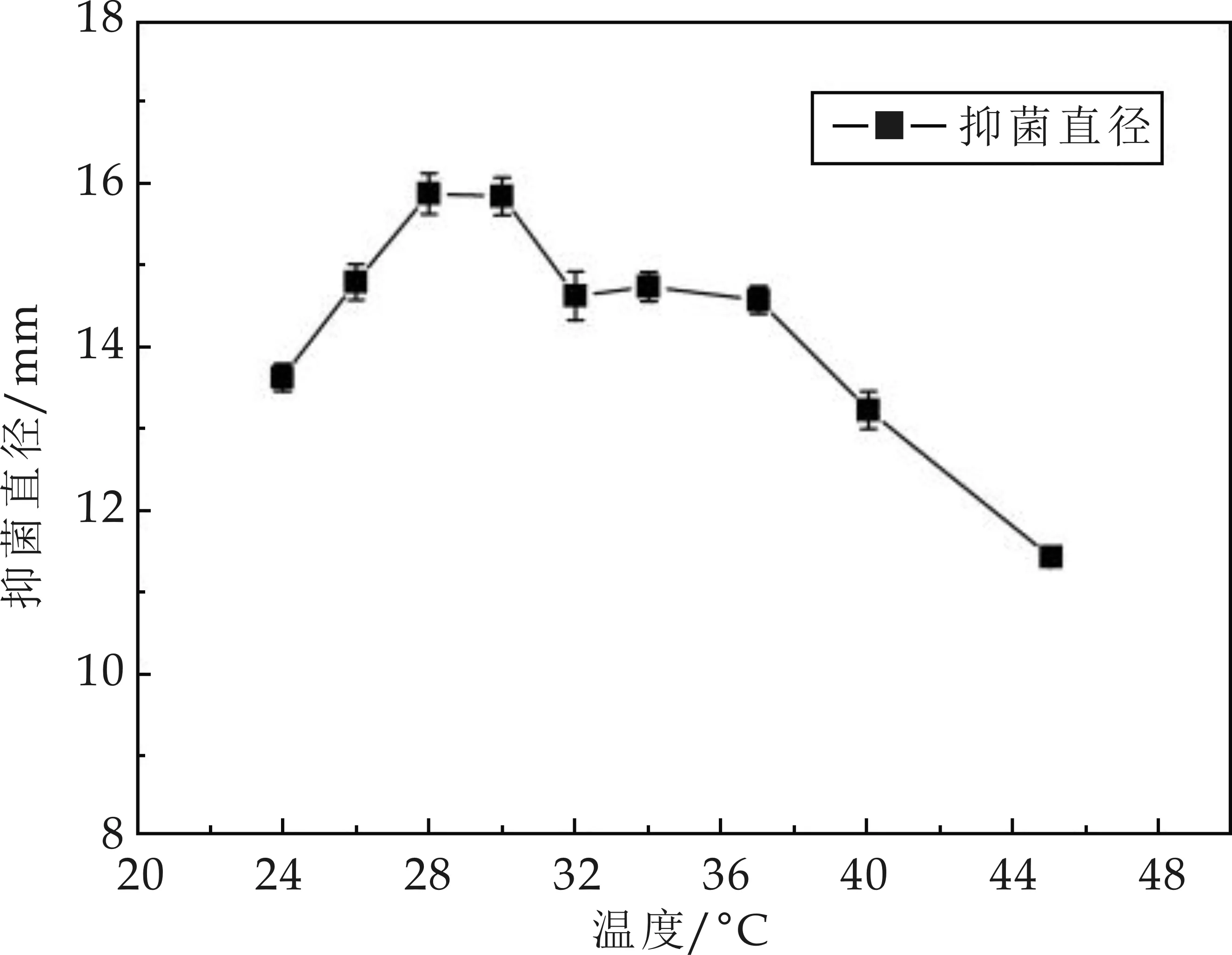
圖4 溫度對(duì)抗菌物質(zhì)活性影響
2.2.3 初始pH對(duì)菌株M01抑菌活性的影響
培養(yǎng)基初始pH對(duì)菌株M01產(chǎn)生抗菌物質(zhì)的抑菌活性影響如圖5所示.由圖5可知,將發(fā)酵培養(yǎng)基初始pH分別調(diào)為3、4、5后,發(fā)酵液中無抑菌活性物質(zhì)產(chǎn)生,這可能是該菌體自身對(duì)酸較敏感,超高了其耐受范圍,限制了菌體的生長,從而影響了菌株M01分泌活性抗菌物質(zhì).還可能是發(fā)酵液中一定酸度的存在,改變了菌株M01代謝調(diào)控通路,使該菌不能產(chǎn)生抗菌活性物質(zhì).當(dāng)培養(yǎng)基初始pH分別調(diào)為6~11后,發(fā)酵液中有明顯的抑菌活性物質(zhì)產(chǎn)生,且pH調(diào)為7時(shí),菌株M01產(chǎn)生的抗菌物質(zhì)抑菌活性最高.從圖5進(jìn)一步可以看出,培養(yǎng)基初始pH對(duì)菌株M01抗菌物質(zhì)生產(chǎn)非常重要.
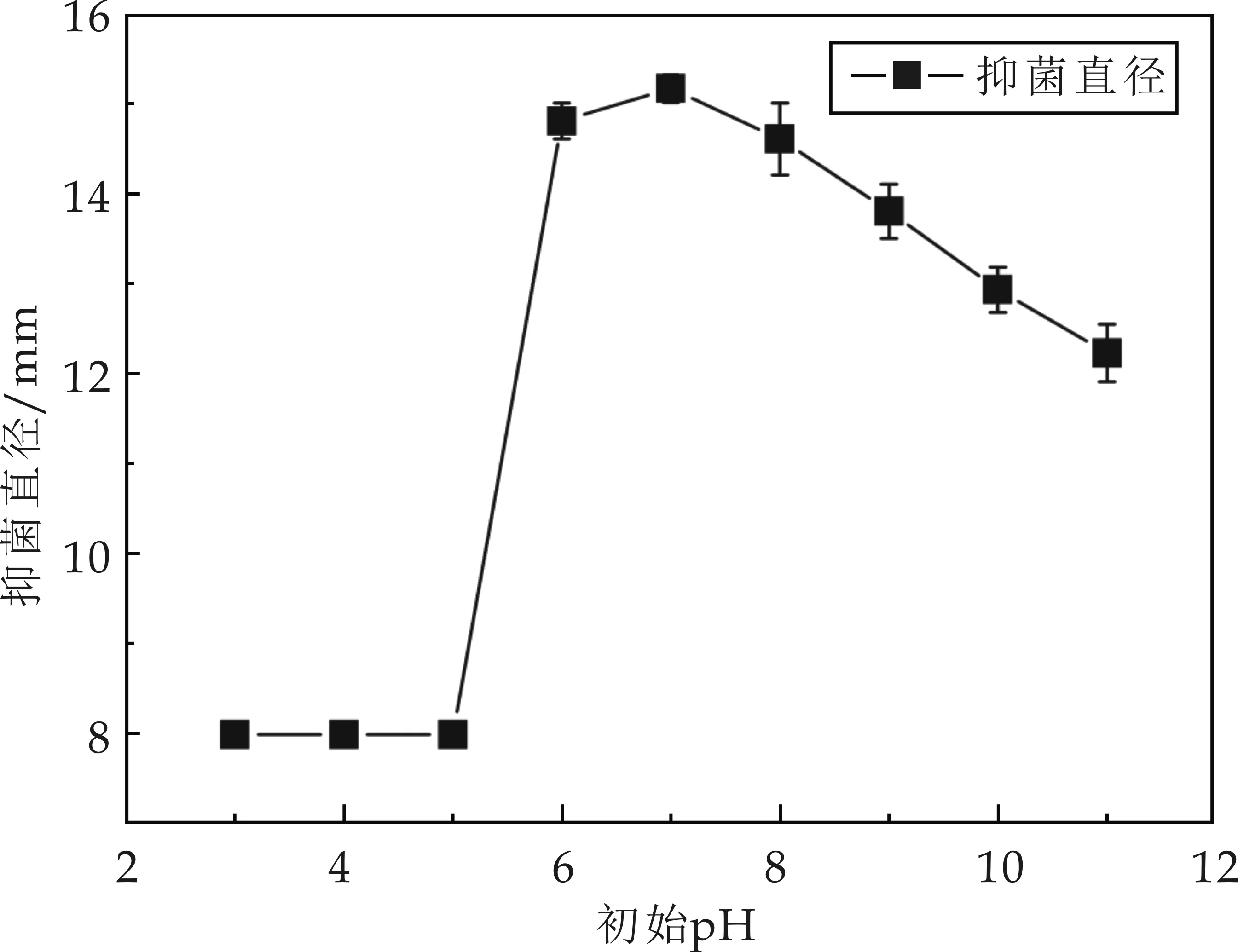
圖5 初始pH對(duì)抗菌物質(zhì)活性影響
2.2.4 接種量對(duì)菌株M01抑菌活性的影響
接種量對(duì)細(xì)菌菌株的生長及產(chǎn)物的分泌有著重要的影響,一般來說,接種量越小,細(xì)菌生長的遲滯期越長,菌體生長緩慢,發(fā)酵周期延長,增加生產(chǎn)成本;接種量過大,發(fā)酵底物消耗過快,菌體大量形成,不利于菌體代謝產(chǎn)物的形成.不同接種量對(duì)菌株M01產(chǎn)生的抗菌物質(zhì)抑菌活性的影響如圖6所示.由圖6可知,當(dāng)發(fā)酵培養(yǎng)基的接種量為6%時(shí),抗菌物質(zhì)的抑菌活性最好.
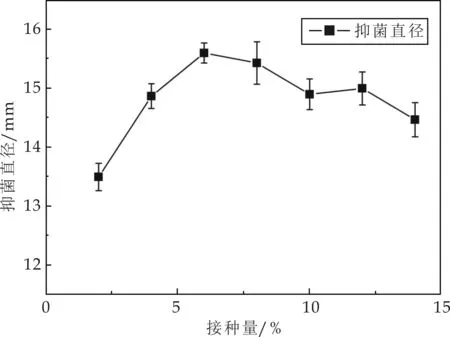
圖6 接種量對(duì)抗菌物質(zhì)活性影響
2.2.5 發(fā)酵工藝參數(shù)正交試驗(yàn)優(yōu)化
以單因素實(shí)驗(yàn)結(jié)果為正交優(yōu)化依據(jù),如表1所示選定正交試驗(yàn)的因素水平,并以抗菌物質(zhì)的抑菌直徑為正交優(yōu)化試驗(yàn)的測(cè)定指標(biāo)進(jìn)行試驗(yàn),通過直觀的極差分析,得到產(chǎn)抗菌物質(zhì)的最佳工藝.
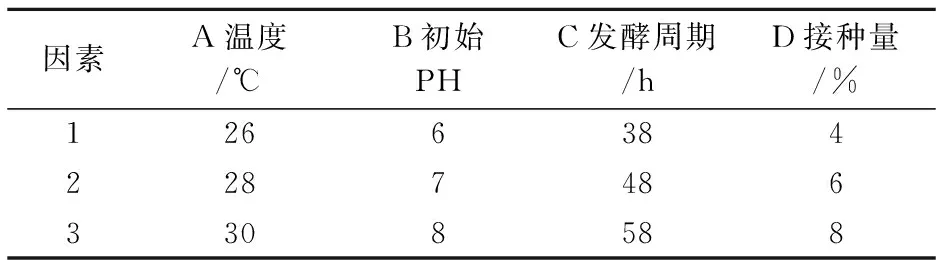
表1 發(fā)酵工藝參數(shù)因素水平
發(fā)酵工藝優(yōu)化正交試驗(yàn)分析結(jié)果如表2 所示.由表2可知,短短芽孢桿菌M01產(chǎn)抗菌物質(zhì)的最佳發(fā)酵工藝為A2B1C2D3,即發(fā)酵溫度為28 ℃,發(fā)酵培養(yǎng)基初始pH 6.0,發(fā)酵周期48 h,接種量8%,抗菌物質(zhì)的抑菌直徑達(dá)27.6 mm.對(duì)實(shí)驗(yàn)結(jié)果進(jìn)行極差分析可知,RC>RB>RA>RD.
即選取的影響因素對(duì)抗菌物質(zhì)的抑菌活性影響主次順序?yàn)椋喊l(fā)酵周期>發(fā)酵培養(yǎng)基初始pH>發(fā)酵溫度>接種量,表明發(fā)酵時(shí)間對(duì)抗菌物質(zhì)的抑菌活性影響最為明顯,發(fā)酵培養(yǎng)基初始pH次之,發(fā)酵溫度第三,接種量影響相對(duì)最小.
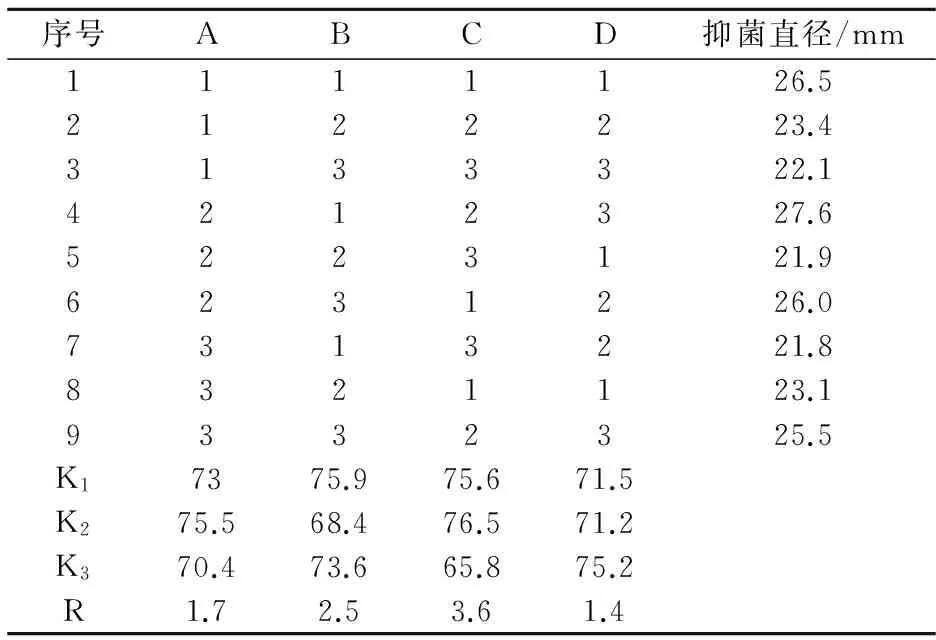
表2 發(fā)酵工藝的正交試驗(yàn)優(yōu)化
2.2.6 發(fā)酵工藝優(yōu)化前后的抑菌活性
菌株M01發(fā)酵工藝優(yōu)化前后產(chǎn)抗菌物質(zhì)的抑菌活性大小如圖7所示.由圖7可知,發(fā)酵工藝優(yōu)化前得到的抗菌物質(zhì)的抑菌直徑為18.6 mm,發(fā)酵工藝優(yōu)化后菌株M01產(chǎn)生的抗菌物質(zhì)的抑菌直徑為25.8 mm,比優(yōu)化前產(chǎn)生的抗菌物質(zhì)的抑菌活性提高了38.7%,表明優(yōu)化后的發(fā)酵工藝能夠明顯的提高抗菌物質(zhì)的抑菌活性.此外,研究發(fā)現(xiàn)優(yōu)化后的發(fā)酵工藝同樣適用于發(fā)酵罐(15 L)發(fā)酵,瓊脂打孔擴(kuò)散法測(cè)定發(fā)酵罐發(fā)酵產(chǎn)生的抗菌物質(zhì)的抑菌活性可達(dá)28.3 mm,因此該工藝的開發(fā)對(duì)于菌株M01抗菌物質(zhì)的批量生產(chǎn)具有重要經(jīng)濟(jì)效益及社會(huì)價(jià)值.
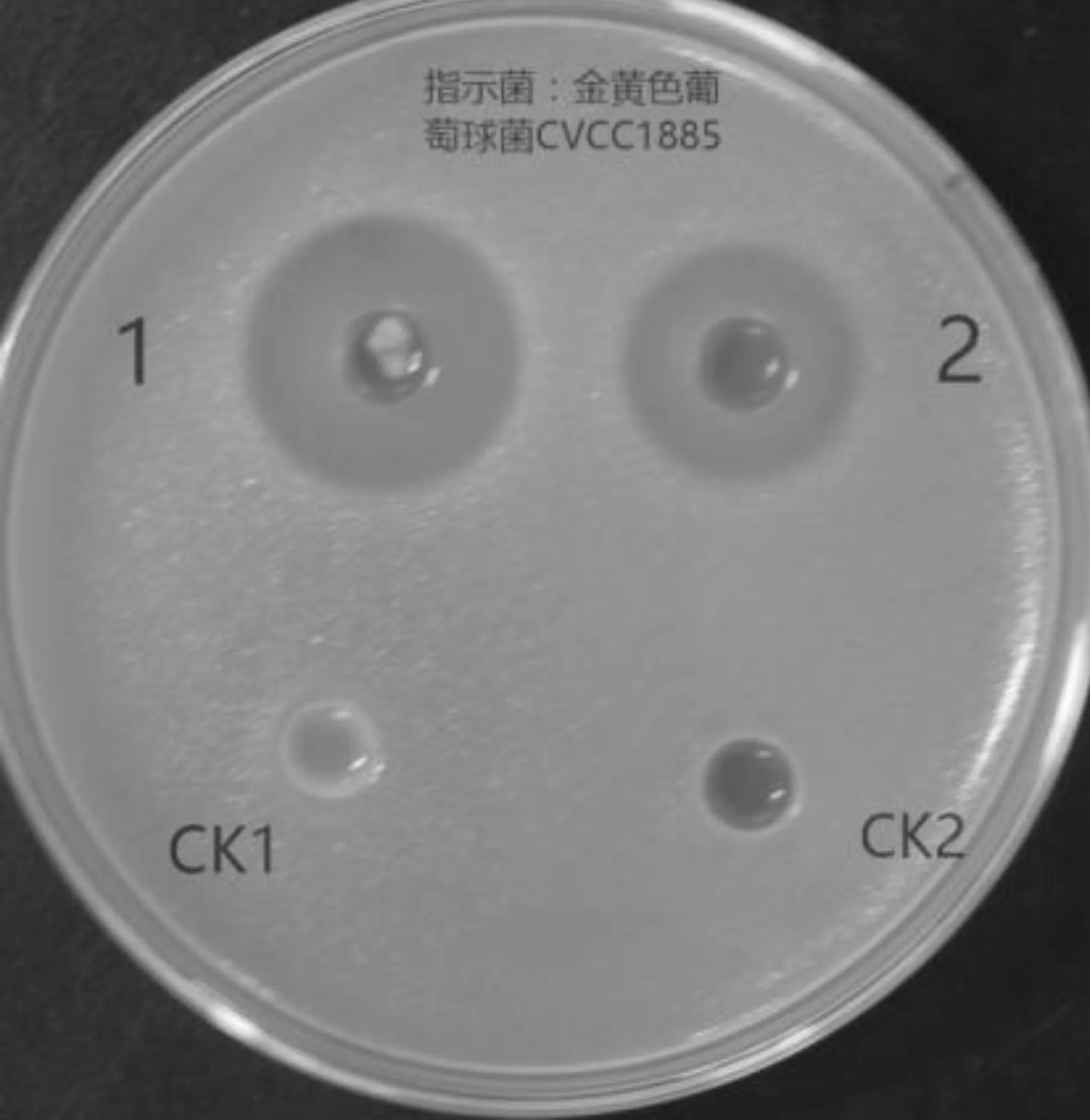
1:工藝優(yōu)化后抗菌物質(zhì)的抑菌活性;2:工藝優(yōu)化前抗菌物質(zhì)的抑菌活性;CK1 :空白發(fā)酵培養(yǎng)基;CK2 :無菌水圖7 菌株M01發(fā)酵工藝優(yōu)化驗(yàn)證
2.3 菌株M01抗菌活性物質(zhì)的提取
采用正丁醇、氯仿、乙酸乙酯、二甲基亞砜、石油醚過夜萃取菌株M01發(fā)酵離心上清液,分別得到有機(jī)相和水相,經(jīng)抑菌活性測(cè)定,有機(jī)相溶液對(duì)指示細(xì)菌無抑菌活性,而水相溶液對(duì)指示細(xì)菌有明顯的抑菌活性,且與未經(jīng)萃取的上清液抑菌活性基本一致.這說明了以上有機(jī)試劑均無法達(dá)到萃取上清液中抗菌物質(zhì)的目的.其原因可能是該抗菌活性物質(zhì)是極性較大的化合物.以大孔樹脂XAD-16對(duì)上清液中的抗菌物質(zhì)進(jìn)行提取,發(fā)現(xiàn)經(jīng)大孔樹脂XAD-16吸附后,只有部分抗菌物質(zhì)能夠被提取出來,因此大孔樹脂XAD-16吸附提取法無法達(dá)到完全提取抗菌物質(zhì)的目的.試用硫酸銨分段鹽析法提取菌株M01代謝產(chǎn)生的主要抗菌活性物質(zhì),試驗(yàn)結(jié)果發(fā)現(xiàn)硫酸銨分段鹽析法也無法將上清液中的抗菌物質(zhì)提取出來.
試用低溫乙醇沉淀法對(duì)菌株M01發(fā)酵離心上清液中的主要抗菌活性物質(zhì)進(jìn)行提取,等體積的上清液緩加入不同飽和度的冰冷無水乙醇,4 ℃冰箱靜止過夜,離心分離,分別測(cè)定不同飽和度的沉淀及上清液的抑菌活性,實(shí)驗(yàn)結(jié)果如圖8所示.
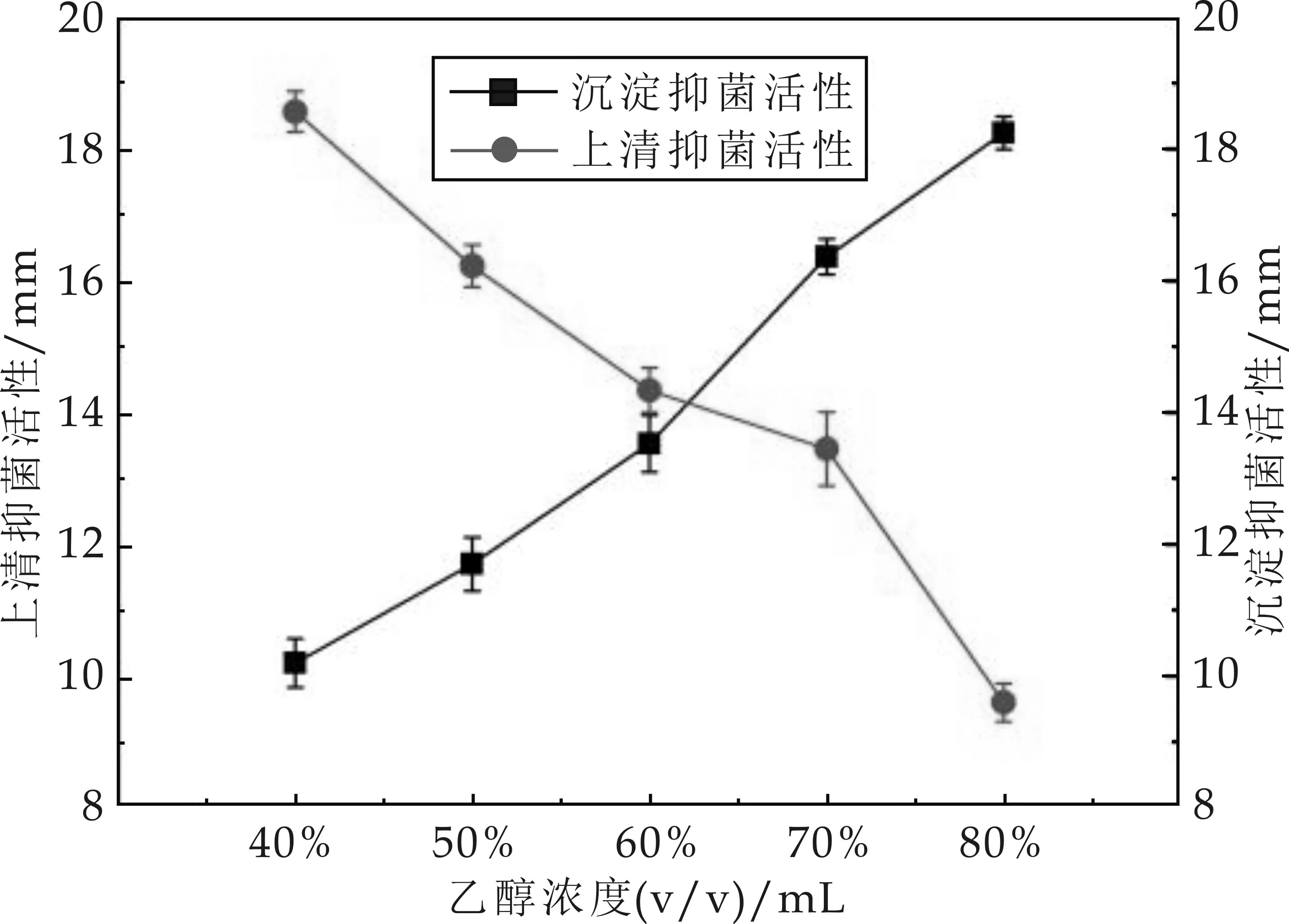
圖8 不同乙醇濃度對(duì)抗菌物質(zhì)的提取
由圖8可知,隨著冰冷無水乙醇飽和度的增加,處理后的沉淀的抑菌活性不斷增強(qiáng),至80%飽和度處理后,沉淀對(duì)指示菌的抑菌活性達(dá)到最強(qiáng),但處理后的上清液中的抑菌活性隨著冰冷無水乙醇飽和度的增加而下降,至80%飽和度處理后,上清夜中的抑菌活性完全消失,表明該法能夠?qū)⑸锨逡褐兄饕咕镔|(zhì)完全提取出來,且以80%乙醇為最適乙醇沉淀濃度.
2.4 菌株M01主要抑菌活性成分初步分析
在本研究中,菌株M01的主要抑菌活性物質(zhì)不能被有機(jī)溶劑萃取,也不能被硫酸銨沉淀,但可以被終濃度為80%的冷乙醇沉淀,與短短芽孢桿菌HAB-5[12]、FM4B[13]和JK2[1]等報(bào)道的結(jié)果類似.將經(jīng)80%乙醇沉淀下來的抗菌活性物質(zhì)溶解于25 mmol/L PBS緩沖液中,置于透析袋內(nèi),24 h透析脫鹽,經(jīng)Sephadex-50凝膠層析,收集58管洗脫液,每管8 mL,將其二倍稀釋在280 nm條件下測(cè)定各管的吸光值,其結(jié)果如圖9所示.
由圖9可知,在收集的4~18管洗脫液中,隨著收集管數(shù)的增加,洗脫液的吸光值呈現(xiàn)先增大后減小的變化趨勢(shì),表明各管洗脫液中蛋白類物質(zhì)的濃度同樣先增大后減小,且在第9管其濃度達(dá)到最大.吸取各收集管中溶液200μL進(jìn)行抑菌活性測(cè)定發(fā)現(xiàn)5~16管具有抑菌活性,其抑菌活性的大小與收集管內(nèi)蛋白類物質(zhì)的濃度成正比.其余各收集管洗脫液均無抑菌活性.采用PEG20000對(duì)其余各收集管洗脫液進(jìn)行30 min的透析濃縮,瓊脂打孔擴(kuò)散法測(cè)定抑菌活性發(fā)現(xiàn)4、17、18收集管也有抑菌活性,由此可初步分析發(fā)酵上清液中的主要抗菌活性成分是蛋白類物質(zhì).
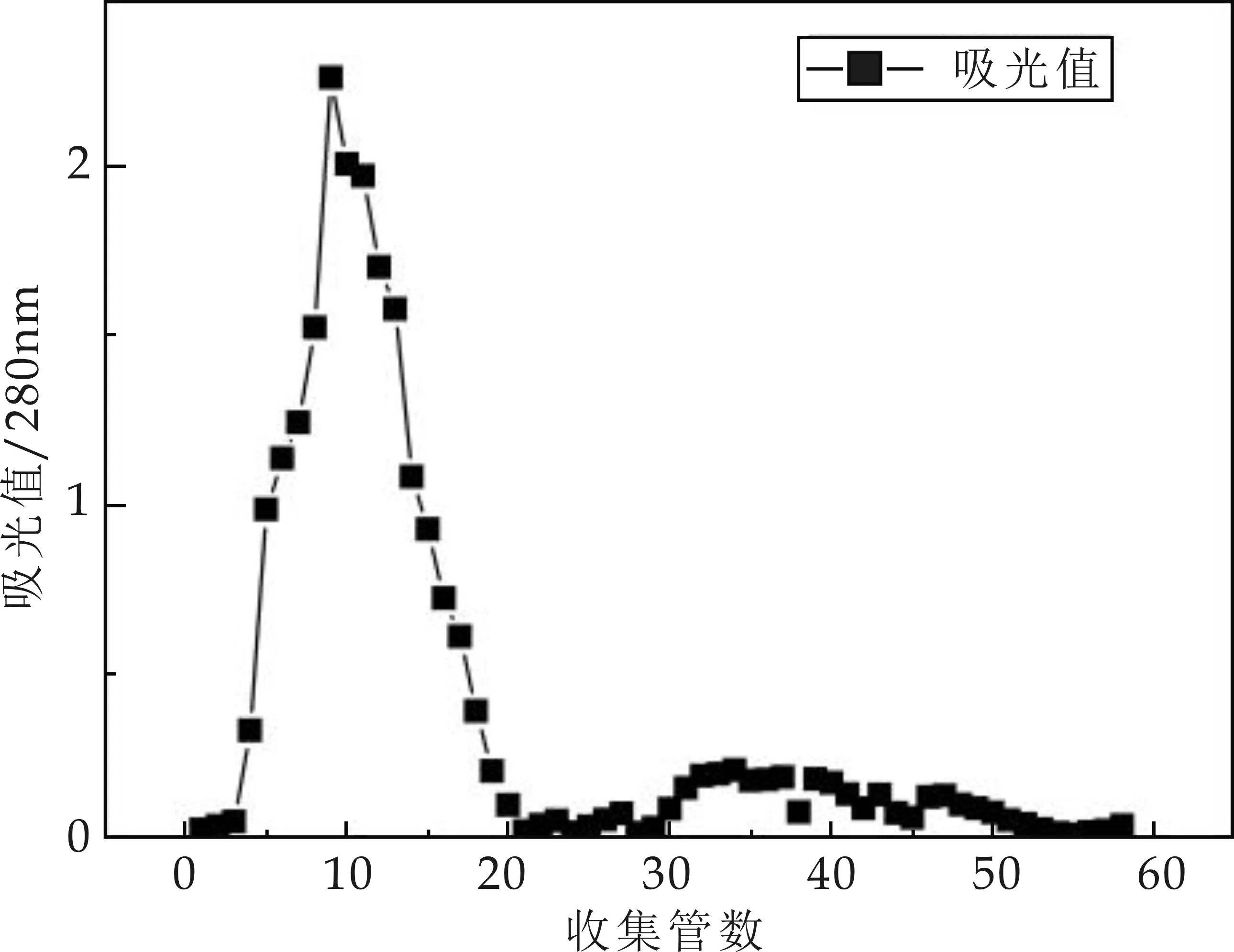
圖9 不同收集管洗脫液的吸光值測(cè)定
2.5 SDS-PAGE分析
經(jīng)葡聚糖凝膠初步純化后具有抑菌活性的洗脫液跑SDS-PAGE凝膠電泳如圖10所示.由圖10可知,不同的收集管中蛋白質(zhì)的分子量各不相同,同時(shí)也可以進(jìn)一步看出,蛋白質(zhì)濃度的大小與各收集管中蛋白質(zhì)的種類與大小密切相關(guān),通過抑菌活性測(cè)定發(fā)現(xiàn)9號(hào)收集管中的抗菌物質(zhì)抑菌活性最好,15號(hào)管中的抗菌物質(zhì)也具有良好的抗指示菌活性,但相對(duì)其余收集管抑菌活性較弱,由此可以初步說明分子量為62.0 kDa、40.0 kDa、29.0 kDa、20.1 kDa的蛋白都可能是菌株M01抑菌活性物質(zhì)的主要成分,其中29.0 kDa左右的蛋白可能是菌株M01抑菌活性物質(zhì)的重要成分.這與報(bào)道的HAB-5[12]的主要抑菌物質(zhì)可能是分子量為60.0 kDa、59.0 kDa、43.5 kDa、和14.4 kDa大小的肽類物質(zhì),其中14.4 kDa更可能是HAB-5主要抑菌物質(zhì)的分子量的研究結(jié)果極為相似.
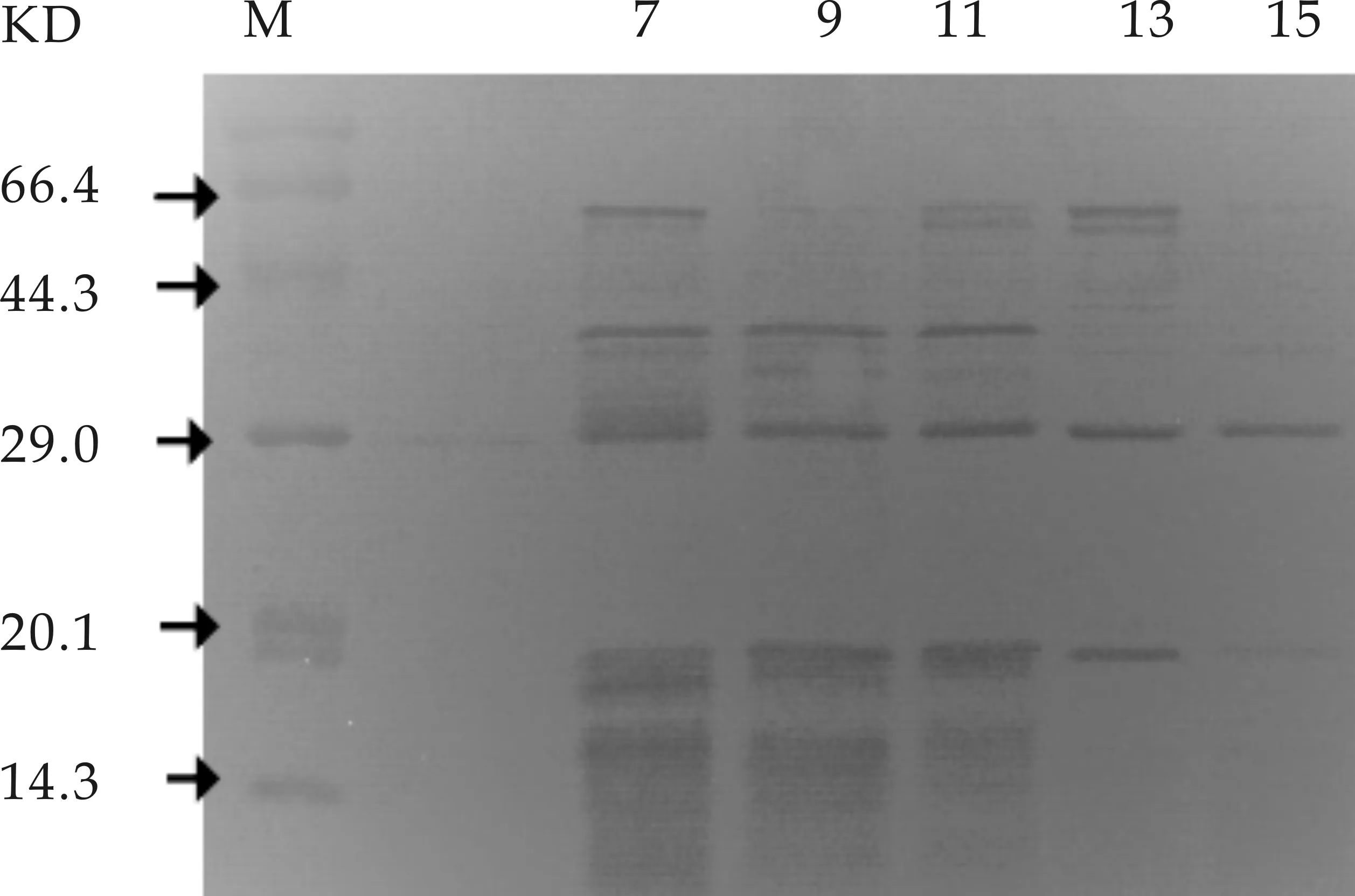
圖10 菌株M01抑菌活性物質(zhì) 的聚丙烯酰胺凝膠電泳
3 結(jié)論
本研究對(duì)生防菌短短芽孢桿菌M01產(chǎn)生抗菌物質(zhì)的工藝條件進(jìn)行優(yōu)化,并得到了產(chǎn)抗菌活性物質(zhì)的最佳發(fā)酵工藝條件:初始pH6.0,接種量8%,發(fā)酵溫度28 ℃,發(fā)酵周期48 h, 在該工藝條件下,菌株M01產(chǎn)生的抗菌物質(zhì)對(duì)金黃色葡萄球菌CVCC1885抑菌活性比優(yōu)化前提高了38.7%,采用80%乙醇沉淀法提取抗菌活性物質(zhì),得抗菌活性粗提物,對(duì)其進(jìn)行透析脫鹽,過Sephadex-50凝膠層析柱初步分離純化,SDS-PAGE分析發(fā)現(xiàn)分子量為29.0 KD左右的蛋白可能是菌株M01抑菌活性物質(zhì)的重要成分.具體哪一種分子量的蛋白是抗菌物質(zhì)的主要成分還需進(jìn)一步的純化做質(zhì)譜分析.
[1] 郝曉娟,劉 波,謝關(guān)林,等.短短芽孢桿菌JK-2菌株抑菌物質(zhì)特的研究[J].浙江大學(xué)學(xué)報(bào)(農(nóng)業(yè)與生命科學(xué)版),2007,33(5):484-489.
[2] Li S,Zhao Z A,Li M,et al.Purification and characterization of a novel chitinase fromBacillusbrevis[J].Journal of Industrial Microbiology & Biotechnology,2011,38(4):557-563.
[3] Jianmei C,Bo L,Zheng C,et al.Identification of ethylparaben as the antimicrobial substance produced byBrevibacillusbrevisFJAT-08 09-GLX[J].Microbiological Research,2015,172(3):48-56.
[4] 車建美.短短芽胞桿菌(Brevibacillusbrevis)對(duì)龍眼保鮮機(jī)理的研究[D].福建:福建農(nóng)林大學(xué),2011.
[5] 薛東紅.短短芽孢桿菌XDH的鑒定及其抗菌物質(zhì)的分離、純化與部分性質(zhì)研究[D].泰安:山東農(nóng)業(yè)大學(xué),2006.
[6] Murray T,Leighton F C,Seddon B.Inhibition of fungal spore germination by gramicidin S and its potential use as a biocontrol against fungal plant pathogens[J].Letters in Applied Microbiology,2010,3(1):5-7.
[7] Wafaa M.Haggag.Isolation of bioactive antibiotic peptides fromBacillusbrevisandBacilluspolymyxa against botrytis grey mould in strawberry[J].Archives of Phytopathology & Plant Protection,2008,41(7):477-491.
[8] Bapat S,Shah A K.Biological control of fusarial wilt of pigeon pea byBacillusbrevis[J].Canadian Journal of Microbiology,2000,46(2):125-129.
[9] Sunita C,Allan E J,Steve W.Biological control of fusarium oxysporum,f.sp.lycopersici,on tomato by brevibacillus brevis[J].Journal of Phytopathology,2010,158(8):470-478.
[10] Edwards S G,Seddon B.Mode of antagonism ofBrevibacillusbrevisagainst botrytis cinerea in vitro[J].Journal of Applied Microbiology,2001,91(4):652-659.
[11] Kang S C,Park S,Lee D G.Purification and characteriza-tion of a novel chitinase from the entomopathogenic fungus,metarhizium anisopliae[J].Journal of Invertebrate Pathology,1999,73(3):276-281.
[12] 楊廷雅,孫 亮,周婷婷,等.短短芽孢桿菌BrevibacillusbrevsHAB-5主要抑菌活性成分的分析及其特性研究[J].中國生物防治學(xué)報(bào),2014,30(2):222-231.
[13] 胡雪芹,芮廣虎,周雪梅,等.生防菌FM4B的鑒定及抗菌物質(zhì)的性質(zhì)研究[J].上海交通大學(xué)學(xué)報(bào)(農(nóng)業(yè)科學(xué)版),2011,29(1):75-80.
【責(zé)任編輯:陳佳】
OptimizationoftechnologicalconditionsforproductionantibacterialsubstancesfromBrevibacillusbrevisM01andinvestigationofthemainantibacterialcomponents
WANG Zhong-zhong1, GONG Guo-li1,2
(1.School of Food and Biological Engineering, Shaanxi University of Science & Technology, Xi′an 710021, China; 2.Xi′an Microbiology and Pharmaceutical Engineering Laboratory, Xi′an 710021, China)
2017-06-21
陜西省教育廳自然科學(xué)專項(xiàng)科研計(jì)劃項(xiàng)目(14JK1101); 西安市未央?yún)^(qū)科技計(jì)劃項(xiàng)目(201309)
王忠忠(1992-),男,寧夏平羅人,在讀碩士研究生,研究方向:微生物發(fā)酵
2096-398X(2017)05-0145-06
Q939.92
A

