海參腸組織蛋白酶D的提取及酶學特性研究
,,,,,, ,
(大連工業大學食品學院,國家海洋食品工程技術研究中心,遼寧大連 116034)
海參腸組織蛋白酶D的提取及酶學特性研究
郭曉坤,李傲婷,韓佳潤,杜椅楠,郭天民,于翠平,唐越,吳海濤*
(大連工業大學食品學院,國家海洋食品工程技術研究中心,遼寧大連116034)
本研究以海參腸為原料,采用pH3.0 50 mmol/L 甘氨酸-鹽酸緩沖體系,按1∶6 (w/v)的料液比,在4 ℃浸提1 h,獲得海參腸組織蛋白酶D的粗酶液。以酸變性牛血紅蛋白為底物,進行酶活測定,并研究了該酶的酶學性質。結果表明,海參腸組織蛋白酶D粗酶的最適pH為3.0,在pH3.0~7.0之間穩定性較好;最適反應溫度為50 ℃,在4~40 ℃具有較高穩定性。5 mmol/L的金屬離子Mg2+、Ca2+、Ni2+、Zn2+、Cd2+和K+對該酶有激活作用,而Fe3+和Fe2+則對其有抑制作用。天冬氨酸蛋白酶抑制劑Pepstatin A對該酶活性有較強的抑制作用。上述結果說明,在本研究條件下提取獲得的海參腸組織蛋白酶D粗酶是一種酸性蛋白酶,其組成以天冬氨酸蛋白酶為主。
海參腸,組織蛋白酶D,提取,酶學特性
Abstract:The crude cathepsin D was obtained from sea cucumber(Stichopusjaponicus)guts in this paper. The crude cathepsin D was extracted by using 50 mmol/L Glycine-HCl buffer(pH3.0)with material to solvent ratio of 1∶6 (w/v)at 4 ℃ for 1 h. The activity and characterization of the enzyme were investigated by using acid denatured hemoglobin as a substrate. The results showed that the optimum pH of the crude cathepsin D was pH3.0 and was stable between pH3.0~7.0. The crude cathepsin D exhibited its optimal temperature at 50 ℃ and was stable at 4~40 ℃. The crude cathepsin D was activated by metal ions of Mg2+,Ca2+,Ni2+,Zn2+,Cd2+and K+,while inhibited by Fe3+and Fe2+at concentration of 5 mmol/L. The crude cathepsin D was strongly inhibited by aspartic protease inhibitor pepstatin A. These results suggested that the crude cathepsin D obtained fromS.japonicusguts was acid protease maily composed of aspartic protease under the condition of present study.
Keywords:sea cucumber gut;cathepsin D;extraction;enzyme characterization
海參(Stichopusjaponicus)是不含膽固醇的食用資源,富含多種活性成分,營養價值高,被視為佐膳佳品和理想滋補品[1]。但海參易發生自溶,給其運輸和加工造成了諸多不便,并引起了經濟損失[2]。自溶主要由內源酶作用引起的,目前已從海參組織中分離獲得多種內源酶,例如半胱氨酸蛋白酶[3]、類組織蛋白酶L[4]、酸性磷酸酶[5]、組織蛋白酶B[6]、乙酰膽堿酯酶[7]、堿性磷酸酶[8]等,對這些酶的研究為揭示海參的自溶機理奠定了基礎。
組織蛋白酶D是一種重要的胞內天冬氨酸蛋白酶,在生物界中廣泛存在。組織蛋白酶D具有多種生物功能,參與胞內蛋白質的降解,酶原、激素和生長因子的激活[9]。目前,關于哺乳動物來源的組織蛋白酶D的相關研究已較為廣泛,已從人、牛及豬的組織中分離純化出了組織蛋白酶D[10-12]。關于水產品組織蛋白酶D的研究也有相關報道,主要集中在大宗水產品。例如,Jiang等[13]利用pH7.0 20 mmol/L磷酸鹽緩沖液,按1∶5 (w/v)的料液比,對羅非魚肌肉脫脂粉中的組織蛋白酶D進行了提取,獲得粗酶液后,經進一步純化,獲得羅非魚組織蛋白酶D,該酶的最適pH為3.5,最適溫度為37 ℃;Wang等[14]利用pH2.5 100 mmol/L McIlvaine緩沖液,按1∶4 (w/v)的料液比,對大西洋鱈魚肝臟組織蛋白酶D進行了提取及純化,該酶水解酸變性牛血紅蛋白的最適pH為3.0;Balti等[15]利用pH3.0 10 mmol/L甘氨酸-鹽酸緩沖液,按1∶10 (w/v)的料液比,從烏賊肝胰臟中獲得了組織蛋白酶D的粗酶液;Merino等[16]采用pH7.4 25 mmol/L Tris-HCl緩沖液,按1∶4 (w/v)的料液比,對海星組織蛋白酶D進行了提取,并純化得到海星組織蛋白酶D。然而,關于海參來源的組織蛋白酶D的研究,國內外尚未見報道。
因此,本研究以海參加工中的副產物為研究對象,從海參腸中提取了組織蛋白酶D,并對其提取條件和酶學性質進行了研究,以期為進一步開發利用海參腸奠定研究基礎。
1 材料與方法
1.1 材料與儀器
新鮮海參 大連長興水產市場;L-酪氨酸、Folin酚、牛血紅蛋白、考馬斯亮藍R-250 上海生工生物工程技術服務有限公司;胃酶抑素A(Pepstatin A)、苯甲磺酰氟(PMSF)、反-環氧丁二酰基-L-亮氨酰胺基(4-胍基)丁烷(E-64)、碘乙酸(IAA) 美國Sigma-Aldrich公司;其他試劑 均為國產分析純。
BS224S電子天平 賽多利斯科學儀器有限公司;Scientz-Ⅲ型數控層析冷柜 寧波新芝生物科技股份有限公司;DF-101S恒溫加熱磁力攪拌器、98-2強磁力攪拌器 鞏義予華儀器有限公司;HITACHI CF16RXII離心機 日本株式會社日立制作所;XW-80A漩渦振蕩器 上海精科實業有限公司;Infinite200 NANO酶標定量測定儀 TECAN(上海)貿易有限公司;明澈TM-D24UV純水系統 美國Millipore公司;IKA T25勻漿機 德國IKA公司;UV-5200型紫外可見分光光度計 上海元析儀器有限公司。
1.2 實驗方法
1.2.1 海參腸組織蛋白酶D提取條件的確定
1.2.1.1 提取緩沖液pH的確定 配制不同pH的緩沖液:50 mmol/L Glycine-HCl緩沖液(pH2.0~3.0);50 mmol/L NaAc-HAc緩沖液(pH4.0~5.0);50 mmol/L Na2HPO4-NaH2PO4緩沖液(pH6.0~8.0)。稱取15 g海參腸,分別加入75 mL上述緩沖液,冰浴中勻漿,浸提12 h,4 ℃、8500×g下冷凍離心30 min,收集上清,測定蛋白含量和總酶活力,以總酶活力最高者為100%,用相對總酶活力來表示。
1.2.1.2 料液比的確定 稱取15 g海參腸,分別加入30、45、60、75、90和105 mL(料液比分別為1∶2、1∶3、1∶4、1∶5、1∶6、1∶7)pH3.0 50 mmol/L Glycine-HCl緩沖液,冰浴中勻漿,浸提12 h,4 ℃、8500×g下冷凍離心30 min,收集上清,測定蛋白含量和總酶活力,以總酶活力最高者為100%,用相對總酶活力來表示。
1.2.1.3 提取時間的確定 稱取15 g海參腸,加入90 mL pH3.0 50 mmol/L Glycine-HCl緩沖液,冰浴中勻漿,分別浸提0.5、1、2、3、4、6、8、10、12、14和16 h,4 ℃、8500×g下冷凍離心30 min,收集上清液,測定蛋白含量和總酶活力,以總酶活力最高者為100%,用相對總酶活力來表示。
1.2.2 海參腸組織蛋白酶D酶活力的測定 組織蛋白酶D活力的測定以酸變性牛血紅蛋白為底物,參考Anson等[17]的方法,并略有修改。具體方法如下:75 μL酶液和525 μL pH3.0 100 mmol/L Glycine-HCl緩沖液混合,加入150 μL 2% 酸變性牛血紅蛋白開始反應,在37 ℃孵育2 h,加入750 μL 8% TCA終止反應,10000×g離心30 min,收集上清,用Lowry法[18]測定TCA中酶水解底物釋放的肽的含量。以L-酪氨酸為標準品,所得標準曲線為y=0.0034x+0.0026(R2=0.9997)。在空白對照組中,按照上述條件,將酶液與底物溶液分別進行孵育2 h,在酶液中加入750 μL 8% TCA使酶失活,再與底物混合。
酶活力單位的定義:在pH3.0,37 ℃條件下,每2 h水解酸變性牛血紅蛋白產生1 μg酪氨酸類似物所需要的酶的量為一個酶活力單位(U)。
酶比活力的計算:酶比活力(U/mg)=總酶活力(U)/蛋白質質量(mg)
1.2.3 蛋白含量的測定 蛋白含量的測定參考杜英[19]的方法,具體方法如下:取1 mL酶液,加入4 mL考馬斯亮藍溶液,混勻,靜置2 min,于595 nm下測吸光值。以牛血清蛋白為標準品,所得標曲為y=0.0191x+0.0081(R2=0.9986)。
1.2.4 海參腸組織蛋白酶D的酶學性質
1.2.4.1 pH對酶活性和穩定性的影響 考察pH對酶活性的影響時,按1.2.2中酶活力的測定方法,反應體系采用pH1.0、2.0、3.0、4.0、5.0、6.0和7.0的緩沖液,所用緩沖液如下:100 mmol/L Glycine-HCl緩沖液(pH1.0~3.0);100 mmol/L NaAc-HAc緩沖液(pH4.0~6.0);100 mmol/L Tris-HCl緩沖液(pH7.0~8.0),以酶活力最高者為100%。考察pH對酶穩定性的影響時,按1.2.2中酶活力的測定方法,先將酶液與不同pH的緩沖液混合,在25 ℃孵育60 min,再加入底物開始反應,測定酶活力,以酶活力最高者為100%,用相對酶活力來表示。
1.2.4.2 溫度對酶活性和穩定性的影響 考察溫度對酶活性的影響時,按1.2.2中酶活力的測定方法,將反應溫度設置為20、30、40、50、60、70和80 ℃,以酶活力最高者為100%。考察溫度對酶穩定性的影響時,按1.2.2中酶活力的測定方法,先將酶液和pH3.0緩沖液混合,在4、10、15、20、30、40、50、60、70和80 ℃條件下預先孵育30 min,立即在冰上冷卻,測定酶活力,以酶活力最高者為100%,用相對酶活力來表示。
1.2.4.3 金屬離子對酶活性的影響 按1.2.2中酶活力的測定方法,先將酶液與pH3.0 100 mmol/L Glycine-HCl緩沖液混合,加入不同金屬離子的氯鹽溶液,在37 ℃孵育30 min,然后加入底物開始反應。所用金屬離子如下:Na+、K+、Mg2+、Ca2+、Ni2+、Zn2+、Cd2+、Fe2+和Fe3+,終濃度為5 mmol/L。以未加金屬離子的情況所測酶活力為100%。
1.2.4.4 抑制劑對酶活性的影響 按1.2.2中酶活力的測定方法,先將酶液與pH3.0 100 mmol/L Glycine-HCl緩沖液混合,加入抑制劑,在25 ℃孵育30 min,然后加入底物開始反應。本文所用抑制劑濃度接近文獻報道中所采用的濃度[15,20],其在反應體系中的終濃度如下:PMSF(5 mmol/L)、IAA(1 mmol/L)、E-64(0.1 mmol/L)和Pepstatin A(1 mmol/L)。以未加抑制劑的情況所測酶活力為100%。
1.3 數據處理
每個樣品設三組平行,實驗數據以平均值±標準差表示。采用SPSS 13.0軟件進行顯著性分析,p<0.05時具有顯著性差異。
2 結果與分析
2.1 海參腸組織蛋白酶D提取條件的確定
2.1.1 緩沖液pH對海參腸組織蛋白酶D提取效果的影響 緩沖液pH對相對總酶活力、蛋白質含量及相對比活力的影響如圖1所示。以相對比活力為主要考察指標,探究浸提緩沖液pH對海參腸組織蛋白酶D提取效果的影響。由圖1可知,隨著提取緩沖液pH的增加,相對比活力呈現出遞減的趨勢,其中pH2.0時,相對比活力最高。但pH2.0時,海參腸組織蛋白酶D的相對總酶活力較低,僅為pH3.0時的1/3左右。此外,pH2.0時,蛋白質的溶出量極低,這也正是導致pH2.0條件下相對比活力偏高的原因。因此,綜合考慮提取緩沖液pH對相對總酶活力、蛋白質含量及相對比活力的影響,將提取緩沖液的pH定為pH3.0,該提取條件與從烏賊肝胰臟提取組織蛋白酶D[15]時所用的pH(pH3.0)相一致,與從大西洋鱈魚[14]中提取組織蛋白酶D時所用的pH(pH2.5)相接近。
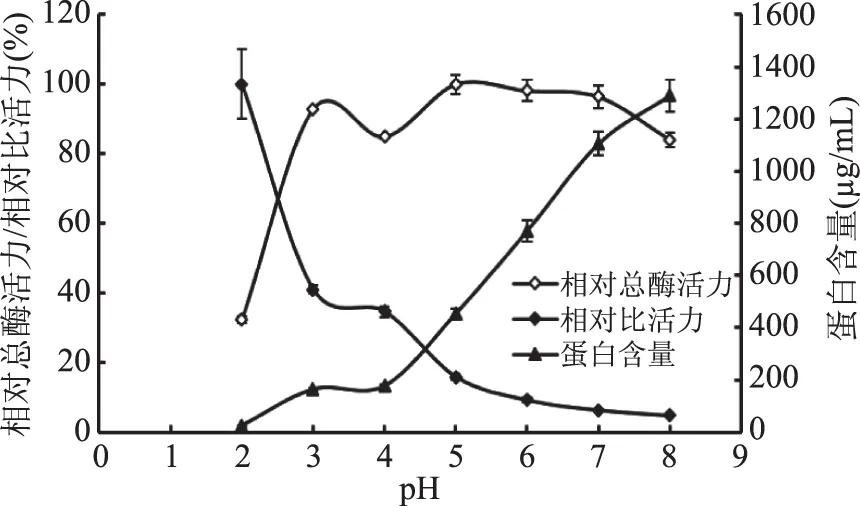
圖1 緩沖液pH對海參腸組織蛋白酶D相對總酶活力、蛋白濃度和相對比活力的影響Fig.1 Effect of different buffer pH on relative total activity,protein concentration and relative specific activity of cathepsin D from sea cucumber guts
2.1.2 料液比對海參腸組織蛋白酶D提取效果的影響 以相對比活力為主要考察指標,探究料液比對海參腸組織蛋白酶D提取效果的影響。由圖2可知,隨提取緩沖液體積的增加,相對比活力呈現出增加的趨勢,但增加趨勢逐漸減緩,當料液比(w/v)為1∶6以后,相對比活力開始無明顯增加,因此,將提取條件的料液比(w/v)設為1∶6。
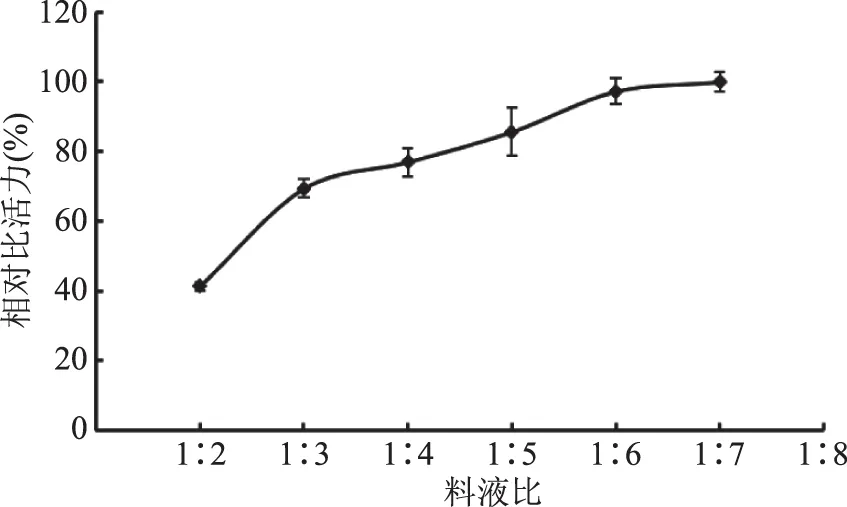
圖2 料液比對海參腸組織蛋白酶D相對比活力的影響Fig.2 Effect of material liquid ratio on relative specific activity of cathepsin D from sea cucumber guts
2.1.3 浸提時間對海參腸組織蛋白酶D提取效果的影響 以相對比活力為判斷依據,探究浸提時間對組織蛋白酶D提取效果的影響。由圖3可知,提取時間小于1 h時,酶的溶出量逐漸增加,比活力呈增加趨勢,提取時間大于1 h時,相對比活力隨著提取時間的增加而減小,這可能由于在長時間的浸提過程中,雜蛋白的含量提高或者在浸提過程中部分組織蛋白酶D發生了降解,致使相對比活力下降,因此將提取時間設為1 h。
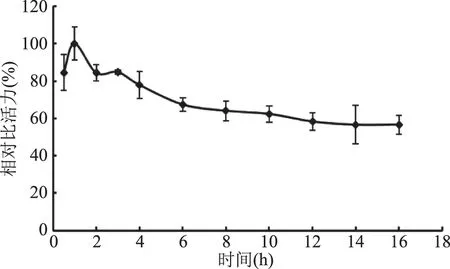
圖3 浸提時間對海參腸組織蛋白酶D相對比活力的影響Fig.3 Effect of different time on relative specific activity of cathepsin D from sea cucumber guts
2.2 海參腸組織蛋白酶D的酶學性質
2.2.1 pH對海參腸組織蛋白酶D活性和穩定性的影響 在不同pH條件下,酶和底物分子中基團的解離程度不同,從而影響分子的構像以及底物與酶的結合能力和催化能力。pH對酶活性的影響如圖4所示,以牛血紅蛋白為底物時,海參腸組織蛋白酶D在pH1.0~7.0范圍內均呈現出活性,其最適pH在pH3.0附近。這與烏賊肝胰臟[15]以及大西洋鱈魚肝臟[14]組織蛋白酶D的最適pH相接近。通常認為,不同來源的組織蛋白酶D的最適pH介于pH3.0~5.0之間[15]。此外,也有報道認為,在酸性條件下,組織蛋白酶D的最適pH可能會因選用的蛋白底物的變化而發生改變[21-22]。pH對酶穩定性的影響如圖4所示,海參腸組織蛋白酶D在pH3.0~7.0,25 ℃條件下孵育60 min均可保持80%以上的相對比活力,當pH高于7.0時,活性快速下降,pH8.0時,相對比活力僅為47.1%。而Jiang等[23]對斑節蝦和草蝦組織蛋白酶D進行研究時則發現,兩種組織蛋白酶D的pH穩定區間分別為pH5.0~7.0和pH4.0~8.0。這種現象表明組織蛋白酶D的酶學性質可能因其來源的不同而存在差異。

圖4 pH對海參腸組織蛋白酶D活性和穩定性的影響Fig.4 Effect of pH on the activity and the stability of cathepsin D from guts of sea cucumber

表1 金屬離子對海參腸組織蛋白酶D活性的影響Table 1 Effects of matel ions on cathepsin D of sea cucumber guts
注:*與空白對照組比較,具有顯著差異(p<0.05)。
2.2.2 溫度對海參腸組織蛋白酶D活性和穩定性的影響 由圖5可知,在20~50 ℃的范圍內,海參腸組織蛋白酶D的活性隨溫度的上升而上升,在50 ℃達到最大值,隨著溫度進一步升高,酶活力快速下降,70 ℃時相對比活力僅為4.9%。海參腸組織蛋白酶D的最適反應溫度與烏賊肝胰臟[15]、鯉魚肌肉[24]以及斑節蝦組織蛋白酶D[23]的最適溫度一致,但比鴕鳥肌肉組織蛋白酶D[25]的最適溫度要高(45 ℃),比貽貝組織蛋白酶D[26]的最適溫度要低(60 ℃),這也再次表明組織蛋白酶D的酶學性質可能因來源的不同而存在差異。溫度對酶穩定性的影響如圖5所示,當溫度低于40 ℃時,海參腸組織蛋白酶D的活性可以穩定在74%以上,當溫度高于40 ℃時活性快速下降,當在50 ℃孵育30 min時,酶活損失率約為74.5%,當溫度高于60 ℃時,幾乎完全失活。研究發現,雞腸道組織蛋白酶D[27]在pH3.6,50 ℃的條件下孵育30 min,酶活性幾乎沒有損失,牛組織蛋白酶D[28]在pH3.5,50 ℃的條件下孵育30 min,殘存酶活性仍高于70%。海參腸組織蛋白酶D的熱穩定性相對較差,這可能與海參棲息環境及生活習性相關,海參通常在溫度較低的秋冬季節生長,夏季進入休眠期,海參體內蛋白酶的酶學特性可能與該生理現象相適應。

圖5 溫度對海參腸組織蛋白酶D活性和穩定性的影響Fig.5 Effect of temperature on the activity and the stability of cathepsin D from guts of sea cucumber
2.2.3 金屬離子對海參腸組織蛋白酶D活性的影響 由表1可知,以酸變性牛血紅蛋白為底物時,Mg2+、Ca2+、Ni2+、Zn2+、Cd2+和K+對海參腸組織蛋白酶D有激活作用,Fe3+和Fe2+對海參腸組織蛋白酶D有抑制作用。研究表明,烏賊肝胰臟[15]和羅非魚肌肉組織蛋白酶D[13]的活性受多種金屬離子的影響,Mg2+、Ca2+、Ni2+、Zn2+和Cd2+對兩種來源的組織蛋白酶D均具有激活能力,Fe3+則對兩種來源的組織蛋白酶D的活性具有抑制能力,與本研究結果相一致。
2.2.4 抑制劑對酶活性的影響 抑制劑對海參腸組織蛋白酶D活性的影響如表2所示,天冬氨酸蛋白酶抑制劑Pepstatin A,半胱氨酸蛋白酶抑制劑E-64和IAA在相應的濃度下,均可顯著抑制海參腸組織蛋白酶D的活性(p<0.05)。

表2 抑制劑對海參腸組織蛋白酶D活性的影響Table 2 Effects of inhibitor on cathepsin D from guts of sea cucumber
注:*與空白對照組比較,具有顯著差異(p<0.05)。
但是,5 mmol/L絲氨酸蛋白酶抑制劑PMSF對海參腸組織蛋白酶D無顯著抑制作用。Jamdar等[27]在研究雞腸道中純化的天冬氨酸蛋白酶時發現,10 μmol/L Pepstatin A可完全抑制雞腸道組織蛋白酶D的活性,1 mmol/L PMSF可抑制該組織蛋白酶D的部分活性,10 μmol/L E-64則對該組織蛋白酶D無任何影響;Rafik等[15]研究烏賊肝胰腺組織蛋白酶D時發現,1.5 μmol/L Pepstatin A可完全抑制該酶活性,1 mmol/L E-64和1 mmol/L IAA可分別抑制該酶部分活性,而5 mmol/L PMSF則無任何影響;Jiang等[29]在比較鯖魚和遮目魚肌肉組織蛋白酶D的性質時發現,1.46 μmol/L Pepstatin A可完全抑制兩種魚肌肉組織蛋白酶D的活性,1 mmol/L IAA和1 mmol/L PMSF均可抑制鯖魚和遮目魚肌肉組織蛋白酶D 的部分活性。Jiang等[13]認為來自不同動物組織的組織蛋白酶D水解牛血紅蛋白的活性均可受到Pepstatin A的抑制,本研究有類似的結果。但在本研究中Pepstatin A并沒有完全抑制海參腸組織蛋白酶D的活性,可能是由于本研究中使用的是海參腸組織蛋白酶D的粗酶。粗酶中可能含有一些其他的酶類,Pepstatin A對這些酶類沒有抑制作用或者抑制作用較弱,因此出現了未完全抑制的現象。
3 結論
本研究所確定的海參腸組織蛋白酶D的提取條件為,在4 ℃,利用50 mmol/L pH3.0 Glycine-HCl緩沖液,按1∶6的料液比(w/v)浸提1 h;海參腸組織蛋白酶D的酶學性質研究表明,該酶水解酸變性牛血紅蛋白的最適pH為3.0,最適溫度為50 ℃,在pH3.0~7.0,4~40 ℃的范圍內活性較為穩定;金屬離子Fe3+和Fe2+可抑制該酶活性,Mg2+、Ca2+、Ni2+、Zn2+、Cd2+和K+對該酶有激活作用;蛋白酶抑制劑E-64、碘乙酸和Pepstatin A均可顯著抑制海參腸組織蛋白酶D粗酶的活性。在本研究條件下提取獲得的海參腸組織蛋白酶D粗酶是一種酸性蛋白酶,其組成以天冬氨酸蛋白酶為主。
[1]朱蓓薇. 海珍品加工理論與技術的研究[M]. 北京:科學出版社,2010:3-4.
[2]Wu H T,Li D M,Zhu B W,et al. Proteolysis of noncollagenous proteins in sea cucumber,Stichopusjaponicus,body wall:characterization and the effects of cysteine protease inhibitors[J]. Food Chemistry,2013,141(2):1287-1294.
[3]Qi H,Dong X P,Cong L N,et al. Purification and characterization of a cysteine-like protease from the body wall of the sea cucumberStichopusjaponicus[J]. Fish Physiology and Biochemistry,2007,33(2):181-188.
[4]Zhu B W,Zhao L L,Sun L M,et al. Purification and characterization of a cathepsin L-like enzyme from the body wall of the sea cucumberStichopusjaponicus[J].Bioscience,Biotechnology,and Biochemistry,2008,72(6):1430-1437.
[5]Zhu B W,Yu J W,Zhang Z S,et al. Purification and partial characterization of an acid phosphatase from the body wall of sea cucumberStichopusjaponicus[J]. Process Biochemistry,2009,44(8):875-879.
[6]Sun L M,Zhu B W,Wu H T,et al. Purification and characterization of cathepsin B from the gut of the sea cucumber(Stichopusjaponicas)[J]. Food Science and Biotechnology,2011,20(4):919-925.
[7]Wu H T,Li D M,Zhu B W,et al. Characterization of acetylcholinesterase from the gut of sea cucumberStichopusjaponicus[J]. Fisheries Science,2013,79(2):303-311.
[8]Wu H T,Li D M,Zhu B W,et al. Purification and characterization of alkaline phosphatase from the gut of sea cucumberStichopusjaponicus[J]. Fisheries Science,2013,79(3):477-485.
[9]張志林,肖蓉,李慶偉. 組織蛋白酶D的功能多樣性[J]. 中國生物化學與分子生物學報,2014(7):647-654.
[10]Wright L M,Levy E S,Patel N P,et al. Purification and characterization of cathepsin D from normal human breast tissue[J]. The Protein Journal,1997,16(3):171-181.
[11]Gubensek F,Barstow L,Kregar I,et al. Rapid isolation of cathepsin D by affinity chromatography on the immobilized synthetic inhibitor[J]. FEBS Letters,1976,71(1):42-44.
[12]Canduri F,Ward R J,Wf D A J,et al. Purification and partial characterization of cathepsin D from porcine(Susscrofa)liver using affinity chromatography[J]. IUBMB Life,1998,45(4):797-803.
[13]Jiang S T,Wang J H,Chen C S. Purification and some properties of calpain II from tilapia muscle(TilapianiloticaXTilapiaaurea)[J]. Journal of Agricultural & Food Chemistry,1991,39(2):237-241.
[14]Wang P A,Stenvik J,Larsen R,et al. Cathepsin D from Atlantic cod(Gadusmorhua,L.)liver. Isolation and comparative studies[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,2007,147(3):504-511.
[15]Balti R,Hmidet N,Jellouli K,et al. Cathepsin D from the Hepatopancreas of the Cuttlefish(Sepiaofficinalis):Purification and Characterization[J]. Planta,1973,109(4):293-306.
[16]Merino V,Kumar N S. Isolation,affinity purification and biochemical characterization of a lysosomal cathepsin D from the deuterostomeAsteriasrubens[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,2012,161(3):240-246.
[17]Anson M L. The estimation of pepsin,trypsin,papain,and the cathepsin with hemoglobin[J]. Journal of General Physiology,1938,22(1):79-89.
[18]Lowry O H,Rosebrough N J,Farr A L,et al. Protein measurement with the Folin phenol reagent[J]. Journal of Biological Chemistry,1951,193(1):265-275.
[19]杜英. 海參腸乙酰膽堿酯酶的提取、純化及其特性研究[D].大連:大連工業大學,2011:14-15.
[20]Komai T,Kawabata C,Amano M,et al. Todarepsin,a new cathepsin D from hepatopancreas of Japanese common squid(Todarodespacificus)[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,2004,137(3):373-382.
[21]Stoknes I,Rustad T. Purification and characterization of a multicatalytic proteinase from Atlantic salmon(Salmosalar)muscle[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,1995,111(4):587-596.
[22]Doke S N,Ninjoor V,Nadkami G B. Characterization of Cathepsin D from the Skeletal Muscle of Fresh Water Fish[J]. Bioscience,Biotechnology,and Biochemistry,1980,44(7):1521-1528.
[23]Jiang S T,Nei F P,Chen H C,et al. Comparative study on the cathepsin D from banded shrimp(Penaeusjaponicus)and grass shrimp(Penaeusmonodon)[J]. Journal of Agricultural & Food Chemistry,1992,40(6):961-966.
[24]Goldman-Levkovitz S,Rimon A,Rimon S. Purification properties and specificity of cathepsin D fromCyprinuscarpio[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,1995,112(1):147-151.
[25]Krause J,Tshidino S C,Ogawa T,et al. Purification andpartial characterization of ostrich skeletal muscle cathepsin D and its activity during meat maturation[J]. Meat Science,2011,87(3):196-201.
[26]Venugopal A,Kumar N S. Biochemical characterization of cathepsin D from the musselLamellidenscorrianus[J]. Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,2014,169(1):25-30.
[27]Jamdar S N,Harikumar P. Purification,Identification and Characterization of Aspartic Proteases of Chicken Intestine[J]. Journal of Food Biochemistry,2015,40(4):451-462.
[28]Draper A M,Zeece M G. Thermal Stability of Cathepsin D[J]. Journal of Food Science,1989,54(6):1651-1652.
[29]Jiang S T,Her Y H,Lee J J,et al. Comparison of the Cathepsin D from Mackerel(Scomberaustralasicus)and Milkfish(Chanoschanos)Muscle[J]. Bioscience Biotechnology & Biochemistry,1993,57(4):571-577.
ExtractionandcharacterizationofcathepsinD
fromseacucumber(Stichopusjaponicus)guts
GUOXiao-kun,LIAo-ting,HANJia-run,DUYi-nan,GUOTian-min,YUCui-ping,TANGYue,WUHai-tao*
(School of Food Science and Technology,Dalian Polytechnic University,National Engineering Research Center of Seafood,Dalian 116034,China)
TS254
A
1002-0306(2017)18-0135-06
2017-02-13
郭曉坤(1990-),男,碩士研究生,研究方向:食品生物技術,E-mail:gxkzy2016@126.com。
*通訊作者:吳海濤(1980-),女,博士,副教授,研究方向:食品生物技術,E-mail:wht205@163.com。
國家自然科學基金資助項目(31370037);遼寧省教育廳科學研究一般項目(L2015050);大連市高層次人才創新支持計劃項目(2015R083)。
10.13386/j.issn1002-0306.2017.18.026

