光譜法研究高良姜素與人血清白蛋白的相互作用
, , , ,,*
(1.山西醫科大學基礎醫學院,山西太原 030001;2.山西醫科大學藥學院,山西太原 030001)
光譜法研究高良姜素與人血清白蛋白的相互作用
薛燕斌1,2,喬華1,李波1,丁偉1,2,孫體健1,*
(1.山西醫科大學基礎醫學院,山西太原030001;2.山西醫科大學藥學院,山西太原030001)
在模擬生理條件下,采用熒光猝滅、同步熒光、三維熒光和圓二色譜,研究高良姜素與人血清白蛋白(HSA)之間的相互作用。結果表明:高良姜素對HSA有較強的熒光猝滅作用,且為靜態猝滅,結合過程中氫鍵和范德華力起主要作用。不同溫度下二者的結合常數(Ka)與結合位點數(n)分別為1.26×106L/mol、1.17(290.15 K),4.34×105L/mol、1.09(296.15 K),1.23×105L/mol、1.00(303.15 K),9.87×104L/mol、0.99(310.15 K)。同步熒光、三維熒光和圓二色譜顯示高良姜素與HSA作用時更靠近色氨酸殘基,使其周圍的疏水性減弱,而對蛋白構象影響較小。
高良姜素,人血清白蛋白,相互作用,同步熒光光譜,三維熒光光譜,圓二色譜
Abstract:Under the imitated physiological condition,the interaction between galangin and human serum albumin(HSA)was studied by fluorescence quenching,synchronous fluorescence,three-dimensional fluorescence and circular dichroism spectra. The results suggested that galangin had a strong ability to quench the HSA fluorescence in a static mode,during which hydrogen bond and Van Edward force played dominant roles. The binding constants(Ka)and site numbers(n)obtained at different temperatures were 1.26×106L/mol,1.17(290.15 K),4.34×105L/mol,1.09(296.15 K),1.23×105L/mol,1.00(303.15 K),9.87×104L/mol,0.99(310.15 K),respectively. Spectra of synchronous fluorescence,three-dimensional fluorescence and circular dichroism revealed that galangin interacted with tryptophan residues in BSA more strongly than with tyrosine residues,and the vicinity of tryptophan residues was less hydrophobic. However,conformational changes of HAS were slighter.
Keywords:galangin;human serum albumin;interaction;synchronous fluorescence spectra;three-dimensional fluorescence spectra;circular dichroism spectra
高良姜(AlpiniaofficinarumHance)是一種藥食同源中藥材,屬熱帶多年生姜科草本植物。高良姜素是從高良姜中提取的一種黃酮化合物[1],具有抗氧化[2]、抗腫瘤[3]等多種生物活性[4]而受到廣泛關注,有望開發為食品強化劑應用于醫藥領域。血清白蛋白是血液中含量最豐富的載體蛋白,參與外源性物質在體內的運送、分布、代謝及消除等過程,是生命活性物質發揮生物效應的重要載體和靶向分子[5]。目前,關于天然活性物質與血清白蛋白相互作用的研究已有大量文獻記載[6-8],但對于高良姜素與人血清白蛋白(HSA)相互作用的機理研究鮮有報道。本實驗采用熒光猝滅法研究高良姜素與HSA的結合作用,考察了結合反應的結合常數、結合位點數及結合熱力學參數,并利用同步熒光光譜、三維熒光光譜和圓二色譜探討了HSA在高良姜素作用下構象的變化,為進一步闡明高良姜素在人體內的儲存方式、傳輸機制及藥理作用等提供理論基礎。
1 材料與方法
1.1 材料與儀器
高良姜素標準品 薩恩化學技術有限公司,批號:EE230130,用10%乙醇溶液配制1.0×10-4mol/L儲備液,保存于4 ℃冰箱中備用;人血清白蛋白(HSA) 北京索萊寶科技有限公司,用pH7.4磷酸鹽緩沖溶液(簡稱PBS溶液)配制3.0×10-5mol/L儲備液,保存于4 ℃冰箱中備用;其它試劑 均為分析純;實驗用水 為Milli-Q超純水。
Cary Eclipse熒光光譜儀 美國Varian公司;MOS 500圓二色光譜儀 法國Bio-Logic公司;pHS-3C型酸度計 上海雷磁儀器廠。
1.2 實驗方法
1.2.1 樣品制備 在10 mL比色管中,依次加入1.0 mL HSA儲備液,適量PBS溶液,再加入不同體積高良姜素儲備液,并補充適當體積10%乙醇溶液(以使各溶液中乙醇含量相同),配制3.0×10-6mol/L HSA的PBS溶液及含不同濃度(0、0.6×10-6、0.8×10-6、1.0×10-6、2.0×10-6、3.0×10-6、4.0×10-6、5.0×10-6、6.0×10-6、7.0×10-6、8.0×10-6、9.0×10-6、10.0×10-6mol/L)高良姜素的PBS溶液。
1.2.2 熒光光譜 激發和發射狹縫寬度為5 nm,以HSA的最佳激發波長280 nm為激發光源,記錄各待測樣品溶液300~450 nm波長范圍熒光發射光譜,掃描步長1 nm,實驗溫度為290.15 K。
同步熒光光譜測定條件:激發光和發射光波長差(Δλ)分別固定在Δλ=15 nm和Δλ=60 nm,掃描步長1 nm,實驗溫度為290.15 K。
三維熒光光譜測定條件:HSA濃度為3.0×10-6mol/L;高良姜素濃度為10.0×10-6mol/L;熒光光譜儀的光源為氙弧燈;激發光波長范圍為200~500 nm;發射光波長范圍為200~500 nm;激發和發射狹縫寬度為5 nm;激發光波長掃描間隔為5 nm;掃描光譜儀自動校正,掃描步長1 nm,實驗溫度為290.15 K。采用Cary Eclipse軟件進行數據分析。
1.2.3 圓二色譜 室溫下,利用圓二色光譜儀測定各樣品在200~250 nm波長范圍的圓二色譜,比色皿厚度為1 cm,掃描速度60 nm/min,實驗溫度為290.15 K。
2 結果與分析
2.1 高良姜素對HSA的猝滅機理研究
2.1.1 高良姜素與HSA作用的熒光猝滅光譜 HSA分子會吸收紫外光并發射熒光,因此可以利用蛋白分子內源性熒光的變化,考察高良姜素與HSA的結合作用,結果如圖1所示。
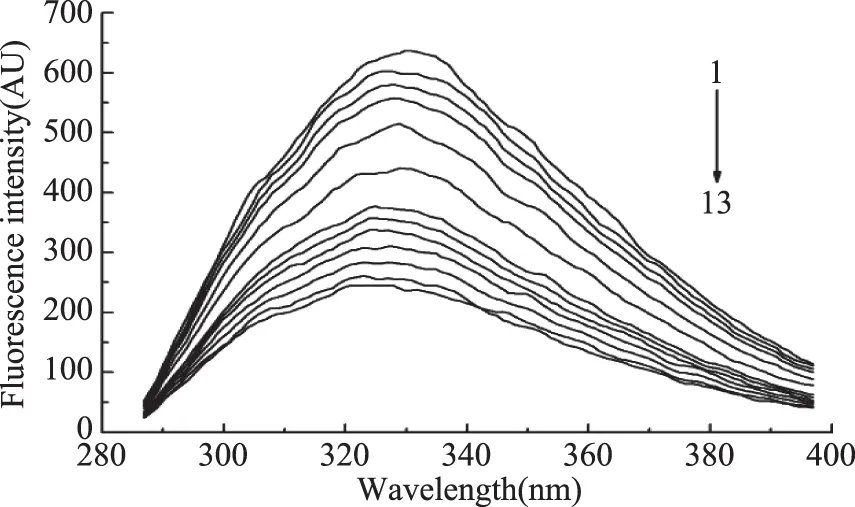
圖1 不同濃度高良姜素對HSA熒光光譜的影響Fig.1 Effect of galangin on fluorescence spectra of HSA注:曲線1~13表示高良姜素濃度分別為0、0.6×10-6、0.8×10-6、1.0×10-6、2.0×10-6、3.0×10-6、4.0×10-6、5.0×10-6、6.0×10-6、7.0×10-6、8.0×10-6、9.0×10-6、10.0×10-6 mol/L,圖3同。
由圖1可以看出,當高良姜素的濃度增大時,在HSA熒光猝滅的同時,熒光峰的峰位由330 nm藍移到323 nm,說明HSA與高良姜素之間的相互作用使得其表面氨基酸殘基周圍疏水性能及本身構象發生改變。
2.1.2 高良姜素對HSA的熒光猝滅機理 為了進一步闡明高良姜素對HSA的熒光猝滅機理,用Stern-Volmer方程[9]對測定數據進行分析。
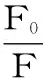
式(1)
式中:F0和F分別是未加入和加入高良姜素時HSA的熒光強度;KSV為動態猝滅常數;[Q]為高良姜素的濃度;Kq為雙分子猝滅速率常數;τ0為猝滅體不存在時熒光分子平均壽命。
作出F0/F-[Q]關系圖并計算出不同溫度下的動態猝滅常數,結果見圖2和表1。由圖2和表1可知,猝滅常數KSV隨著溫度的升高而減小,初步推斷猝滅機理為靜態猝滅過程。
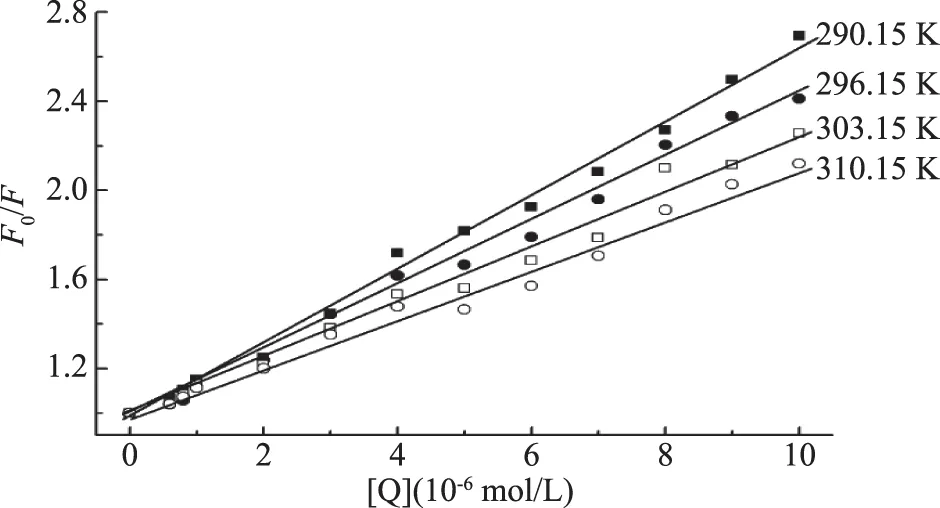
圖2 高良姜素與HSA作用的Stern-Volmer圖Fig.2 Stern-Volmer plots of the interaction between galangin and HSA
為驗證猝滅類型,依據方程(1)計算出Kq值(表1所示)。由于生物大分子熒光壽命約為10-8s,290.15 K時,Kq計算值為1.67×1013L/mol·s。而各類猝滅劑與生物分子的最大碰撞猝滅速率常數為2.0×1010L/mol·s[9],表明高良姜素對HSA的猝滅過程常數大于擴散控制的速率常數,所以高良姜素對HSA的猝滅屬靜態猝滅,即高良姜素與HSA在基態時形成了復合物,并且生成的高良姜素-HSA復合物不發光,會與未反應的HSA競爭吸收激發光,從而降低了HSA的熒光強度。
2.1.3 結合常數和結合位點數 靜態猝滅的結合常數Ka由修正的Stern-Volmer方程[7]計算而得:
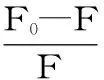
式(2)

表1 不同溫度下高良姜素與HSA作用的猝滅常數Table 1 Quenching constants for the interaction of galangin with HSA at different temperatures
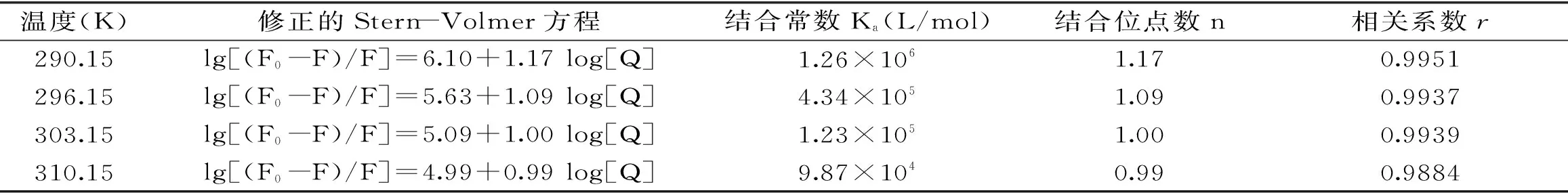
表2 不同溫度下高良姜素與HSA作用的結合常數Ka和結合位點數nTable 2 Binding constants(Ka)and site numbers(n)for the interaction of galangin with HSA at different temperatures
式中:F0和F分別是未加入和加入高良姜素時HSA的熒光強度;Ka為結合常數;n為結合位點數;[Q]為高良姜素的濃度;計算結果列于表2。
表2結果表明,Ka隨溫度升高逐漸減小,說明溫度升高時高良姜素與HSA形成復合物的穩定性降低。同時,表2顯示n都在1附近,說明高良姜素與HSA結合時是1∶1結合;但隨溫度升高,n逐漸減小,說明溫度升高,高良姜素與HSA結合程度降低。
2.1.4 高良姜素與HSA的結合作用力研究 為了考察高良姜素與HSA的結合作用力,可以通過計算結合的熱力學常數進行預測。在溫度變化不大時,可以近似認為反應的焓變(ΔH)為常數,根據熱力學參數間的關系式式(3)~式(5)[10]:
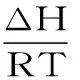
式(3)
ΔG=-RTlnKa
式(4)
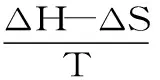
式(5)
分別計算得到ΔH,熵變(ΔS)和吉布斯自由能變(ΔG)。式中:Ka為結合常數;R為氣體摩爾常數;ΔH、ΔS及ΔG計算結果見表3。
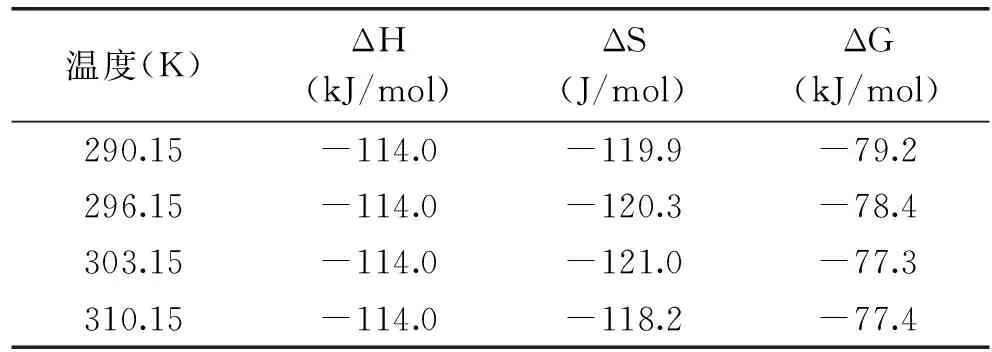
表3 不同溫度下高良姜素與HSA作用的熱力學參數Table 3 Thermodynamic parameters for the interaction of galangin with HSA at different temperatures
依據Ross與Subramanian利用小分子與生物大分子反應的熱力學參數的變化判斷其作用力類型的規律[11],即當ΔS>0,ΔH>0為典型的疏水作用力;ΔS<0,ΔH<0為氫鍵和范德華力;當ΔS>0,ΔH<0時為靜電作用力。表3顯示,高良姜素與BSA結合時氫鍵和范德華力起主要作用。
2.2 高良姜素對HSA構象的影響
2.2.1 同步熒光光譜 同步熒光光譜能夠提供蛋白質分子中酪氨酸殘基和色氨酸殘基的特征信息,可用于蛋白構象變化的分析。當Δλ=15 nm時只反映酪氨酸殘基的熒光,當Δλ=60 nm時僅反映色氨酸殘基的熒光[12],實驗結果如圖3所示。
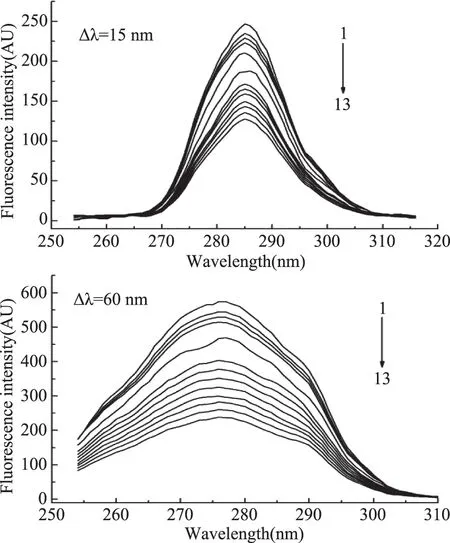
圖3 不同濃度高良姜素對HSA同步熒光光譜的影響Fig.3 Effect of galangin on synchronous fluorescence spectra of HSA
圖3顯示,加入高良姜素,酪氨酸殘基熒光發射峰保持不變,而色氨酸殘基發射峰由276 nm紅移至278 nm,說明酪氨酸殘基周圍的疏水微環境沒有改變,但色氨酸殘基周圍的疏水性有所降低,表明高良姜素與HAS結合后使得HAS的構象發生改變,但變化不大。同時,HSA的同步熒光峰強度都降低,但降低的幅度不同,說明兩種殘基與高良姜素的作用程度不同。高良姜素對HSA同步熒光的猝滅百分率由公式(6)[12]計算:
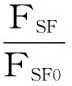
式(6)
式中:FSF0和FSF分別為未加入和加入高良姜素時的同步熒光強度。計算結果如圖4所示。
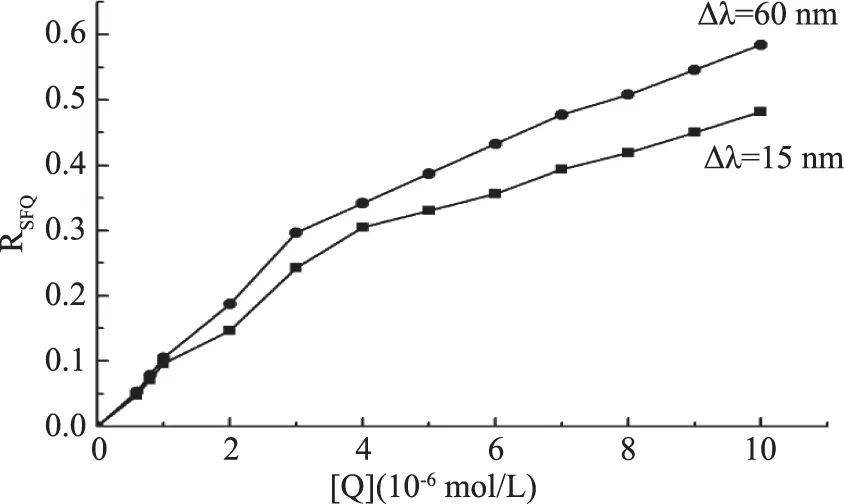
圖4 高良姜素對HSA同步熒光光譜的猝滅百分率Fig.4 Quenching percentage of galangin on synchronous fluorescence intensity of HSA
由圖4可知,隨高良姜素濃度增大,酪氨酸和色氨酸殘基的熒光強度都逐漸減小,同一濃度時,色氨酸殘基熒光強度降低幅度較酪氨酸殘基的降低幅度更大,表明高良姜素與HSA作用時更靠近色氨酸殘基。
2.2.2 三維熒光光譜 三維熒光光譜能更加全面地展現樣品的熒光信息,有利于綜合考查樣品的組分分布和構型變化,通常用等高線圖的形式描述[13]。高良姜素與HSA作用的三維熒光光譜如圖5所示。

圖5 HSA及高良姜素-HSA的三維熒光圖譜Fig.5 Three-dimensional fluorescence spectra of HSA and galangin-HSA
圖5看出,HSA的三維熒光光譜中有兩個熒光峰,峰Ⅰ反映HSA的多肽骨架結構,峰Ⅱ反映酪氨酸和色氨酸殘基的疏水微環境[14]。從峰的位置看,加入高良姜素后,峰Ⅰ的激發和發射波長未發生移動,但峰Ⅱ的激發波長略顯紅移,發射波長略顯藍移;從峰的強度看,加入高良姜素,峰Ⅰ和峰Ⅱ都有不同程度降低,說明高良姜素對HAS的構象有影響但不顯著,與同步熒光結論一致。
2.2.3 圓二色譜 圓二色光譜可以簡單靈敏的地評價蛋白質構象變化[15]。高良姜素與HSA作用的圓二色譜如圖6所示。
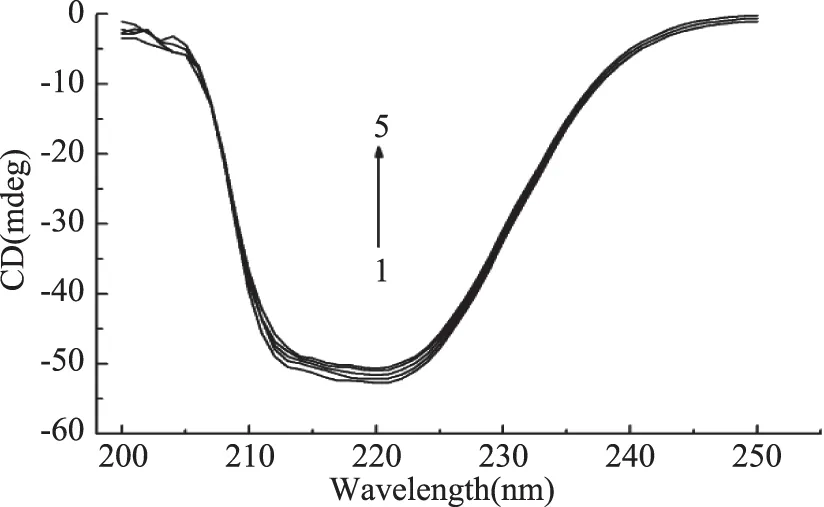
圖6 高良姜素對HSA圓二色譜的影響Fig.6 Effect of galangin on circular dichroism spectra of HSA注:曲線1~5表示高良姜素濃度分別為0、1.0×10-6、3.0×10-6、5.0×10-6、10×10-6 mol/L。
由圖6可以看出,HSA在210 nm和220 nm有兩個負槽,這是典型α-螺旋結構的特征表現。當加入高良姜素時,HSA的CD值減小(靠近0刻線),但形狀和肩峰的位置沒有改變。表明高良姜素的濃度逐漸增加時,能誘導HSA的二級結構發生微弱的變化。當加入0、1、3、5、10×10-6mol/L高良姜素時,依文獻[16]可計算出HSA的α-螺旋度分別為58.5%、57.0%、56.2%、55.3%、53.8%。結果表明高良姜素與HSA結合時改變了HSA的二級結構,但改變幅度不大。
3 結論
高良姜素與HSA之間通過范德華力和氫鍵產生了較強的結合作用,結合常數在106數量級,結合位點數約為1。高良姜素對HSA熒光猝滅過程是形成復合物的靜態猝滅,在形成復合物時更靠近色氨酸殘基,使其周圍的疏水性減弱,但對蛋白的構象影響不大。
[1]Huang HZ,Chen AY,Rojanasakul Y,et al. Dietary compounds galangin and myricetin suppress ovarian cancer cell angiogenesis[J]. Journal of Functional Foods,2015,15:464-475.
[2]Kim YR,Kim MA,Cho HJ,et al. Galangin prevents aminoglycoside-induced ototoxicity by decreasing mitochondrial production of reactive oxygen species in mouse cochlear cultures[J]. Toxicology Letters,2016,245:78-85.
[3]許奕夫,姚鑫. 高良姜素抑制乳腺癌轉移作用機制研究[J]. 中草藥,2016,47(10):1731-1738.
[4]張旭光,尹航,陳峰,等. 高良姜素藥理活性的研究進展[J]. 中國現代中藥,2016,18(11):1532-1536.
[5]Paul BK,Samanta A,Guchhait N. Exploring hydrophobic subdomain IIA of the protein bovine serum albumin in the native,intermediate,unfolded,and refolded states by a small fluorescence molecular reporter[J]. Journal of Physical Chemistry B,2010,114:6183-6196.
[6]黃漢昌,姜招峰. 蘆丁與人血清白蛋白相互作用的紫外可見光譜特性研究[J]. 天然產物研究與開發,2011,23(3):476-481.
[7]姚惠芳,景浩. 篤斯越橘花青素與牛血清白蛋白的相互作用[J]. 食品科學,2013,34(23):6-10.
[8]欒強,譚鳳芝,徐同寬,等. 氯化血紅素與牛血清白蛋白作用的光譜性質研究[J]. 食品工業科技,2007,28(11):72-75.
[9]Zhang GW,Ma YD,Wang L,et al. Multispectroscopic studies on the interaction of maltol,a food additive,with bovine serum albumin[J]. Food Chemistry,2012,133:264-270.
[10]Rasoulzadeh F,Najarpour H,Naseri A,et al. Fluorescence quenching study of quercetin interaction with bovine milk xanthine oxidase[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2009,72:190-193.
[11]Li DJ,Zhu JF,Jin J,et al. Studies on the binding of nevadensin to human serum albumin by molecular spectroscopy and modeling[J]. Journal of Molecular Structure,2007,846:34-41.
[12]Wang ZQ,Li JS,Wang J,et al. Spectrometry researches on interaction and sonodynamic damage of riboflavin(RF)to bovine serum albumin(BSA)[J]. Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2012,87:1-10.
[13]Qiao H,Zhang SW,Wang W. Fluorescence spectroscopic and viscosity studies of hydrogen bonding in Chinese Fenjiu[J]. Journal of Bioscience and Bioengineering,2013,115:405-411.
[14]Li T,Cheng ZJ,Cao LJ,et al. Comparison of interactions between three food colorants and BSA[J]. Food Chemistry,2016,194:740-748.
[15]裴明硯,鄭學仿,曹洪玉,等. 3-溴丙酮酸與人血清白蛋白相互作用的光譜學研究[J]. 分析化學,2010,38(7):948-952.
[16]Shahabadi N,Maghsudi M,Rouhani S. Study on the interaction of food colourant quinoline yellow with bovine serum albumin by spectroscopic techniques[J]. Food Chemistry,2012,135:1836-1841.
Spectroscopicanalysisofinteractionbetweengalanginandhumanserumalbumin
XUEYan-bin1,2,QIAOHua1,LIBo1,DINGWei1,2,SUNTi-jian1,*
(1.School of Basic Medicine,Shanxi Medical University,Taiyuan 030001,China; 2.College of Pharmacy,Shanxi Medical University,Taiyuan 030001,China)
TS202.3
A
1002-0306(2017)18-0065-05
2017-02-23
薛燕斌(1991-),男,碩士研究生,研究方向:天然產物化學,E-mail:xueyb2015@126.com。
*通訊作者:孫體健(1960-),女,大學本科,教授,研究方向:天然產物化學及藥物分析,E-mail:suntijian@126.com。
山西省自然科學基金(2015011024)。
10.13386/j.issn1002-0306.2017.18.013

