扦插環境對平歐雜種榛黃化萌條生根效果的影響
田雪鄰,宋鋒惠,古麗米熱·卡克什,史彥江,馬合木提·阿不來提,李嘉誠,張晉
(1.新疆農業大學林學與園藝學院,新疆烏魯木齊,830052;2.新疆林業科學院經濟林研究所,新疆烏魯木齊,830000)
扦插環境對平歐雜種榛黃化萌條生根效果的影響
田雪鄰1,2,宋鋒惠2,古麗米熱·卡克什2,史彥江2,馬合木提·阿不來提2,李嘉誠1,張晉1
(1.新疆農業大學林學與園藝學院,新疆烏魯木齊,830052;2.新疆林業科學院經濟林研究所,新疆烏魯木齊,830000)
目的研究平歐雜種榛黃化萌條扦插的適宜環境及管理方式,為簡化扦插環境及田間管理提供理論依據。方法采用方差分析、相關性分析等方法,將黃化萌條置于3個環境下扦插管理,分析比較萌條抽梢生長、根系生長及根系質量等指標的差異。結果在不同環境下,扦插生長根系指標存在差異性;3個環境條件下以塑料大棚(A)葉綠素含量及根系綜合指標最佳,其次為榛子示范園行間(B),長山核桃大樹行間(C)最低,說明扦插管理對根系生長影響較大。B環境因光照充足,綜合根系指標高于C環境,但C環境抽梢生長及生根率指標較高,證明扦插中期土壤濕度增加可促進扦插生長,且土壤肥力同樣影響根系生長力;此外,黃化萌條與嫩枝扦插相比較,管理復雜度降低50%,且生根速率、生根率、根系質量等均提高。結論生產中應以A環境扦插生長為參考,扦插管理前期嚴格控溫控濕,后期逐步加大與外界環境的接觸面,大幅度降低了黃化萌條的扦插管理復雜度。
平歐雜種榛;黃化萌條;扦插環境;管理模式
0 引 言
【研究意義】平歐雜種榛(CorylusheterophyllaFisch.×CorylusavellanaL.)是平榛和歐洲榛雜交培育而成的高效栽培種,集雙親優勢基因,具果大豐產出仁率高,果實口味佳,抗寒適應性強等特點[1]。其榛仁富含蛋白質、脂肪、氨基酸、維生素、微量元素等,且鈣、磷、鐵含量高于其他堅果[2],為世界四大干果之一,此外,部分品種被廣泛作為植被恢復及荒坡綠化樹種[3],木材堅硬,紋理色澤美觀,具極大的經濟價值和生態效益。我國作為重要的榛屬資源國,在長江以北至N42°地區均可栽培,自1999年選育出平榛與歐洲榛的雜交品系(平歐雜種榛),全國多省區開展了不同規模的引種栽培區域試驗,現栽培面積已超2.67×104hm2,深受廣大生產者、消費者歡迎,成為農業種植結構調整的生態經濟林首選樹種。【前人研究進展】黃化萌條即是指萌條在生長發育過程中長時間未見光的當年生枝條,因缺乏光照而莖部泛黃且無葉片,不能合成葉綠素,故根莖端薄壁細胞含量增多[4],生根促進因子水平上升,生長素活性增大[5]。平歐雜種榛黃化萌條為綠枝壓條繁苗后在鋸末基質中根部萌生的弱勢苗,生長發育形成半木質化黃化萌條,萌條內因內源生長素運輸和外源生長素的吸收轉化水平提高,生長素在基部積累較多,進而生根率較高[4,6]。【本研究切入點】相關生根試驗發現,黃化萌條作為育苗扦插繁殖材料,較傳統嫩枝扦插生根率提高35%[6],生根能力升高。利用平歐雜種榛的黃化萌條扦插不僅能充分利用消耗母株營養而形成的萌條資源,為生產提供品種苗木。【擬解決的關鍵問題】研究管理簡易、低成本的平歐雜種榛黃化萌條扦插方法,采用3個不同扦插環境,統一扦插種植黃化萌條,采取全人工及半人工兩種方式管理,探究最佳扦插管理方式,并分析比較不同扦插環境下插條生長的差異,篩選最優種植及管理方式,為扦插管理提供有效科學依據。
1 材料與方法
1.1 材 料
試驗地位于新疆伊犁察布查爾縣榛子示范基地(E:81°8′,N:43°45′),年均溫10.3 ℃,年日照2 712 h,相對濕度較低,降雨量250 mm,晝夜溫差大。試驗設立3點扦插環境:塑料大棚(A)、榛子示范園行間(B)、長山核桃大樹行間(C)。A環境為人工搭建的3.0 m高的簡易塑料拱棚,面積約64 m2,拱棚覆蓋1層塑料膜和2層遮陽網;B環境為竹片搭建的高1.0 m簡易塑料小棚,處于榛子樹行間,榛子樹高1.3~1.8 m,冠幅0.7~1.2 m,光照充足;C環境與B環境搭建方式相同,于長山核桃樹行間,長山核桃樹高3~3.5 m冠幅1.5~2.5 m,遮蔭度高于B環境,土壤濕度相對較大。
以2015年秋季統一剪取并貯藏于地下的平歐雜種榛新榛1號(84~254#)品種的半木質化黃化萌條為材料,于2016年4月12日挖出,于陰涼處剪取中段10~12 cm、粗度0.35~0.45 mm、規格一致的萌條為扦插條,3個環境分別扦插300株插穗。
1.2 方 法
1.2.1 塑料大棚(A)
2016年4月16日進行扦插,扦插基質為壤土。先用800倍高錳酸鉀溶液消毒基質,然后清水沖洗2遍。以株行距10×30 cm打孔扦插,插條用100 mg/L的IBA(吲哚丁酸)生長激素中浸泡10 min,扦插深度為3~4 cm,并壓實周圍土壤,插后即刻澆水。
1.2.2 榛子示范園行間(B)、長山核桃大樹行間(C)
2016年4月15日B、C環境同時進行扦插,扦插基質為翻耕后的大田土壤。插行內地面鋪設滴灌帶、覆蓋黑色地膜。插條用100 mg/L的IBA(吲哚丁酸)浸泡10 min,株行距10 cm×30 cm,打孔扦插,扦插深度3~4 cm,并壓實周圍土壤,即刻澆水。之后以軟竹片搭建寬0.6 m,長20 m的東西走向簡易長型拱棚,棚上覆蓋一層塑料膜和兩層遮蔭網,固定。
1.2.3 管理
A環境條件下:采用全人工式管理,插后每日清晨08:00正門通風10 min,控制棚溫在20~30 ℃,濕度85%以上;午間棚內溫度≥25 ℃時,掀開棚正門塑料膜及南北方塑料膜通風,若溫度≥30 ℃時增加噴水降溫;30 d后,隨氣溫上升加大棚內通風量,掀開棚內東西方向塑料膜通風,床面噴水次數逐步改為加量減次,基質滲透深度5 cm為宜;60 d后,去除大棚上部塑料薄膜,逐步過渡至棚內濕度趨于外界空氣濕度時,依次摘除遮陽網。
B、C環境條件下:采用半人工式管理,自扦插之日起,每日當棚溫 ≥25 ℃時打開棚東西兩端塑料膜通風,溫度降低立即關閉,當棚內平均濕度小于60%滴灌(8 h);15 d后棚內溫度≥30 ℃時,將棚南北兩端塑料膜每隔2 m固定掀開30 cm高度通風,遮蔭網保持覆蓋狀態;隨氣溫上升,棚內溫度>33 ℃時,在塑料棚頂部兩側,每隔2 m將塑料膜割直徑20 cm的圓孔,加大棚內通風力度;55 d后去除塑料膜,60 d后摘除遮蔭網。
插后60 d,插條平均展葉數量達3片以上,每隔7 d噴施(2 g/L尿素+1.5 g/L磷酸二氫鉀+0.375 g/L氨基酸)葉面肥;待130 d扦條葉片自然脫落時起苗,調查插條生根效果。
1.3 數據處理
自扦插之日起,棚外及3個環境試驗棚內分別掛簡易的溫濕度觀測儀、扦插基質地表放地溫表,每日08:00、14:00、20:00定時觀察記錄棚外常溫及棚內溫濕度、地溫。扦插10 d起,選擇10株定苗,每5 d用直尺測量插條生根及抽梢長度;插條葉片脫落時,起苗調查統計插穗的一級根系數量指標:
扦插生根率=生根插條/插條總數量;根長≥0.5 cm為生根;
生根保存率=起苗后成活苗數量/插條總株數;
直尺測量根長、游標卡尺測量根莖;
生根范圍為插條生根面的最長截距;
飽滿芽數量即生根成活插條上飽滿芽數量;
采集3個環境0~30 cm深度的縱向土壤,梅花形采樣,每環境采5個點土樣,測定pH值、速效氮、速效磷、速效鉀含量。
用Microsoft Office Excel 軟件進行數據整理和繪圖,SPSS 19.0軟件進行數據統計,通過方差分析比較不同處理間的差異,并對各根系性狀指標做相關分析。
2 結果與分析
2.1 不同環境中溫度對根系生長的的影響
自扦插后,控制各環境遮蔭度在75%~85%,濕度≥85%,溫度20~30 ℃。研究表明,隨時間推移,扦插后3個黃化萌條扦插環境的棚溫、地溫趨于一致。扦插初期,以A環境的棚溫、地溫最高,其次為B、C環境;6月后逐漸降低遮蔭度及濕度,而3種環境的棚溫、地溫表現為快速接近趨勢,7~8月,不同環境皆去除塑料棚膜,插穗于外界環境條件下生長,而地溫高于外界1~2 ℃。圖1
研究表明,扦插10~15 d出現愈傷,20~25 d開始生長;扦插初期,處于愈傷組織和生根的初期,適于根系生理活動的最適范圍(20~25 ℃),此時根系吸收水分和礦質營養能力較弱,而穗條在高溫環境下,不能保證植株對水分和礦質營養的需求[7]。3個環境根系長度30 d前差異不顯著(P>0.05),30 d后A環境根系生長加快,B、C則保持原速率,B環境于50 d生長速率加快。結合溫度分析,不同環境的溫度對插穗初期生根影響較小,30 d后隨溫度的升高各環境插穗生長速率加快,由此說明溫度變化與根生長呈正比,適宜的溫度差有利于根系的生長。圖2

圖1 3種環境溫度差異
Fig.1 Analysis the three environmental temperature’s difference

圖2 3種環境根系生長動態
Fig.2 Root dynamic growth of three environments
2.2 不同種植環境對新梢生長的影響
研究表明,插后55~60 d抽梢生長,115 d停止。3個環境新梢生長量呈顯著差異(P<0.05),60 d后以A環境(5.0 cm)抽梢長度最佳,70 d(5.8 cm)速率降低,而C環境梢長升至最高(6.4 cm),結合C環境可知遮蔭環境下土壤濕度升高促進梢生長;至90 d,B環境生長量(5.95 cm)生長量超過A(5.9 cm),A環境在80 d后抽梢生長接近停止,可見B環境根系供養較多以致新梢生長時間較長,說明統一環境下土壤肥力同樣影響根系的活力,此外,B插條后期抽梢率較大,此現象可能與該環境半人工式管理灌水頻率低相關,相關研究發現,灌水力度對根系適應性存在較強相關性[8-9]。圖3,表1
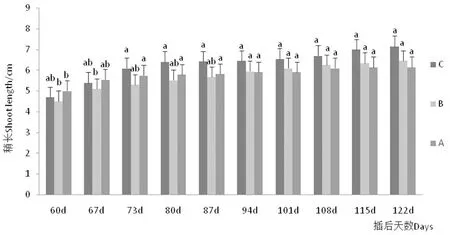
圖3 3種環境新梢生長動態
Fig.3 Branch growth dynamics of the three environments
表1 3個試驗地概況
Table 1 Soil specific profiles in three experimental sites

環境EnvironmentalpH土壤養分Soilnutrient(mg/kg)速效氮Availablenitrogen速效磷Availablephosphorus速效鉀AvailablepotassiumA7 6773 3319 0694 00B7 9160 8319 07135 17C7 6343 3319 22105 10
2.3 不同種植環境下葉綠素含量的差異
葉綠素含量是作為監測植被生長健康狀況的重要標志之一。葉綠素含量的高低是光合作用能力和植被發育階段的指示器[10],研究表明,3種環境在60、90和120 d三個時期葉綠素含量差異達極顯著水平,以A環境含量最高(32.4 mg/g),與最低含量(24.8 mg/g)差異達7.0 mg/g,6~7月外界溫度(圖1)及光照強度不斷上升,B、C環境葉綠素含量顯著增加,B環境增加達4 mg/g,A環境變化則較小,可見光照及溫度的增加可促進葉綠素含量的升高,有關研究發現,溫度通過影響葉片葉綠素含量而使內部碳同化酶活性降低,限制因素影響葉片光合作用[11]。7~8月,除C環境外各環境均增加2 mg/g,與該環境土壤環境結合分析,C環境土壤速效氮(43.33 mg/kg)含量最低,土壤中氮能促進蛋白質和葉綠素的形成[12],該環境土壤速效氮含量最低,故對葉綠素增長促進較小,加之遮蔭環境降低了植被發育階段增長速率。表2
2.4 不同扦插環境根系生長指標的差異
研究表明,生根數量、根長、根粗均顯著(P<0.05)或極顯著(P<0.01)正相關。其中,生根數量和根長、根粗的相關系數分別為0.69和0.67,根長和根粗的相關系數為0.73,三者變化趨勢一致,說明根據某一指標的高低,可以在一定程度上預測另外2種指標的情況;飽滿芽數是第二年插條成活率及苗木壯苗的重要指標[13],飽滿芽數與各指標均表現顯著正相關,可見根系的質量直接影響第二年的苗木生長,根系生根范圍對于生根密度的增加起推動效果,生根范圍的值增加,生根數量則顯著增加,且生根粗度小幅度增加,但對根長、根部地徑、飽滿芽數影響則較小。可見,隨生根數量增加,根系指標表現為顯著提升,而各指標的增加進一步促進飽滿芽數的增加,從而促進苗木第二年的長勢。表3
表2 3個不同環境葉綠素含量差異
Table 2 Analysis of chlorophyll contents in three difference environments (mg/g)
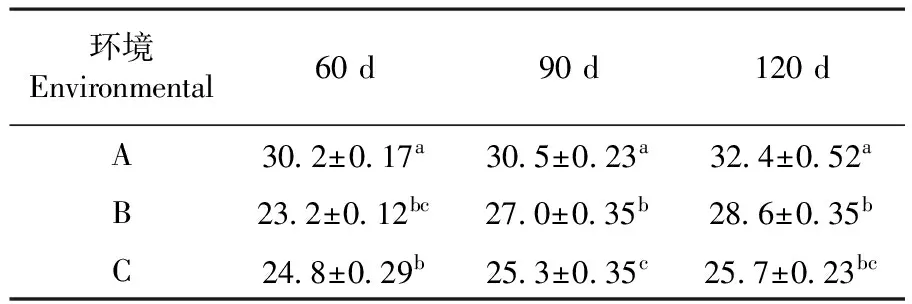
環境Environmental60d90d120dA30 2±0 17a30 5±0 23a32 4±0 52aB23 2±0 12bc27 0±0 35b28 6±0 35bC24 8±0 29b25 3±0 35c25 7±0 23bc
注:不同小寫字母分別表示差異顯著(P<0.05)
Note: The small and capital letters represent significant difference at 0.05
表3 根系指標間相關性
Table 3 Correlation analysis of root index

生根數量Rootingquantity根長Rootlength根粗Rootdiameter生根范圍Rootingrange根部地徑Rootdiameter飽滿芽數Fullbudnumber生根數量Rootingquantity1根長Rootlength0 69?1根粗Rootdiameter0 67?0 73?1生根范圍Rootingrange0 68?0 200 481根部地徑Rootdiameter0 550 590 95??0 281飽滿芽數Fullbudnumber0 72?0 84??0 97??0 350 89??1
注:表中*表示相關性達0.05顯著水平;**表示相關性達0.01顯著水平
Note:*Correlation is significant at 0.05 level(2-tailed);**Correlation is significant at 0.01 level(2-tailed)
研究表明,3個不同環境間各根系指標除根部地徑外其余指標存在極顯著差異(P<0.05);其中,3環境生根率以A環境較高(90.86 %),半人工管理則以C環境較高(77.92 %),由此可推知控制管理濕度對生根率影響較大;生根條數、根長、根粗均以A環境最佳,分別為3.21 條、17.51 cm、1.41 mm,C環境最低,分別為2.63 條、11.61 cm、1.21 mm,從環境角度分析,前期的溫濕度管理對根系質量影響較大,氣溫通過地溫間接地影響植物的生長發育特性,而后期若土壤濕度較大會抑制根系生長。不同環境指標僅根部地徑差異不顯著,可見不同環境插條根部粗度變化量較小;飽滿芽數作為根系繁殖力的重要指標,不僅能增強枝力,在根系生長中產生激素促進根的生長[14-15],3環境以A環境飽滿芽數最適宜(2.77 個),且與根系各指標呈正相關,其最大值高達其余環境的2倍,A環境根系繁殖力顯著高于其他環境,其次為B環境,但其成活率較低,說明提高成活率仍然需要高度控溫控濕;C環境各項指標均較低,該環境因具一定遮蔭,溫度均值低于其他環境,而扦插后期根系的發展需要充足光照,地溫則直接影響植物的根部,從而影響到整個植株的生長發育,與B環境產生差異原因可能是光照。表4
表4 3環境根系生長指標的差異性分析
Table 4 Analysis of the growth index difference of the three environments
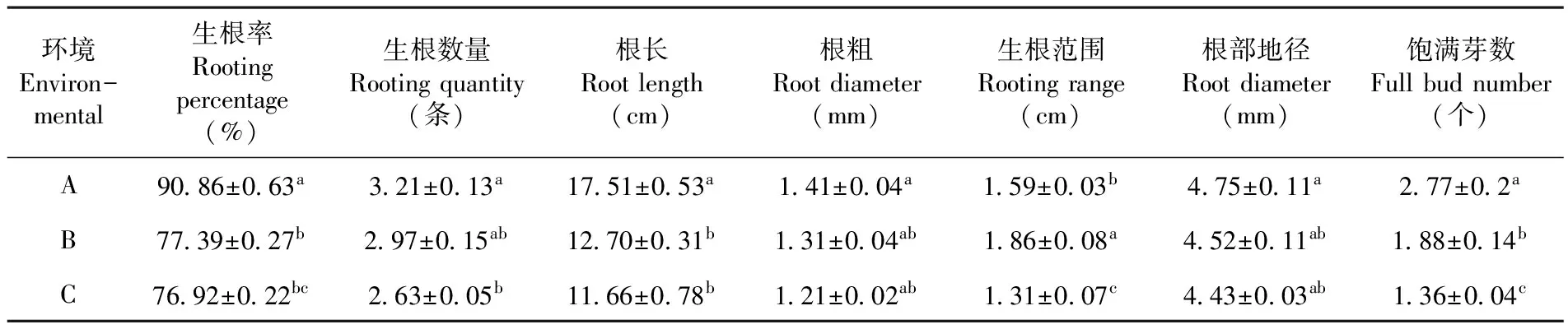
環境Environ-mental生根率Rootingpercentage(%)生根數量Rootingquantity(條)根長Rootlength(cm)根粗Rootdiameter(mm)生根范圍Rootingrange(cm)根部地徑Rootdiameter(mm)飽滿芽數Fullbudnumber(個)A90 86±0 63a3 21±0 13a17 51±0 53a1 41±0 04a1 59±0 03b4 75±0 11a2 77±0 2aB77 39±0 27b2 97±0 15ab12 70±0 31b1 31±0 04ab1 86±0 08a4 52±0 11ab1 88±0 14bC76 92±0 22bc2 63±0 05b11 66±0 78b1 21±0 02ab1 31±0 07c4 43±0 03ab1 36±0 04c
注:不同小寫字母分別表示差異顯著(P<0.05)
Note: The small and capital letters represent significant difference at 0.05
3 討 論
與該品種嫩枝扦插相比較,平歐雜種榛黃化萌條扦插生根速率、生根率、根系質量均較高,嫩枝扦插因留有葉片,管理前期葉片表面須保持一層水膜,噴水力度大頻率高,即使生根后葉面水分須保持有1/3,此外管理期間溫度低生根慢,溫度太高致葉片失水脫落,死亡率增加,管理復雜度較高,而黃化萌條扦插管理濕度僅控制在85 %以上,溫度25 ℃左右即可,管理復雜度直線降低[6]。
黃化萌條統一規格扦插于A、B、C環境,抽梢生長、葉綠素含量、生根率、根系指標等呈顯著差異。相關研究發現,不同土壤濕度對根系生長速度的影響非常顯著[16]。一定范圍內,根系生長與土壤水分狀況呈正相關[17],且側根發生部位受不同深度土壤含水量的影響[18-19],但水分量過高時,根系活力反而下降,進而影響根系生長,3環境以B環境具遮蔭土壤濕度較高,新梢生長及生根率指標偏高,但因樹下插條的吸光度降低,致其葉綠素含量及根系生長評價指標降低,光照對扦插尤為重要,但扦插中期增加土壤濕度可促進生根及梢生長。
對3環境根系比較發現,3環境以塑料大棚(A)環境條件下根系綜合指標最佳,其次為B環境,C環境最低,由此說明扦插管理模式對根系生長影響較大,此結論與之前多數扦插生根管理結論一致[20-21]。A環境因全程人工控溫控濕,環境條件為萌條扦插最適值,生根率及成活率達其余兩環境1/3倍;B環境與C環境管理方式相同,但B環境因光照充足,綜合根系指標高于C環境;相關研究發現,當環境日均溫小于18 ℃時不適插條生根,日均溫最利于根系生長,故溫度過低或過高均不利生長。
4 結 論
4.1 黃化萌條扦插與傳統嫩枝扦插生根(30 d)相比,很大程度上降低了管理復雜度。該萌條生根條件前期要求較高,溫濕度過低或過高則影響其生長,且土壤養分同為重要影響因子。
4.2 3個環境以A環境下嚴格人工調控光強、空氣濕度、溫度等因素插條的根系生長最快,生根效果最佳。
4.3 生產實踐中應以A環境為參照,插后0~55 d于塑料大棚環境條件下,人工管理控溫控濕,55~60 d后僅控制土壤濕度,逐步通風透光,增加光照面積,轉移至外界環境,減少人工管理時間,由此可大幅度降低平歐雜種榛黃化萌條扦插的管理成本,實現黃化萌條的合理利用。
References)
[1] 趙娣. 我國東北野生榛子種質資源調查及選優[D]. 北京: 北京林業大學碩士學位論文, 2013.
ZHAO Di. (2013).InvestigationandselectionofwildhazelnutgermplasmresourcesinNortheastChina[D]. Master Thesis. Beijing Forestry University, Beijing. (in Chinese)
[2] 趙明慧, 姜子濤, 劉韜, 等. 平榛葉中黃酮類化合物成分的研究[J]. 現代食品科技, 2014, 30(12): 235-240.
ZHAO Ming-hui, JIANG Zi-tao, LIU Tao, et al. (2014). A study on flavonoids from leavrs of Corylus heterophylla Fish.[J].ModernFoodScienceandTechnology, 30(12):235-240. (in Chinese)
[3] 王艷梅, 馬天曉, 翟明普. 榛子遺傳改良研究進展[J]. 經濟林研究, 2007, 25(1): 70-74.
WANG Yan-mei, MA Tian-xiao, ZHAI Ming-pu. (2007). Research progress on genetic improvement of hazelnut [J].ForestResearch, 25(1):70-74. (in Chinese)
[4] 孫文全. 黃化作用與插條生根[J]. 植物生理學通訊, 1990,(4): 77-80.
SUN Wen-quan. (1990). Yellowing and rooting of cuttings [J].PlantPhysiologyNewsletter, (4):77-80. (in Chinese)
[5] Muir RM,Zhu L. (1983).Physiolplant[M]. (57): 407.
[6] 董寧光, 齊建勛, 陳永浩, 等. 沙藏埋枝處理對促進平歐雜種榛綠枝扦插生根的機制分析[J]. 果樹學報, 2016, 33(12): 1 510-1 516.
DONG Ning-guang, QI Jian-xun, CHEN Yong-hao, et al. (2016). Physiological and biochemical basis of hazelnut rhizogenesis promoted by embedded stock etiolation [J].JournalofFruitScience, 33(12):1,510-1,516. (in Chinese)
[7] 朱瑞宏, 丁永川, 郭琪玖. 日光溫室冬茬黃瓜冷凍害及其防治[J]. 中國蔬萊, 2000,(1): 42-43.
ZHU Rui-hong, DING Yong-chuan, GUO Qi-jiu. (2000). Prevention and control the Cold damage of Winter Cucumber in solar greenhouse [J].Chinesevegetable.(1): 42-43. (in Chinese)
[8] 楊小林, 張希明, 李義玲, 等. 塔克拉瑪干沙漠腹地幾種植物根系分形特征[J]. 干旱地理, 2009, 32(2): 249-254.
YANG Xiao-lin, ZHANG Xi-Ming, LI Yi-ling, et al. (2009). Root fractal characteristics at the hinterland of Taklimakan Desert [J].AridLandGeography, 32(2): 249-254. (in Chinese)
[9] 楊傳杰, 羅毅, 孫林, 等. 水分脅迫對覆膜滴灌棉花根系活力和葉片生理的影響[J]. 干旱區研究, 2012, 29(5): 802-810.
YANG Chuan-jie, LUO Yi, SUN Lin, et al. (2012). Effect of water stress on root vigor and leaf physiology of cotton under mulch drip irrigation [J].AridRegionStudies, 29(5): 802-810. (in Chinese)
[10] Minohac L. ChlorophyⅡ SPAD-502 Instruction Manual [A]. Tokyo: Radiometric Instruments Operations, 1989:17.
[11] 馮玉龍, 姜淑梅. 根系溫度對甜椒生理特征的影響[J]. 植物生理學通訊, 2000, 36(4): 308-311.
FENG Yu-long, JIANG Shu-mei.(2000)Effects of root temperature on physiological characteristics of sweet pepper [J].PlantPhysiologyNewsletter, 36(4): 308-311. (in Chinese)
[12] 戴靜, 康宇. 氮磷鉀配施對玉米主要性狀和產量的影響及其施肥規律[J]. 山西農業科學, 2007, 35(10): 62-64.
DAI Jing, KANG Yu. (2007). Influence of matching phosphate fertilizer with potash fertilizer on corns main property and output [J].JournalofShanxiAgriculturalSciences, 35(10): 62-64. (in Chinese)
[13] 郭俊杰, 李紅玉.核桃芽接育苗技術[J]. 河南林業科技, 2007, 27(1): 51-52.
GUO Jun-jie, LI Hong-yu. (2007). Walnut budding seedling technology [J].JournalofHenanForestryScienceandTechnology, 27(1): 51-52. (in Chinese)
[14] 樊慶忠. 樹形改造對紅富士蘋果生長和結果的影響[D]. 泰安: 山東農業大學碩士論文, 2005.
FAN Qing-zhong. (2005).Effectsoftreeremodelingongrowthandoutcomeofredfujiapple[D]. Master Thesis. Shandong Agricultural University, Tai'an. (in Chinese)
[15] 何志祥. 油茶樹體調控模式與技術的研究[D]. 長沙: 中南林業科技大學碩士學位論文, 2013.
HE Zhi-xiang. (2013). Study on the regulation model and technology ofCamelliaoleifera[D]. Master Thesis. Central South University of Forestry and Technology, Changsha.
[16] 胡曉棠, 陳虎, 王靜, 等.不同土壤濕度對膜下滴灌棉花根系生長和分布的影響[J]. 中國農業科學, 2009, 42(5): 1 682-1 689.
HU Xiao-tang, CHEN Hu, WANG Jing, et al. (2009). Effects of soil water content on cotton root growth and distribution under mulched drip irrigation [J].ScientiaAgriculturaSinica, 42(5): 1,682-1,689. (in Chinese)
[17] Turner, N. C., & Begg, J. E. (1981). Plant-water relations and adaptation to stress.Plant&Soil, 58(1-3): 97-131.
[18] Taylor, H. M., & Klepper, B. (1974). Water relations of cotton. i. root growth and water use as related to top growth and soil water content.AgronomyJournal, 66(4):584-588.
[19] 胡守林, 鄭德明, 鄧成貴, 等. 不同耕作方式棉花根系發育能力的研究[J]. 水土保持研究, 2006, 13(6): 115-119.
HU Shou-lin , ZHENG De-ming, DENG Cheng-gui, et al. (2006). Study on root system development ability of cotton with different cultivation way [J].ResearchofSoilandWaterConservation, 13(6): 115-119. (in Chinese)
[20] 張永清. 谷類作物根系生長與調控研究[M]. 北京:中國農業科學技術出版社, 2006.
ZHANG Yong-qing. (2006).Studyonrootsystemgrowthandregulationincerealcrops[M]. Beijing: China Agricultural Science and Technology Press. (in Chinese).
[21] 王育梅. 榛子綠枝扦插繁殖技術[J]. 中國林副特產, 2013, 123(2): 49-50.
WANG Yu-mei. (2013). Hazel Twig Cutting Propagation Technology [J].ChineseForestProducts, 123(2): 49-50. (in Chinese)
Abstract:【Objective】 To study etiolation coppice shoot cutting sui
Table environment and management ofCorylusheterophyllaFisch ×CorylusavellanaL. in the hope of providing theoretical basis for simplifying cutting environment and field management.【Method】In this study, variance analysis and correlation analysis were used to analyze the differences among the indexes such as shoot growth, root growth and root quality of the seedlings under 3 environments.【Result】There were differences in growth and root indexes in different environments; Under 3 environmental conditions, chlorophyll content and root system index were best in plastic greenhouse (A), followed by hazelnut demonstration garden (B), and pecan trees between rows (C) were lowest, which showed that cutting management mode had a great effect on root growth. Because of the sufficient illumination of B environment, the comprehensive root index was higher than that of C, but C environment had higher rooting rate and faster branch growth. This could be seen that the increase of soil moisture could promote the growth of cuttings in the medium stage soil moisture; in addition to that, soil fertility could also affect root growth. Furthermore, compared softwood cuttings with etiolation coppice shoot management complexity reduced 50%, and the root growth rate, rooting rate and root quality were improved.【Conclusion】The results preliminary responded to the importance of etiolation coppice shoot cutting environment and management model. In view of the future production work, we should take the whole artificial arch shed (A) as reference, strictly control the temperature and humidity in the early stages, and gradually increase the contact surface with the external environment, greatly reduce the management complexity of a yellow bud for the future cutting work in the late stage.
Keywords:CorylusheterophyllaFisch. ×CorylusavellanaL.; etiolation coppice shoot; cutting environment; management mode
EffectsofEtiolationCoppiceShootCuttingEnvironmentonRootingofCorylusheterophyllaFisch. ×CorylusavellanaL.
TIAN Xue-lin1,2, SONG Feng-hui2, Gulimire Kakeshi2, SHI Yan-jiang2,Mahemuti Abulaiti2,LI Jia-cheng1, ZHANG Jin1
(1.CollegeofForestryandHorticulture,XinjiangAgriculturalUniversity,Urumqi830052,China;2.XinjiangAcademyofForestryEconomicForestResearchInstitute,Urumqi830000,China)
10.6048/j.issn.1001-4330.2017.09.009
S664.4
A
1001-4330(2017)09-1636-08
2017-06-23
2015年中央財政林業科技推廣項目“平歐雜種榛優良品種高效栽培示范推廣”
田雪鄰(1991-),女,新疆奎屯人,碩士研究生,研究方向為經濟林栽培,(E-mail)1002756818qq.com
史彥江(1961-),男,山西人,研究員,研究方向為林木遺傳育種,(E-mail) syj504@126.com
Supported by: The Central Government Forestry Science and Technology Extension Project of 2015 "Efficient Cultivation and Demonstration ofCorylusHeterophyllaFisch. ×CorylusAvellanaL Varieties in Flat Europe"
Corresponding author: Shi Yan-jiang (1961-), male, Shanxi, researcher, research field: forest heritage breeding. (E-mail)syj504@126.com

