硅對不同鹽生境下高羊茅生物量及滲透調節物質含量的影響
周鈺佩,劉慧霞,于 成,林麗果,林選棟
1 草地農業生態系統國家重點實驗室 蘭州大學草地農業科技學院, 蘭州 730020 2 西北民族大學生命科學與工程學院, 蘭州 730030
硅對不同鹽生境下高羊茅生物量及滲透調節物質含量的影響
周鈺佩1,劉慧霞2,*,于 成1,林麗果2,林選棟2
1 草地農業生態系統國家重點實驗室 蘭州大學草地農業科技學院, 蘭州 730020 2 西北民族大學生命科學與工程學院, 蘭州 730030
高羊茅(Festucaarundinacea)因長期多頻灌溉往往生長在土壤鹽漬化或潛在鹽漬化的生境中。采用盆栽試驗研究了不同鹽生境下添加硅對兩個高羊茅品種(抗性強的XD和抗性弱的K31)生物量和滲透調節物質的影響。結果表明:不同鹽生境均降低了兩個不同抗性高羊茅品種K31和XD的地上生物量和地下生物量。添加硅顯著增加了鹽濃度小于或等于150 mmol/L時XD的地上和地下生物量,以及鹽濃度小于或等于100 mmol/L時K31地下生物量,但對K31地上生物量沒有顯著影響。添加硅顯著增加了鹽濃度小于或等于150 mmol/L時XD的地下地上生物量比,以及鹽濃度100 mmol/L時K31地上地下生物量比。鹽生境降低了XD和K31可溶性糖、可溶性蛋白、脯氨酸和丙二醛含量。添加硅沒有顯著影響XD的滲透調節物質含量,但顯著降低了鹽濃度大于或等于200 mmol/L時K31的可溶性糖含量,以及鹽濃度250 mmol/L時K31的脯氨酸含量。添加硅均顯著降低鹽濃度大于或等于150 mmol/L時K31和XD的丙二醛含量,但XD的降低幅度大于K31。結果表明,添加硅對鹽生境下高羊茅生長有一定的促進作用,但這種促進作用與品種自身抗性密切相關。
鹽漬土壤;鹽濃度;高羊茅;品種;添加硅;生物量;滲透調節物質含量
Abstract: Tall fescue (Festucaarundinacea) typically grows in saline soil or potential saline soil because tall fescue turf often needs to be irrigated. A pot experiment was conducted to investigate the effects of silicon (Si) supplements on the biomass and osmolyte content of two tall fescue varieties (XD and K31) at different soil saline levels. The variety XD is strongly resistant to salinity and K31 is weakly resistant. Above- and underground biomass of both varieties tended to decrease as soil salinity increased. Added Si significantly increased the above- and belowground biomass of XD when soil salinity was 150 mmol/L or below and the belowground biomass of K31 when the salinity was 100 mmol/L or below; it did not affect the aboveground biomass of K31. Silicon supplementation significantly increased the root-to-shoot ratio of XD when the salinity was 150 mmol/L or below and that of K31 at a salinity of 100 mmol/L. Salinity reduced the soluble sugar, soluble protein, proline, and malondialdehyde contents of both varieties. Silicon supplementation did not affect the osmolyte contents of XD. It significantly decreased the soluble sugar content of K31 when it was 200 mmol/L or above and proline content of K31 when the salinity was 100 mmol/L. Silicon supplementation significantly decreased the MDA content of both varieties when the salinity was 150 mmol/L or above, but the magnitude of decrease was greater in XD than in K31. These results indicate that silicon supplementation aids in growth of tall fescue in saline soil, and that this benefit is closely related to the biology of the variety.
KeyWords: saline soil; salinity; tall fescue; variety; silicon; biomass; osmolyte contents
多年生冷季型禾草高羊茅(Festucaarundinacea)是西北乃至西部地區城鎮草坪綠地建植的主要草種之一[1]。高羊茅草坪綠地需要灌溉維持其功能的正常發揮[2],但長期多頻次的灌溉往往會促進土壤深層可溶性鹽向淺層富集,容易引起土壤次生鹽漬化[3],因此高羊茅往往生長在土壤鹽漬化或潛在鹽漬化的生境中,而鹽漬生境反過來往往會嚴重影響高羊茅草坪綠地的建植和使用壽命[4],所以提高高羊茅耐鹽性是延長草坪綠地持久性利用的重要途徑[5]。添加外源硅不僅能夠促進植物的生長,而且能夠提高植物的耐鹽性[6-7]。已有研究表明,外源硅能夠提高大麥(HordeumvulgareL.)[8]、水稻(OryzasativaL.)[9]、黑麥草(LoliumperenneL.)[10]、番茄(Solanumlycopersicum)[11]等植物的耐鹽性,但硅提高植物耐鹽性的有益作用與植物種類密切相關,譬如1 mmol/L的硅就能顯著提高120 mmol/L鹽濃度下大麥的膜流動性[8],而只有3 mmol/L硅才能對50 mmol/L鹽濃度下水稻株高具有最大的增幅效應[9]。硅增強植物耐鹽性的作用不僅與植物種類有關,而且與同一種植物的不同品種密切相關,例如同樣鹽生境下添加硅后,耐鹽性小麥(Triticumaestivumcv.)品種Izmir- 85莖和根的Na含量要遠遠小于敏感型小麥(Triticumdurumcv.)品種Gediz- 75[12],早熟禾(PoapratensisL.)品種‘Perfection’的鮮重增加量要大于品種‘Midnight’[13],耐鹽性弱的美洲狼尾草(P.amcrieanum)體內丙二醛含量的降幅要遠遠大于耐鹽性強的雜交狼尾草(P.amcrieanum×P.purpurenm)[14]。目前已經證實外源性硅能夠增加鹽生境下高羊茅品種紅象的株高和生物量[5],但我國西北乃至西部地區城鎮草坪綠地建植中使用的高羊茅品種較多[15-16],硅對不同高羊茅品種耐鹽性的影響是否存在差異,目前尚無科學證據。本研究通過分析外源性硅對不同抗性高羊茅品種生物量和滲透調節物質的影響,揭示硅提高不同高羊茅品種耐鹽性的異同,以期為高羊茅草坪綠地的管理提供科學依據。
1 材料與方法
1.1 試驗設計
試驗采用盆栽試驗,3個處理因素分別為鹽濃度、添加硅否和品種。鹽濃度采用NaCl配制,分別為0、50、100、150、200、250、300、350、400 mmol/L,在每個鹽濃度梯度下,再設置添加硅(+Si)和不添加硅(-Si)兩種處理。鹽生境下硅濃度為2 mmol/L時高羊茅的種子發芽率和保苗率最高[17],因此本試驗中硅處理的硅離子濃度設置為2 mmol/L,硅源采用硅酸鈉形式添加[5-13]。計算鹽分濃度時,將硅酸鈉帶入的鹽離子濃度考慮在內,因此鹽分濃度還包括硅酸鈉內的鈉離子。參試的兩個高羊茅品種分別為抗性強的XD和抗性較弱的K31,試樣種子來源于北京百綠集團。試驗總計36個處理,每個處理重復6次。試驗在蘭州大學榆中校區智能日光溫室內進行。為減輕其他養分元素的干擾,試驗采用珍珠石和蛭石(體積比為1∶1) 的混合基質,將混勻基質等量放入塑料盆(高15cm,盆口直徑14cm),播種時間為2015年5月20日,每個盆內播種飽滿的高羊茅種子300粒,然后將塑料盆隨機擺放。在Hoagland營養液中添加相應濃度的硅酸鈉和氯化鈉,將其充分混合后配置成處理溶液,種植用處理溶液按照試驗設計澆灌每個塑料盆,直至盆底托盤有處理溶液滲出為止,當盆底不再滲出處理溶液時,稱重,記錄每個塑料盆的重量。此后每隔一天分別稱重,然后根據減輕重量添加處理溶液。待高羊茅品種完全出苗后(高羊茅發芽時間21 d),根據高羊茅出苗率決定哪種處理繼續進行。當某種處理的高羊茅出苗率低于60%時,認為這種處理將來無法有效建植草坪綠地[18],故放棄繼續觀測;若高羊茅出苗率大于或等于60%,則認為該處理有可能在未來有效建植草坪綠地,繼續觀測。對于遴選的能夠繼續觀測的處理,采用人工定株措施,即每個盆中選擇長勢均勻的50株幼苗,其他多余幼苗以間苗的形式人工除去,以便排除密度對高羊茅生長的影響。根據試驗過程中高羊茅的最終出苗率,當鹽濃度大于300 mmol/L時,無論添加硅還是不添加硅,兩個品種的出苗率均低于60%(表1),因此后續觀測試驗中將鹽濃度大于300 mmol/L的處理舍棄。而對鹽濃度小于或等于250 mmol/L的處理持續觀測40d,然后取樣。
表1硅對不同鹽濃度處理下高羊茅累計發芽率的影響(%)
Table1Theeffectofsiliconsuppliesonthecumulativegerminationrateoftwotallfescuevarietiesunderdifferentsaltconcentrationconditions
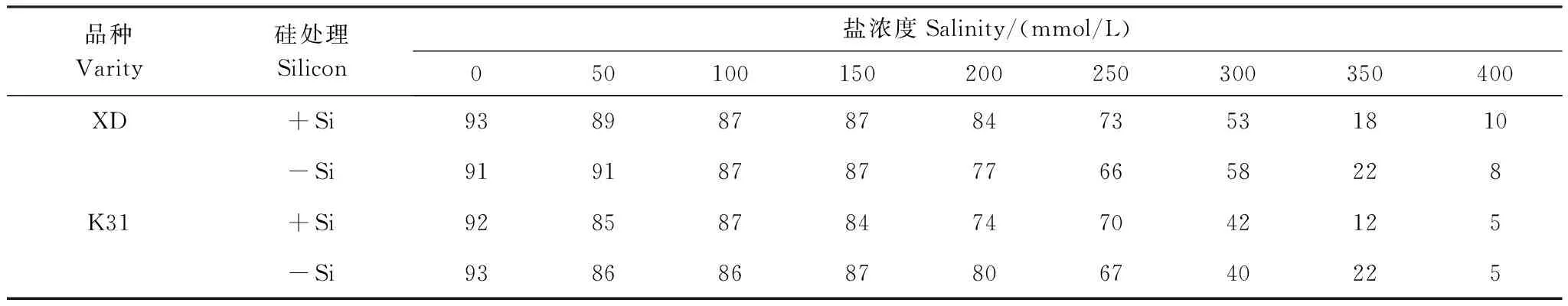
品種Varity硅處理Silicon鹽濃度Salinity/(mmol/L)050100150200250300350400XD+Si938987878473531810-Si91918787776658228K31+Si92858784747042125-Si93868687806740225
XD:向導Persuaion;K31品種的編號全稱
1.2 取樣與指標測定
1.2.1 取樣方法
每個處理中,3盆測定生物量,3盆測定生理指標。對于測定生物量的重復,將每個盆中的高羊茅植株完整地從盆中取出(包括地上和地下),利用自來水沖洗干凈,利用鑷子手工再次除去附著于植物上的蛭石和珍珠巖,然后用濾紙吸干植株表面的水分,全部用剪刀分為莖葉和根系,分別保存。對于測定滲透調節物質和酶活性的重復,利用剪刀僅收獲莖葉,每個盆中的樣品置于液氮中保存,然后帶回實驗室后快速轉移到-80℃冰柜中保存,以備實驗分析。
1.2.2 指標測定
生物量測定采用常規烘干法測定。參照郝再彬[19]的方法,采用考馬斯亮藍法測定可溶性蛋白,采用硫代巴比妥酸法測定丙二醛。參照李合生[20]的方法,用蒽酮法測定可溶性糖,用酸性茚三酮顯色法測定脯氨酸。
1.3 數據分析
數據采用SPSS 17.0 軟件進行三因素方差分析,采用LSD法檢驗不同數據組間的差異顯著性,Duncan法進行多重差異性比較,結果用均值±標準差(Mean±SD)表示,數據制圖采用Excel 2007軟件。
2 結果
2.1 鹽濃度、添加硅和高羊茅品種對各項測定指標的方差分析
三因素ANOVA分析結果表明:高羊茅品種對可溶性蛋白、脯氨酸、丙二醛、地上和地下生物量及比值具有顯著影響(P<0.05),而對可溶性糖沒有明顯影響(表2);鹽濃度對可溶性糖、可溶性蛋白、脯氨酸、丙二醛、地上和地下生物量及比值均具有顯著影響(P<0.05);硅處理對可溶性糖、脯氨酸、丙二醛、地上和地下生物量及比值具有顯著作用(P<0.05),而對可溶性蛋白沒有顯著影響。高羊茅品種、鹽濃度和硅處理三者的交互作用對可溶性蛋白和地下生物量具有顯著的交互作用(P<0.05)。
2.2 不同鹽濃度下硅對兩個高羊茅生物量的影響
2.2.1 鹽濃度對兩個高羊茅生物量的影響
無論是添加硅還是不添加硅,兩個高羊茅品種K31和XD的地上生物量和地下生物量均隨著鹽濃度增加而呈下降趨勢(表3)。不添加硅時,K31地上生物量在鹽濃度小于或等于100 mmol/L時顯著降低(P<0.05),XD地上生物量在鹽濃度小于或等于200 mmol/L時顯著降低(P<0.05);K31和XD地下生物量均在鹽濃度小于或等于150 mmol/L顯著降低(P<0.05)。添加硅時,K31地上生物量和地下生物量均在鹽濃度為200 mmol/L時顯著降到最低(P<0.05),XD地上生物量和地下生物量均隨著鹽濃度升高而顯著降低(P<0.05)。
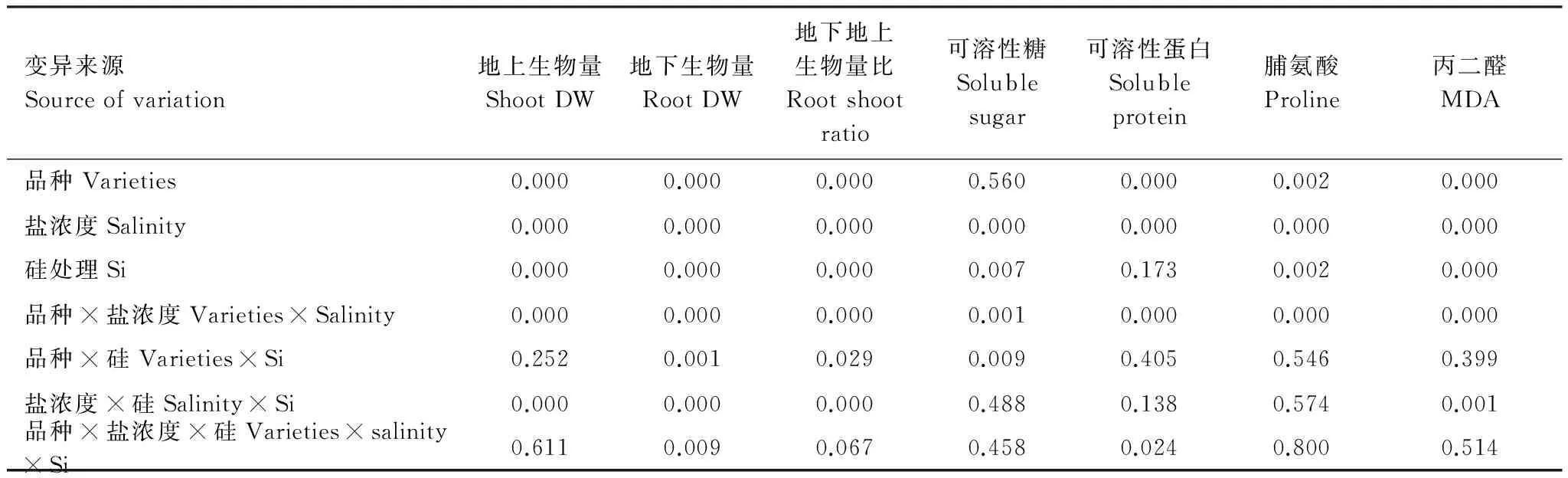
表2 高羊茅生物量和生理指標的三因素方差分析
DW表示干重Dry weight
表3不同鹽濃度下硅對兩個高羊茅品種地上地下生物量及其比值的影響
Table3Effectofsiliconsuppliesonshootandrootbiomassandtheirratiooftwotallfescuevarietiesunderdifferentsaltconcentrationconditions
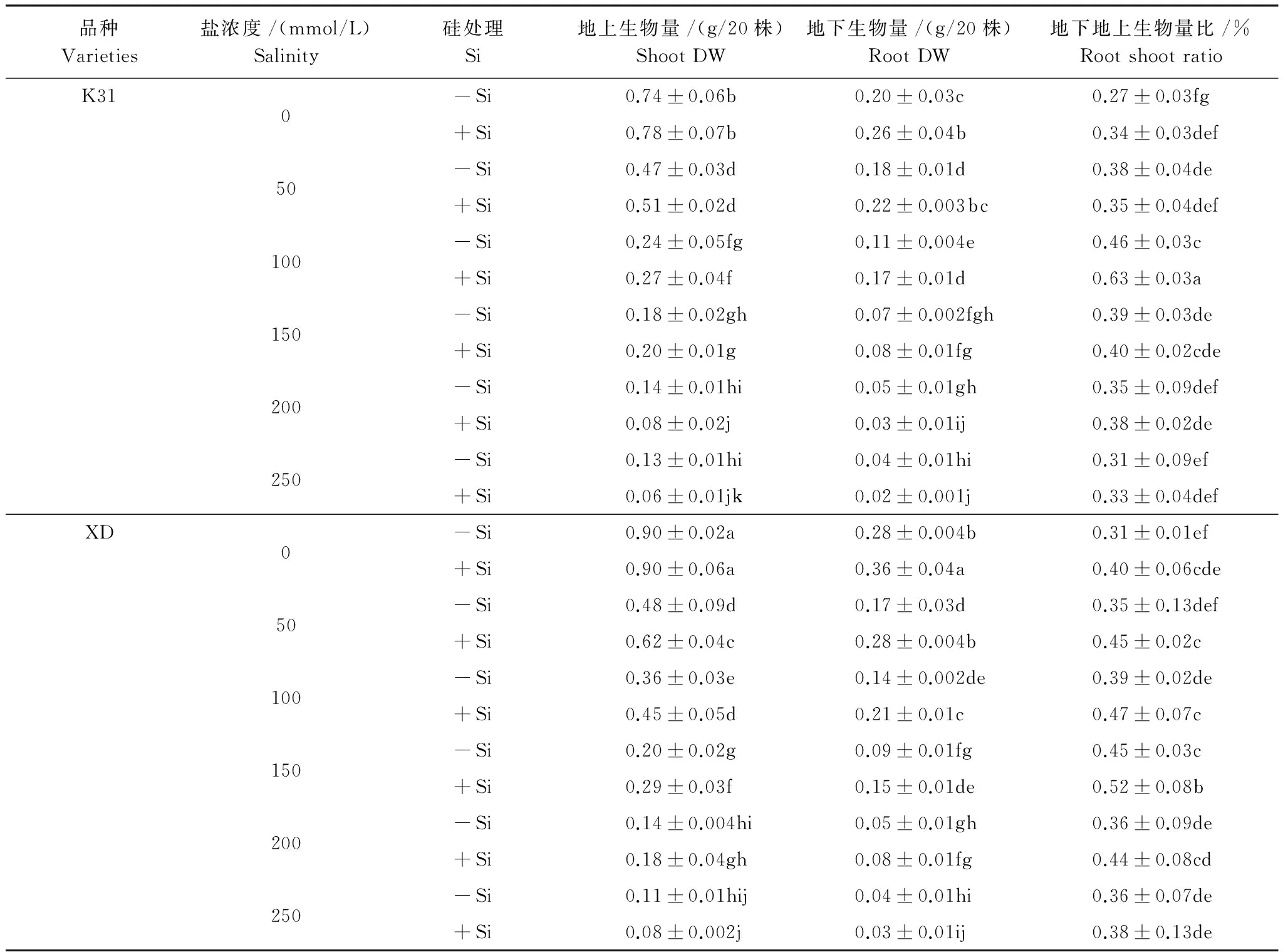
品種Varieties鹽濃度/(mmol/L)Salinity硅處理Si地上生物量/(g/20株)ShootDW地下生物量/(g/20株)RootDW地下地上生物量比/%RootshootratioK310-Si0.74±0.06b0.20±0.03c0.27±0.03fg+Si0.78±0.07b0.26±0.04b0.34±0.03def50-Si0.47±0.03d0.18±0.01d0.38±0.04de+Si0.51±0.02d0.22±0.003bc0.35±0.04def100-Si0.24±0.05fg0.11±0.004e0.46±0.03c+Si0.27±0.04f0.17±0.01d0.63±0.03a150-Si0.18±0.02gh0.07±0.002fgh0.39±0.03de+Si0.20±0.01g0.08±0.01fg0.40±0.02cde200-Si0.14±0.01hi0.05±0.01gh0.35±0.09def+Si0.08±0.02j0.03±0.01ij0.38±0.02de250-Si0.13±0.01hi0.04±0.01hi0.31±0.09ef+Si0.06±0.01jk0.02±0.001j0.33±0.04defXD0-Si0.90±0.02a0.28±0.004b0.31±0.01ef+Si0.90±0.06a0.36±0.04a0.40±0.06cde50-Si0.48±0.09d0.17±0.03d0.35±0.13def+Si0.62±0.04c0.28±0.004b0.45±0.02c100-Si0.36±0.03e0.14±0.002de0.39±0.02de+Si0.45±0.05d0.21±0.01c0.47±0.07c150-Si0.20±0.02g0.09±0.01fg0.45±0.03c+Si0.29±0.03f0.15±0.01de0.52±0.08b200-Si0.14±0.004hi0.05±0.01gh0.36±0.09de+Si0.18±0.04gh0.08±0.01fg0.44±0.08cd250-Si0.11±0.01hij0.04±0.01hi0.36±0.07de+Si0.08±0.002j0.03±0.01ij0.38±0.13de
同列數據后不同字母表示不同處理間差異達5%顯著水平
兩個高羊茅品種K31和XD地下地上生物量比對鹽濃度的響應一致,均隨著鹽濃度的增大而呈現出先上升后降低的趨勢(表3)。不添加硅時, K31的地下地上生物量比在鹽濃度小于或等于100 mmol/L時有顯著變化(P<0.05),但鹽濃度大于100 mmol/L時無顯著變化,而XD的地下地上生物量比僅在鹽濃度150 mmol/L時最大(P<0.05),在其他鹽濃度下均沒有顯著變化。添加硅時, K31的地下地上生物量比在鹽濃度100 mmol/L時顯著最大(P<0.05),在其他鹽濃度下均沒有顯著變化,而XD的地下地上生物量比在鹽濃度150 mmol/L時達到最大(P<0.05)。
2.2.2 添加硅對兩個高羊茅生物量的影響
硅對高羊茅地上生物量的影響與品種和鹽濃度高低密切相關。當鹽濃度較低時,硅對K31的地上生物量影響不顯著,但對XD地上生物量顯著影響,即鹽濃度小于或等于150 mmol/L時添加硅顯著增加了XD的地上生物量(P<0.05)。硅對兩個高羊茅品種的地下生物量的影響趨同,均表現為鹽濃度低于某一數值時硅顯著增加了地下生物量(P<0.05),而當鹽濃度大于某一數值時硅對地下生物量沒有顯著影響,但兩個品種對應的鹽濃度值存在分異,K31對應的鹽濃度為100 mmol/L,而XD對應的鹽濃度為150 mmol/L。
硅對K31和XD地下地上生物量比的影響與鹽濃度高低密切相關。當鹽濃度為100 mmol/L時,添加硅顯著增加了K31地下地上生物量比(P<0.05),而在其他鹽濃度下均無顯著差異;當鹽濃度大于150 mmol/L時,添加硅對XD的地下地上生物量比沒有顯著影響,而當鹽濃度小于或等于150 mmol/L時,添加硅顯著增加了XD的地下地上生物量比(P<0.05)。
2.3 不同鹽濃度下硅對高羊茅葉片滲透調節物質的影響
2.3.1 鹽濃度對兩個高羊茅葉片滲透調節物質的影響
添加硅和不添加硅處理時,K31與XD的可溶性糖含量、可溶性蛋白含量、脯氨酸含量隨鹽濃度增加均表現為增加的變化態勢(表4),但不同滲透調節物質顯著增加所對應的鹽濃度存在差異,而且可溶性糖、可溶性蛋白和脯氨酸含量顯著增加所對應的鹽濃度因品種而存在差異。

表4 不同鹽濃度下硅處理對兩個高羊茅品種葉片滲透調節物質含量的影響
不添加硅時,隨鹽濃度增加K31的可溶性糖和可溶性蛋白含量沒有顯著變化,脯氨酸含量在鹽濃度為50、150、250 mmol/L時顯著增加(P<0.05);XD可溶性糖含量在鹽濃度為250 mmol/L時顯著增加(P<0.05),可溶性蛋白含量在鹽濃度為50 mmol/L和150 mmol/L時顯著增加(P<0.05),脯氨酸含量在鹽濃度大于或等于100 mmol/L時顯著增加(P<0.05)。添加硅時,K31的可溶性糖含量隨鹽濃度增加沒有顯著變化,而XD的可溶性糖含量在鹽濃度大于200 mmol/L時顯著增加(P<0.05);K31可溶性蛋白含量在鹽濃度為200 mmol/L時顯著最大(P<0.05),XD的可溶性蛋白含量在鹽濃度為150 mmol/L顯著最大(P<0.05); K31脯氨酸含量在鹽濃度為50 mmol/L和150 mmol/L時顯著增加(P<0.05),而XD在鹽濃度大于或等于100 mmol/L時脯氨酸含量顯著增加(P<0.05)。
2.3.2 添加硅對兩個高羊茅滲透調節物質的影響
硅對高羊茅葉片滲透調節物質含量的影響不僅與鹽濃度高低有關,而且與品種有關。雖然硅對同一鹽濃度下XD的可溶性糖和脯氨酸含量沒有顯著影響,但硅卻顯著影響了K31的可溶性糖和脯氨酸含量。當鹽濃度大于或等于200 mmol/L時硅顯著降低了K31的可溶性糖含量(P<0.05),當鹽濃度為250 mmol/L時硅顯著降低了K31的脯氨酸含量(P<0.05)。而在同一鹽濃度下,硅對兩個高羊茅品種的可溶性蛋白含量均沒有顯著影響。
2.4 不同鹽濃度下硅對高羊茅葉片丙二醛含量的影響
2.4.1 鹽濃度對兩個高羊茅葉片丙二醛含量的影響
添加硅和不添加硅處理系列中,K31和XD的丙二醛含量隨鹽濃度增加均表現為上升趨勢(圖1)。不添加硅時,隨著鹽濃度升高K31丙二醛含量分別在鹽濃度為150 mmol/L和200 mmol/L時顯著增加(P<0.05),XD丙二醛含量分別在鹽濃度為50 mmol/L和100 mmol/L時顯著增加(P<0.05)。添加硅時,K31丙二醛含量在鹽濃度為200 mmol/L時顯著增加(P<0.05),而XD丙二醛含量在鹽濃度為50 mmol/L時顯著增加(P<0.05)。
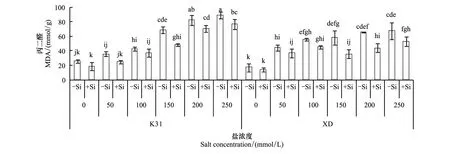
圖1 不同鹽濃度下硅處理對兩個高羊茅品種葉片丙二醛含量的影響Fig.1 The effect of silicon supplies on the MDA content of two tall fescues varieties under different salt concentration conditions
2.4.2 添加硅對兩個高羊茅葉片丙二醛含量的影響
當鹽濃度相同時,K31和XD的丙二醛含量對硅的響應趨同,表現為當鹽濃度大于或等于150 mmol/L時,硅顯著降低了丙二醛含量(P<0.05)。當鹽濃度為150、200、250 mmol/L時,硅降低K31丙二醛含量的幅度分別為20.73、11.49、12.44 mmol/g,而XD的降低幅度分別為22.60、21.43、14.70 mmol/g,說明同一鹽濃度下,硅對XD丙二醛含量的降低幅度大于K31。
3 討論
植物生物量是綜合響應鹽脅迫的直觀體現[21]。本研究表明,高羊茅品種K31和XD的地上生物量在鹽濃度大于或等于50 mmol/L時顯著降低,說明鹽濃度小于50 mmol/L時,高羊茅能夠通過自身調節機制適應輕度鹽生境,而鹽濃度大于50 mmol/L,高羊茅品種已經不能通過自身的調節機制適應鹽生環境,這與金絲小棗(Ziziphusjujuba)幼苗[22]對鹽濃度變化的響應基本趨同。然而同一鹽濃度下兩個高羊茅品種地上生物量對添加硅的響應不一致,表現為同一鹽濃度下硅對K31的地上生物量沒有明顯的影響,而硅顯著增加了XD的地上生物量,其中XD對添加硅的響應趨同于金絲小棗幼苗、大麥、水稻、黑麥草、番茄,而K31沒有趨同于上述植物對硅響應的結果,這說明同一植物,其不同品種地上生物量在鹽生境下響應硅的結果存在分異。因此,將硅作為環境友好型元素添加時,不僅要考慮植物種類的響應,還要考慮同一物種不同品種的響應差異。雖然高羊茅兩個品種K31和XD的地上生物量對添加硅的響應存在分異,但其地下生物量對鹽濃度和添加硅的響應基本趨同,表現為K31和XD的地下生物量均隨鹽濃度增加表現為逐漸減小的趨勢,且較低鹽濃度下添加硅均顯著增加了其地下生物量,這與紫花苜蓿(MedicagosativaL.)根系生物量響應鹽脅迫和外源性硅的過程類同[23],說明鹽生境下,植物地上生物量較地下生物量在鹽生境下感應硅更加敏感。雖然高羊茅品種K31和XD的地下生物量對鹽濃度和添加硅的響應趨勢基本趨同,但其過程存在明顯的差異,硅顯著增加K31地下生物量的鹽濃度為100 mmol/L,而硅顯著增加XD地下生物量的鹽濃度卻是150 mmol/L,即硅對XD地下生物量的影響程度比K31更大。當鹽濃度超過150 mmol/L時,硅添加顯著降低了高羊茅K31的地下生物量,而對XD地下生物量沒有影響,這說明鹽脅迫下外源硅促進高羊茅地下生物量積累受鹽濃度約束,而當鹽濃度較高時,添加硅不僅不會增加地下生物量,反而可能降低地下生物量,對高羊茅植物根系的吸收能力產生不利的影響,這可能是高鹽脅迫下添加硅降低了植物正常的物質代謝和能量代謝有關[24],從而降低了高羊茅的地下生物量。地下/地上生物量比往往用來檢驗鹽生境下植物幼苗期根系生長狀況[25],雖然高羊茅品種K31和XD的地下/地上生物量比對添加硅響應趨同,添加硅均在不同程度上增加了K31和XD的地下/地上生物量比,但是K31和XD對硅的響應過程中存在差異,在鹽濃度分別為100 mmol/L和150 mmol/L時顯著增加K31和XD的地下/地上生物量比,說明添加硅影響了鹽生境下K31和XD地上和地下生物量的分配模式,有利于高羊茅將更多的物質積累在地下部分,從而有利于高羊茅根系部分從土壤中吸收更多的水分和養分來維持草坪綠地的健康和品質。
生物量是高羊茅響應鹽生境的外在體現,而高羊茅生理生化過程則是其適應鹽生境的內在機制,特別是滲透調節和細胞膜結構[26]。當植物遭受鹽脅迫傷害,植物往往通過產生脯氨酸、可溶性糖和可溶性蛋白等滲透調節物質而維持細胞內外的滲透平衡[27],減輕鹽脅迫對植物的傷害效應。已有研究表明,鹽脅迫下添加硅可通過增加高粱(SorghumbicolorL. Moench)葉片內的可溶性糖含量而維持滲透調節,緩解鹽害,促進植株生長[28]。本研究結果表明,雖然兩個高羊茅品種植株葉片內的可溶性糖、可溶性蛋白、脯氨酸以及丙二醛含量均隨鹽濃度增加而逐漸升高,但添加硅均在不同程 度上降低了同一鹽濃度下葉片內的可溶性糖、可溶性蛋白、脯氨酸以及丙二醛含量,此結果在紫花苜蓿[29]、小麥(TriticumaestivumL.)[12]、葡萄(VitisviniferaL.)[30]和玉米(ZeamaysL.)[31]等植物中也得到了證實,說明高羊茅添加硅在鹽生境下改善高羊茅的滲透調節過程,保護了細胞膜的完整性,緩解了鹽脅迫對高羊茅造成的危害,增強了其抗鹽能力。雖然添加硅均改善了高羊茅的滲透調節過程,但不同高羊茅品種響應硅改善其滲透調節能力存在一定的差異,添加硅降低抗性弱品種(K31)的可溶性糖和脯氨酸含量的幅度要大于抗性強的品種(XD),說明在鹽生境狀態下添加硅對耐鹽性弱的品種具有更顯著的滲透調節效應。鹽濃度脅迫下添加硅對XD葉片內丙二醛含量的降低幅度要大于K31,說明硅維持XD品種細胞膜結構完整性的效應要比K31好,從而更好地促進XD品種正常生長,這點也從添加硅顯著提高了高羊茅品種XD地上生物量得到佐證,可以看出硅對高羊茅在鹽生境下的影響不僅表現在滲透調節功效上,還表現在膜結構方面。這說明添加硅對高羊茅生長的影響不僅與鹽濃度密切相關,而且與品種自身抗性密切相關。
[1] 白小明, 相斐, 魯存海, 孫吉雄. 氮磷鉀肥對高羊茅擴展性和根系特性的影響. 草地學報, 2009, 17(5):600-606.
[2] 杜建雄, 侯向陽, 劉金榮. 草地早熟禾對干旱及旱后復水的生理響應研究. 草業學報, 2010, 19(2):31-38.
[3] Flowers T J. Improving crop salt tolerance. Journal of Experimental Botany, 2004, 55(396):307-319.
[4] 楊海霞, 劉潤進, 郭紹霞. AM真菌摩西球囊霉對鹽脅迫條件下高羊茅生長特性的影響. 草業學報, 2014(4):195-203.
[5] 劉慧霞, 郭興華, 郭正剛. 鹽生境下硅對坪用高羊茅生物學特性的影響. 生態學報, 2011, 31(23):7039-7046.
[6] 朱佳, 梁永超, 丁燕芳, 李兆軍. 硅對低溫脅迫下冬小麥幼苗光合作用及相關生理特性的影響. 中國農業科學, 2006, 39(9):1780-1788.
[7] 鄭世英, 鄭芳, 徐建, 潘恩敬, 耿建芬, 李東臣. 外源硅對NaCl脅迫下小麥幼苗生長及光合特性的影響.麥類作物學報, 2015, 35(1):111-115.
[8] Liang Y C, Zhang W H, Chen Q, Liu Y L, Ding R X. Effect of exogenous silicon (Si) on H+-ATPase activity, phospholipids and fluidity of plasma membrane in leaves of salt-stressed barley(HordeumvulgareL.). Environmental and Experimental Botany, 2006, 57(3):212-219.
[9] Gong H J, Randall D P, Flowers T J. Silicon deposition in the root reduces sodium uptake in rice (OryzasativaL.) seedlings by reducing bypass flow. Plant Cell and Environment, 2006, 29(10):1970-1979.
[10] 劉建新, 胡浩斌, 王鑫. 硅對鹽脅迫下黑麥草幼苗活性氧代謝和光合參數的影響. 中國草地學報, 2008, 30(5):25-31.
[11] 朱永興, 李換麗, 胡彥宏, 張田田, 韓衛華, 宮海軍. 硅酸鹽提高番茄抗鹽性的效應與生理機制. 農業環境科學學報, 2015, 34(2):213-220.
[12] Tuna A L, Kaya C, Higgs D, Murillo-Amador B, Aydemir S, Girgin A R. Silicon improves salinity tolerance in wheat plants. Environmental and Experimental Botany, 2008, 62(1):10-16.
[13] Bae E J, Lee K S, Huh M R, Lim C S. Silicon significantly alleviates the growth inhibitory effects of NaCl in salt-sensitive ‘Perfection’ and ‘Midnight’ Kentucky bluegrass (PoapratensisL.). Horticulture Environment and Biotechnology, 2012, 53(6):477-483.
[14] 劉大林, 張華, 曹喜春, 胡楷崎, 王奎, 劉兆明, 楊俊俏. 硅對鹽脅迫下不同狼尾草屬牧草生理代謝的影響. 草地學報, 2013, 21(6):1119-1123.
[15] 王忠文, 王曉琴. 干旱荒漠區觀賞草坪草種的特性研究. 甘肅科技縱橫, 2011, 40(4):54-55.
[16] 師尚禮, 李溫. 西北地區羊茅屬牧草和草坪草的綜合評價. 甘肅農業大學學報, 2000, 35(2):127-131.
[17] 劉慧霞, 王康英, 郭興華. 不同土壤水分條件下硅對坪用高羊茅種子出苗及生物學特性的影響. 草業學報, 2012, 21(1):199-205.
[18] 孫祎龍, 呂鳳華. 東北寒冷地區冷地型草坪建植及養護管理. 草原與草坪, 2004(1):62-64.
[19] 郝再彬, 蒼晶, 徐仲. 植物生理試驗. 哈爾濱: 哈爾濱工業大學出版社, 2004.
[20] 李合生. 植物生理生化試驗原理和技術. 北京: 高等教育出版社, 2006.
[21] Sairam R K, Rao K V, Srivastava G C. Differential response of wheat genotypes to long term salinity stress in relation to oxidative stress, antioxidant activity and osmolyte concentration. Plant Science, 2002, 163(5):1037-1046.
[22] 劉永霞. 硅對金絲小棗鹽脅迫的緩解效應及其機理[D]. 南京: 南京林業大學, 2007.
[23] 劉慧霞, 郭正剛, 周雪榮, 郭興華, 鄒文輝, 王愛國. 硅對紫花苜蓿根系生長的影響. 中國草地學報, 2009, 31(1):28-31..
[24] 王玉萍, 王映霞, 白向利, 王小青, 張峰. 硅對NaCl脅迫下甜瓜種子萌發及幼苗生長的影響. 草業學報, 2015, 24(5):108-116.
[25] 解明. 外源硅對鹽脅迫下玉米萌發及幼苗生長量的影響. 新疆農墾科技, 2015(7):50-52.
[26] 張潤花, 郭世榮, 樊懷福, 李娟. 外源亞精胺對鹽脅迫下黃瓜幼苗體內抗氧化酶活性的影響. 生態學雜志, 2006, 25(11):1333-1337.
[27] 劉建新, 王金成, 王瑞娟, 賈海燕. 外源過氧化氫提高燕麥耐鹽性的生理機制. 草業學報, 2016, 25(2):216-222.
[28] Yin L, Wang S W, Li J Y, Tanaka K, Oka M. Application of silicon improves salt tolerance through ameliorating osmotic and ionic stresses in the seedling ofSorghumbicolor. Acta Physiologiae Plantarum, 2013, 35(11):3099-3107.
[29] 張永峰, 梁正偉, 隋麗, 崔彥如. 鹽堿脅迫對苗期紫花苜蓿生理特性的影響. 草業學報, 2009, 18(40):230-235.
[30] Soylemezoglu G, Demir K, Inal A, Gunes A. Effect of silicon on antioxidant and stomatal response of two grapevine (VitisviniferaL.) rootstocks grown in boron toxic, saline and boron toxic-saline soil. Scientia Horticulturae, 2009, 123(2):240-246.
[31] 李佐同, 高聚林, 王玉鳳, 楊克軍. 硅對NaCl脅迫下玉米幼苗生理特性的影響. 玉米科學, 2011, 19(2): 73-76.
Effectsofsiliconsupplementsonbiomassandosmolytecontentsoftallfescue(Festucaarundinacea)underdifferentsoilsalinityconditions
ZHOU Yupei1, LIU Huixia2,*, YU Cheng1, LIN Liguo2, LIN Xuandong2
1StateKeyLaboratoryofGrasslandAgro-ecosystems;CollegeofPastoralAgricultureScienceandTechnology,LanzhouUniversity,Lanzhou730020,China2CollegeofLifeScienceandEngineering,NorthwestUniversityforNationalities,Lanzhou730030,China
國家自然科學基金資助項目(31360581);中央高校基本科研業務費資助項目(31920130050)
2016- 05- 10; < class="emphasis_bold">網絡出版日期
日期:2017- 03- 26
*通訊作者Corresponding author.E-mail: liuhuixia2@aliyun.com
10.5846/stxb201605100909
周鈺佩,劉慧霞,于成,林麗果,林選棟.硅對不同鹽生境下高羊茅生物量及滲透調節物質含量的影響.生態學報,2017,37(16):5514- 5521.
Zhou Y P, Liu H X, Yu C, Lin L G, Lin X D.Effects of silicon supplements on biomass and osmolyte contents of tall fescue (Festucaarundinacea) under different soil salinity conditions.Acta Ecologica Sinica,2017,37(16):5514- 5521.

