中華蜜蜂幼蟲腸道的高表達(dá)基因分析
解彥玲,王鴻權(quán),張 璐,侯志賢,刀 晨,江亮亮,熊翠玲,鄭燕珍,徐細(xì)建,黃枳腱,郭 睿,陳大福
(福建農(nóng)林大學(xué) 蜂學(xué)學(xué)院,福建 福州 350002)
中華蜜蜂幼蟲腸道的高表達(dá)基因分析
解彥玲,王鴻權(quán),張 璐,侯志賢,刀 晨,江亮亮,熊翠玲,鄭燕珍,徐細(xì)建,黃枳腱,郭 睿*,陳大福
(福建農(nóng)林大學(xué) 蜂學(xué)學(xué)院,福建 福州 350002)
中華蜜蜂(中蜂)是中國特有的本土蜜蜂資源,也是養(yǎng)蜂生產(chǎn)中的常用蜂種之一,具有重要的生態(tài)和經(jīng)濟(jì)價(jià)值。本研究利用RNA-seq技術(shù)對中蜂5和6日齡幼蟲腸道進(jìn)行深度測序,得到的有效讀段(clean reads)數(shù)分別為29290630與26636038,Q20分別為98.45%和98.38%。GO富集分析結(jié)果顯示,Ac5中的高表達(dá)基因(HEGs)富集在44個(gè)GO term,其中基因富集數(shù)最多的為代謝進(jìn)程(753 unigenes),其次是催化活性(679 unigenes)與結(jié)合(657 unigenes);Ac6中的HEGs富集在44個(gè)GO term,其中基因富集數(shù)最多的為代謝進(jìn)程(792 unigenes),其次是結(jié)合(760 unigenes)和催化活性(744 unigenes)。KEGG代謝通路(pathway)富集分析結(jié)果顯示,Ac5的HEGs富集在129個(gè)pathway,其中基因富集數(shù)最多的是核糖體(103 unigenes)、內(nèi)質(zhì)網(wǎng)蛋白質(zhì)加工(68 unigenes)和碳代謝(67 unigenes);Ac6的HEGs富集在129個(gè)代謝通路,其中基因富集數(shù)最多的是核糖體(103 unigenes)、氧化磷酸化(88 unigenes)及內(nèi)質(zhì)網(wǎng)蛋白質(zhì)加工(68 unigenes)。進(jìn)一步對HEGs進(jìn)行Venn分析,結(jié)果顯示,二者共有的HEGs為2 015個(gè),特有的HEGs分別為219和491個(gè)。研究結(jié)果不僅可提供中蜂幼蟲腸道發(fā)育過程中的基因表達(dá)譜數(shù)據(jù),也為分子水平上深入研究中蜂幼蟲腸道發(fā)育提供重要信息。
RNA-seq;中華蜜蜂;幼蟲腸道;高表達(dá)基因
東方蜜蜂(Apiscerana)主要集中分布于亞洲的中國、日本、泰國、菲律賓和伊朗等國家,以及俄羅斯遠(yuǎn)東地區(qū)[1]。中華蜜蜂(Apisceranacerana,簡稱中蜂)特指分布在我國的東方蜜蜂,其距今已有3 000多年的馴養(yǎng)歷史[2]。中蜂是我國重要的本土蜜蜂資源,也是養(yǎng)蜂生產(chǎn)中的常用蜂種之一,在長期的進(jìn)化過程中已高度適應(yīng)我國的氣候、蜜源等生態(tài)環(huán)境,具有諸多優(yōu)點(diǎn),例如善于利用零星蜜源、飼料消耗量少、對蜂螨和球囊菌等具有較強(qiáng)的抗性等[3]。
昆蟲腸道具有消化、吸收和免疫防御等重要功能。有關(guān)蜜蜂腸道的研究主要集中在腸道菌群,如Gilliam[4]曾通過傳統(tǒng)培養(yǎng)方法對西方蜜蜂(Apismellifera)腸道內(nèi)的微生物進(jìn)行分離鑒定,發(fā)現(xiàn)其腸道內(nèi)有復(fù)雜而多樣的共生微生物群;Jeyaprakash等[5]利用基于16S rRNA序列分析的分子生物學(xué)技術(shù)研究了非洲兩種西方蜜蜂的腸道菌,發(fā)現(xiàn)其腸道內(nèi)只有少數(shù)幾類特定的細(xì)菌;Li等[6]在東方蜜蜂中檢測到5種類型的細(xì)菌,其中Pasteurellaceae(Gamma-1)、Lactobacillus (Firm)、Neisseriaceae(Beta)和Bifidobacterium(Bifido)共占東方蜜蜂細(xì)菌總量的90%。然而,蜜蜂及其幼蟲腸道發(fā)育的相關(guān)研究非常滯后,腸道過程中的基因表達(dá)規(guī)律尚不明確。前期研究中,我們已對中蜂幼蟲腸道參考轉(zhuǎn)錄組進(jìn)行了組裝和注釋(未發(fā)表數(shù)據(jù)),可為其轉(zhuǎn)錄組學(xué)研究提供可靠的參考信息。本研究利用RNA-seq技術(shù)對中蜂5日齡和6日齡幼蟲腸道進(jìn)行深度測序,通過GO(gene ontology)和KEGG(Kyoto encyclopedia of genes and genomes)代謝通路富集分析對幼蟲腸道高表達(dá)基因(HEGs)進(jìn)行轉(zhuǎn)錄組學(xué)研究,研究結(jié)果可在轉(zhuǎn)錄組水平提供中蜂幼蟲腸道發(fā)育過程中的基因表達(dá)譜數(shù)據(jù),也為在分子水平深入研究腸道發(fā)育提供重要信息。
1 材料與方法
1.1 生物材料
本研究中使用的中蜂幼蟲取自福建農(nóng)林大學(xué)蜂學(xué)學(xué)院教學(xué)蜂場。
1.2 主要試劑及儀器
DNaseⅠ和Oligotex mRNA Kits Midi試劑盒購自德國Qiagen公司,Dynal M280磁珠購自Invitrogen公司,DNA ligase購自美國Thermo公司,RNA Reagent抽提試劑盒、ExTaqpolymerase及Superscript Ⅱ reverse transcriptase均購自日本TaKaRa公司。純化cDNA的Ampure beads為美國Agencourt產(chǎn)品,cDNA文庫構(gòu)建試劑盒TruSeqTMDNA Sample Prep Kit-Set A為美國Illumina公司產(chǎn)品。其他試劑為國產(chǎn)分析純。
恒溫恒濕氣候箱購自中國寧波江南儀器廠,高速冷凍離心機(jī)購自德國Eppendorf公司,倒置顯微鏡為上海光學(xué)儀器五廠產(chǎn)品,超凈工作臺(tái)為蘇州安泰空氣技術(shù)有限公司產(chǎn)品,PCR儀為美國Bio Rad公司產(chǎn)品,凝膠成像系統(tǒng)為上海培清科技有限公司產(chǎn)品,超低溫冰箱為中科美菱低溫科技股份有限公司產(chǎn)品。
1.3 中蜂幼蟲的人工飼養(yǎng)
參照王倩等[7]的方法配制中蜂幼蟲飼料,其中將D-果糖和D-葡萄糖換為新鮮蜂蜜。預(yù)實(shí)驗(yàn)中中蜂幼蟲7日齡成活率達(dá)到70%以上。選擇20群群勢較強(qiáng)的蜂群(外觀無白堊病癥狀),對上述蜂群進(jìn)行PCR檢測,結(jié)果陰性的蜂群作為本研究的實(shí)驗(yàn)蜂群。將2日齡幼蟲移至無菌的24孔細(xì)胞培養(yǎng)板(每孔對應(yīng)1只幼蟲,孔內(nèi)加有35 ℃預(yù)溫的幼蟲飼料),在35 ℃,相對濕度70%條件下培養(yǎng)至6日齡。每隔24 h更換飼料。
1.4 測序樣品準(zhǔn)備
分別剖取中蜂5日齡和6日齡的幼蟲腸道,為盡量減少腸道RNA的降解,將從解剖取樣到樣品放入液氮速凍的時(shí)間控制在30 s以內(nèi),每剖取一組樣品,液氮速凍并迅速放入-80 ℃超低溫冰箱保存?zhèn)溆谩?/p>
1.5 cDNA合成與RNA-seq
利用RNAiso Reagent試劑盒抽提上述2個(gè)幼蟲腸道的總RNA,然后用RNase-free DNaseⅠ去除基因組DNA殘留。RNA的質(zhì)量通過瓊脂糖凝膠電泳和NanoDrop ND-1000(NanoDrop, Wilmington, DE, USA)進(jìn)行檢測。cDNA文庫構(gòu)建參照張曌楠等[8]的建庫方法。
上述幼蟲腸道樣品委托廣州基迪奧生物科技有限公司進(jìn)行雙端測序,測序平臺(tái)為Illumina Hiseq 2500。測序數(shù)據(jù)已上傳NCBI SRA數(shù)據(jù)庫,SRA號(hào)為:SRA456721。
1.6 基因表達(dá)豐度計(jì)算與高表達(dá)基因分析
Illumina PE125測序下機(jī)的原始讀段(raw reads),經(jīng)去除含接頭(adapter)的、含N比例大于10%的和低質(zhì)量的reads得到有效讀段(clean reads),進(jìn)而利用Tophat 軟件將有效讀段(clean reads)映射(mapping)至中蜂幼蟲腸道參考轉(zhuǎn)錄組(未發(fā)表數(shù)據(jù)),表達(dá)量的計(jì)算使用FPKM(fragments per kilobase of transcript per million mapped reads)法,其計(jì)算公式為:FPKM=(106C×103)/NL。
選取各腸道樣品FPKM值大于15的高HEGs,利用在線分析工具OmicsShare(http://www.omicshare.com/tools/index.php/Home/Index/index.html)進(jìn)行GO分類及KEGG pathway富集分析。
2 結(jié)果與分析
2.1 RNA-seq測序數(shù)據(jù)概述
對2個(gè)中蜂幼蟲腸道樣品進(jìn)行深度測序,Ac5和Ac6分別得到的reads數(shù)為29893270與27182602,去除低質(zhì)量reads后的clean reads數(shù)分別為29290630與26636038,Q20分別為98.45%和98.38%(表1),說明本研究中的RNA-seq數(shù)據(jù)質(zhì)量良好,可用于進(jìn)一步分析。Ac5與Ac6的clean reads mapping到中蜂幼蟲腸道參考轉(zhuǎn)錄組的比例分別為88.98%和89.87%。Ac5和Ac6樣品表達(dá)基因數(shù)分別為25 987和28 004,分別占參考基因總數(shù)(43 556 unigenes)的59.66%和64.29%。
2.2 Ac5與Ac6中高表達(dá)基因的GO分類
一般認(rèn)為FPKM值在0.10~3.75的是低表達(dá)基因,在3.75~15.00為中度表達(dá)基因,大于15.00的為高度表達(dá)基因(HEGs)[9],根據(jù)FPKM值選取所有HEGs進(jìn)行GO富集分析,結(jié)果顯示,Ac5中的HEGs富集在44個(gè)GO term,其中基因富集數(shù)最多的為代謝進(jìn)程(753 unigenes),其次是催化活性(679 unigenes)、結(jié)合(657 unigenes)、細(xì)胞進(jìn)程(591 unigenes)和單組織進(jìn)程(528 unigenes);Ac6中的HEGs富集在44個(gè)GO term,其中基因富集最多的為代謝進(jìn)程(792 unigenes),其次是結(jié)合(760 unigenes)、催化活性(744 unigenes)、細(xì)胞進(jìn)程(656 unigenes)和單組織進(jìn)程(582 unigenes)(圖1)。
2.3 Ac5與Ac6中高表達(dá)基因的KEGG pathway富集分析
KEGG pathway 富集分析結(jié)果顯示,Ac5的HEGs富集在129個(gè)代謝通路(pathway),其中基因富集數(shù)最多的是核糖體(103 unigenes),其次是內(nèi)質(zhì)網(wǎng)蛋白質(zhì)加工(68 unigenes)和碳代謝(67 unigenes);Ac6的HEGs富集在129個(gè)代謝通路,其中基因富集數(shù)最多的是核糖體(103 unigenes),其次是氧化磷酸化(88 unigenes)和內(nèi)質(zhì)網(wǎng)蛋白質(zhì)加工(68 unigenes)(圖2)。上述結(jié)果說明,蛋白等基礎(chǔ)物質(zhì)代謝和能量代謝在中蜂幼蟲腸道發(fā)育過程中非常活躍,腸道發(fā)育對物質(zhì)和能量的需求旺盛。
表1RNA-seq數(shù)據(jù)信息統(tǒng)計(jì)
Table1Overview of RNA-seq data in this study

樣本Sample原始數(shù)據(jù)Rawreads有效讀段數(shù)Cleanreads(%)接頭Adapter(%)低質(zhì)量讀段Lowquality(%)99%堿基正確率(Q20)(%)Ac52989327029290630(97.98%)271218(0.91%)328722(1.1%)3604436630(98.45%)Ac62718260226636038(97.99%)224524(0.83%)319664(1.18%)3275561178(98.38%)
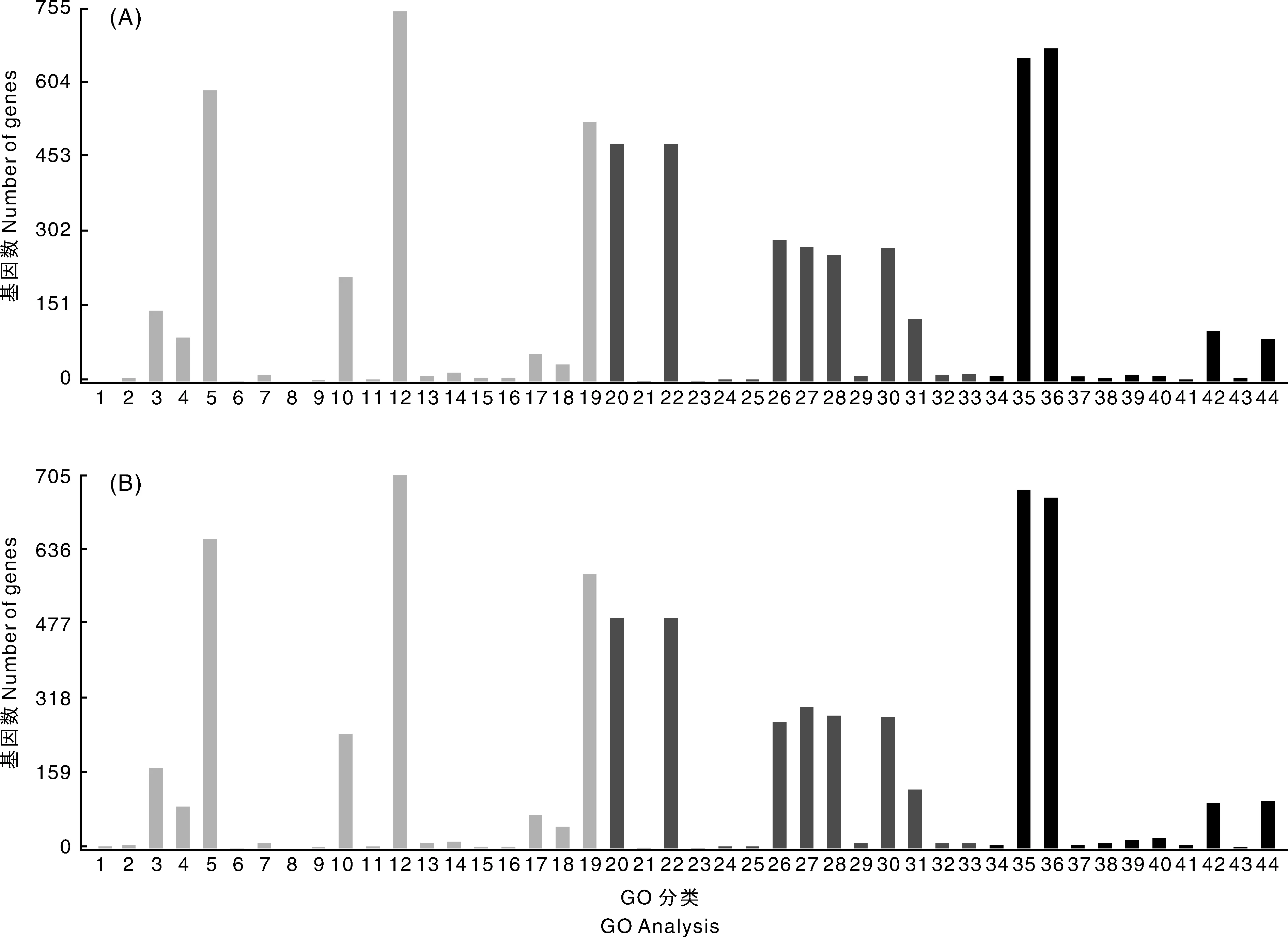
A, Ac5樣品HEGs的GO分類;B, Ac6樣品HEGs的GO分類;1, 行為;2, 生物黏附;3, 生物調(diào)控;4, 細(xì)胞成分組織或生物合成;5, 細(xì)胞進(jìn)程;6, 解毒作用 ;7, 發(fā)育進(jìn)程;8, 生長;9, 免疫系統(tǒng)進(jìn)程;10, 定位;11, 運(yùn)動(dòng);12, 代謝進(jìn)程;13, 多組織進(jìn)程;14, 多細(xì)胞組織進(jìn)程;15, 生殖;16, 生殖進(jìn)程;17, 應(yīng)激;18, 信號(hào);19, 單組織進(jìn)程;20, 細(xì)胞;21, 細(xì)胞連接;22, 細(xì)胞零件;23, 細(xì)胞外基質(zhì);24, 胞外區(qū);25, 胞外區(qū)零件;26, 大分子復(fù)合物;27, 細(xì)胞膜;28,細(xì)胞膜零件;29, 細(xì)胞膜內(nèi)腔;30, 細(xì)胞器;31, 細(xì)胞器零件;32, 病毒;33, 病毒零件;34, 抗氧化活性;35, 結(jié)合;36, 催化活性;37, 電子轉(zhuǎn)運(yùn)活性;38, 分子功能調(diào)節(jié)因子;39, 分子轉(zhuǎn)換器活性;40, 核酸結(jié)合轉(zhuǎn)錄因子活性;41, 信號(hào)轉(zhuǎn)導(dǎo)因子;42, 結(jié)構(gòu)分子活性;43, 轉(zhuǎn)錄因子活性,蛋白結(jié)合;44, 轉(zhuǎn)運(yùn)子活性A, GO enrichment analysis of HEGs in Ac5; B, GO enrichment analysis of HEGs in Ac6; 1, Behavior; 2, Biological adhesion; 3, Biological regulation; 4, Cellular component organization or biogenesis; 5, Cellular process; 6, Detoxification; 7, Developmental process; 8, Growth; 9, Immune system process; 10, Localization; 11, Locomotion; 12, Metabolic process; 13, Multi-organism process; 14, Multicellular organismal process; 15, Reproduction; 16, Reproductive process; 17, Response to stimulus; 18, Signaling; 19, Single-organism process; 20, Cell; 21, Cell junction; 22, Cell part; 23, Extracellular matrix; 24, Extracellular region; 25, Extracellular region part; 26, Macromolecular complex; 27, Membrane; 28, Membrane part; 29, Membrane-enclosed lumen; 30, Organelle; 31, Organelle part; 32, Virion; 33, Virion part; 34, Antioxidant activity; 35, Binding; 36, Catalytic activity; 37, Electron carrier activity; 38, Molecular function regulator; 39, Molecular transducer activity; 40, Nucleic acid binding transcription factor activity; 41, Signal transducer activity; 42, Structural molecule activity; 43, Transcription factor activity, protein blinding; 44, Transporter activity圖1 高表達(dá)基因的GO富集分析Fig.1 GO enrichment analysis of HEGs
2.4 Ac5與Ac6中高表達(dá)基因的Venn分析
對Ac5和Ac6中蜂幼蟲腸道樣品的Venn分析結(jié)果顯示(圖3),二者的共有HEGs為2 015個(gè),特有HEGs分別為219和491個(gè),說明絕大多數(shù)HEGs在中蜂5和6日齡幼蟲腸道均有高表達(dá),推測這些共有HEGs對中蜂幼蟲腸道的正常發(fā)育十分重要,而特有HEGs在幼蟲腸道的不同發(fā)育時(shí)期發(fā)揮特殊作用。
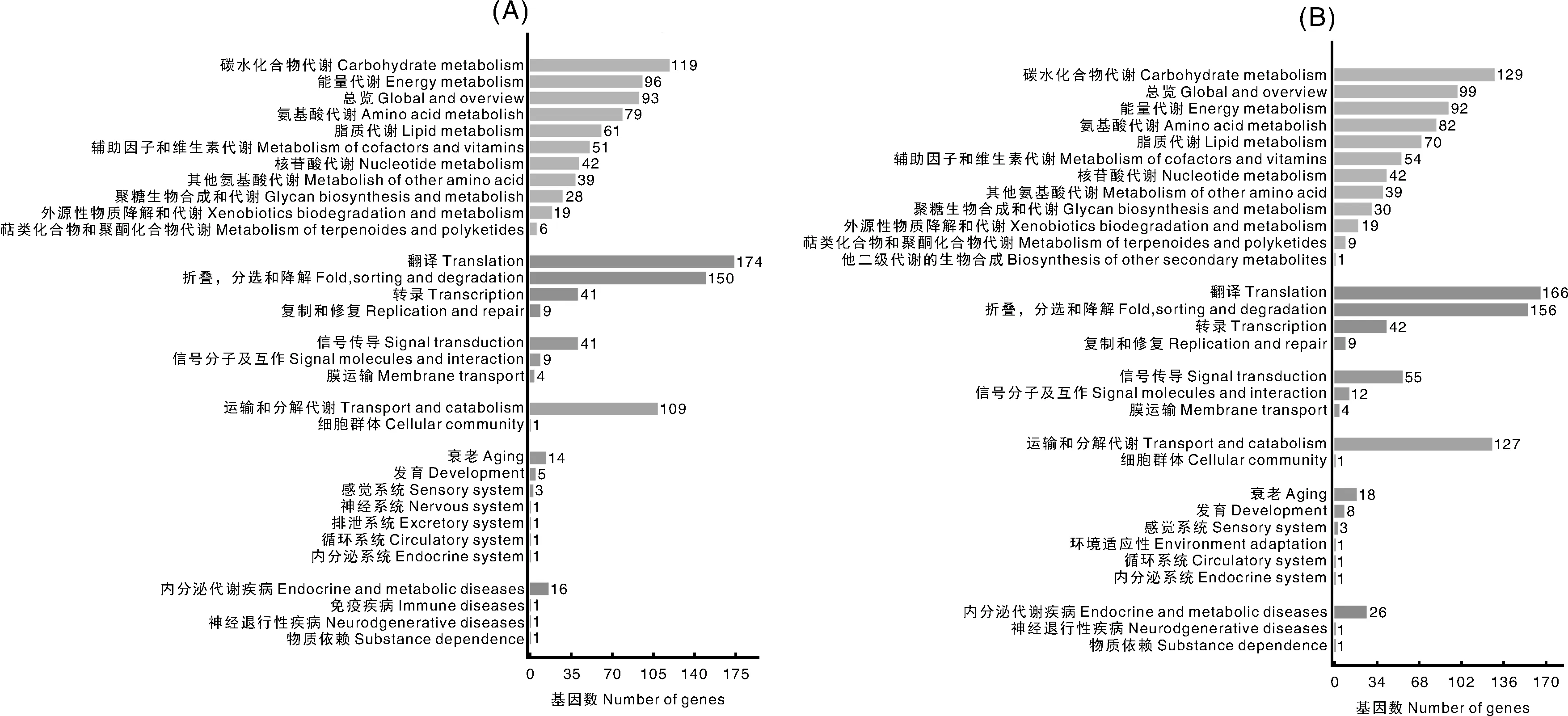
圖2 高表達(dá)基因的KEGG pathway富集分析Fig.2 KEGG pathway enrichment analysis of HEGs
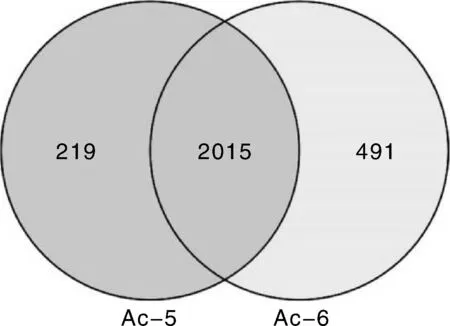
圖3 Ac5和Ac6中高表達(dá)基因的Venn分析Fig.3 Venn analysis of HEGs in Ac5 and Ac6
3 討論
中蜂是我國特有的本土蜂種,也是我國生態(tài)系統(tǒng)不可或缺的組成部分,具有十分重要的生態(tài)價(jià)值[10]。此外,中蜂作為養(yǎng)蜂生產(chǎn)中的常用蜂種,具有較高的經(jīng)濟(jì)價(jià)值。目前,有關(guān)中蜂及其幼蟲腸道發(fā)育的分子研究鮮有報(bào)道。近年來,高通量測序技術(shù)發(fā)展迅猛,因其通量大和準(zhǔn)確度高而廣泛應(yīng)用于動(dòng)物、植物和微生物的研究領(lǐng)域,在蜜蜂的相關(guān)研究中也取得一些重要進(jìn)展[11-13]。本研究利用RNA-seq技術(shù)對中蜂5日齡和6日齡腸道進(jìn)行深度測序,發(fā)現(xiàn)二者的表達(dá)基因數(shù)分別占參考基因總數(shù)的59.66%和64.29%,而前期研究顯示4日齡中蜂幼蟲腸道表達(dá)基因數(shù)為36 602,占84.03%(未發(fā)表數(shù)據(jù)),說明中蜂幼蟲腸道在不同發(fā)育時(shí)期所表達(dá)的基因數(shù)量差別較大,發(fā)育早期表達(dá)的基因數(shù)明顯多于發(fā)育后期。本研究還發(fā)現(xiàn),Ac5和Ac6中均有大量HEGs富集在核糖體和內(nèi)質(zhì)網(wǎng)蛋白加工,說明中蜂幼蟲腸道的發(fā)育過程對蛋白質(zhì)的需求大增,因而蛋白質(zhì)代謝旺盛。還發(fā)現(xiàn)大量HEGs富集在氧化磷酸化,說明中蜂幼蟲腸道發(fā)育過程中伴隨物質(zhì)代謝的增強(qiáng),能量代謝也相應(yīng)提高。
角質(zhì)層和圍食膜是昆蟲免疫防御的第一道防線[1],當(dāng)病原微生物突破這道防線后,將遭遇昆蟲體內(nèi)細(xì)胞免疫與體液免疫的抵抗,包括內(nèi)吞作用、黑化作用、吞噬作用、蛋白的酶促水解及抗菌肽等[14]。值得注意的是,對于Ac5和Ac6,相當(dāng)多的HEGs富集在細(xì)胞免疫通路,如內(nèi)吞作用、溶酶體和吞噬體,且隨著發(fā)育時(shí)間的延長,富集在上述細(xì)胞免疫通路的HEGs數(shù)量呈增加趨勢,表明在中蜂幼蟲腸道發(fā)育后期,細(xì)胞免疫通路較為活躍,可能賦予中蜂幼蟲較強(qiáng)的免疫防御能力。
西方蜜蜂的基因組早在2016年就已公布[15],為其分子研究奠定了重要基礎(chǔ)。前期研究中,我們已對健康及球囊菌脅迫的意大利蜜蜂(Apismelliferaligustica,簡稱意蜂)幼蟲腸道進(jìn)行了HEGs分析(待發(fā)表)。較之意蜂,中蜂的分子研究進(jìn)展緩慢,其中參考基因組的缺失是最大的制約因素。直到2015年,Park等[16]通過二代測序技術(shù)對雄蜂進(jìn)行測序,組裝得到中蜂參考基因組,然而作者當(dāng)時(shí)并未同時(shí)公布基因位置及注釋信息,導(dǎo)致該參考基因組無法被有效利用。腸道對于蜜蜂及其幼蟲而言具有十分重要的作用,它是重要的消化吸收場所和免疫防御器官。我們在前期研究中denovo組裝并注釋了中蜂幼蟲腸道的參考轉(zhuǎn)錄組,可為深入研究中蜂幼蟲腸道的發(fā)育機(jī)理、幼蟲響應(yīng)病原(如球囊菌、東方蜜蜂微孢子蟲和囊狀幼蟲病毒)脅迫的應(yīng)答機(jī)制提供重要的參考信息。
此前,中蜂幼蟲腸道發(fā)育的組學(xué)研究未見報(bào)道,有關(guān)中蜂幼蟲腸道發(fā)育機(jī)理的研究相對滯后。本研究在前期研究基礎(chǔ)上,對中蜂5日齡和6日齡幼蟲腸道進(jìn)行HEGs分析,研究結(jié)果不僅可提供中蜂幼蟲腸道發(fā)育過程中的基因表達(dá)譜數(shù)據(jù),也為在分子水平深入研究中蜂幼蟲腸道發(fā)育提供重要信息。本研究是根據(jù)基因表達(dá)量FPKM值篩選得到HEGs,進(jìn)而預(yù)測其功能,若要在分子水平更加全面、深入地研究中蜂幼蟲腸道的發(fā)育,則需要對不同日齡的幼蟲腸道進(jìn)行差異表達(dá)基因分析,進(jìn)一步建立腸道發(fā)育過程中的分子調(diào)控網(wǎng)絡(luò)、挖掘關(guān)鍵調(diào)控基因。這將是我們下一步的工作重點(diǎn)。
[1] 龔一飛. 蜜蜂分類與進(jìn)化[M]. 福建: 福建科學(xué)技術(shù)出版社, 2000.
[2] 楊冠煌. 中華蜜蜂[M]. 北京: 中國農(nóng)業(yè)科技出版社, 2001.
[3] 張復(fù)興. 現(xiàn)代養(yǎng)蜂生產(chǎn)[M]. 北京: 中國農(nóng)業(yè)大學(xué)出版社, 1998.
[4] GILLIAM M. Identification and roles of non-pathogenic microflora associated with honey bees[J].FEMSMicrobiologyLetters, 1997, 155(1): 1-10.
[5] JEYAPRAKASH A, HOY M A, ALLSOPP MH. Bacterial diversity in worker adults ofApismelliferacapensis andApismelliferascutellata (Insecta: Hymenoptera) assessed using 16S rRNA sequences[J].JournalofInvertebratePathology, 2003, 84(2): 96-103.
[6] LI JL, QIN HR, WU J, et al.The prevalence of parasites and pathogens in Asian honeybeesApisceranain China[J].PLoSOne, 2012, 7(11): e47955.
[7] 王倩, 孫亮先, 肖培新, 等. 室內(nèi)人工培育中華蜜蜂幼蟲技術(shù)研究[J]. 山東農(nóng)業(yè)科學(xué), 2009(11): 113-116. WANG Q, SUN L X, XIAO P X, et al. Study on technology for indoor artificial feeding ofApisceranaceranalarvae[J].ShandongAgriculturalSciences, 2009(11): 113-116. (in Chinese with English abstract)
[8] 張曌楠, 熊翠玲, 徐細(xì)建, 等. 蜜蜂球囊菌的參考轉(zhuǎn)錄組denovo組裝及SSR分子標(biāo)記開發(fā)[J]. 昆蟲學(xué)報(bào), 2017,60(1): 34-44. ZHANG Z N, XIONG C L, XU X J, et al. De novo assembly of a reference transcriptome and development of SSR markers forAscosphaeraapis[J].ActaEntomologicaSinica, 2017, 60(1): 34-44. (in Chinese with English abstract)
[9] MORTAZAVI A, WILLIAMS BA, MCCUE K, et al. Mapping and quantifying mammalian transcriptomes by RNA-Seq[J].NatureMethods, 2008, 5(7): 621-628.
[10] 丁桂玲. 中華蜜蜂(Apiscerana)群體多樣性的研究[D]. 北京: 中國農(nóng)業(yè)科學(xué)院, 2006. DING G L. Study on the population diversity ofApiscerana[D]. Beijing: Chinese Academy of Agricultural Sciences, 2006. (in Chinese with English abstract)
[11] CORNMAN R S, LOPEZ D, EVANS J D. Transcriptional response of honey bee larvae infected with the bacterial pathogenPaenibacilluslarvae[J].PLoSOne, 2013, 8(6): e65424.
[12] JULIE A, BARBARA MISME-AUCOUTURIER, BERNARD V, et al. Transcriptome analyses of the honeybee response toNosemaceranaeand insecticides[J].PloSOne, 2014, 9(3): e91686.
[13] CRISTINO A S, BARCHUUK A R, FREITAS F C, et al. Neuroligin-associated microRNA-932 targets actin and regulates memory in the honeybee[J].NatureCommunications, 2014, 5: 5529.
[15] HONEY BEE GENOME SEQUENCING CONSORTIUM. Insights into social insects form the genome of the honeybeeApismellifera[J].Nature, 2006, 443(7114): 931-949.
[16] PARK D, JUNE J W, CHOI B S, et al. Uncovering the novel characteristics of Asian honey bee,Apiscerana, by whole genome sequencing[J].BMCGenomics, 2015, 16: 1.
(責(zé)任編輯張 韻)
AnalysisofhighlyexpressedgenesoflarvalgutofApisceranacerana
XIE Yanling, WANG Hongquan, ZHANG Lu, HOU Zhixian, DAO Chen, JIANG Liangliang, XIONG Cuiling, ZHENG Yanzhen, XU Xijian, HUANG Zhijian, GUO Rui*, CHEN Dafu
(CollegeofBeeScience,F(xiàn)ujianAgricultureandForestryUniversity,F(xiàn)uzhou350002,China)
Apisceranaceranais not only a specific honeybee species resource in China, but also a frequently-used honeybee species in apiculture. In the present study, the 5-(Ac5) and 6-day-old (Ac6) larval guts ofA.c.ceranawere sequenced using RNA-seq. After filtration, 29290630 and 26636038 clean reads with a Q20 of 98.45% and 98.38% were obtained in Ac5 and Ac6. GO enrichment analysis results showed that the highly expressed genes (HEGs) in Ac5 were enriched in 44 GO terms, among them metabolic process (753 unigenes), catalytic activity (679 unigenes) and binding (657 unigenes) were the largest groups; the HEGs in Ac6 were enriched in 44 GO terms, and the mostly enriched one was metabolic process (792 unigenes), followed by binding (760 unigenes) and catalytic activity (744 unigenes). KEGG enrichment analysis results suggested that the HEGs of Ac5 were enriched in 129 pathways, among them ribosome (103 unigenes) was the largest group, followed by protein processing in endoplasmic reticulum (68 unigenes) and carbon metabolism (67 unigenes); the HEGs of Ac6 were enriched in 129 pathways, the mostly enriched ones were ribosome (103 unigenes), oxidative phosphorylation (88 unigenes) as well as protein processing in endoplasmic reticulum (68 unigenes). Our findings can not only offer the gene expression profiles during the developmental process of the larval gut ofA.c.ceranaat transcriptome level, but also provide key information for further investigation of the larval gut’s development.
RNA-seq;Apisceranacerana; larval gut; highly expressed genes
S89
:A
:1004-1524(2017)09-1575-06
解彥玲,王鴻權(quán),張璐,等. 中華蜜蜂幼蟲腸道的高表達(dá)基因分析[J].浙江農(nóng)業(yè)學(xué)報(bào),2017,29(9): 1575-1580.
10.3969/j.issn.1004-1524.2017.09.22
2017-03-20
現(xiàn)代農(nóng)業(yè)產(chǎn)業(yè)技術(shù)體系建設(shè)專項(xiàng)基金(CARS-45-KXJ7);福建農(nóng)林大學(xué)科技發(fā)展基金(KF2015123);福建省大學(xué)生創(chuàng)新創(chuàng)業(yè)項(xiàng)目(201610389053)
解彥玲(1996—),女,浙江湖州人,主要從事蜂學(xué)研究。E-mail: 1103430452@qq.com
*通信作者,郭睿,E-mail: fafu_ruiguo@126.com

