大腸埃希菌O111黏附牦牛子宮內膜上皮細胞致炎模型的建立
吳慶俠,董海龍,朱洪云,劉忠艷(西藏農牧學院,西藏林芝 860000)
大腸埃希菌O111黏附牦牛子宮內膜上皮細胞致炎模型的建立
吳慶俠,董海龍,朱洪云,劉忠艷
(西藏農牧學院,西藏林芝 860000)
為建立大腸埃希菌O111黏附牦牛子宮內膜上皮細胞的致炎模型,體外分離、培養牦牛子宮內膜上皮細胞,培養5 d后,加入大腸埃希菌O111,通過計算細胞上細菌的黏附數量研究細菌數量和孵育時間對黏附效果的影響,得到最佳黏附條件,通過ELISA法測定細胞培養上清液中腫瘤壞死因子-α(TNF-α)、白細胞介素-6(IL-6)、白細胞介素-1β(IL-1β)的質量濃度變化來鑒定模型。結果表明,大腸埃希菌為1×105CFU/mL、孵育時間為120 min是黏附的最佳條件。ELISA 法檢測結果表明,與對照組相比,60、90、120 min組TNF-α、IL-6、IL-1β的質量濃度顯著升高,致炎效果明顯,表明致炎模型建立成功。
大腸埃希菌O111;牦牛子宮內膜上皮細胞;致炎模型
奶牛子宮內膜炎是奶牛產后的常發病,大腸桿菌是其致病的一種重要的條件性致病菌,發病率在15%左右[1],嚴重危害奶牛產業的經濟效益。大腸埃希菌O111是具有高致病力的菌株,王孝武等[2]研究表明,從患病奶牛子宮內膜10 份樣本中分離出12 株細菌,其中7 株為大腸桿菌;杭蘇琴等[3]研究表明,從患有子宮內膜炎的奶牛子宮黏液中分離大腸桿菌,血清學分型結果表現為O111型占41.84%,占有比例最高。
對于奶牛子宮內膜炎的研究,國內外普遍采用體外培養子宮內膜細胞,建立相應炎癥模型的方式[4]。目前,牦牛作為藏區牧民的主要生活資料,同樣面臨產后子宮內膜炎的困擾,臨床觀察統計,西藏林芝地區牦牛子宮內膜炎的發病率已達到18%,尤其是胎衣不下所引起的子宮內膜炎尤為多見。羊云飛[5]通過16S rRNA對藏區牦牛源大腸桿菌進行分離、血清學鑒定,發現O111所占比例較高,達到13.6%。然而體外建立O111菌株感染牦牛子宮內膜細胞的致炎模型未見報道。
本研究通過體外分離、培養的牦牛子宮內膜上皮細胞為模型,分別評價大腸埃希菌O111的數量,以及子宮內膜細胞孵育時間對該菌黏附性的影響,最后通過雙抗體夾心ELISA法檢測細胞培養上清液中腫瘤壞死因子α(TNF-α)、白細胞介素-6(IL-6)、白細胞介素-1β(IL-1β)的質量濃度變化,從而成功構建模型,為進一步研究其致病及抗病機制提供條件。
1 材料與方法
1.1 材 料
1.1.1 牦牛子宮和菌種來源 牦牛子宮取自西藏林芝市巴宜區牦牛屠宰廠。大腸埃希O111(Escherichiacoli,ATCC43887)由中國農業大學王九峰教授惠贈。
1.1.2 菌種與試劑 D-MEM/F12培養液、胎牛血清、膠原酶Ⅱ購自Gibco公司;TNF-α、IL-6、IL-1β檢測試劑盒均購自博士德生物;雙抗(青霉素和鏈霉素)為哈藥集團生產;營養肉湯、PBS緩沖液均為自配。
1.1.3 主要儀器和設備 6 孔和96 孔細胞培養板為Costar公司產品;CO2培養箱(上海福瑪試驗設備有限公司)、酶標儀(美國伯騰儀器有限公司)、倒置生物顯微鏡(Nikon公司)、離心機(Sigma公司)、雙人超凈工作臺(蘇凈凈化設備有限公司)。
1.2 方 法
1.2.1 大腸埃希菌O111懸液制備 將大腸埃希菌O111于營養肉湯內培養,37 ℃振蕩12 h后取出,3 000 r/min離心10 min,去上清液,使用無菌PBS緩沖液懸浮菌種,再次3 000 r/min離心10 min,去上清液,使用D-MEM/F12培養液將菌種重懸,并將其調至1×107CFU/mL,備用。
1.2.2 牦牛子宮內膜上皮細胞的培養 參照吳慶俠等[6]的方法進行,具體操作如下:將采取的牦牛子宮于含有雙抗的無菌PBS溶液中反復沖洗后剪開子宮角,剪取子宮內膜層,把剪取好的子宮內膜層用無菌PBS溶液反復沖洗,直至溶液清亮。將其放入空的血清瓶中,剪成肉糜狀以便消化,用無菌PBS溶液沖洗數次后使用2 g/L的膠原酶Ⅱ消化4 h,消化過程中注意每隔30 min搖動消化瓶1次,消化結束后,74 μm濾網過濾消化液,400 r/min離心5 min,收集沉淀(主要為上皮細胞),無菌PBS溶液重懸后自然沉降,下方的沉降物即為純度較高的上皮細胞。去上清液,使用含φ= 5%胎牛血清的D-MEM/F12培養液制成細胞懸液,移入到預先放置有無菌蓋玻片(22 mm×22 mm)的6 孔板中,每孔2 mL,培養5 d后,觀察細胞形態,爬滿蓋玻片時進行黏附試驗。
1.2.3 大腸埃希菌O111對牦牛子宮內膜上皮細胞的黏附 大腸埃希菌不同數量分組黏附:使用D-MEM/F12培養液,將“1.2.1”中備用的菌液調整細菌數量為1×107、1×106、1×105、1×104和1×103CFU/mL,D-MEM/F12培養液作為空白對照,依次加入到“1.2.2”中培養好的牦牛子宮內膜上皮細胞進行黏附試驗。CO2培養箱中孵育2 h。孵育結束后,取出蓋玻片,使用無菌PBS緩沖液沖洗5 次,去除雜質和未黏附細菌等。自然晾干或低溫烘干,甲醇固定20 min,革蘭氏染色觀察大腸埃希菌O111對牦牛子宮內膜上皮細胞的黏附性。每組在顯微鏡下隨機挑選10 個視野,統計每個視野下每個細胞黏附細菌的數量。
孵育不同時間分組黏附:將“1.2.1”中備用的細菌數量為1×107CFU/mL的菌液,加入到“1.2.2”中培養好的牦牛子宮內膜上皮細胞進行黏附試驗。孵育時間在30、60、90、120和150 min時分別取樣,同“大腸埃希菌不同數量分組黏附”試驗中計算方法,計算細胞上細菌的黏附數量。1.2.4 黏附過程中TNF-α、IL-6、IL-1β的質量濃度檢測 選取已培養好上皮細胞的6孔板2個,取其中10 孔取上清液,每孔取3 次,每次取0.1 mL,保證每個檢測因子有10 個待檢樣,將上清液移入到96 孔板中,作為對照組待測。將數量為1×107CFU/mL的菌液加入2 個培養好的牦牛子宮內膜上皮細胞6 孔板中進行孵育,孵育時間在60、90、120 min時選取其中10 孔采取上清液,每孔取3 次,每次0.1 mL,同樣保證每個檢測因子有10 個待檢樣,將上清液移入到96 孔板中待測,采用雙抗體夾心ELISA法測定上清液中TNF-α、IL-6、IL-1β的質量濃度,檢測嚴格按照說明書進行。
1.2.5 數據的統計分析 試驗結果重復3 次,采用SPSS 21.0統計軟件,對試驗數據進行統計分析,結果以“平均數±標準差”表示,用 SigmaPlot 12.5軟件繪制柱狀圖。
2 結果與分析
2.1 牦牛子宮內膜上皮細胞的培養
分離的上皮細胞經培養18 h后開始貼壁,以細胞團為中心向四周輻射生長(圖1)。5 d后,上皮細胞在培養皿底部呈鋪路石樣排列生長(圖2)。上皮細胞純度較高,看不到明顯雜質或其他細胞。
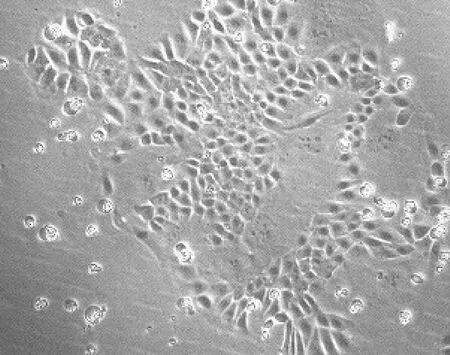
圖1 培養18 h后上皮細胞生長形態(100×)Fig.1 Growth morphology of epithelialcells after 18 h culture(100×)
2.2 不同細菌數量對黏附效果的影響
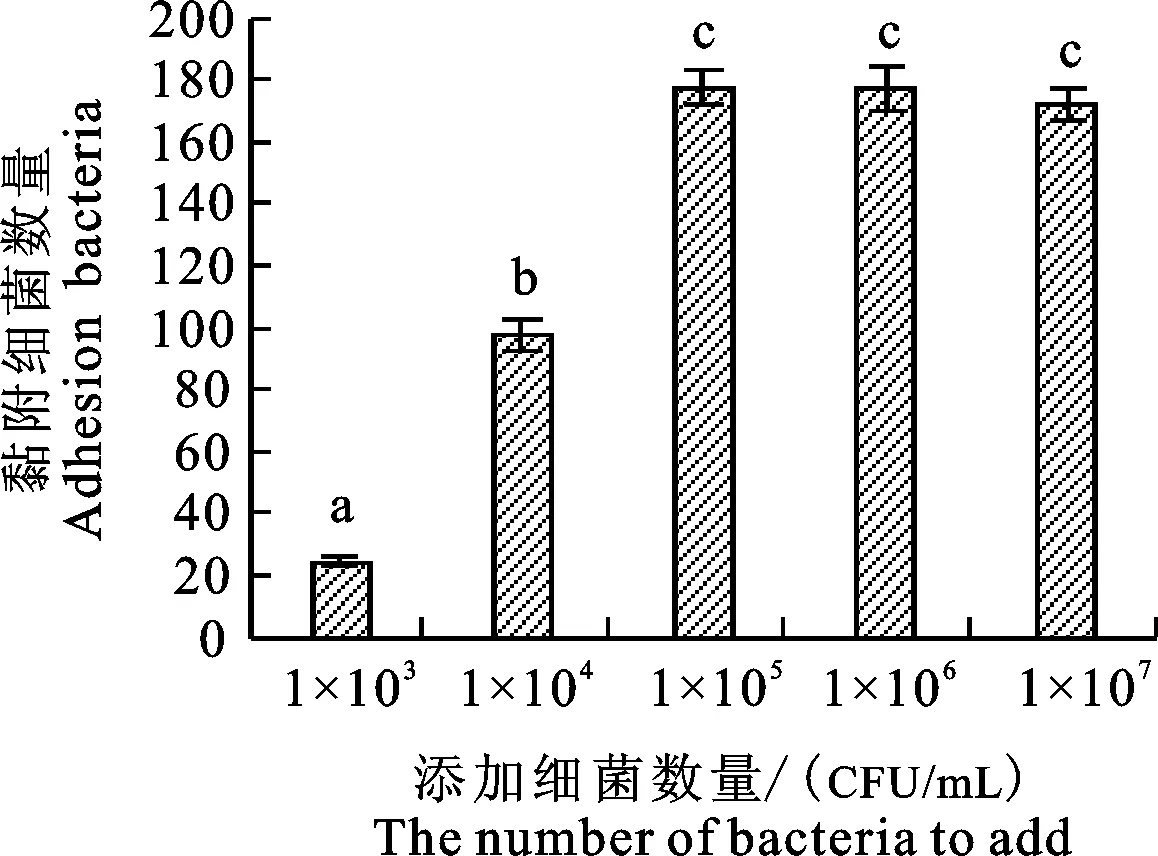
在染色前,通過倒置顯微鏡觀察發現,隨著添加大腸埃希菌O111數量的增加,部分細胞變圓脫壁,脫壁細胞的數量隨著細菌數量的增加而增加;仍然貼壁的細胞形態上沒有明顯變化。大腸埃希菌對牦牛子宮內膜上皮的黏附性,隨著細菌數量的增加,每個細胞上平均黏附的細菌數呈逐步增加(圖3和圖4),大腸埃希菌數量為1×103、1×104、1×105CFU/mL時黏附細菌的數量差異顯著(P<0.05),而大腸埃希菌數量為1×105、1×106、1×107CFU/mL時黏附細菌數量的組間差異不顯著(P>0.05)。提示細菌數量為1×105CFU/mL時,黏附細菌數開始穩定,單個牦牛子宮內膜上皮細胞的黏附細菌數量已經達到最大,使大腸埃希菌O111黏附量趨于飽和,因此最佳黏附效果的細菌數量為1×105CFU/mL。
2.3 不同孵育時間對黏附效果的影響
如圖5所示,隨著時間的增加,黏附細菌數量逐步增加,孵育時間為30、60、90和120 min時黏附細菌的數量差異顯著(P<0.05),孵育120 min與150 min相比較,無顯著差異(P>0.05),提示在孵育120 min時,黏附細菌數量趨于穩定,黏附細菌量達到最大,因此最佳黏附的孵育時間為120 min。
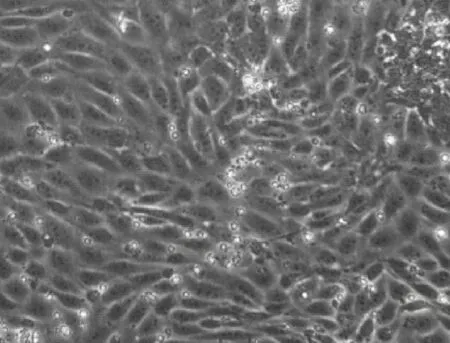
圖2 培養5 d后上皮細胞生長形態(200×)Fig.2 Growth morphology of epithelialcells after 5 d culture(200×)

A~C.大腸埃希菌O111的數量依次為103、104、105CFU/mL Concentration ofEscherichiacoliO111is 103CFU/mL,104CFU/mL,105CFU/mL
圖3不同數量大腸埃希菌O111在牦牛子宮內膜上皮細胞的黏附(革蘭氏染色,1000×)
Fig.3AdhesionofEscherichiacoliO111onendometrialepitheliumcellsofyakatdifferentconcentrations(Gram’sstaining,1000×)
不同小寫字母表示差異顯著(P<0.05),下同。
Different lowercase letters are significantly differente at level ofP<0.05,the same below.
圖4不同數量的大腸埃希菌O111對牦牛子宮內膜上皮細胞黏附效果
Fig.4EffectsofdifferentnumbersofEscherichiacoliO111onadhesiontoendometrialepitheliumcells
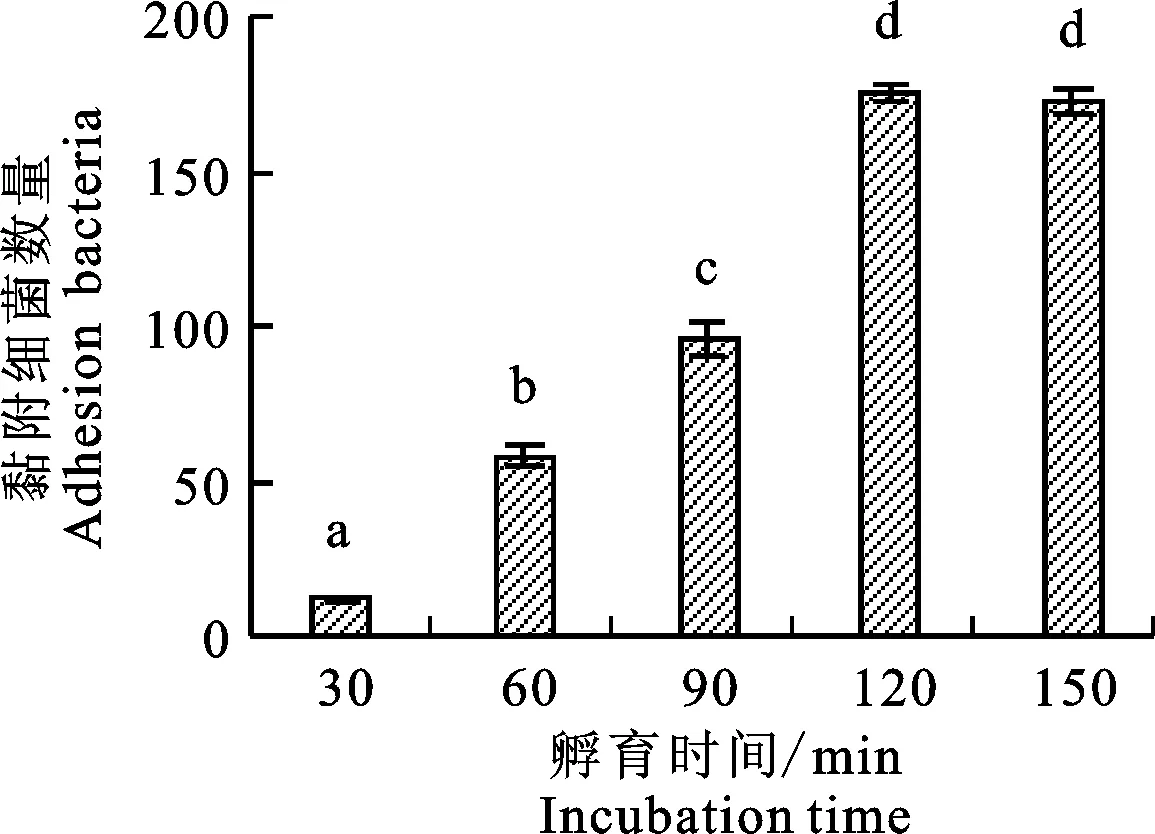
圖5 不同孵育時間的黏附效果Fig.5 Effects of different incubation time on adhesion
2.4ELISA法檢測細胞培養上清液中TNF-α、IL-6、IL-1β的質量濃度變化
由表1可知,90 和120 min組比較,上清液中TNF-α、IL-6、IL-1β的質量濃度均差異不顯著(P>0.05),而60、90、120 min組與對照組均差異顯著(P<0.05),提示在大腸埃希菌的作用下,炎性反應變化明顯。
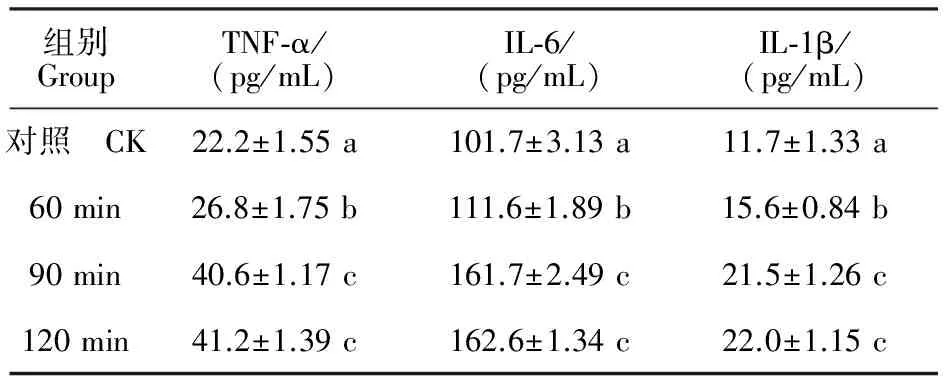
表1 不同時間內TNF-α、IL-6、IL-1β的質量濃度Table 1 Mass concentration changes of TNF-, IL-6 and IL-1 in different time
注:同列不同小寫字母表示差異顯著(P<0.05)。
Note:Different lowercase letters in the same column are significantly different at level ofP<0.05.
3 討 論
在生殖系統中,子宮占據著重要地位,其內膜上皮直接接觸微生物,起到免疫作用,有研究表明,子宮內膜上皮細胞與免疫細胞一樣,具有分泌和免疫應答的功能[7],能夠釋放炎癥介質。近年來人們對牛子宮相關炎性疾病的研究都涉及到體外細胞的培養技術,本試驗中,牦牛子宮內膜上皮細胞的培養參照吳慶俠等[6]的培養方法,得到純度較高的上皮細胞,并使用原代細胞進行試驗。
大腸埃希菌是子宮內膜炎的重要致病菌,目前體外子宮內膜致炎模型的建立,多是使用大腸桿菌脂多糖(LPS)進行誘導,模型中LPS的致炎效果均很明顯,已成功建立的模型有人[8]、小鼠[9]、奶牛[10]、山羊[11]等,這些模型的建立有的是為揭示致炎癥發生過程中子宮內膜細胞相關炎性因子的一系列表達變化[12],有的是用于檢驗藥物或者中藥提取物對子宮內膜炎的抑制效果等。而直接使用細菌對體外培養的細胞進行黏附的試驗很少,本試驗直接使用大腸埃希菌對體外培養的牦牛子宮內膜細胞進行黏附建立致炎模型,主要是天然模擬大腸埃希菌感染細胞的過程,從而探討其定植機制。余抒等[13]研究發現大腸埃希菌黏附HeLa細胞的最佳條件是加入細菌量為1×105CFU/mL,孵育時間為4 h,本試驗結果表明,最佳的加入細菌量也為1×105CFU/mL,與其結果一致,但孵育2 h即達到最佳效果,最佳孵育時間有所不同,分析可能是由于黏附的細胞對象不同所造成的,本試驗所用細胞為原代子宮內膜上皮細胞,而余抒等[13]試驗使用的是瘤細胞,瘤細胞的細胞表面所表達的一系列因子水平與常規細胞相比有很大差異。
Fischer等[14]研究奶牛在產后一定時間內,子宮內膜上皮細胞中相關炎性因子基因表達變化與臨床型和隱性型子宮內膜炎的關系,認為炎性趨化因子(CXCL5)、IL-1β、IL-6和TNF的基因可作為隱性子宮內膜炎診斷和治療監測的標志基因。Ghasemi等[15]對患有亞臨床型子宮內膜炎的奶牛血液中TNF-α、IL-6等進行檢測,結果其表達水平遠遠高于健康奶牛,趙立香等[16]的試驗表明,通過直接對奶牛子宮內灌注大腸桿菌菌液導致TNF-α、IL-6、IL-1β等表達增多,于曉紅等[17]試驗表明在LPS的作用下奶牛子宮內膜上皮細胞TNF-α、IL-6、IL-1β表達量均有不同程度的增加。本試驗結果也表明,在大腸埃希菌的作用下,上清液中TNF-α、IL-6、IL-1β的質量濃度與對照組相比均顯著升高(P<0.05),與相關報道[16-17]一致。
本試驗確定大腸埃希菌O111對體外培養的牦牛子宮內膜上皮細胞黏附最佳條件,即細菌數量為1×105CFU/mL,孵育時間為120 min,同時使用ELISA法檢測細胞培養上清液中TNF-α、IL-6、IL-1β的質量濃度變化,表明在大腸埃希菌的作用下,炎性反應明顯,從而成功建立體外細菌黏附子宮內膜致炎模型。該模型將進一步用于大腸桿菌致牦牛子宮內膜炎癥機理及益生菌防治牦牛子宮內膜炎的研究。
Reference:
[1] LEBLANC S J,OSAWA T,DUBUC J.Reproductive tract defense and disease in postpartum dairy cows[J].Theriogenology,2011,76(9):1610-1618.
[2] 王孝武,王旭榮,楊志強,等.甘肅省某牛場奶牛子宮內膜炎病原菌的分離鑒定及其耐藥性分析[J].西北農業學報,2014,23(6):16-21.
WANG X W,WANG X R,YANG ZH Q,etal.Isolation,identification and drug-resistance of pathogenic bacteria from the dairy cows infected by edometritis in gansu[J].ActaAgriculturaeBoreali-occidentalisSinica,2014,23(6):16-21(in Chinese with English abstract).
[3] 杭蘇琴,王一昊,鄭 婕,等.產后奶牛子宮內大腸桿菌的分離和血清型鑒定[J].畜牧與獸醫,2015,47(3):104-106.
HANG S Q,WANG Y H,ZHENG J,etal.Isolation and identification ofEscherichiacolifrom the postpartum dairy cows[J].AnimalHusbandry&VeterinaryMedicine,2015,47(3):104-106(in Chinese ).
[4] DACIES D,MEADE K G,SHAN H,etal.Toll-like receptor and antimicrobial peptide expression in the bovine endometrium[J].ReproductiveBiology&Endocrinology,2008,6(1):1-12.
[5] 羊云飛.牦牛、牧民源大腸桿菌分離鑒定、耐藥基因檢測、PFGE分析及耐藥性傳遞的研究[D].成都:四川農業大學,2011.
YANG Y F.Study on detection of sulfonamides resistance and florfeniol resistance genes and PFGE ofE.colifrom yak and herdsman[D].Chengdu:Sichuan Agricultural University,2011(in Chinese with English abstract).
[6] 吳慶俠,董海龍,芮亞培.牦牛子宮內膜腺上皮細胞分離培養方法比較[J].安徽農業科學,2011,39(18):11085-11087.
WU Q X,DONG H L,RUI Y P.Comparison on in-vitro culture methods of yak endometrial gland epithelial cells[J].JournalofAnhuiAgricultureScience,2011,39(18):11085-11087(in Chinese with English abstract).
[7] LAGOW E,DESOUZA M M ,CARSON D D.Mammalian reproductive tract mucins[J].HumanReproductionUpdate,1999,5(4):280-292.
[8] JING Y Y,HAN Z P,SUN K,etal.Toll-like receptor 4 signaling promotes epithelial-mesenchymal transition in human hepatocellular carcinoma induced by lipopolysaccharide[J].BMCMedicine,2012,10(1):98.
[9] 楊 倩,史萬玉,趙駐軍,等.小鼠子宮內膜細胞炎癥模型的建立[J].河北農業大學學報,2011,34(6):87-90.
YANG Q,SHI W Y,ZHAO ZH J,etal.Inflammatory model of endometrial cells in mice[J].JournaofAgriculturalUniversityofHebei,2011,34(6):87-90(in Chinese with English abstract).
[10] 張桂林,崔曉妮,曹榮峰.脂多糖誘導奶牛子宮內膜上皮細胞核因子kB的表達[J].中國獸醫科學,2010,40(10):1063-1066.
ZHANG G L,CUI X N,CAO R F.Expression of NF-kB LPS-induced in bovine endometrial epithelial cel[J].ChineseVeterinaryScience,2010,40(10):1063-1066(in Chinese with English abstract).
[11] 鄺曉嬌,張世棟,董書偉,等.丹參水提物對山羊子宮內膜上皮細胞炎癥模型中基質金屬蛋白酶-2表達的影響[J].動物醫學進展,2015,36(3):54-59.
KUANG X J,ZHANG SH D,DONG SH W,etal.Effect of extract of salvia miltiorrhiza on MMP-2 in endometrium epithelial cell inflamamation model of goat[J].ProgressinVeterinaryMedicine,2015,36(3):54-59(in Chinese with English abstract).
[12] SWANGCHANUTHAI T,LAVENDER CRM,CHENG Z,etal.Time course of defense mechanisms in bovine endometrium in response to lipopolysaccharide[J].Biologyofreproduction,2012,87(6):1-13,135.
[13] 余 抒,顧 江,曾 浩,等.腸出血性大腸埃希菌O157∶H7黏附HeLa細胞模型的建立[J].第三軍醫大學報,2007,29(20):1933-1935.
YU SH,GU J,ZENG H,etal.Establishm ent of an enterohem orrhagicEscherichiacoliO 157∶H7 attached HeLa cell model[J].ActaAcademiaeMedicinaeMilitarisTertiae,2007,29(20):1933-1935(in Chinese with English abstract).
[14] FISCHER C,DRILLICH M,ODAU S,etal.Selected pro-inflammatory factor transcripts in bovine endometrial epithelial cells are regulated during the oestrous cycle and elevated in case of subclinical or clinical endometritis[J].ReproductionFertility&Development,2010,22(5):818-829.
[15] GHASEMI F,GONZALEZ-CANO P,GRIEBEL PJ,etal.Proinflam-matory cytokine gene expression inendometrial eytobrush samples harvested from cows with and withour sublinical endome-tritis[J].Theriogenology,2012,78(7):1538-1547.
[16] 趙立香,郭夢堯,李豐陽,等.大腸桿菌引發奶牛子宮內膜炎的致病機制研究[J].黑龍江畜牧獸醫,2013(10):14-17.
ZHAO L X,GUO M Y,LI F Y,etal.Research on the pathogenic mechanism of endometritis caused byEscherichiacoliin dairy cattle[J].HeilongjiangAnimalScienceandVeterinaryMedicine,2013(10):14-17(in Chinese with English abstract).
[17] 于曉紅,白云靜,程 鵬,等.苦參堿對奶牛子宮內膜上皮細胞抗炎作用及其機制[J].北京農學院學報,2015,30(3):35-39.
YU X H,BAI Y J,CHENG P,etal.Anti-inflammatory effect of matrine on the bovine endometrial epithelial cell and its mechanism[J].JournalofBeijingUniversityofAgriculture,2015,30(3):35-39(in Chinese with English abstract).
EstablishmentofInflammationModelsforEscherichiacoliO111AdheredtoYakEndometrialEpithelialCells
WU Qingxia,DONG Hailong,ZHONG Hunyun and LIU Zhongyan
(Xizang Agricultural and Animal Husbandry College,Linzhi Tibet 860000,China)
The yak endometrial epithelial cells were isolated and cultured in vitro to establish inflammation models caused byE.coliO111adhesion yak endometrial epithelial cells. After 5 days’ culture,EscherichiacoliO111was added in, the optimum condition was obtained by calculation of bacteria number to study the cell adhesion effect under different conditions of bacterial number and incubation time. The optimization model was identified by DAS-ELISA method to determine the content change of tumor necrosis alpha (TNF-α), leukocyte mediated IL-6 and IL-1 factors in cell culture supernatant. The results showed that the number ofE.coliwas 1×105CFU/mL, and the incubation time was 120 min, which was the best condition for adhesion. ELISA test results proved that the TNF-α, IL-6, IL-1β mass concentration increased significantly and had obvious inflammation effect in 60 min, 90 min and 120 min test groups than control group. The model of inflammation was established successfully after series of test.
EscherichiacoliO111; Yak endometrial epithelial cells; Inflammatory model
2016-07-05
2016-08-02
Tibet Natural Science Foundation(No.2015212-14-34);Funded by Key Lab Construction Program of Clinical Veterinary Medicine for Medical Universities and Colleges in Tibet.
WU Qingxia, female, associate professor. Research area:animal clinical disease.E-mail:goodwqx@163.com
S857.23
A
1004-1389(2017)09-1289-06
(責任編輯:顧玉蘭Responsibleeditor:GUYulan)
日期:2017-09-12
網絡出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170912.1740.008.html
2016-07-05
2016-08-02
西藏自治區自然科學基金(2015212-14-34);西藏自治區臨床獸醫學高校重點試驗室建設資助項目。
吳慶俠,女,副教授,從事動物臨床疾病研究。E-mail:goodwqx@163.com
董海龍,男,副教授,主要從事產科疾病相關研究。E-mail: 984718586@qq.com
CorrespondingauthorDONG Hailong, male, associate professor. Research area:animal obstetric diseases. E-mail:984718586@qq.com

