磷酸轉移酶系統關鍵基因敲除對Klebsiellapneumoniae產1,3-丙二醇的影響
陸競爭,任順利,諸葛斌*,陸信曜,宗紅,方慧英,宋健
1(江南大學,糖化學與生物技術教育部重點實驗室,江蘇 無錫,214122) 2(江南大學,工業生物技術教育部重點實驗室,工業微生物研究中心,江蘇 無錫,214122) 3(江南大學,化學與材料工程學院,江蘇 無錫,214122)
磷酸轉移酶系統關鍵基因敲除對Klebsiellapneumoniae產1,3-丙二醇的影響
陸競爭1,2,任順利1,2,諸葛斌1,2*,陸信曜1,2,宗紅1,2,方慧英1,2,宋健3
1(江南大學,糖化學與生物技術教育部重點實驗室,江蘇 無錫,214122) 2(江南大學,工業生物技術教育部重點實驗室,工業微生物研究中心,江蘇 無錫,214122) 3(江南大學,化學與材料工程學院,江蘇 無錫,214122)
克雷伯氏菌(Klebsiellapneumoniae)在以葡萄糖作輔底物發酵甘油生產1,3-丙二醇(1,3-propanediol, 1,3-PDO)過程中,由于細胞存在碳分解代謝抑制現象,葡萄糖優先于甘油被菌體吸收代謝用于細胞生長及副產物的累積,影響1,3-PDO的合成。基于K.pneumoniae葡萄糖轉運及碳代謝調控相關的磷酸轉移酶系統(phosphotransferase system, PTS),利用Red重組技術對PTS系統中與葡萄糖特異性轉運相關的基因ptsG(編碼葡萄糖特異性轉運膜透性酶EⅡBCGlc)、crr(編碼胞漿可溶性葡萄糖特異性轉運酶EⅡAGlc)分別進行敲除,并考察上述基因缺失對細胞生長、1,3-PDO合成和副產物代謝的影響。結果顯示,敲除ptsG、crr基因后,甘油轉化率較野生菌分別提高26.2%和42.7%,其中突變株K.pneumoniaeΔcrr的1,3-PDO的產量達到23.1 g/L,提高35.8%。上述結果表明,敲除ptsG、crr基因改造PTS系統能夠有效提高底物甘油利用率,強化1,3-PDO合成。
crr;ptsG;磷酸轉移酶系統;克雷伯氏菌;1,3-丙二醇
1,3-丙二醇(1,3-propanediol,1,3-PDO)作為一種重要的化工原料,應用于聚合物、醫藥和化妝品等行業,特別是作為新型聚酯類纖維聚對苯二甲酸丙二醇酯(polytrimethylene terephthalate,PTT)單體越來越受關注[1-2]。在已有的1,3-PDO合成菌株中,克雷伯氏菌(Klebsiellapneumoniae)因能高效生產1,3-PDO被廣泛研究[3]。但在以葡萄糖作輔底物發酵甘油生產1,3-PDO過程中,K.pneumoniae優先代謝葡萄糖用于菌體生長,同時阻遏抑制甘油代謝,不利于1,3-PDO的合成[4]。
磷酸轉移酶系統(phosphotransferase system,PTS)作為葡萄糖主要轉運系統,由EⅠ(ptsH編碼)、HPr(ptsI編碼)、EⅡAGlc(crr編碼),以及EⅡBCGlc(ptsG編碼)構成[4]。如圖1,EI與磷酸烯醇式丙酮酸(Phosphoenolpyruvate,PEP)反應獲得磷酸基團,并將其加載到HPr上,繼而磷酸基團傳遞至EⅡAGlc、EⅡBCGlc,接著EⅡBCGlc將周質空間內的葡萄糖轉運至胞內并磷酸化,磷酸化葡萄糖進而進入分解代謝途徑。其中EⅡAGlc和EⅡBCGlc不僅參與葡萄糖的特異性轉運,還具有碳分解代謝抑制調控作用。
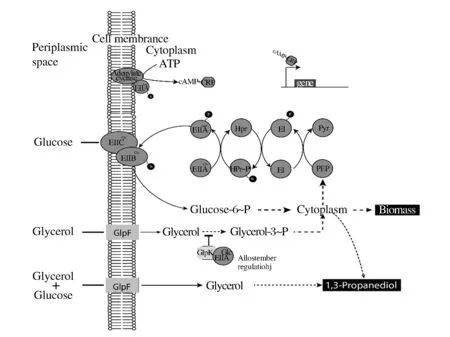
圖1 K. pneumoniae葡萄糖磷酸轉移酶系統Fig.1 Glucose-specific phosphotransferase system of K. pneumoniae
研究表明,敲除ptsG、crr基因有助于弱化葡萄糖的轉運、碳分解代謝抑制作用,從而有效實現混合碳源共底物發酵[5-6]。但目前對于K.pneumoniaePTS系統的碳代謝調控與細胞生長、1,3-PDO的合成及相關副產物代謝之間的關系尚未報道。基于此,本文通過敲除K.pneumoniae的ptsG、crr基因,分析PTS系統基因缺失對細胞生長、1,3-PDO合成的影響,對K.pneumoniae以葡萄糖作輔底物發酵甘油生產1,3-PDO的研究具有指導意義。
1 材料與方法
1.1菌株與質粒
本研究用到的菌株和質粒見表1。

表1 本文使用的菌株和質粒
1.2培養基與培養方法
種子培養基(g/L):酵母粉 5,胰蛋白胨 10,NaCl 10。發酵培養基(g/L):甘油 40,葡萄糖12,酵母粉 6,KH2PO47.5,MgSO42,(NH4)2SO42,FeSO40.005,VB120.015,微量元素溶液10 mL,KOH調pH至8.0。微量元素溶液(g/L):ZnCl20.07,MnCl2·4H2O 0.1,H3BO30.06,CoCl2·6H2O 0.2,CuCl20.02,NiCl2·6H2O 0.025,Na2MoO4·2H2O 0.035。種子培養:1%接種量(體積比),37 ℃、150 r/min,培養8~10 h。發酵培養:250 mL三角瓶50 mL裝液量,4%接種量(體積比),37 ℃、150 r/min,培養48 h。所有培養基在1×105Pa滅菌15 min。
1.3主要試劑和儀器
氯霉素、硫酸卡那霉素、阿拉伯糖,生工生物工程(上海)股份有限公司;DNA凝膠回收試劑盒、質粒提取試劑盒,上海捷瑞生物工程有限公司;Taq DNA聚合酶購自大連寶生物有限公司;液相色譜柱:Aminex HPX-87H column(300 mm×7.8 mm;9 μm),BioRad公司;PCR儀、電轉儀,Eppendorf公司;引物由蘇州泓迅生物科技有限公司合成;1,3-PDO標準品,Sigma公司;其他試劑均為國產分析純。
1.4引物設計
采用Primer軟件,根據NCBI已報道的K.pneumoniae中ptsG、crr基因序列(Gen Bank Accession No.NC_011283.1)設計引物見表2。
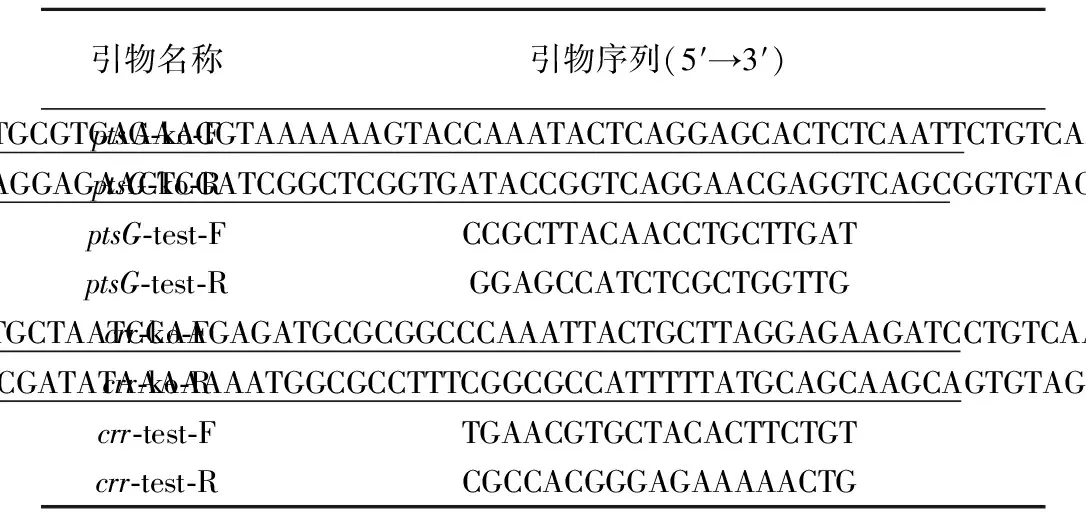
表2 基因敲除使用的引物
注:下劃線部分為敲除基因的同源臂序列。
1.5缺失菌株的構建
基因敲除過程按照文獻報道進行[7]。將含氯霉素抗性的pKD46_Cm質粒轉入K.pneumoniae,轉接至液體LB培養基(含氯霉素),加入阿拉伯糖誘導后制備K.pneumonia敲除電轉感受態。以pKD13作模板進行PCR反應獲得crr、ptsG基因敲除盒,回收并電轉至K.pneumoniae感受態,涂布于含有卡那霉素的LB平板篩選,PCR鑒定獲得陽性克隆。導入pCP20質粒誘導表達FLP重組酶消除上述引入的抗性標記基因。
1.6測定方法
生物量用600 nm處光吸收值測定。以發酵培養基為空白對照,然后將發酵液于8 000 r/min離心5 min,并收集菌體,生理鹽水洗滌3次后,將收集的菌體置于105 ℃烘箱中干燥至恒重后稱重,根據實驗計算得出細胞干重公式:1 OD600= 0.36 g/L。樣品中葡萄糖含量用SBA-40C雙通道生物傳感分析儀進行測定,具體測定方法參考儀器使用說明書。1,3-PDO及其他代謝產物產量用高效液相色譜法(high performance liquid chromatography,HPLC)測定,檢測條件為:Amines HPX-87H (Bio-Rad) (300 mm × 7.8 mm,9 μm)液相色譜柱,使用示差折光及紫外檢測器,流動相:5 mmol/L KH2PO4,流速0.6 mL/min,柱溫60 ℃,進樣量10 μL。
2 結果與分析
2.1PTS系統關鍵基因敲除
利用Red重組技術敲除K.pneumoniaePTS系統關鍵基因ptsG、crr。如圖2,野生菌ptsG、crr基因驗證條帶大小分別為1 523和1 054 bp。而缺失菌中對應驗證條帶大小分別為762和645 bp,條帶大小與預期結果相符,說明基因敲除成功,得到突變株K.pneumoniaΔptsG、K.pneumoniaΔcrr。

M-DL2503 Marker;1-野生菌;2-ptsG敲除菌;3-野生菌;4-crr敲除菌圖2 ptsG基因(A)和crr基因(B)敲除的PCR驗證Fig.2 PCR verifications of ptsG (A) and crr(B) gene knockout mutants
2.2突變株生長性能分析
以6 g/L葡萄糖為底物,與野生菌相比,crr突變株生物量減半、1,3-PDO產量下降;而ptsG突變株則基本無法生長(數據未列出)。為進一步提高產物積累量,對糖濃度進行優化,發現添加12 g/L葡萄糖最利于K.pneumoniaΔcrr和K.pneumoniaΔptsG合成1,3-PDO。此時,K.pneumoniaΔcrr和K.pneumoniaΔptsG的生物量分別為野生菌的62.7%和23.6%(圖3)。可見高糖濃度能夠改善細胞生長并部分回補基因缺失對生物量的影響。上述結果表明,crr和ptsG基因敲除弱化了PTS系統功能,限制了葡萄糖向胞內的轉運,使得細胞生物量顯著降低。已有研究發現,雖然敲除ptsG基因可以提高胞內cAMP水平,促進cAMP-CRP依賴的碳分解代謝過程的相關基因的表達,但ptsG編碼的EⅡBCGlc對GalP和ManXYZ等其他糖轉運系統的合成具有正調控作用[8]。因此,敲除ptsG將嚴重影響糖轉運,導致菌體生長顯著下降。而crr基因編碼的EⅡAGlc的高表達則會抑制甘油轉運、代謝相關基因表達[9]。因此,crr基因敲除可以緩解甘油代謝的抑制作用,同時還可提高胞內cAMP水平、激活cAMP-CRP依賴型碳分解代謝過程相關基因的表達[10],從而使得K.pneumoniaΔcrr具有較高的生物量。另一方面,較高的糖濃度可能激活了GalP和MglBAC等其他葡萄糖轉運系統,使得基因缺失對生物量的影響在12 g/L糖質量濃度下出現一定的回補[11]。
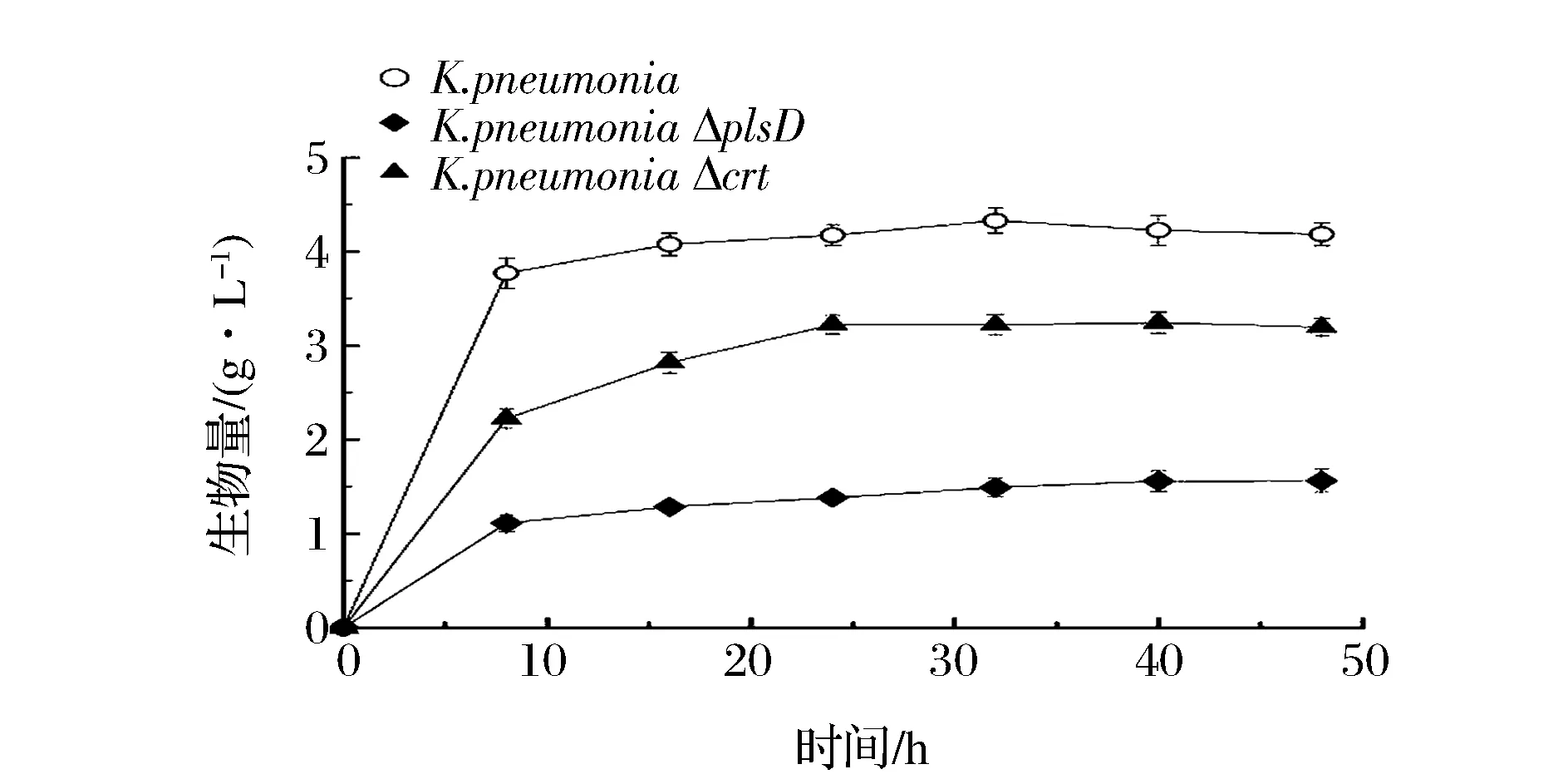
圖3 K. pneumoniae及突變株發酵甘油產1,3-PDO的生物量Fig.3 The biomass of K. pneumoniae and mutants (K. pneumoniae ΔptsG, K. pneumoniae Δcrr) in glycerol fermentation for 1,3-propanediol production
2.3突變株代謝分析
如圖4A,發酵前4 h野生菌葡萄糖基本耗完,菌體快速生長。而ptsG、crr突變株由于葡萄糖轉運受損,糖耗速率明顯下降。其中,crr突變株的葡萄糖16 h基本耗完;而ptsG突變株由于葡萄糖轉運能力嚴重受損,至發酵結束僅消耗一半葡萄糖,使得菌體生物量較其他菌株減少。上述結果表明,敲除ptsG、crr基因弱化了葡萄糖轉運,限制了細胞對葡萄糖的消耗。
基因敲除弱化了菌株生長,使得突變株的甘油消耗速率在發酵前期均低于野生菌(圖4-B)。其中,K.pneumoniaΔptsG耗甘油量減少34.2%;而crr缺失菌在前期甘油代謝能力稍弱,但耗甘油總量與野生菌相似,表明crr敲除有利于甘油代謝。此外,由于PTS系統關鍵基因敲除弱化了糖轉運和代謝,細胞可能通過強化甘油歧化途徑進行代償,從而使得兩株缺失菌的單位菌體耗甘油量分別提高76%和31.6%,進一步表明ptsG、crr敲除使得細胞甘油代謝能力提高。此外,由于生長嚴重受限,突變株K.pneumoniaΔptsG1,3-PDO產量降低32.7%。相比之下,突變株K.pneumoniaΔcrr1,3-PDO產量達到23.1 g/L,提高35.8%,表明crr敲除有利于產物積累。此外,2株缺失菌的單位菌體產量均提高約80%。另一方面,ptsG和crr突變株的甘油轉化率分別提高26.2%和42.7%,表明ptsG、crr敲除使得胞內甘油碳流向1,3-PDO合成途徑偏轉。
2,3-丁二醇(2,3-Butanediol,BDO)作為主要的副產物之一,在1,3-PDO發酵生產過程中用于維持胞內氧化還原勢平衡,防止培養基酸化[12]。發酵前期,葡萄糖代謝旺盛,產生大量的丙酮酸、還原力,促進BDO的累積。crr、ptsG基因敲除之后,葡萄糖轉運能力下降,致使菌體糖耗受限,影響葡萄糖代謝,BDO積累較野生菌下降。其中,crr敲除菌BDO產量減少25.7%,ptsG敲除菌BDO基本檢測不到(圖4-C),表明crr、ptsG基因敲除可以有效減少BDO累積,致使更多碳流轉向1,3-PDO的合成[13]。在發酵后期,由于BudC催化BDO發生可逆反應,BDO濃度下降,碳源重新進入糖酵解途徑,并產生還原力[14],進一步驅動發酵后期1,3-PDO的積累。
如圖4-D,由于ptsG、crr基因敲除影響PTS系統的碳源轉運能力,部分碳源由非PTS系統轉運至胞內,通過ATP磷酸化激活進入代謝途徑,加大了細胞對能量的需求[15-16],中間代謝物可能經乙酸合成途徑生成乙酸產生ATP以補償細胞能量需求,導致單位菌體乙酸產量有所提高。但由于生物量下降,乙酸終產量分別減少39.7%、18.2%,表明敲除ptsG、crr基因弱化乙酸積累。
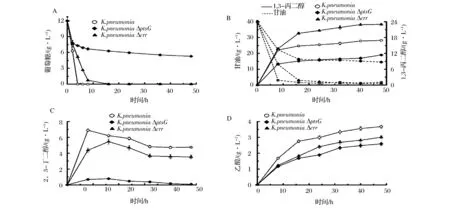
圖4 K. pneumoniae及突變株發酵甘油產1,3-PDO發酵過程中(A)剩余葡萄糖、(B)1,3-丙二醇、剩余甘油、(C)2,3-丁二醇、(D)乙酸Fig.4 (A) Residual glucose,(B) 1,3-PDO, residual glycerol, (C) 2,3-BDO, (D) Acetatein fermentation of K. pneumoniaeand mutants that produced 1,3-propanediol from glycerol
3 結論
本研究對K.pneumoniaePTS系統中與葡萄糖特異性轉運相關的ptsG、crr基因分別進行敲除,并考察了細胞生長、1,3-PDO的合成及副產物代謝的變化。結果表明,基因敲除能夠改善底物代謝能力,提高甘油轉化率。其中,crr基因敲除對生物量影響相對較弱,1,3-PDO產量提高35.8%,甘油轉化率提高42.7%,同時減少了BDO、乙酸等副產物積累。綜上可知,敲除PTS系統中與葡萄糖特異性轉運相關基因可以有效改善底物代謝能力,減少副產物積累,促進1,3-PDO的合成,為后續進一步改造提高甘油發酵合成1,3-PDO提供思路和借鑒。
[1] LEE CS,AROUA MK,DAUD WMAW,et al.A review: Conversion of bioglycerol into 1,3-propanediol via biological and chemical method[J].Renewable and Sustainable Energy Reviews,2015,42:963-972.
[2] 祃棟猛,陸信曜,陳文強,等.發酵后期補加2種氮源對克雷伯氏菌合成1,3-丙二醇的影響[J].食品與發酵工業,2016,42(8):8-12.
[3] CELIńSKAE.Klebsiellasppas a 1, 3-propanediol producer-the metabolic engineering approach[J].Critical Reviews in Biotechnology,2012,32(3):274-288.
[4] DEUTSCHER J,FRANCKE C,POSTMA P W.How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria[J].Microbiology and Molecular Biology Reviews,2006,70(4):939-1 031.
[5] 嚴濤,趙錦芳,高文慧.大腸桿菌工程菌ptsG基因敲除及其缺陷株混合糖同型乙醇發酵[J].生物工程學報,2013,29(7):937-945.
[6] OH BR,HONG WK,HEO SY,et al.The production of 1,3-propanediol from mixtures of glycerol and glucose by aKlebsiellapneumoniaemutant deficient in carbon catabolite repression[J].Bioresource Technology,2013,130(1):719-724.
[7] KIRILL AD,BARRY LW.One-step inactivation of chromosomal genes inEscherichiacoliK-12 using PCR products[J].The Proceedings of the National Academy of Sciences of the United States of America,2000,97(12):6 640-6 645.
[8] STEINSIEK S,BETTENBROCK K.Glucose transport inEscherichiacolimutant strains with defects in sugar transport systems[J].Journal of Bacteriology,2012,194(21):5 897-5 908.
[9] VAN DVJ,VAN DK,POSTMA PW.Quantification of the regulation of glycerol and maltose metabolism by EⅡAGlc of the phosphoenolpyruvate-dependent glucose phosphotransferase system inSalmonellatyphimurium[J].Journal of Bacteriology,1994,176(12):3 518-3 526.
[10] BETTENBROCK K,SAUTER T,JAHREISK,et al.Correlation between growth rates, EIIACrrphosphorylation, and intracellular cyclic AMP levels inEscherichiacoliK-12[J].Journal of Biotechnology,2007,189(19):6 891-6 900.
[11] ESCALANTE A,SALINAS C A,GOSSET G,et al.Current knowledge of theEscherichiacoliphosphoenolpyruvate-carbohydrate phosphotransferase system: peculiarities of regulation and impact on growth and product formation[J].Applied Microbiology and Biotechnology,2012,94(6):1 483-1 494.
[12] LEE S,KIM B,JEONG D,et al.Observation of 2,3-butanediol biosynthesis in Lys regulator mutatedKlebsiellapneumoniaeat gene transcription level[J].Journal of Biotechnology,2013,168(4):520-526.
[13] 陸信曜,季廣建,宗紅,等.budR表達水平對克雷伯氏菌甘油代謝的影響[J].食品與發酵工業,2016,42(4):24-27.
[14] YANG TH,RATHNASINGH C,LEE HJ,et al.Identification of acetoin reductases involved in 2,3-butanediol pathway inKlebsiellaoxytoca[J].Journal of Biotechnology,2014,172(1):59-66.
[15] YAO R,HIROSE Y,SARKARD,et al.Catabolic regulation analysis ofEscherichiacoliand itscrp,mlc,mgsA,pgiandptsGmutants[J].Microbial Cell Factories,2011,10:67.
[16] ERNI B.The bacterial phosphoenolpyruvate: sugar phosphotransferase system (PTS): an interface between energy and signal transduction[J].Journal of the Iranian Chemical Society,2013,10(3):593-630.
Theeffectsofknockingoutkeygenesinphosphotransferasesystemon1,3-propanediolproductionofKlebsiellapneumoniae
LU Jing-zheng1,2, REN Shun-li1,2,ZHUGEBin1,2*,LU Xin-yao1,2,ZONG Hong1,2,FANG Hui-ying1,2,SONG Jian3
1(The Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, China) 2(The Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, School of Biotechnology,Research Centre of Industrial Microbiology, Wuxi 214122, China) 3(School of Chemistry and Material, Jiangnan University,Wuxi 214122, China)
During production of 1,3-propanediol from glycerol byKlebsiellapneumoniaewith glucose as co-substrate, glucose has the priority of being used for accumulated biomass and byproducts due to the carbon catabolism repression (CCR), which results in an obstacle on 1,3-propanediol production. Based on the phosphotransferase system (PTS) involved in glucose specific transferance and corresponding carbon metabolic regulation,ptsGgene encoding EⅡBCGlcandcrrgene encoding EⅡAGlcwere respectively knocked out by Red disruption system in this study. The effects ofptsG,crr-deficient PTS on cell growth, 1,3-propanediol production, and byproducts accumulation were examined. It was observed that after knocking outptsGandcrrgenes, the yields of glycerol increased by 26.2%, 42.7% compared with the parent strains, respectively. A yield of 23.1 g/L 1,3-propanediol byK.pneumoniaeΔcrrwas achieved with increase of 35.8%. The results above demonstrated that modification of PTS by disruption ofptsGandcrrgenes could improve the yield of glycerol and enhance the 1,3-propanediol production.
crr;ptsG; phosphotransferase system (PTS);Klebsiellapneumoniae; 1,3-propanediol
10.13995/j.cnki.11-1802/ts.013991
碩士研究生(諸葛斌教授為通訊作者,E-mail:bzhuge@163.com)。
2017-02-06,改回日期:2017-03-14

